2. 黑龙江省动物疾病致病机制与比较医学重点实验室, 哈尔滨 150030
2. Heilongjiang Provincial Key Laboratory of Pathogenic Mechanism for Animal Disease and Comparative Medicine, Harbin 150030, China
同种异体皮肤移植是指同种之间的不同个体间进行皮肤移植手术,一般广泛应用于自体皮肤发生大面积缺损,如烧伤或者创伤等,无法满足自体移植的情况[1]。但在移植之后,会产生非常严重的免疫排斥反应[2]。这种并发症可以在短时间内大量表达IL-2、IFN-γ等炎性因子破坏移植皮片,促使移植皮片坏死[3]。为抑制免疫排斥反应,目前临床上常用的方式是使用免疫抑制剂。有研究表明,单独使用雷帕霉素抑制剂或糖皮质激素等药物均具有良好的抑制免疫排斥的效果[4],但也可能会造成延长炎症期,抑制血管迁移,肉芽组织再生等伤口愈合不良的副作用[5]。因此为降低药物副作用,免疫抑制剂联合用药的方法被广泛应用于抗排斥反应的治疗中。MP是联合用药中较为常用的药物[6],因其具有良好的抗排异效果在组织器官移植上广泛应用,所以本试验采用MP作为联合用药的药物之一。
间充质干细胞(MSCs)是近年来细胞疗法的主要应用细胞之一,其主要分布于脂肪、骨髓、胎盘、牙髓等组织部位[7]。其中ADSCs以取材方便,无伦理性,免疫原性低,治疗效果好等优势被广泛应用于各种疾病的研究中[8],并已经取得了很好的效果。因其具有抑制免疫排斥反应[9]、炎症反应、组织纤维化[10]、氧化应激,并促进细胞再生等优势,在皮肤损伤相关的研究中得到了很大关注[11-12]。因此本试验采取ADSCs与MP联合用药。
有研究表明,巴马小型猪皮肤厚度、分层、光镜结构、超微结构、以及一些特殊结构都与人相似[13]。并且在猪、人、兔等皮肤损伤时应用IL-1α后,小型猪与人的皮肤创口的愈合速度显著提高,这说明猪与人的皮肤损伤主要是通过创面上皮化来修复。而兔是通过创口收缩的方式愈合[14]。所以小型猪作为动物模型可以更准确地模拟出ADSCs+MP对人异体皮肤移植的影响。
本试验通过比较ASG、MP、ADSCs、ADSCs+MP对小型猪异体皮肤移植所产生的免疫排斥反应与创口愈合方面的影响。旨在研究ADSCs+MP在抗排异与促进创口愈合方面的应用前景,并为ADSCs+MP对异体皮肤移植临床应用奠定理论基础。
1 材料与方法 1.1 实验动物本试验经东北农业大学动物伦理委员会监督,选取1岁龄广西巴马小型猪12头(30~40 kg,雌雄各半)。经临床与实验室健康检查后进行试验。在整个试验过程中,饲养管理条件保持一致。
1.2 仪器设备及试剂兽用便携式多参数监护仪(深圳迈瑞生物医疗电子股份有限公司),动物呼吸麻醉机(美国SurgiVet公司),EPOCH连续波长酶标仪(美国BIOTEK基因有限公司),组织研磨仪(上海净信实业发展有限公司)。
丙泊酚乳状注射液(西安力邦制药有限公司),异氟烷(河北一品制药有限公司生产),DMEM低糖培养基(美国Invitrogen有限公司),胎牛血清(美国Clark公司),反转录试剂盒(TaKaKa生物技术有限公司),荧光定量PCR染料(湖南Innovagene科技有限公司),IL-4、IL-6、IL-10、TNF-α、IL-2、IL-1β、IFN-γ、皮质醇、CXCR4、SDF-1(上海酶联生物科技有限公司),SOD、GSH(南京建成生物工程研究所)。免疫印迹中使用的一抗:PI3K(abclonal, A16950, 1∶1 000)、AKT(abclonal, WH133854, 1∶1 000)、P-AKT(Wanleibio, WLP001a, 1∶1 000)、11β-HSD1(abclonal, WH298017, 1∶1 000)、11β-HSD2(Proteintech, 14192-1-aP, 1∶1 000)、NF-κB(Wanleibio, WL01980, 1∶500)、P-NF-κB(Wanleibio, WL02169, 1∶1 000)、VEGF(abclonal, WH306346, 1∶1 000)、TGF-β(abclonal, A2124, 1∶1 000);二抗:山羊兔抗(Proteintech, SA00001-2, 1∶10 000)。
1.3 试验方法1.3.1 动物分组 将12头小型猪随机分为4组:异体皮肤移植(ASG)组,甲泼尼龙(MP)组,脂肪间充质干细胞(ADSCs)组,脂肪间充质干细胞与甲泼尼龙联合用药(ADSCs+MP)组。
1.3.2 动物试验 试验采用同种异体皮肤移植手术,每次需要两头小型猪同时开展手术。将两头小型猪同时麻醉后,分别在背部造8个4 cm×4 cm的创口,创口间距5 cm。并且将取下来的皮肤修整,保留表皮与真皮层,将两头猪的皮片顺次交换移植到异体皮肤上,采取结节缝合(图 1),待异体皮肤移植结束后,用纱布固定,每日护理换纱布,并在7 d时拆除缝合线。其中ASG组:术后不用药干预,MP组:在术后颈部肌肉注射甲泼尼龙,注射剂量为5 mg·kg-1,连续注射7 d。ADSCs组:术后即刻在每个皮片下面进行皮下注射ADSCs。每个皮片的注射剂量为5×104·cm-2。ADSCs+MP组:术后即可在每个移植皮片皮下注射5×104·cm-2ADSCs,在颈部肌肉注射甲泼尼龙5 mg·kg-1连续7 d。所有组的猪均在术前与术后7、14 d采集血液和组织样本,术后即刻、7、14、21 d拍照记录移植表皮临床变化情况。
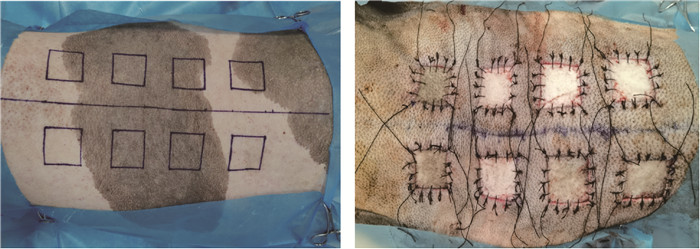
|
图 1 手术模式图与术后即刻图片 Fig. 1 Surgical pattern diagram and postoperative picture |
1.3.3 小型猪脂肪间充质干细胞的分离与培养 采用手术的方式取出小型猪两侧腹股沟皮下脂肪,去除筋膜与血管,并放入0.1%Ⅰ型胶原酶中37℃消化55 min,消化结束后,1 500 r·min-1离心10 min,去除上清液,加入完全培养基。重悬后200目滤网过滤,再次1 500 r·min-1离心10 min,去掉上清液。加入5 mL红细胞裂解液1 500 r·min-1离心5 min,去掉上清液。加入完全培养基、接培养瓶并放入5% CO2、37℃培养箱中培养。待培养瓶中细胞融合70%~80%时传代,传到3~5代时收集脂肪间充质干细胞,备用。
1.4 指标检测1.4.1 血常规及血清生化检测 本研究采用五分类血常规WBC、NEU、LYM按照血常规仪器说明书步骤进行操作。GLB按照试剂盒说明书进行操作。
1.4.2 炎症相关因子和愈合相关因子检测 炎症相关因子IL-2、IL-4、IL-10、IL-1β、IL-6、TNF-α、IFN-γ与愈合相关因子皮质醇、CXCR4、SDF-1均按照ELISA试剂盒(酶联, 上海)说明书的步骤操作。
1.4.3 氧化应激指标 GSH与SOD,均按照相应试剂盒说明书进行操作。
1.4.4 蛋白提取与免疫印迹 取全层皮肤组织研磨碎,放入RIPA(invent in-wb001)、PMSF(碧云天st506-2)等冰上孵育30 min,离心取上清,BCA(碧云天)测蛋白浓度,调平蛋白浓度加上样缓冲液,煮沸10 min,-80 ℃保存。取出蛋白上清,加到已经配好的胶中开始电泳。电泳结束后开始切胶,转模,封闭,敷抗体、洗膜、敷二抗、洗膜、曝光。
1.4.5 总RNA的提取与实时荧光定量PCR 总RNA采用TRzoL试剂(Invitrogen,15596-026) 分离,使用染料(Vazume,Q711-02),研究使用引物序列详见表 1。
|
|
表 1 qRT-PCR引物序列 Table 1 qRT-PCR primer sequences |
1.4.6 组织学分析和免疫组化染色 将取样皮肤放入4%多聚甲醛固定,待固定后石蜡包埋,用苏木精伊红染色。在免疫组化方面,用石蜡切片染色,柠檬酸钠修复液、亚沸腾修复,2%的山羊血清室温封闭1 h,10%山羊血清稀释一抗CD4+(Proteintech, 67786-1-Ig, 1∶1 000)。
1.5 数据统计分析使用GraPhadPrism8软件进行统计分析,结果表示为“平均数±标准差(x±s)”,差异显著性分析使用单因素方差分析方法(one-way ANOVA),各组之间采用多重比较,P<0.05具有统计学意义。
2 结果 2.1 异体皮肤移植皮片表观检查图 2显示,ASG组的移植皮片7 d时可见大量表皮脱落并形成白色苔藓样病变,移植皮片红肿,皮片触感较硬。14 d时移植皮片颜色变黑,皮片触感坚硬,切开皮片时可见真皮与表皮全层全部变黑。MP组的移植皮片在7 d时,质地较软,颜色潮红。14 d时MP组出现皮片颜色大面积变黑,质地较硬,切开皮片发现其表皮与部分真皮颜色变黑。ADSCs组的移植皮片在7 d时可见皮片少部分颜色变红,质地较软。14 d时可见皮片周围变黑,质地较软,切开皮片可见少部分表皮真皮变黑。ADSCs+MP的移植皮片在7 d时可见皮片上有点状潮红,无黑色坏死灶,质地柔软,切开皮片。14 d时可见皮片颜色部分变黑,质地较软,切开皮片可见表皮真皮部分变黑。21 d可见ASG组移植皮片部分脱落,创口中肉芽组织并未填充完全。MP组、ADSCs组、ADSCs+MP组皮片均完全变黑,质地坚硬。

|
图 2 移植皮片表观变化 Fig. 2 Apparent changes in graft skin |
图 3显示,7 d时ASG组可见其表皮脱落,表皮层与真皮层分离,真皮层出现大量空泡。14 d时皮肤结构不可辨认,成均质纤维化。7 d时MP组皮片角质层增厚,有少量炎性细胞。14 d时可见表皮角质层脱落,真皮中大量胶原纤维崩解并且由于坏死出现大面积空洞。7 d时ADSCs组与ADSCs+MP组有少量炎性细胞浸润,14 d时可见ADSCs组与表皮角质层增厚,有炎性细胞浸润,ADSCs+MP组有少量炎性细胞浸润。
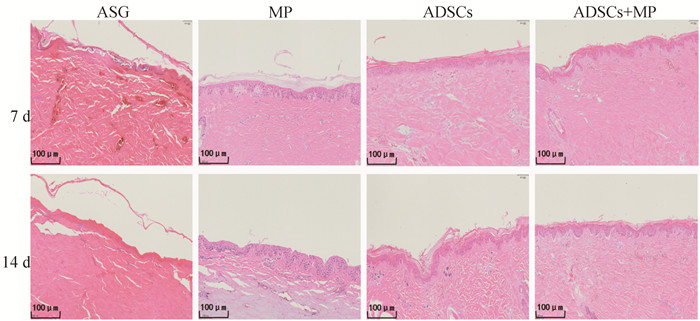
|
图 3 皮肤组织病理变化 Fig. 3 Pathological changes in skin tissue |
图 4可知,在7 d时WBC结果表明,ADSCs组相比于ASG组显著下降(P<0.05),其他组无显著性差异。14 d时ADSCs+MP组较ASG组显著下降(P<0.05),其他组无显著性差异。7 d时NEU结果显示,MP组相较于ASG组显著上升(P<0.05)。在14 d时ADSCs组与ADSCs+MP组相较于ASG组均极显著降低(P<0.01)。LYM在7、14 d各组之间无显著性差异。GLB在7 d时MP组、ADSCs组、ADSCs+MP组相较于ASG组均极显著降低(P<0.01)。在14 d时MP组相较于ASG组显著下降(P<0.05),其他组无显著性差异。
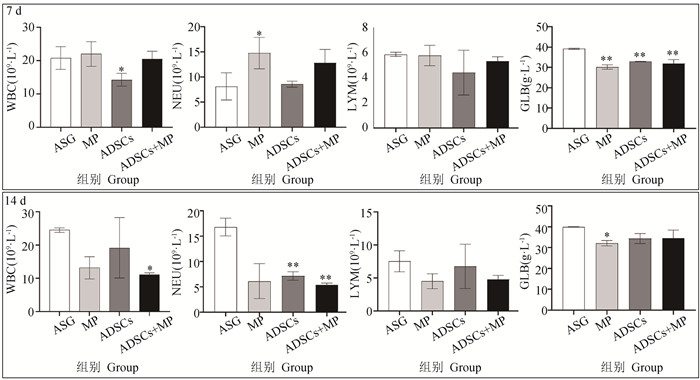
|
与ASG组相比,*.P < 0.05, **.P < 0.01 Compared with ASG group, *.P < 0.05, **.P < 0.01 图 4 血常规及血清生化GLB结果 Fig. 4 Blood routine and serum biochemical GLB results |
图 5显示,在7、14 d时,ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的GSH表达量极显著高于ASG组与MP组。14 d时,ADSCs+MP组(P<0.05)的GSH的表达量显著高于ADSCs组。在7 d时,ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的SOD表达量极显著高于ASG组与MP组。MP组(P<0.05)的表达量显著高于ASG组。14 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的SOD表达量极显著高于ASG组。ADSCs+MP组(P < 0.01)的SOD表达量极显著高于MP组。MP组与ASG组无显著性差异。
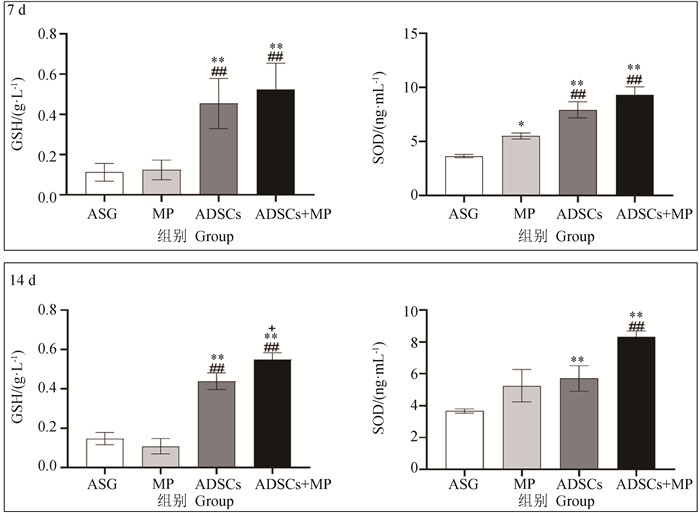
|
与ASG组相比,*.P < 0.05, **.P < 0.01;与MP组相比,##.P < 0.01;与ADSCs组相比,+.P < 0.05 Compared with ASG group, *.P < 0.05, **.P < 0.01; Compared with MP group, ##.P < 0.01; Compared with ADSCs group, +.P < 0.05 图 5 氧化应激反应指标结果 Fig. 5 Results of oxidative stress indexes |
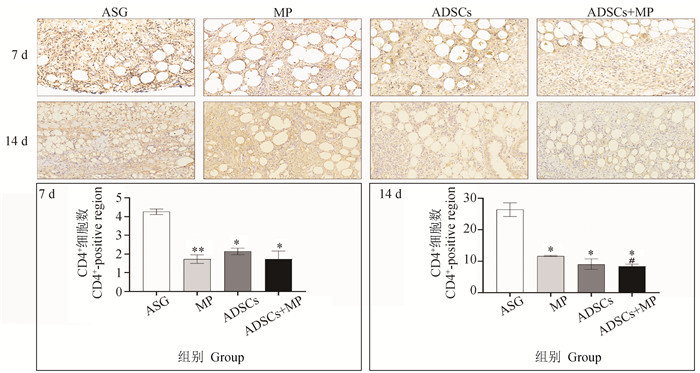
图 6显示,7 d时可见ADSCs组(P < 0.05)与ADSCs+MP组(P < 0.05)的CD4+T细胞的数量显著低于ASG组。MP组(P < 0.01)CD4+T细胞数量极显著低于ASG组。ADSCs组与ADSCs+MP组无显著性差异。在14 d时可见MP组(P < 0.05)、ADSCs组(P < 0.05)、ADSCs+MP组(P < 0.05)的CD4+T细胞数量显著低于ASG组,ADSCs+MP组(P < 0.05)显著低于MP组。
|
与ASG组相比,*.P < 0.05, **.P < 0.01;与MP组相比,#.P < 0.05 Compared with ASG group, *.P < 0.05, **.P < 0.01; Compared with MP group, #.P < 0.05 图 6 CD4+T细胞在各组的表达 Fig. 6 Expression of CD4+ T cells in each group |
图 7显示,在7 d时IL-1β在ASG组的表达量均极显著高于MP组(P < 0.01)、ADSCs组(P < 0.01)、ADSCs+MP组(P < 0.01)。在14 d时,IL-1β在ASG组的表达量显著高于MP组(P < 0.05)、ADSCs组(P < 0.05)、ADSCs+MP组(P < 0.05)。MP、ADSCs、ADSCs+MP之间没有显著性差异。IL-6的表达量在7 d时ASG组显著高于MP组(P < 0.05)、ADSCs+MP组(P < 0.05),极显著高于ADSCs组(P < 0.01)。在14 d时,IL-6 ASG组的表达量极显著高于MP组(P < 0.01)、ADSCs组(P < 0.01)、ADSCs+MP组(P < 0.01)。MP、ADSCs、ADSCs+MP之间没有显著性差异。TNF-α的表达量7 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)相对于ASG组极显著下降,MP组相对于ASG组无显著性差异。14 d时4组无显著性差异。IL-2的表达量在7、14 d时相对于ASG组,ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)极显著降低,MP组相对于ASG组无显著性差异。IFN-γ的表达量在7、14 d时相对于ASG组,MP组(P < 0.01)、ADSCs组(P < 0.01)、ADSCs+MP组(P < 0.01)极显著下降。在7、14 d时,IL-4的表达量ADSCs+MP组(P < 0.01)相对于ASG组极显著升高。ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)IL-10的表达量相对于ASG组,ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)在7、14 d时极显著上升。MP组相对于ASG组无显著性差异。

|
与ASG组相比,*.P < 0.05, **.P < 0.01 Compared with ASG group, *.P < 0.05, **.P < 0.01 图 7 炎症因子表达量结果 Fig. 7 Expression results of inflammatory factors |
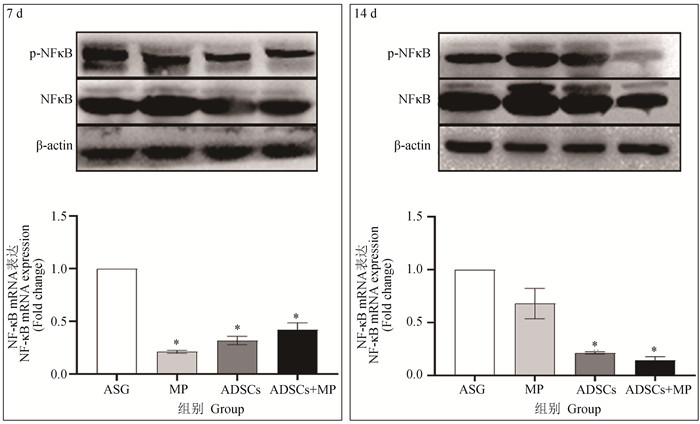
图 8显示,在7、14 d时NF-κB的蛋白结果表明。ASG组P-NFκB的表达量显著大于ADSCs组、ADSCs+MP组。在7 d时MP组(P<0.05)、ADSCs组(P<0.05)、ADSCs+MP组(P<0.05)的NF-κB基因表达量显著低于ASG组,MP组、ADSCs组、ADSCs+MP组之间无显著性差异。14 d时,ADSCs组(P<0.05)与ADSCs+MP组(P<0.05)的NF-κB基因表达量显著低于ASG组,MP组与ASG组无显著性差异。
|
与ASG组相比,*.P < 0.05, **.P < 0.01 Compared with ASG group, *.P < 0.05, **.P < 0.01 图 8 NF-κB的蛋白与基因的表达量 Fig. 8 Protein and gene expression of NF-κB |
图 9表明,7 d时MP组TGF-β的表达量显著低于ADSCs与ADSCs+MP组。但14 d时MP组与ADSCs组、ADSCs+MP组并未有显著性差异。VEGF在7、14 d时ADSCs组、ADSCs+MP组的表达量显著高于MP组。CXCR4在7 d的ADSCs组(P<0.01)、ADSCs+MP组(P<0.01)、MP组(P<0.01)的表达量极显著高于ASG组,ADSCs组(P<0.05)显著高于MP组,ADSCs+MP组(P<0.01)极显著高于MP组,ADSCs+MP组(P<0.05)显著高于ADSCs组。CXCR4在14 d的ADSCs组(P<0.01)、ADSCs+MP组(P<0.01)的表达量极显著高于ASG组。MP组(P<0.05)的表达量显著高于ASG组。SDF1在7、14 d时,ADSCs组(P<0.01)与ADSCs+MP组(P<0.01)SDF1的表达量极显著高于MP组,ADSCs组(P<0.01)极显著高于ASG组。

|
与ASG组相比,*.P < 0.05, **.P < 0.01;与MP组相比,#.P < 0.05,##.P < 0.01;与ADSCs组相比,+.P < 0.05 Compared with ASG group, *.P < 0.05, **.P < 0.01; Compared with MP group, #.P < 0.05, ##.P < 0.01; Compared with ADSCs group, +.P < 0.05 图 9 愈合生长因子表达量 Fig. 9 Expression of healing growth factor |
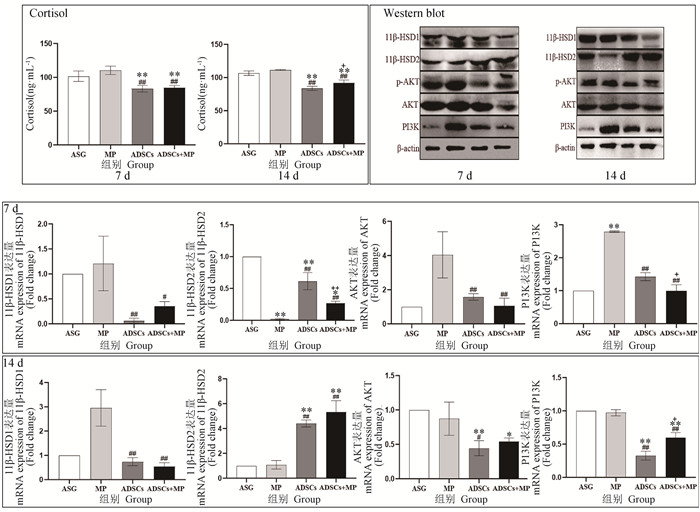
图 10表明,在7、14 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)皮质醇(cortisol)的表达量极显著低于ASG组与MP组。在14 d时,ADSCs+MP组(P < 0.05)显著高于ADSCs组。14 d时免疫印迹结果表明,在7、14 d时ADSCs组与ADSCs+MP组的11β-HSD1显著小于MP组,并且其11β-HSD2的表达量显著大于MP组。P-AKT的表达中MP组显著大于ADSCs组与ADSCs+MP组。在7、14 d时MP组PI3K的表达显著高于ADSCs组与ADSCs+MP组。从基因表达量上分析:11β-HSD1在7 d时ADSCs组(P < 0.01)的表达量极显著低于MP组,ADSCs+MP组(P < 0.05)显著低于MP组。14 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的表达量极显著低于MP组。11β-HSD2在7 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的表达量极显著高于MP组,MP组(P < 0.01)与ADSCs组(P < 0.01)极显著低于ASG组,ADSCs+MP组(P < 0.05)显著低于ASG组,ADSCs+MP组(P < 0.01)极显著低于ADSCs组。14 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的表达量极显著高于ASG组与MP组。7 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的AKT的表达量极显著低于MP组。14 d时,ADSCs组AKT的表达量极显著(P < 0.01)低于ASG组,显著(P < 0.05)低于MP组。ADSCs+MP组(P < 0.05)AKT的表达量显著低于ASG组。7 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)PI3K的表达量极显著低于MP组,ADSCs+MP组(P < 0.05)的表达量显著低于ADSCs组。14 d时ADSCs组(P < 0.01)与ADSCs+MP组(P < 0.01)的表达量极显著低于ASG组与MP组。
|
与ASG组相比,*.P < 0.05, **.P < 0.01;与MP组相比,#.P < 0.05,##.P < 0.01;与ADSCs组相比,+.P<0.05,++.P < 0.01 Compared with ASG group, *.P < 0.05, **.P < 0.01; Compared with MP group, #.P < 0.05, ##.P < 0.01; Compared with ADSCs group, +.P<0.05, ++.P < 0.01 图 10 创口生长因子上游通路的表达量检测 Fig. 10 Expression detection of the upstream pathway of wound growth factor |
对于异体皮肤移植,移植皮片排斥反应评估主要是依据kanitakis与banff 2007分级[15]。其中kanitakis分级主要是依据皮肤表观变化。banff 2007分级主要依据病理学变化,如:炎症浸润、角质层细胞状态等进行病理分级(表 2、3)。从皮肤表观上分析,7 d时ASG组在Ⅲ~Ⅳ级,MP组在Ⅱ~Ⅲ级,ADSCs组与ADSCs+MP组在Ⅰ~Ⅱ级。14 d时ASG组与MP组为Ⅳ级,ADSCs组皮片黑色坏死部分在1/3~2/3,为Ⅲ~Ⅳ级、ADSCs+MP组在Ⅱ~Ⅲ级。21 d时4组皮片均为Ⅳ级。表明在21 d时4组皮片均已坏死。从病理学分析可见,在7 d时ASG组为Ⅲ~Ⅳ级,MP组在Ⅱ~Ⅲ级,ADSCs组与ADSCs+MP组为Ⅱ~Ⅲ级。14 d时ASG组与MP组为Ⅳ级,ADSCs组为Ⅲ~Ⅳ级,ADSCs+MP组为Ⅱ~Ⅲ级。综合两种分析评级方式可见在ASG组皮片存活时间为7 d左右,而MP组存活时间为7~14 d,ADSCs组与ADSCs+MP组存活时间则为14~21 d。这说明ADSCs+MP可以有效延长皮片存活时间。
|
|
表 2 目测法皮片排斥分级 Table 2 Visual skin rejection grading |
|
|
表 3 病理学分析移植皮片排斥分级 Table 3 Case analysis of grading of grafted skin rejection |
异体皮肤移植后,由于HLA的不完全匹配可能会导致移植物中的T淋巴细胞进入到受体体内,对受体造成全身性的炎症反应。本研究对受体小型猪血液进行血常规与血清生化进行检测。结果表明,应用ADSCs组与ADSCs+MP组可以显著减少血液中中性粒细胞与球蛋白的含量。说明ADSCs+MP抑制由异体皮肤移植引发的全身性炎性反应。
研究表明,导致异体移植皮片坏死的主要原因是供受体之间的免疫排斥反应。在异体皮肤移植7 d时,移植皮片会与创口间组织粘连,并在创底与移植皮片之间会有相应的肉芽组织再生与血管重建。但当血供建立完成后,异体皮片中的树突细胞会随着血管进入到受体的次级淋巴结中,此时经抗原呈递细胞的识别后会刺激CD4+与CD8+的大量分泌[16],并会大量分化TH1进而促进IL-2与IFN-γ等炎性因子的分泌[17-18]。导致7~14 d时在创底与异体移植皮片交界处产生大量炎症反应并导致移植皮片坏死。结果表明,ADSCs+MP可以有效抑制CD4+T细胞。并且通过抑制炎症因子上游蛋白NF-κB来抑制炎症因子IL-2与IFN-γ的表达,从而抑制免疫排斥反应。
在伤口愈合炎症期时,巨噬细胞根据愈合过程的阶段表达不同的表型和活动。促炎巨噬细胞在早期被招募到伤口区域。它们表达TNF-α、IL1β、IL-6等促炎因子以杀死病原体,在抗炎反应后期时抗炎巨噬细胞会被召集到创口处抑制炎症的发展,并促进肉芽组织填充。但甲泼尼龙大量使用时,会显著延长伤口的炎症期,并抑制血管的重建与肉芽组织的再生。从而导致伤口愈合缓慢[19-20]。本研究表明,相对于MP组,ADSCs+MP可以显著促进抗炎巨噬细胞分泌IL-10、IL-4,并且抑制促炎巨噬细胞分泌IL-6、IL-1β、TNF-α。使创伤快速渡过炎症反应期,达到促进创口组织再生的目的。
VEGF可以激活内皮细胞增殖、迁移和形成芽。此外,VEGF还参与了血管形成、伤口愈合和器官再生[21]。但糖皮质激素会通过抑制VEGF达到抑制血管再生的目的[22]。本研究结果表明,相对于MP组,ADSCs+MP组可以显著提高VEGF、SDF-1、CXCR4的表达。这证明ADSCs具有逆转糖皮质激素抑制血管生成和迁移的作用。除此之外,TGF-β具有抑制CD4+T细胞、抑制IL-2等炎性因子表达并增强肉芽组织再生等的功能[23-24],本试验结果表明甲泼尼龙可以抑制TGF-β的表达,但在ADSCs+MP中可显著促进TGF-β的表达。说明ADSCs+MP可通过促进VEGF、TGF-β等生长因子的分泌来促进创口愈合。
在表皮真皮中存在11β-HSD1能将可的松转化为皮质醇发挥出抗炎的作用[25]。而当皮肤皮质醇表达过量时会导致延长皮肤创口愈合炎症反应期,抑制创口肉芽组织再生与血管重建[26-27]。当注射大量外源性糖皮质激素时,可以通过11β-HSD1的大量表达来促进皮质醇的升高[28],进而危害皮肤创口愈合。但这种升高可以被ADSCs所逆转。这证明ADSCs可以通过抑制11β-HSD1、促进11β-HSD2的表达来抑制皮肤皮质醇的含量,进而促进皮肤愈合。研究表明,外源性给予糖皮质激素时会导致机体PI3K/AKT的水平升高[29],并且当PI3K被抑制时,11β-HSD1也会被抑制[30]。本试验结果表明,ADSCs可以逆转由甲泼尼龙引起的PI3K高表达。由此研究表明ADSCs有可能是通过PI3K/AKT通路来影响11β-HSD1的表达,进而达到抑制皮质醇表达的目的。
4 结论1) ADSCs+MP组相对于ASG组,有效延长皮片存活时间至14~21 d。并为以后更换组织工程皮等创造更有利的条件与时间。2)ADSCs+MP通过影响NF-κB的表达抑制IL-2、INF-γ等炎性因子的表达抑制免疫排斥反应。3)相较于ASG组,ADSCs+MP通过促进VEGF、TGF-β、SDF-1等愈合因子的表达,进而促进创口愈合。4)ADSCs可以通过PI3K/AKT通路影响11β-HSD1的表达,起到抑制皮脂醇增多的作用。
| [1] |
SCHLOTTMANN F, BUCAN V, VOGT P M, et al. A short history of skin grafting in burns: from the gold standard of autologous skin grafting to the possibilities of allogeneic skin grafting with immunomodulatory approaches[J]. Medicina (Kaunas), 2021, 57(3): 225. |
| [2] |
GOOPTU M, KORETH J. Translational and clinical advances in acute graft-versus-host disease[J]. Haematologica, 2020, 105(11): 2550-2560. DOI:10.3324/haematol.2019.240309 |
| [3] |
CLIMOV M, MATAR A J, FARKASH E A, et al. Survival of allogeneic self-assembled cultured skin[J]. Transplantation, 2016, 100(10): 2071-2078. DOI:10.1097/TP.0000000000001353 |
| [4] |
UENO P, FELIPE C, FERREIRA A, et al. Wound healing complications in kidney transplant recipients receiving Everolimus[J]. Transplantation, 2017, 101(4): 844-850. DOI:10.1097/TP.0000000000001392 |
| [5] |
BOOTUN R. Effects of immunosuppressive therapy on wound healing[J]. Int Wound J, 2013, 10(1): 98-104. DOI:10.1111/j.1742-481X.2012.00950.x |
| [6] |
HAHNENKAMP K, BÖHLER K, WOLTERS H, et al. Organ-protective intensive care in organ donors[J]. Dtsch Arztebl Int, 2016, 113(33-34): 552-558. |
| [7] |
ANUDEEP T C, JEYARAMAN M, MUTHU S, et al. Advancing regenerative cellular therapies in non-scarring alopecia[J]. Pharmaceutics, 2022, 14(3): 612. DOI:10.3390/pharmaceutics14030612 |
| [8] |
LI C, WEI S Q, XU Q C, et al. Application of ADSCs and their exosomes in scar prevention[J]. Stem Cell Rev Rep, 2022, 18(3): 952-967. DOI:10.1007/s12015-021-10252-5 |
| [9] |
HU J L, KWON S T, KIM S W, et al. Effects of administration route of adipose-derived stem cells on the survival of allogeneic skin grafts in mice[J]. Transplant Proc, 2021, 53(7): 2397-2406. DOI:10.1016/j.transproceed.2021.07.006 |
| [10] |
MAZINI L, ROCHETTE L, ADMOU B, et al. Hopes and limits of adipose-derived stem cells (ADSCs) and mesenchymal stem cells (MSCs) in wound healing[J]. Int J Mol Sci, 2020, 21(4): 1306. DOI:10.3390/ijms21041306 |
| [11] |
SMAKAJ A, DE MAURO D, ROVERE G, et al. Clinical application of adipose derived stem cells for the treatment of aseptic non-unions: current stage and future perspectives-systematic review[J]. Int J Mol Sci, 2022, 23(6): 3057. DOI:10.3390/ijms23063057 |
| [12] |
EYLERT G, DOLP R, PAROUSIS A, et al. Skin regeneration is accelerated by a lower dose of multipotent mesenchymal stromal/stem cells-a paradigm change[J]. Stem Cell Res Ther, 2021, 12(1): 82. DOI:10.1186/s13287-020-02131-6 |
| [13] |
胡俊西. 巴马小型香猪皮肤比较生物学研究[D]. 重庆: 西南大学, 2006. HU J X. Comparative biological research of skin in Bama minipig[D]. Chongqing: Southwest University, 2006. (in Chinese) |
| [14] |
陈俊颖, 魏泓. 猪皮肤在创伤修复中的应用研究进展[J]. 西南国防医药, 2009, 19(11): 1151-1153. CHEN J Y, WEI H. Research progress on the application of porcine skin in trauma repair[J]. Medical Journal of National Defending Forces in Southwest China, 2009, 19(11): 1151-1153. (in Chinese) |
| [15] |
CENDALES L C, KANITAKIS J, SCHNEEBERGER S, et al. The Banff 2007 working classification of skin-containing composite tissue allograft pathology[J]. Am J Transplant, 2008, 8(7): 1396-1400. DOI:10.1111/j.1600-6143.2008.02243.x |
| [16] |
LUO L, LI C W, WU W Q, et al. Functional analysis of alloreactive memory CD4+ T cells derived from skin transplantation recipient and naive CD4+ T cells derived from untreated mice[J]. J Surg Res, 2012, 176(2): 649-656. DOI:10.1016/j.jss.2011.11.003 |
| [17] |
RICHTERS C D, HOEKSTRA M J, DU PONT J S, et al. Immunology of skin transplantation[J]. Clin Dermatol, 2005, 23(4): 338-342. DOI:10.1016/j.clindermatol.2004.07.022 |
| [18] |
BENICHOU G, YAMADA Y, YUN S H, et al. Immune recognition and rejection of allogeneic skin grafts[J]. Immunotherapy, 2011, 3(6): 757-770. DOI:10.2217/imt.11.2 |
| [19] |
WYNN T A, VANNELLA K M. Macrophages in tissue repair, regeneration, and fibrosis[J]. Immunity, 2016, 44(3): 450-462. DOI:10.1016/j.immuni.2016.02.015 |
| [20] |
AITCHESON S M, FRENTIU F D, HURN S E, et al. Skin wound healing: normal macrophage function and macrophage dysfunction in diabetic wounds[J]. Molecules, 2021, 26(16): 4917. DOI:10.3390/molecules26164917 |
| [21] |
LOGIE J J, ALI S, MARSHALL K M, et al. Glucocorticoid-mediated inhibition of angiogenic changes in human endothelial cells is not caused by reductions in cell proliferation or migration[J]. PLoS One, 2010, 5(12): e14476. DOI:10.1371/journal.pone.0014476 |
| [22] |
LANGENDORF E K, ROMMENS P M, DREES P, et al. Dexamethasone Inhibits the pro-angiogenic potential of primary human myoblasts[J]. Int J Mol Sci, 2021, 22(15): 7986. DOI:10.3390/ijms22157986 |
| [23] |
FUJIO K, KOMAI T, INOUE M, et al. Revisiting the regulatory roles of the TGF-β family of cytokines[J]. Autoimmun Rev, 2016, 15(9): 917-922. DOI:10.1016/j.autrev.2016.07.007 |
| [24] |
MORIKAWA M, DERYNCK R, MIYAZONO K. TGF-β and the TGF-β family: context-dependent roles in cell and tissue physiology[J]. Cold Spring Harb Perspect Biol, 2016, 8(5): a021873. DOI:10.1101/cshperspect.a021873 |
| [25] |
ZHONG C X, WANG S Z, DANG L, et al. Progress in 11β-HSD1 inhibitors for the treatment of metabolic diseases: a comprehensive guide to their chemical structure diversity in drug development[J]. Eur J Med Chem, 2020, 191: 112134. DOI:10.1016/j.ejmech.2020.112134 |
| [26] |
TERAO M, MUROTA H, KIMURA A, et al. 11β-Hydroxysteroid dehydrogenase-1 is a novel regulator of skin homeostasis and a candidate target for promoting tissue repair[J]. PLoS One, 2011, 6(9): e25039. DOI:10.1371/journal.pone.0025039 |
| [27] |
TIGANESCU A, HUPE M, UCHIDA Y, et al. Increased glucocorticoid activation during mouse skin wound healing[J]. J Endocrinol, 2014, 221(1): 51-61. DOI:10.1530/JOE-13-0420 |
| [28] |
DASHTI-KHAVIDAKI S, SAIDI R, LU H. Current status of glucocorticoid usage in solid organ transplantation[J]. World J Transplant, 2021, 11(11): 443-465. DOI:10.5500/wjt.v11.i11.443 |
| [29] |
MORGAN S A, SHERLOCK M, GATHERCOLE L L, et al. 11β-hydroxysteroid dehydrogenase type 1 regulates glucocorticoid-induced insulin resistance in skeletal muscle[J]. Diabetes, 2009, 58(11): 2506-2515. DOI:10.2337/db09-0525 |
| [30] |
SHIBAYAMA Y, ALKHOURY C, NEMAZANYY I, et al. Class 3 phosphoinositide 3-kinase promotes hepatic glucocorticoid receptor stability and transcriptional activity[J]. Acta Physiol (Oxf), 2022, 235(1): e13793. |
(编辑 白永平)



