青海省特色野生植物黑果枸杞(Lycium ruthenicum Murray)含有丰富的花青素(anthocyanidin),有“花青素之王”之称,花青素别名花色苷,是水溶性类黄酮色素的重要亚类[1-3]。据报道,花青素有预防心血管疾病等生物功效[4-5]。近年来, 对于花青素抗炎[6]、抗氧化能力得到多方面的证实[7-8]。
氧气对于机体的正常有氧代谢至关重要,是维持稳态的基础[9]。居住在高海拔地区[10]、低氧血症(低血氧含量和低血压)、供氧受损和细胞摄氧/利用受损会使机体中氧含量和压力低于正常水平,会使机体造成缺氧[11]。研究表明,缺氧能够诱发一系列心血管疾病,导致心内环境低氧引起心肌细胞凋亡对机体带来的影响[12]。但目前,很少看到黑果枸杞花青素对H9c2大鼠心肌细胞凋亡影响的调控作用的报道,基于此,本研究通过探究黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡影响,明确其对低氧诱导的H9c2大鼠心肌细胞的保护作用,为深入研究黑果枸杞花青素调控低氧诱导的H9c2大鼠心肌细胞凋亡的分子机制提供理论参考,也为其对动物机体的免疫作用研究提供一定的理论依据。
1 材料与方法 1.1 细胞来源大鼠H9c2细胞株购自中国科学院上海细胞库。
1.2 药物及试剂黑果枸杞花青素(纯度:64.4%)购自青海金麦杞生物科技有限公司;红景天苷(salidroside)标准品SS8080购自北京索莱宝科技有限公司;DMEM干粉、胎牛血清、双抗购自Gibco公司;PBS购自Hfart公司;Hoechst33342/PI双染试剂盒CA1120-100T、RIPA裂解液、5×蛋白上样缓冲液、TRIZOL购自北京索莱宝科技有限公司;LDH检测试剂盒C0016、ROS检测试剂盒S0033S、细胞凋亡检测试剂盒C1062S、鼠源GADPH一抗、山羊抗兔IgG A0516购自碧云天生物技术有限公司;鼠源Bcl2一抗、鼠源Bax一抗购自美国Proteintech公司;PageRuler预染蛋白Marker购自美国Thermo fisher公司;PVDF膜购自美国Millipore公司。
1.3 仪器台式电热恒温鼓风干燥箱及CO2细胞培养箱,购自美国NUAIRE公司;MIC-101细胞低氧小室-细胞缺氧-细胞高氧富氧培养仓,购自杭州Aipu Instrument Equipment有限公司;高速低温水平离心机购自英国Dynamica公司;酶标仪购自意大利MuLTISKAN公司;电子天平购自美国METTLER TOLEDO公司;倒置荧光显微镜购自日本奥林巴斯公司;高端流式细胞仪购自美国BECKMAN COULTER公司;电泳仪、荧光定量PCR仪器购自美国Bio-Rad公司;恒温金属浴购自苏州江东精密仪器有限公司;Western blot转膜仪、电泳仪购自北京六一生物科技公司;摇床购自美国SCILOGEX公司;PH仪购自美国Alalis公司;化学发光成像仪购自北京赛智科技有限公司。
1.4 细胞培养1.4.1 细胞常规培养 H9c2大鼠心肌细胞于37 ℃、5% CO2、饱和湿度条件下在细胞培养箱中进行常规培养,待细胞生长至融合度70%~80%时进行传代,2~3 d进行一次细胞传代,培养足够的细胞。
1.4.2 构建体外H9c2大鼠心肌细胞低氧模型 H9c2大鼠心肌细胞生长密度约60%时,将细胞分为常氧组和低氧组,常氧组细胞置于CO2培养箱(O2=21%,N2=74%,CO2=5%)将低氧组细胞置于细胞低氧培养装置(O2=1%,N2=94%,CO2=5%)中作低氧诱导24 h,常氧组细胞则进行常规培养。
1.5 LDH含量测定将H9c2大鼠心肌细胞以1×105·mL-1的密度接种于96孔板中,100 μL·孔-1,细胞生长密度约60%时进行诱导。设常氧组(N)、低氧组(H)和低氧+黑果枸杞花青素组(H+AC),常氧组细胞进行常规培养,低氧组细胞在O2=1%条件下诱导24 h,低氧+黑果枸杞花青素组细胞采用50 μg·mL-1黑果枸杞花青素预处理12 h后,置于低氧+50 μg·mL-1黑果枸杞花青素条件下继续诱导培养24 h。在各时间点前的1 h,阳性对照孔加10 μL LDH最大稀释剂,随后将96孔板400 g离心5 min;取120 μL各孔上清和60 μL LDH检测试剂(检测前新鲜配制,包括20 μL乳酸溶液、20 μL酶溶液、20 μL 1×NT溶液),加至新的96孔板中,避光孵育30 min用酶标仪检测各孔490 nm处吸光度。
1.6 观察细胞形态将H9c2大鼠心肌细胞以1×106·mL-1的密度接种于6孔板中(1 mL·孔-1),细胞分组及培养同“1.5”,正常光源下通过倒置荧光显微镜观察心肌细胞形态学变化。
1.7 ROS含量测定将H9c2大鼠心肌细胞以1×106·mL-1的密度接种于6孔板中(1 mL·孔-1),待细胞贴壁24 h后,对细胞进行诱导,设常氧组(N)、低氧组(H)和低氧+黑果枸杞花青素组(H+AC)、低氧+红景天苷组(H+Sal)。常氧组细胞进行常规培养;低氧组细胞在O2=1%条件下诱导24 h;低氧+黑果枸杞花青素组细胞采用50 μg·mL-1黑果枸杞花青素预处理12 h后,细胞置于低氧+50 μg·mL-1黑果枸杞花青素条件下继续诱导培养24 h;低氧+红景天苷组细胞采用1×10-4 mol·L-1红景天苷预处理12 h后,细胞置于低氧+1×10-4 mol·L-1红景天苷条件下继续诱导培养24 h[13]。无血清培养液:DCFH-DA=1∶1 000对DCFH-DA进行稀释,阳性对照组加入10 μL Rosup,原位装载DCFH-DA荧光探针后孵育30 min,洗涤2次以充分去除未装载的探针,通过荧光酶标仪测定荧光强度值,其中,激发波长为502 nm,发射波长为530 nm。
1.8 Hoechst33342/PI双染法检测黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡程度以每孔5×105·mL-1细胞接种至24孔培养板,细胞分组及培养同“1.7”。PBS洗涤2次后加入4%甲醛固定,先后加入Hoechst33342和PI染液,避光室温孵育30 min后洗涤2次,在倒置荧光显微镜上观察拍照。
1.9 流式细胞术检测黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡率将H9c2大鼠心肌细胞以1×106·mL-1的密度接种于6孔板中(每孔1 mL),待细胞贴壁24 h后,对细胞进行诱导,细胞分组同“1.7”。收集细胞液,加入不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶收集贴壁细胞,用PBS清洗两次后, 进行AnnexinV/PI双染,避光室温孵育5 min后, 上机检测。
1.10 qRT-PCR法检测黑果枸杞花青素对低氧诱导的凋亡相关因子(Bcl2、Bax)在mRNA表达水平细胞分组同“1.7”,TRIZOL法提取Total RNA,分别通过凝胶电泳和微量核酸蛋白检测仪检测RNA样品的完整性和浓度。通过逆转录体系(4.0 μL 5×FastKing-RT Super Mix、50 ng~2.0 μg Total RNA和RNase Free ddH2O)进行42 ℃反应15 min,而后95 ℃反应3 min获得cDNA。之后使用荧光定量反应体系(10 μL 2×SuperReal Color PreMix、0.6 μL正向引物、0.6 μL反向引物、2 μL含Dilution Buffer的cDNA模板和RNase-free ddH2O)进行95 ℃条件下反应15 min;95 ℃ 10 sec;55 ℃ 30 sec;72 ℃ 32 sec进行40个循环,使用上海生工设计合成的引物,如表 1所示,各基因的相对表达量采用2-ΔΔct法表示。
|
|
表 1 凋亡因子引物序列 Table 1 Primer sequences of apoptosis factors |
细胞分组同“1.7”,提取细胞总蛋白通过BCA法蛋白质定量,而后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,70 V电泳20 min,当marker条带跑过浓缩胶,电压升高到120 V。切胶后转印50 min,封闭液封闭2 h,聚偏氟乙烯[poly(vinylidene fluoride),PBST]洗涤PVDF膜5次。一抗4 ℃孵育过夜;次日PBST洗涤5次后加入二抗孵育1 h。ECL发光液显色后用凝胶成像系统观察条带分布。
1.12 统计学分析运用SPSS 22.0统计软件进行单因素方差分析,邓肯氏法进行组间多重比较,所得数据均以“x±s”表示,采用Graphpad Prism 8.0软件绘图。*表示差异显著(P < 0.05);** 表示差异极显著(P < 0.01);无标注表示差异不显著(P>0.05)。
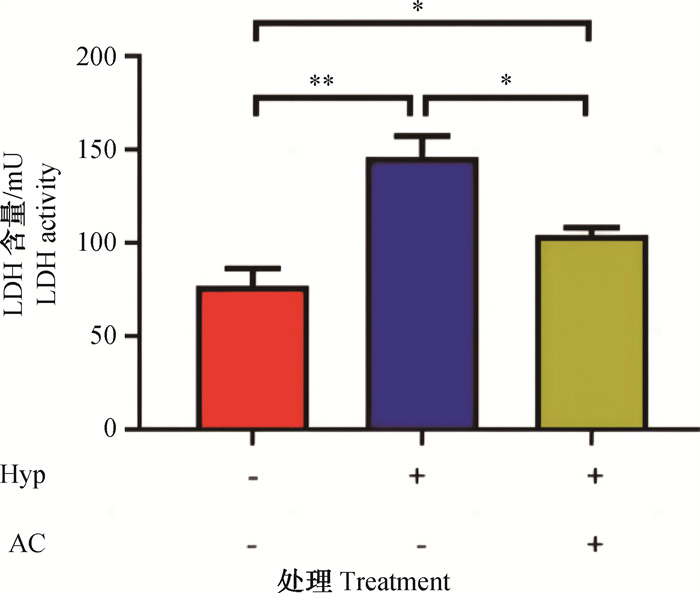
2 结果 2.1 黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞LDH含量的影响由图 1可知,与常氧组相比,低氧组H9c2大鼠心肌细胞LDH含量极显著增加(P<0.01);低氧+黑果枸杞花青素组LDH含量显著增加(P<0.05)。与低氧组相比,低氧+黑果枸杞花青素组H9c2大鼠心肌细胞LDH含量显著减少(P<0.05)。综上所述,黑果枸杞花青素可以有效抑制低氧环境下H9c2大鼠心肌细胞LDH含量,降低低氧诱导的细胞损伤,保护细胞完整性。
|
Hyp. 低氧;AC. 黑果枸杞花青素;*. P < 0.05;**. P < 0.01 Hyp. Hypoxia; AC. Anthocyanin; *. P < 0.05;**. P < 0.01 图 1 黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞LDH含量的影响 Fig. 1 Effect of Lycium ruthenicum Murray anthocyanin on LDH content in H9c2 rat cardiomyocytes under hypoxic condition |
由图 2可知,在正常光源下观察细胞形态发现,与常氧组相比,低氧和低氧+黑果枸杞花青素组H9c2大鼠心肌细胞出现不同程度的密度降低,细胞缩小,细胞边界模糊,呈现凋亡和坏死形态。与低氧组相比,低氧+黑果枸杞花青素组细胞密度升高,细胞边界清晰,细胞形态相对正常。结果表明,黑果枸杞花青素可提高低氧诱导的H9c2大鼠心肌细胞密度,减少低氧诱导的细胞形态改变,提高H9c2大鼠心肌细胞活性。

|
Hyp. 低氧;AC. 黑果枸杞花青素;正常细胞用黑色箭头标识,非正常细胞用红色箭头标识 Hyp. Hypoxia; AC. Anthocyanin; Normal cells are marked with black arrows and abnormal cells are marked with red arrows 图 2 黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞形态的影响 Fig. 2 Effects of Lycium ruthenicum Murray anthocyanin on cell morphology in H9c2 rat cardiomyocytes under hypoxic condition |
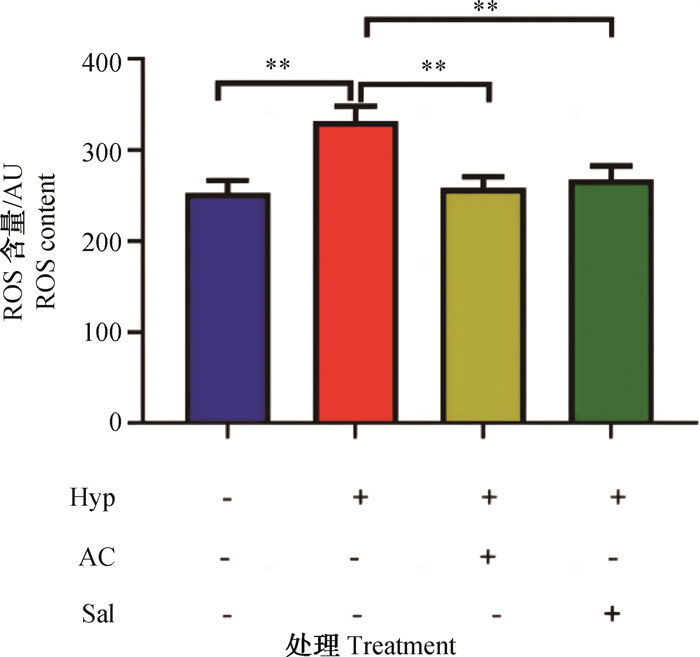
各组ROS含量见图 3。可以看出,与常氧对照组相比,低氧组ROS含量极显著增加(P<0.01),低氧+黑果枸杞花青素和低氧+红景天苷组ROS含量无显著变化(P>0.05)。与低氧组相比,低氧+黑果枸杞花青素和低氧+红景天苷组ROS含量均极显著减少(P<0.01);低氧条件下,黑果枸杞花青素与阳性对照红景天苷对细胞ROS含量的调控作用差异不显著(P>0.05)。综上所述,黑果枸杞花青素可有效降低低氧诱导的H9c2大鼠心肌细胞ROS积聚。
|
Hyp. 低氧;AC. 黑果枸杞花青素;Sal. 红景天苷;*. P < 0.05;**. P < 0.01;无标注表示P>0.05 Hyp. Hypoxia; AC. Anthocyanin; Sal. Salidroside; *. P < 0.05;**. P < 0.01; Unlabeled indicates no significant difference (P>0.05) 图 3 黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞ROS含量的影响 Fig. 3 Effect of Lycium ruthenicum Murray anthocyanin on ROS content in H9c2 rat cardiomyocytes under hypoxic condition |
Hoechst33342和PI均可与DNA或RNA结合,Hoechst33342通过细胞膜将早中期凋亡细胞和正常细胞染成亮蓝色分叶状或碎片状和淡蓝色圆形,而PI因通不过正常细胞细胞膜只能将坏死和晚期凋亡细胞染成不规则红色。Hoechst33342及PI荧光染色结果发现, 与常氧组相比,低氧组蓝色和红色荧光强度明显增强;低氧+黑果枸杞花青素组的荧光强度有增强趋势。与低氧组相比,低氧+黑果枸杞花青素组蓝色和红色荧光强度显著降低(图 4)。结果表明黑果枸杞花青素可有效减少低氧诱导的细胞坏死和细胞凋亡。

|
图 4 黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡的影响 Fig. 4 Effect of Lycium ruthenicum Murray anthocyanin on apoptosis in H9c2 rat cardiomyocytes under hypoxic condition |
由图 5可知,与常氧组相比,低氧组H9c2大鼠心肌细胞凋亡率极显著升高(P < 0.01);低氧+黑果枸杞花青素和低氧+红景天苷组H9c2大鼠心肌细胞凋亡率无显著变化(P>0.05)。与低氧组相比,低氧+黑果枸杞花青素组和低氧+红景天苷组H9c2大鼠心肌细胞凋亡率均极显著降低(P < 0.01)。低氧条件下,黑果枸杞花青素与阳性对照红景天苷对H9c2大鼠心肌细胞凋亡率的影响差异不显著(P>0.05)。结果表明,黑果枸杞花青素可有效抑制低氧诱导的H9c2大鼠心肌细胞凋亡率。

|
A. 大鼠心肌细胞流式细胞术结果图;B. 大鼠心肌细胞凋亡率柱状图(Hyp. 低氧;AC. 黑果枸杞花青素;Sal. 红景天苷;*. P < 0.05;**. P < 0.01;无标注表示P>0.05) A. Flow cytometry of rat cardiomyocytes; B. Histogram of rat cardiomyocyte apoptosis rate (Hyp. Hypoxia; AC. Anthocyanin; Sal. Salidroside; *. P < 0.05;**. P < 0.01; Unlabeled indicates no significant difference, P>0.05) 图 5 黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡率的影响 Fig. 5 Effects of Lycium ruthenicum Murray anthocyanin on apoptosis rate in H9c2 rat cardiomyocytes under hypoxic condition |
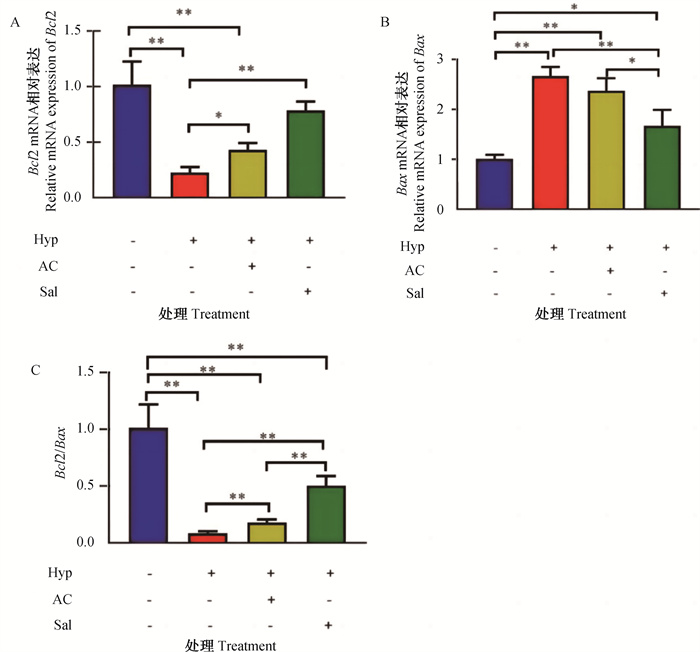
从图 6可以看出,与常氧组相比,低氧组Bcl2和Bcl2/Bax比值的mRNA表达极显著降低(P < 0.01),Bax的mRNA表达极显著上调(P < 0.01);低氧+黑果枸杞花青素组中Bcl2和Bcl2/Bax比值因子的mRNA表达极显著降低(P < 0.01),Bax的mRNA表达无显著变化(P>0.05);低氧+红景天苷组Bax的mRNA表达显著上调(P < 0.05),Bcl2/Bax比值的mRNA表达极显著下降(P < 0.01),Bcl2的mRNA表达无显著变化(P>0.05)。与低氧组相比,低氧+黑果枸杞花青素组中Bcl2和Bcl2/Bax比值的mRNA表达显著上调(P < 0.05),Bax的mRNA表达无显著变化(P> 0.05);低氧+红景天苷组Bcl2和Bcl2/Bax比值的mRNA表达极显著上调(P<0.01),Bax的mRNA表达极显著降低(P<0.01)。低氧条件下,黑果枸杞花青素与Bcl2 mRNA表达的调控作用与阳性对照红景天苷无显著差异(P>0.05)。
|
A. 凋亡相关因子Bcl2 mRNA表达水平;B. 凋亡相关因子Bax mRNA表达水平;C. 凋亡相关因子Bcl2/Bax mRNA表达水平。*. P < 0.05;**. P < 0.01;无标注表示P>0.05 A. Expression level of apoptosis-related factor Bcl2 mRNA; B. Expression level of apoptosis-related factor Bax mRNA; C. Expression level of apoptosis-related factor Bcl2/Bax mRNA. *. P < 0.05;**. P < 0.01; Unlabeled indicates no significant difference (P>0.05) 图 6 黑果枸杞花青素对H9c2大鼠心肌细胞凋亡相关因子mRNA水平表达的影响 Fig. 6 Effects of Lycium ruthenicum Murray anthocyanin on the mRNA expression of apoptosis related factors in H9c2 rat cardiomyocytes |
综上,黑果枸杞花青素在低氧条件下通过上调Bcl2和Bcl2/Bax比值的mRNA表达,下调Bax的mRNA表达来抑制低氧诱导的H9c2大鼠心肌细胞的凋亡。
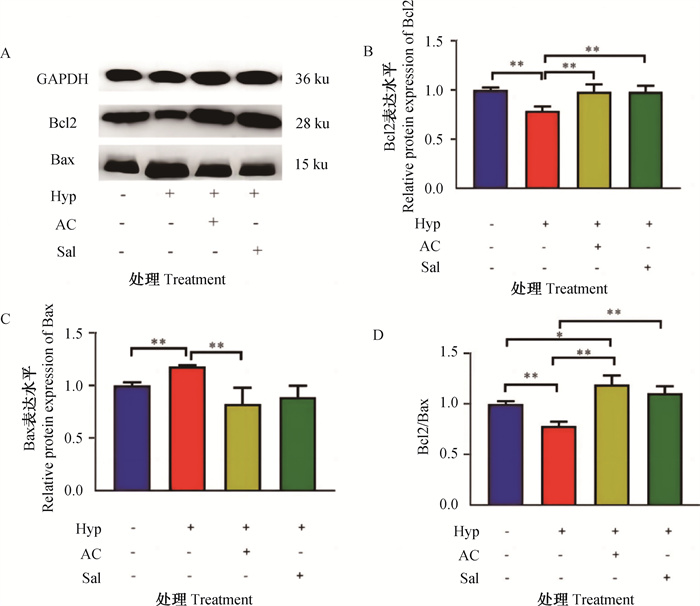
2.7 黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡相关因子(Bcl2、Bax、Bcl2/Bax)在蛋白水平表达的影响从图 7可以看出,与常氧组相比,低氧组Bcl2和Bcl2/Bax比值的蛋白表达极显著降低(P < 0.01),Bax的蛋白表达极显著上调(P < 0.01);低氧+黑果枸杞花青素组中Bcl2/Bax比值因子的蛋白表达显著上调(P < 0.05),Bcl2和Bax的蛋白表达无显著变化(P>0.05);低氧+红景天苷组Bcl2、Bax和Bcl2/Bax比值的蛋白表达均无显著变化(P>0.05)。与低氧组相比,低氧+黑果枸杞花青素和红景天苷组中Bcl2和Bcl2/Bax比值的蛋白表达均极显著上调(P < 0.01),Bax的蛋白表达均极显著降低(P < 0.01)。低氧条件下,黑果枸杞花青素与Bcl2、Bax和Bcl2/Bax比值蛋白表达的调控作用与阳性对照红景天苷无显著差异(P>0.05)。
|
A. 蛋白印迹法检测Bcl2、Bax蛋白表达;B. 凋亡相关因子Bcl2蛋白水平表达;C. 凋亡相关因子Bax蛋白水平表达;D. 凋亡相关因子Bcl2/Bax蛋白水平表达。*. P < 0.05;**. P < 0.01;无标注表示P>0.05 A. The protein expressions of Bcl2 and Bax were determined by Western blot; B. The expression of apoptosis-related factor Bcl2 protein; C. The expression of apoptosis-related factor Bax protein; D. The expression of apoptosis-related factor Bcl2/Bax protein. *. P < 0.05;**. P < 0.01; Unlabeled indicates no significant difference (P>0.05) 图 7 黑果枸杞花青素对H9c2大鼠心肌细胞凋亡相关因子蛋白水平表达的影响 Fig. 7 Effects of Lycium ruthenicum Murray anthocyanin on the protein expression of apoptosis related factors in H9c2 rat cardiomyocytes |
综上,黑果枸杞花青素在低氧条件下通过上调Bcl2和Bcl2/Bax比值的蛋白表达,下调Bax的蛋白表达来抑制低氧诱导的H9c2大鼠心肌细胞的凋亡。
3 讨论组织和细胞处于低于正常氧浓度(21%)的环境被称为低氧[14],严重的低氧会对机体心血管系统、神经系统、代谢相关等多系统器官造成损害。低氧条件下,细胞液中LDH含量升高,细胞发生皱缩、变形等形态学变化,细胞结构即细胞膜的完整性和细胞正常形态遭到破坏。本试验研究结果表明,低氧可造成H9c2大鼠心肌细胞膜完整性降低、细胞形态和结构遭到破坏,呈现凋亡和坏死的形态,与前人研究结果一致[15-16]。此外,试验结果显示,黑果枸杞花青素可以有效保护低氧诱导的H9c2大鼠心肌细胞的细胞形态,抑制低氧诱导的H9c2大鼠心肌细胞ROS积聚,并通过下调Bax、上调Bcl2和Bcl2/Bax比值的mRNA和蛋白表达抑制低氧诱导的H9c2大鼠心肌细胞凋亡。
细胞凋亡是受多基因复杂调控的细胞程序化死亡,涉及胞内相关因子激活、表达及调控等;对动物机体免疫防御、细胞损伤等具有重要作用[17-18]。Bcl2家族蛋白与细胞凋亡机制密切相关,其中抗凋亡蛋白Bcl2的异常表达是凋亡发生的一个关键因素。位于膜表面的Bcl2有调节线粒体通透性转运孔开放的作用,在凋亡信号刺激下,Bcl2的异常表达促使其不可逆的过度开放,破坏细胞膜完整性,释放出促凋亡因子。Bax和Bcl2同属于Bcl2家族,但二者功能相反,Bcl2抑制凋亡的发生,而Bax则促进细胞凋亡[19]。线粒体有氧呼吸是内源性ROS的主要来源[20],缺氧可导致细胞产生大量ROS,ROS若未得到及时清除则破坏机体天然的抗氧化系统,可以直接损伤心肌细胞、蛋白结构及DNA并可通过上调Bcl2、下调Bax的表达诱导心肌细胞凋亡,进而引起缺氧性机体损伤,从而影响心的结构和功能[21-22]。本试验研究发现,低氧环境下,H9c2大鼠心肌细胞ROS过度积聚,通过上调Bax、下调Bcl2和Bcl2/Bax比值的mRNA和蛋白表达促进H9c2大鼠心肌细胞凋亡。红景天苷是缓解高原反应临床药物红景天的主要活性物质之一,具有抗疲劳、抗衰老、免疫调节、清除氧自由基等多种功效[23],已证实对心肌缺血具有保护作用,抑制心肌细胞的凋亡[24],具有良好的抗氧化和消除自由基等生理功能,故试验中将其作为阳性对照组对比检测黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡的影响和对其低氧适应性的作用。本研究结果显示,黑果枸杞花青素可有效抑制低氧诱导的H9c2大鼠心肌细胞ROS含量积聚和凋亡,并在低氧条件下可下调Bax、上调Bcl2和Bcl2/Bax比值的mRNA和蛋白表达来抑制低氧诱导的H9c2大鼠心肌细胞凋亡,且低氧条件下,黑果枸杞花青素对低氧诱导的H9c2大鼠心肌细胞凋亡的抑制作用与红景天苷无显著差异。综上表明,黑果枸杞花青素可有效抑制低氧诱导的H9c2大鼠心肌细胞ROS积聚,并可通过下调Bax、上调Bcl2和Bcl2/Bax的mRNA和蛋白表达抑制H9c2大鼠心肌细胞凋亡。
4 结论低氧条件下,黑果枸杞花青素可以有效抑制H9c2大鼠心肌细胞LDH含量,降低低氧诱导的细胞损伤,保护细胞完整性,并减少低氧诱导的H9c2大鼠心肌细胞形态发生变化,维持H9c2大鼠心肌细胞的正常形态。综上表明,黑果枸杞花青素可以有效缓解低氧引起的H9c2大鼠心肌细胞损伤,对低氧诱导的H9c2大鼠心肌细胞具有良好的保护性。
| [1] |
LI T T, FAN Y F, QIN H, et al. Transcriptome and flavonoids metabolomic analysis identifies regulatory networks and hub genes in black and white fruits of Lycium ruthenicum murray[J]. Front Plant Sci, 2020, 11: 1256. DOI:10.3389/fpls.2020.01256 |
| [2] |
张文颖, 吴华, 莫晨玲, 等. 黑枸杞花青素研究进展[J]. 现代农业科技, 2019(24): 212-214. ZHANG W Y, WU H, MO C L, et al. Research progress on anthocyan of Lycium ruthenicum murr[J]. Modern Agricultural Science and Technology, 2019(24): 212-214. (in Chinese) |
| [3] |
葛翠莲, 黄春辉, 徐小彪. 果实花青素生物合成研究进展[J]. 园艺学报, 2012, 39(9): 1655-1664. GE C L, HUANG C H, XU X B. Research on anthocyanins biosynthesis in fruit[J]. Acta Horticulturae Sinica, 2012, 39(9): 1655-1664. (in Chinese) |
| [4] |
SURESH S, BEGUM R F, ANKUL S S, et al. Anthocyanin as a therapeutic in Alzheimer's disease: a systematic review of preclinical evidences[J]. Ageing Res Rev, 2022, 76: 101595. DOI:10.1016/j.arr.2022.101595 |
| [5] |
张挺, 李冀宏, 周浩楠, 等. 花青素对神经退行性疾病的作用[J]. 生命的化学, 2022, 42(9): 1635-1642. ZHANG T, LI J H, ZHOU H N, et al. Effect of anthocyanins on neurodegenerative diseases[J]. Chemistry of Life, 2022, 42(9): 1635-1642. (in Chinese) |
| [6] |
NIKBAKHT E, SINGH I, VIDER J, et al. Potential of anthocyanin as an anti-inflammatory agent: a human clinical trial on type 2 diabetic, diabetic at-risk and healthy adults[J]. Inflamm Res, 2021, 70(3): 275-284. DOI:10.1007/s00011-021-01438-1 |
| [7] |
PENG Y J, YAN Y M, WAN P, et al. Effects of long-term intake of anthocyanins from Lycium ruthenicum Murray on the organism health and gut microbiota in vivo[J]. Food Res Int, 2020, 130: 108952. DOI:10.1016/j.foodres.2019.108952 |
| [8] |
ZHANG H Y, XU Z L, ZHAO H W, et al. Anthocyanin supplementation improves anti-oxidative and anti-inflammatory capacity in a dose-response manner in subjects with dyslipidemia[J]. Redox Biol, 2020, 32: 101474. DOI:10.1016/j.redox.2020.101474 |
| [9] |
CLAESSON-WELSH L. Oxygen sensing; a stunningly elegant molecular machinery highjacked in cancer[J]. Ups J Med Sci, 2020, 125(3): 205-210. DOI:10.1080/03009734.2020.1769231 |
| [10] |
BURTSCHER J, MALLET R T, BURTSCHER M, et al. Hypoxia and brain aging: neurodegeneration or neuroprotection?[J]. Ageing Res Rev, 2021, 68: 101343. DOI:10.1016/j.arr.2021.101343 |
| [11] |
MACINTYRE N R. Tissue hypoxia: implications for the respiratory clinician[J]. Respir Care, 2014, 59(10): 1590-1596. DOI:10.4187/respcare.03357 |
| [12] |
ZHANG Q L, CAI S W, GUO L P, et al. Propofol induces mitochondrial-associated protein LRPPRC and protects mitochondria against hypoxia in cardiac cells[J]. PLoS One, 2020, 15(9): e0238857. DOI:10.1371/journal.pone.0238857 |
| [13] |
王梦杰, 李玉林, 刘嘉华, 等. 青藏高原黑果枸杞花青素对人肝癌细胞增殖和自噬的影响[J]. 天然产物研究与开发, 2021, 33(1): 79-88. WANG M J, LI Y L, LIU J H, et al. Effect of anthocyanidin of Lycium ruthenicum Murry from Qinghai Tibet Plateaun on the proliferation and autophagy of HepG2 cells[J]. Natural Product Research and Development, 2021, 33(1): 79-88. (in Chinese) |
| [14] |
GARCÍA-ORTIZ N, FIGUEROA-MARTÍNEZ F J, CARRASCO-NAVARRO U, et al. The oxygen concentration in cultures modulates protein expression and enzymatic antioxidant responses in Metarhizium lepidiotae conidia[J]. Fungal Biol, 2018, 122(6): 487-496. DOI:10.1016/j.funbio.2017.10.013 |
| [15] |
黄巧婷, 徐玉明, 许杰, 等. 低氧调控EIMD后骨骼肌细胞膜损伤的研究[J]. 山东体育学院学报, 2018, 34(4): 81-86. HUANG Q T, XU Y M, XU J, et al. Hypoxia regulates cell membrane damage after EIMD[J]. Journal of Shandong Sport University, 2018, 34(4): 81-86. (in Chinese) |
| [16] |
王硕, 吴华, 王梦杰, 等. 紫锥菊提取物对低氧诱导的H9c2大鼠心肌细胞凋亡的影响[J]. 中国兽医科学, 2023, 53(2): 254-261. WANG S, WU H, WANG M J, et al. Effects of cichoric allcid on hypoxia—induced apoptosis of H9c2 cells[J]. Chinese Veterinary Science, 2023, 53(2): 254-261. (in Chinese) |
| [17] |
D'ARCY M S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy[J]. Cell Biol Int, 2019, 43(6): 582-592. |
| [18] |
PISTRITTO G, TRISCIUOGLIO D, CECI C, et al. Apoptosis as anticancer mechanism: function and dysfunction of its modulators and targeted therapeutic strategies[J]. Aging, 2016, 8(4): 603-619. |
| [19] |
杨连君. bcl-2, bax与肿瘤细胞凋亡[J]. 中国肿瘤生物治疗杂志, 2003, 10(3): 232-234. YANG L J. Bcl-2, bax and their roles in tumor apoptosis[J]. Chinese Journal of Cancer Biotherapy, 2003, 10(3): 232-234. (in Chinese) |
| [20] |
WILLEMS P H G M, ROSSIGNOL R, DIETEREN C E J, et al. Redox homeostasis and mitochondrial dynamics[J]. Cell Metab, 2015, 22(2): 207-218. |
| [21] |
杨洁, 高飞. 活性氧与细胞凋亡的研究进展[J]. 国外医学肿瘤学分册, 2002, 29(4): 248-251. YANG J, GAO F. Progress in study for oxygen species and apoptosis[J]. Journal of International Oncology, 2002, 29(4): 248-251. (in Chinese) |
| [22] |
CAO X Y, FU M Y, BI R C, et al. Cadmium induced BEAS-2B cells apoptosis and mitochondria damage via MAPK signaling pathway[J]. Chemosphere, 2021, 263: 128346. |
| [23] |
王笑妍, 李玫, 沈志纲, 等. 红景天苷药理作用研究进展[J]. 中成药, 2022, 44(12): 3932-3935. WANG X Y, LI M, SHEN Z G, et al. Advances in pharmacological Action of Salidroside[J]. Chinese Traditional Patent Medicine, 2022, 44(12): 3932-3935. (in Chinese) |
| [24] |
ZHONG H, XIN H, WU L X, et al. Salidroside attenuates apoptosis in ischemic cardiomyocytes: a mechanism through a mitochondria-dependent pathway[J]. J Pharmacol Sci, 2010, 114(4): 399-408. |
(编辑 白永平)



