猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是影响世界养猪业的重要病原,临床上可引起母猪繁殖障碍、仔猪高死亡率和各年龄阶段猪的呼吸系统症状,给我国养猪业带来了巨大经济损失[1-2]。PRRSV可分为欧洲型(PRRSV-1)和美洲型(PRRSV-2),二者的基因相似性为50%~70%,通过对ORF5序列的系统发育分析,PRRSV-1分为4个亚型,PRRSV-2分为9个谱系[3-4]。我国主要流行PRRSV-2,包括高致病性PRRSV(亚系8.7)、经典PRRSV(亚系5.1)、类NADC30毒株(亚系1.8)及QYYZ毒株(亚系3.5)等基因亚型毒株[5]。
PRRSV基因组为单股正链RNA,长度约为15 kb,包含至少9个开放阅读框(ORFs)[6-7]。其中ORF3编码的糖基化蛋白3(glycosylated protein 3,GP3)具有7个糖基化位点[8]。GP3蛋白由一个切割的信号肽、一个高度糖基化的结构域、一个短疏水区和一个未糖基化的C末端结构域组成。病毒颗粒中GP3与GP2、GP4蛋白形成异源三聚体,并与宿主细胞CD163相互作用,而CD163是PRRSV进入细胞的关键受体[9-10]。GP3蛋白也可表现为细胞分泌形式,分泌的GP3可能作为一种诱饵,分散抗体远离病毒颗粒[11]。病毒颗粒中GP3含量较少,但抗原性较高,参与诱导中和抗体产生[12]。目前,PRRSV GP3蛋白结构和抗原特性尚不十分清楚。
本研究根据PRRSV FJ1402毒株序列扩增ORF3基因,通过原核表达系统成功制备出重组GP3蛋白,将其作为免疫原免疫BALB/c小鼠,制备了7株GP3单克隆抗体,鉴定出4个B细胞表位,为PRRSV诊断和生物学研究奠定了基础。
1 材料与方法 1.1 主要材料PRRSV FJ1402毒株、PRRSV N单抗、杆状病毒系统表达PRRSV GP3蛋白(片段为28—203 aa,表达系统为pFastBacTM Dual)、SP2/0细胞、大肠杆菌E.coli DH5α和Rosetta均由本实验室保存。雌性BALB/c小鼠(6~8周龄)购自扬州大学实验动物中心。
2×Phanta Max Master Mix和Pres-tained Protein Marker,购自南京诺唯赞生物科技股份有限公司;限制性核酸内切酶和T4 DNA连接酶,购自Thermo Fisher Scientific公司;山羊抗小鼠IgG(H+L)-HRP和HRP-SPA,购自上海碧云天生物技术有限公司;HisSep Ni-NTA Agarose Resin,购自上海翊圣生物科技有限公司;RPMI -1640培养基、胎牛血清,购自美国Gibco公司;FITC-羊抗鼠IgG、小鼠单克隆抗体亚型鉴定试剂盒,购自Proteintech生物科技有限公司;TanonTM High-sig ECL Western blot底物试剂盒,购自天能科技有限公司;异丙基硫代-β-D-半乳糖(IPTG)、PEG1450、50×HAT和50×HT,购自美国Sigma公司;其他试剂均为国产分析纯。
1.2 重组质粒构建根据PRRSV FJ1402(GenBank No. KX169 191.1) ORF3基因序列,采用TMHMM Serverv. 2.0网站软件分析GP3蛋白跨膜区为16~38位氨基酸(aa),删除1~38 aa后的目的片段命名为tGP3 (39~254 aa)。引物为28a-tGP3-F: 5′-CGGGATCCGTTAGGGGCAACTTCTCTTT-3′,28a-tGP3-R: 5′-CCCTCGAGTTGCCGCGCGACATTGAGGA-3′,用于扩增tGP3片段,大小为648 bp。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 15 s,72 ℃ 60 s,循环35次;72 ℃ 5 min。将目的片段和pET-28a载体通过Bam HⅠ和XholⅠ双酶切后进行连接,连接产物转化至DH5α菌,经菌液PCR和酶切鉴定正确后送通用生物公司测序,结果显示正确,重组质粒pET-28a-tGP3于-20 ℃保存备用。
为了解析GP3蛋白抗原表位,根据PRRSV FJ1402 ORF3基因序列设计一系列截短体引物并在引物的5′端引入EcoRⅠ酶切位点,3′端引入HindⅢ酶切位点,引物序列如表所示(表 1),送南京金斯瑞公司合成。以重组质粒pET-28a-tGP3为模板,采用PCR方法分别扩增出9个GP3蛋白基因截短体,将截短体和pET-32a载体双酶切后进行连接,构建9个GP3蛋白截短体重组质粒。
|
|
表 1 GP3蛋白截短体PCR引物序列 Table 1 PCR primer sequence of truncated GP3 protein |
将重组质粒pET-28a-tGP3转化Rosetta感受态细胞,挑取单菌落,37 ℃培养,测定菌液OD600 nm为0.6~0.8时加入终浓度为1 mmol·L-1的IPTG,继续培养6 h。收集菌体超声破碎,分离上清和沉淀,SDS-PAGE鉴定蛋白表达形式,采用镍柱亲和层析法纯化目的蛋白,纯化GP3蛋白用超滤管进行浓缩后测定蛋白浓度,Western blot试验鉴定GP3蛋白与PRRSV阳性猪血清的反应性。
1.4 PRRSV GP3蛋白单克隆抗体的制备1.4.1 小鼠免疫 按照文献报道[13],将重组GP3蛋白与等体积ISA206佐剂混合,充分乳化后皮下注射小鼠,60 μg ·只-1,ELISA抗体效价≥1:10 000时,通过腹腔注射50 μg重组GP3蛋白进行冲击免疫。3 d后采集脾,进行细胞融合。
1.4.2 单克隆抗体制备 按照文献报道[13-14],取冲击免疫小鼠脾细胞和SP2/0细胞按照7:1比例混合,加入PEG1450进行融合。将融合细胞铺于含有2% HAT选择培养基的96孔细胞板中,培养6 d左右全换液,间隔24~36 h取杂交瘤细胞上清,用间接ELISA进行检测。筛选到的阳性杂交瘤细胞需要进行2~3次亚克隆,直至单克隆阳性率为100%。将稳定分泌抗体的杂交瘤细胞扩大培养至T25细胞瓶,冻存后于液氮中保存。
1.4.3 间接ELISA筛选阳性杂交瘤细胞 用重组GP3蛋白作为包被抗原,杂交瘤细胞上清作为一抗,同时设立阳性对照(免疫小鼠血清1:100稀释)和阴性对照(SP2/0细胞上清);羊抗鼠IgG(H+L)-HRP孵育二抗;TMB显色后加入终止液,酶标仪检测OD450 nm 时的读数,P/N≥2.1判定为阳性。
1.4.4 腹水制备 按照文献报道[15],取8周龄雌性BALB/c小鼠,腹腔注射500 μL无菌液体石蜡。7 d后,腹腔注射3×106~4×106个杂交瘤细胞。7 d后观察,小鼠腹部胀大并触之有波动感时用头皮针收集腹水,安乐死。收集的腹水4 000 g离心10 min,取上清,分装后, 于-80 ℃保存备用。
1.5 单克隆抗体生物学特性鉴定1.5.1 单克隆抗体细胞株的稳定性试验 将阳性杂交瘤细胞株连续传代,取5、10、15代细胞上清,间接ELISA检测抗体效价和抗体分泌稳定性。
1.5.2 单克隆抗体亚型鉴定 按照单克隆抗体亚型鉴定说明,将单抗细胞上清按照1:200稀释,将待测样品加入板条中,每孔50 μL;加入1×山羊抗小鼠IgA+IgM+IgG-HRP,每孔50 μL,混匀;室温孵育1 h;弃去孔内液体,PBST洗板3次;加入显色液,室温避光显色10~20 min,加入终止液,各孔的OD450 nm值最高的孔即为相应的单抗亚型。
1.5.3 单克隆抗体的特异性反应鉴定 以纯化的PRRSV FJ1402、杆状病毒系统和原核系统表达的重组GP3蛋白为抗原,同时设置相应阴性对照,进行SDS-PAGE和Western blot。将蛋白转印至NC膜上,杂交瘤细胞上清作为一抗,羊抗鼠IgG(H+L)-HRP孵育二抗,加入显色液后判定单抗特异反应性。
1.5.4 间接免疫荧光试验反应性鉴定 PRRSV接种Marc 145细胞,37 ℃培养48 h,加入4%多聚甲醛于37 ℃固定15 min,加入0.1%Triton X-100于室温作用25 min,PBS洗涤后加入单抗37 ℃作用1 h,洗涤后加入FITC-羊抗鼠IgG,37 ℃作用1 h,洗涤后于荧光倒置显微镜下观察。
1.6 单克隆抗体表位鉴定1.6.1 Western blot 将GP3蛋白基因截短体重组质粒转化至表达菌种Rosetta,IPTG诱导表达,SDS-PAGE后将蛋白转印至NC膜上,以单抗腹水为一抗,采用Western blot鉴定单抗识别的抗原表位。
1.6.2 抗原表位合成多肽间接ELISA 根据上述鉴定的抗原表位,合成多肽,以50 μg ·mL-1剂量包被酶标板,加入GP3蛋白单克隆抗体,以猪抗PRRSV血清抗体(G2#)和PBS分别作为阳性和阴性对照,37 ℃作用1 h后,加入HRP-SPA,37 ℃作用1 h。TMB显色后加入终止液,酶标仪检测OD450 nm,P/N≥2.1判定为阳性。
1.7 GP3单抗抗原表位氨基酸位点对比分析选取17株不同谱系的PRRSV-2中国流行毒株及参考毒株序列(BB0907、SY0608、HUN4、JXA1、WUH4、GD1404、CH-1a、IngelvacATP、QYYZ、GM2、VR2332、BJ-4、S1、MN184C、NADC31、NADC30、FJ1402),利用Jalview软件对比分析4种抗原表位序列在各毒株中的保守性。
1.8 GP3单抗与不同毒株反应性选取针对不同抗原表位的单克隆抗体,采用IFA和Western blot测定其与高致病性PRRSV毒株BB0907和经典PRRSV毒株S1的特异反应性。
2 结果 2.1 GP3蛋白基因表达与重组蛋白的制备GP3蛋白基因PCR扩增产物克隆至pET-28a载体,鉴定正确后,转化大肠杆菌,IPTG诱导表达后SDS-PAGE鉴定,目的蛋白大小为25 ku,与预期蛋白大小一致(图 1A),包涵体纯化浓缩后显示单一条带,说明纯化效果较好(图 1B)。Western blot结果显示,重组GP3蛋白和PRRSV阳性猪血清具有较好反应特性(图 1C),可用作免疫原。

|
A. 重组蛋白表达;B. 包涵体纯化;C. Western blot鉴定。M. 蛋白质相对分子质量标准;1. 诱导表达全菌;2. 诱导表达上清;3. 诱导表达沉淀;4. 未诱导表达全菌;5. 空载体诱导全菌;6. 纯化的重组GP3蛋白 A. SDS-PAGE gel electrophoresis of expression cell lysate; B. P urification of inclusion body; C. Western blot detection of GP3 protein. M. Protein molecular marker; 1.Whole cell lysate with induction; 2. Lysate supernatant with induction 3. Lysate precipitation with induction; 4. The whole bacteria of recombinant protein without induction; 5. Empty vector transformed cell lysate with induction; 6.Purified recombinant GP3 protein 图 1 PRRSV重组GP3蛋白纯化及鉴定 Fig. 1 Purification and identification of PRRSV recombinant GP3 protein |
小鼠三免后10 d,间接ELISA测定抗体效价均≥1:10 000。取效价最高的小鼠冲击免疫,3 d后取脾进行细胞融合,通过间接ELISA筛选阳性杂交瘤细胞并进行亚克隆,最终获得7株分泌PRRSV GP3蛋白抗体的杂交瘤细胞,分别命名为2E12、4H9、5B2、6B3、6G7、9F3和9H5。杂交瘤细胞连续传代至15代,每隔5代取细胞上清检测抗体效价,结果显示效价基本稳定。用7株杂交瘤细胞分别制备小鼠腹水并测定其效价,结果如表 2所示,7株腹水单抗(mAbs)ELISA效价为1:(64 000~2 048 000)。
|
|
表 2 杂交瘤细胞上清和小鼠腹水抗体效价的测定 Table 2 antibody titers of hybridoma cells supernatant and ascites mAbs |
2E12、5B2单抗的重链属于IgG2a亚类,4H9、6B3、6G7、9F3和9H5单抗的重链属于IgG2b亚类,7株单抗的轻链类型均为Kappa型(表 3)。
|
|
表 3 单克隆抗体亚型鉴定(OD450 nm) Table 3 Identification of mAb subtypes(OD450 nm) |
7株mAbs均能和PRRSV FJ1402、杆状病毒系统和原核系统表达的重组GP3蛋白发生特异性反应,不与Marc 145细胞、sf9细胞和pET-28a空载体发生反应(图 2)。

|
A. 2E12;B. 4H9;C. 5B2;D. 6B3;E. 6G7;F. 9F3;G. 9H5;M. 蛋白质相对分子质量标准;1. 纯化的PRRSV;2. Marc-145细胞对照;3. 杆状系统表达GP3蛋白;4. sf9细胞对照;5. 重组GP3蛋白;6. 空载诱导全菌蛋白 A. 2E12;B. 4H9;C. 5B2;D. 6B3;E. 6G7;F. 9F3;G. 9H5; M. Protein marker; 1. Purified PRRSV; 2. Marc-145 cell control; 3. GP3 protein expressed by the rod-shaped system 4. sf9 cell control; 5.Recombinant GP3 protein; 6. No-load induced whole bacterial protein 图 2 Western blot鉴定GP3蛋白单克隆抗体与PRRSV、杆状系统表达GP3蛋白和重组GP3蛋白的反应性 Fig. 2 Western blot reactivity of the monoclonal antibodies against PRRSV, GP3 protein expressed through baculovirus expression vector system, and recombinant GP3 protein |
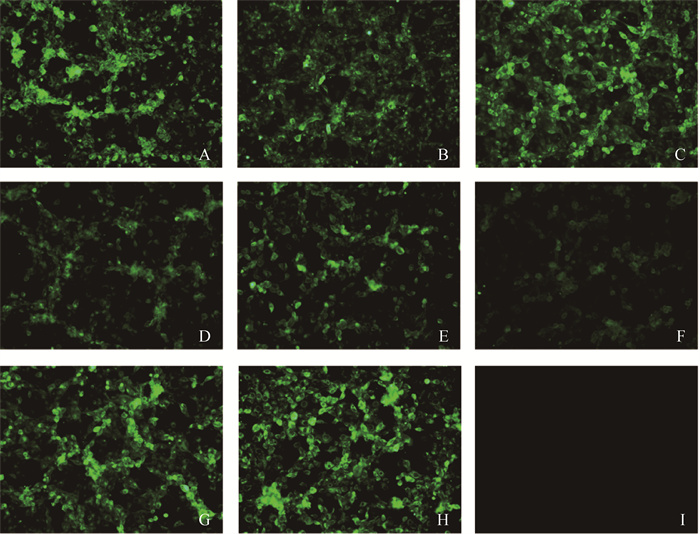
图 3结果显示,7株mAbs均能和PRRSV FJ1402株感染的Marc 145细胞发生特异性的荧光,其中5B2和9H5荧光较强;6B3和9F3荧光较弱。
|
A. 2E12;B. 4H9;C. 5B2;D. 6B3;E. 6G7;F. 9F3;G. 9H5;H. PRRSV N单抗;I. SP2/0上清 A. 2E12; B. 4H9; C. 5B2; D. 6B3; E. 6G7; F. 9F3; G. 9H5; H. PRRSV N mAb; I. SP2/0 supernatant 图 3 GP3蛋白单克隆抗体与PRRSV FJ104株的IFA反应特性鉴定(200×) Fig. 3 The reactivity of anti-PRRSV GP3 monoclonal antibodies against PRRSV FJ104 strain by IFA (200×) |
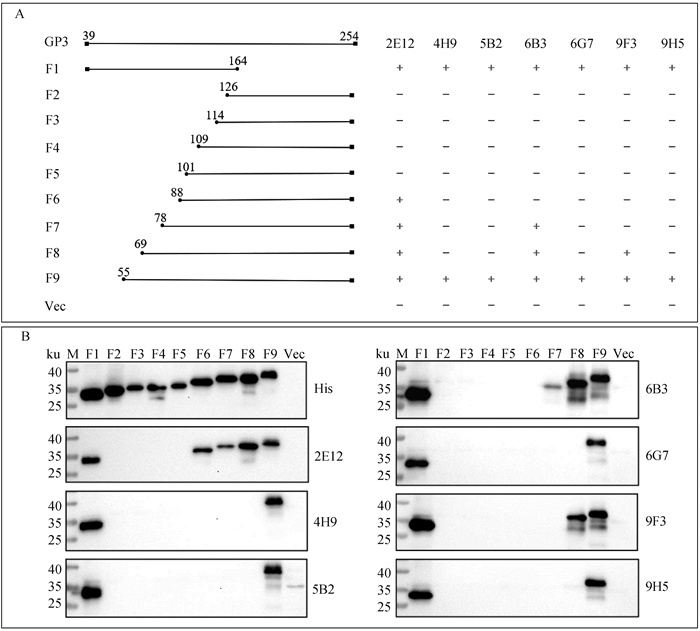
本试验构建了一系列GP3蛋白截短体(图 4A),Western blot结果显示(图 4B),9个GP3蛋白基因截短体重组质粒原核表达蛋白均与His鼠单抗反应,说明重组质粒表达正确。7株单抗中, 4H9、5B2、6G7、9H5识别55PLCPTRQAAAEILE68;9F3识别69PGKSFWCRI77;6B3识别78GHDRCSESDH87;2E12识别88DELGFMVPPGLSS100。
|
A. GP3蛋白截短体;B.单抗识别区域 A. The truncated GP3 protein; B. The region recognized by the mAb 图 4 PRRSV GP3蛋白截短体构建策略及抗原表位鉴定 Fig. 4 Construction strategy of the PRRSV GP3 truncated protein and epitope mapping |
抗原表位合成多肽ELISA鉴定结果见表 4,除9F3外,6株单克隆抗体识别的抗原表位多肽与Western blot结果一致,同时猪抗PRRSV血清抗体(G2#)和55-68 aa、78-87 aa和88-100 aa多肽反应为阳性。
|
|
表 4 单克隆抗体表位ELISA鉴定 Table 4 Identification of the monoclonal antibody epitope by ELISA |
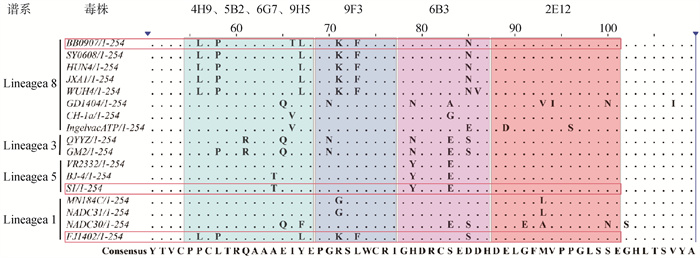
采用Jalview软件对比分析PRRSV-2四个主要流行谱系(Lineage)毒株GP3蛋白氨基酸序列,结果见图 5,55PLCPTRQAAAEILE68和78GHDRCSESDH87保守性较差;而69PGKSFWCRI77在Lineage 5内具有较好的保守性;88DELGFMVPPGLSS100在Lineage 3和Lineage 5之间具有较好的保守性。
|
图 5 PRRSV GP3蛋白抗原表位保守性分析 Fig. 5 Epitope conservation analysis for PRRSV GP3 protein |
采用针对4个不同抗原表位的单抗4H9、9F3、6B3和2E12,IFA和Western blot结果如图 6和7所示,2E12与FJ1402、BB0907、S1毒株反应。4H9、9F3和6B3与FJ1402毒株反应,但不和BB0907、S1毒株反应。

|
图 6 GP3蛋白单克隆抗体与不同亚型PRRSV的IFA反应特性鉴定(200×) Fig. 6 The reactivity of anti-PRRSV GP3 monoclonal antibodies against different subtypes of PRRSV by IFA |

|
A. 4H9;B. 9F3;C. 6B3;D. 2E12。M.蛋白质相对分子质量标准;1.FJ1402;2.BB0907;3.S1;4. Marc-145细胞对照 A. 4H9;B. 9F3;C. 6B3;D. 2E12. M.Protein marker; 1.FJ1402;2.BB0907;3.S1;4. Marc-145 cell control 图 7 GP3蛋白单克隆抗体与Marc-145细胞感染的不同亚型PRRSV的Western blot反应特性鉴定 Fig. 7 Reactivity of the monoclonal antibodies with the different subtypes PRRSV-infected Marc-145 by Western blot |
PRRSV存在基因变异和免疫抑制,商品化疫苗免疫保护效力有限[16-18]。研究PRRSV蛋白抗原特性对安全高效疫苗研究具有重要意义。PRRSV-1和PRRSV-2 GP3蛋白氨基酸序列相似性为54%~60%,PRRSV-2不同基因谱系毒株GP3蛋白基因保守性较差,可变区域主要位于蛋白N端[19]。本研究采用原核表达系统制备获得GP3重组蛋白,研制出7株GP3蛋白单抗,其中2E12单抗与FJ1402、BB0907和S1毒株存在IFA和Western blot反应特性,4H9、9F3和6B3只与FJ1402毒株反应,而不与BB0907和S1毒株反应,5B2和6G7与FJ1402毒株感染细胞IFA荧光效果最佳,为PRRSV不同谱系毒株鉴别和GP3蛋白功能研究提供了有用工具。
PRRSV病毒粒子GP3蛋白含量低于GP5、M和N蛋白,但具有较好免疫原性[20]。PRRSV GP3、M和N蛋白免疫原性水平最高,且GP3蛋白与中和抗体产生有关[21]。GP3蛋白有7个糖基化位点,预测蛋白大小27~29 ku,明显小于SDS-PAGE电泳显示的蛋白大小(41~50 ku)[8]。本研究Western blot结果显示,7株单抗与PRRSV感染细胞之间除了在40 ku左右有明显反应条带外,在其它位置存在数条反应条带,这可能与GP3蛋白糖基化有关。此外,由于杆状病毒系统表达的GP3蛋白为第28―203 aa截短体,Western blot结果显示该重组蛋白反应条带分子量明显小于原核系统表达的重组GP3及PRRSV抗原。
病毒蛋白抗原表位解析对明确蛋白结构和抗原特性有重要作用。Wang等[22]基于肽芯片技术鉴定出PRRSV GP3蛋白抗原活性区域之一位于其N端51-106 aa。张阳等[23]通过GP3蛋白重叠多肽合成,筛选出两个B细胞表位55PLCPTRQAAAEILEPGKS72和82CSENDHDELGFMVPPGLS99。Liang等[24]将GP3蛋白免疫显性肽段55PLCPTRQAAAEILEPGKS72与BSA偶联制备免疫原,制备出GP3蛋白单抗1E5,证明其可与PRRSV高致病毒株反应,而与经典毒株和类NADC30毒株不能反应。Chen等[25]通过36株PRRSV-2分离株序列比对,发现GP3抗原表位87HDELGFMV94保守性良好,而59TRQAAAEILE68表位区域在其它低毒力毒株之间至少存在1个氨基酸差异。此外,也有报道GP3蛋白不同抗原表位存在部分重叠,如抗原表位59TRQAAAEILE68与两个表位61QAARQRLEPGRN72和67YEPGRSLW74重叠[25]。Wang等[26]利用单克隆抗体鉴定出GP3蛋白的B细胞线性表位69PGKSFWCR76,但该表位不能被阳性血清识别,提示该表位不能在猪体内诱导抗体。本研究通过GP3蛋白基因截短体构建表达,采用研制的单克隆抗体,鉴定出4个B细胞线性表位,分别为55 PLCPTRQAAAEILE68、69PGKSFWCRI77、78GHDRCSESDH87和88DELGFMVPPGLSS100,与文献报道类似,但4个表位存在连续性,这可能与蛋白基因截短体构策略有关,这些抗原表位可能还需要更加精准定位。本研究抗原表位合成肽ELISA结果显示,5B2、6G7、6B3和2E12的检测结果均接近于临界值,9F3的检测结果为阴性,这可能与单抗结合能力和稀释度、合成肽抗原性和包被浓度及抗原表位免疫原性弱等因素有关。本研究采用针对4个不同抗原表位的单抗4H9、9F3、6B3和2E12,采用IFA和Western blot检测其与PRRSV 3个谱系毒株反应特性,结果均显示,2E12与FJ1402、BB0907和S1三个谱系毒株均可发生特异反应,4H9、9F3和6B3只与FJ1402毒株反应,而不与BB0907和S1毒株反应,与这三个谱系毒株88-100 aa、55-68 aa、69-77 aa和78-87 aa抗原表位氨基酸比对分析结果一致,但值得注意的是,9F3单抗识别的69-77 aa抗原表位在FJ1402和BB0907毒株之间没有差异,但是9F3单抗IFA和Western blot不能检出PRRSV BB0907和S1毒株感染细胞,提示PRRSV BB0907和S1毒株感染细胞GP3蛋白存在方式与PRRSV FJ1402的存在差异,需要进一步研究证实。
4 结论本研究研制出7株PRRSV FJ1402毒株GP3单克隆抗体,鉴定出GP3蛋白4个抗原表位,分别位于55PLCPTRQAAAEILE68、69PGKSFWCRI77、78GHDRCSESDH87和88DELGFMVPPGLSS100。2E12单抗可识别FJ1402、BB0907和S1三个谱系毒株,但4H9、9F3和6B3单抗只与FJ1402毒株反应,可用于PRRSV检测和GP3蛋白功能研究。
| [1] |
LUNNEY J K, FANG Y, LADINIG A, et al. Porcine reproductive and respiratory syndrome virus (PRRSV): Pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci, 2016, 4: 129-154. DOI:10.1146/annurev-animal-022114-111025 |
| [2] |
CHAND R J, TRIBLE B R, ROWLAND R R. Pathogenesis of porcine reproductive and respiratory syndrome virus[J]. Curr Opin Virol, 2012, 2(3): 256-263. DOI:10.1016/j.coviro.2012.02.002 |
| [3] |
WALKER P J, SIDDELL S G, LEFKOWITZ E J, et al. Changes to virus taxonomy and the International Code of Virus Classification and Nomenclature ratified by the International Committee on Taxonomy of Viruses (2019)[J]. Arch Virol, 2019, 164(9): 2417-2429. DOI:10.1007/s00705-019-04306-w |
| [4] |
OGNO G, RODRÍGUEZ-GÓMEZ I M, CANELLI E, et al. Impact of PRRSV strains of different in vivo virulence on the macrophage population of the thymus[J]. Vet Microbiol, 2019, 232: 137-145. DOI:10.1016/j.vetmic.2019.04.016 |
| [5] |
XU H, SONG S J, ZHAO J, et al. A potential endemic strain in China: NADC34-like porcine reproductive and respiratory syndrome virus[J]. Transbound Emerg Dis, 2020, 67(4): 1730-1738. DOI:10.1111/tbed.13508 |
| [6] |
SUN Z, LIU C L, TAN F F, et al. Identification of dispensable nucleotide sequence in 3' untranslated region of porcine reproductive and respiratory syndrome virus[J]. Virus Res, 2010, 154(1-2): 38-47. DOI:10.1016/j.virusres.2010.08.027 |
| [7] |
LUO X G, CHEN X X, QIAO S L, et al. Porcine reproductive and respiratory syndrome virus enhances self-replication via AP-1-dependent induction of SOCS1[J]. J Immunol, 2020, 204(2): 394-407. DOI:10.4049/jimmunol.1900731 |
| [8] |
DEA S, GAGNON C A, MARDASSI H, et al. Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome (PRRS) virus: comparison of the North American and European isolates[J]. Arch Virol, 2000, 145(4): 659-688. DOI:10.1007/s007050050662 |
| [9] |
XU K, ZHOU Y R, MU Y L, et al. CD163 and pAPN double-knockout pigs are resistant to PRRSV and TGEV and exhibit decreased susceptibility to PDCoV while maintaining normal production performance[J]. eLife, 2020, 9: e57132. DOI:10.7554/eLife.57132 |
| [10] |
ZHANG Y J, ZHANG K, ZHENG H, et al. Development of a monoclonal antibody against porcine CD163 SRCR5 domain which partially blocks infection of PRRSV[J]. Front Vet Sci, 2020, 7: 597843. DOI:10.3389/fvets.2020.597843 |
| [11] |
ZHANG M Z, KRABBEN L, WANG F K, et al. Glycoprotein 3 of porcine reproductive and respiratory syndrome virus exhibits an unusual hairpin-like membrane topology[J]. J Virol, 2018, 92(15): e00660. |
| [12] |
VU H L X, KWON B, YOON K J, et al. Immune evasion of porcine reproductive and respiratory syndrome virus through glycan shielding involves both glycoprotein 5 as well as glycoprotein 3[J]. J Virol, 2011, 85(11): 5555-5564. DOI:10.1128/JVI.00189-11 |
| [13] |
王梦婕, 张杰, 孙杨杨, 等. 猪繁殖与呼吸综合征病毒M蛋白单克隆抗体制备及抗原表位鉴定[J]. 畜牧与兽医, 2022, 54(6): 91-96. WANG M J, ZHANG J, SUN Y Y, et al. Monoclonal antibodies preparation and antigenic epitope identification of M protein of the porcine reproductive and respiratory syndrome virus[J]. Animal Husbandry & Veterinary Medicine, 2022, 54(6): 91-96. (in Chinese) |
| [14] |
ZHANG G P, LI N, CHEN Y M, et al. Identification of the B-cell epitopes on N protein of type 2 porcine reproductive and respiratory syndrome virus, using monoclonal antibodies[J]. Int J Biol Macromol, 2019, 130: 300-306. DOI:10.1016/j.ijbiomac.2019.02.140 |
| [15] |
张路捷, 高雁怩, 夏婷婷, 等. 非洲猪瘟病毒p30蛋白单克隆抗体的制备与鉴定[J]. 畜牧与兽医, 2021, 53(6): 111-115. ZHANG L J, GAO Y N, XIA T T, et al. Preparation and identification of monoclonal antibodies against p30 protein of the African swine fever virus[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(6): 111-115. (in Chinese) |
| [16] |
王芳蕊, 王镇, 韩克元, 等. 猪繁殖与呼吸综合征疫苗的发展历程与研究现状[J]. 畜牧兽医科技信息, 2022(2): 1-5. WANG F R, WANG Z, HAN K Y, et al. Development history and research status of pig reproductive and respiratory syndrome vaccine[J]. Animal husbandry and Veterinary Science and Technology Information, 2022(2): 1-5. (in Chinese) |
| [17] |
MA H, LI X M, LI J L, et al. Immunization with a recombinant fusion of porcine reproductive and respiratory syndrome virus modified GP5 and ferritin elicits enhanced protective immunity in pigs[J]. Virology, 2021, 552: 112-120. DOI:10.1016/j.virol.2020.10.007 |
| [18] |
朱月华, 姜平, 李玉峰, 等. 猪繁殖与呼吸综合征诊断与疫苗研究进展[J]. 动物医学进展, 2011, 32(8): 93-97. ZHU Y H, JIANG P, LI Y F, et al. Advance development in diagnosis and vaccines against porcine reproductive and respiratory syndrome[J]. Progress in Veterinary Medicine, 2011, 32(8): 93-97. DOI:10.3969/j.issn.1007-5038.2011.08.021 (in Chinese) |
| [19] |
WIERINGA R, DE VRIES A A F, RAAMSMAN M J B, et al. Characterization of two new structural glycoproteins, GP3 and GP4, of equine arteritis virus[J]. J Virol, 2002, 76(21): 10829-10840. DOI:10.1128/JVI.76.21.10829-10840.2002 |
| [20] |
DE LIMA M, ANSARI I H, DAS P B, et al. GP3 is a structural component of the PRRSV type Ⅱ (US) virion[J]. Virology, 2009, 390(1): 31-36. DOI:10.1016/j.virol.2009.04.017 |
| [21] |
LUONG H Q, LAI H T L, VU H L X. Evaluation of antibody response directed against porcine reproductive and respiratory syndrome virus structural proteins[J]. Vaccines (Basel), 2020, 8(3): 533. DOI:10.3390/vaccines8030533 |
| [22] |
WANG R, ZHANG Y J. Antagonizing interferon-mediated immune response by porcine reproductive and respiratory syndrome virus[J]. Biomed Res Int, 2014, 2014: 315470. |
| [23] |
张阳. 猪繁殖与呼吸综合征病毒GP3蛋白B细胞表位和T细胞表位的初步筛选[D]. 郑州: 郑州大学, 2018. ZHANG Y. Identification of B-cell epitopes and T-cell epitopes in glycoprotein 3 of porcine reproductive and respiratory syndrome virus[D]. Zhengzhou: Zhengzhou University, 2018. |
| [24] |
LIANG C, LIU H L, ZHOU J M, et al. Development of a monoclonal antibody against PRRSV glycoprotein 3 using an immuodominant peptide as immunogen[J]. Int J Biol Macromol, 2021, 187: 683-689. DOI:10.1016/j.ijbiomac.2021.07.168 |
| [25] |
CHEN J Z, WANG Q, BAI Y, et al. Identification of two dominant linear epitopes on the GP3 protein of highly pathogenic porcine reproductive and respiratory syndrome virus (HP-PRRSV)[J]. Res Vet Sci, 2014, 97(2): 238-243. DOI:10.1016/j.rvsc.2014.07.011 |
| [26] |
WANG Q, PENG J M, SUN Y, et al. Unique epitopes recognized by monoclonal antibodies against HP-PRRSV: deep understanding of antigenic structure and virus-antibody interaction[J]. PLoS One, 2014, 9(10): e111633. DOI:10.1371/journal.pone.0111633 |
(编辑 白永平)



