犬子宫蓄脓是一种犬常见的在子宫腔内积聚脓液并伴有子宫内膜异常增生的疾病,据统计,子宫蓄脓可以在25%的成年雌性犬科动物中发生[1]。如不及时治疗,可能导致一系列严重并发症,包括脓毒症、感染性休克、腹膜炎和多器官功能障碍[1],并有致命的危险。子宫蓄脓的病因较为复杂,许多因素包括年龄、细菌感染、激素水平和生殖生理都是其发生的风险因素[2]。其中,最常从子宫蓄脓中分离出的病原体是大肠杆菌[3-4]。
然而,尽管进行了广泛的研究,目前仍未完全了解子宫蓄脓的复杂发病机制。因此,子宫蓄脓缺乏治愈性的非手术疗法,最有效的治疗方法是卵巢子宫切除术,但仍会导致3%~4%的术后死亡[5-6]。此外,因为早期子宫蓄脓的症状十分轻微,宠主难以及时发现、兽医难以及时进行诊断,在没有干预和治疗的情况下,随着病情的发展,子宫蓄脓有危及生命的可能。因此,快速、早期的诊断和有效的干预在临床实践中具有非常高的价值,为该病寻找可靠的生物标记物是一项重要而迫切的任务,而子宫蓄脓特异性上调基因及其相关产物是潜在的生物标志物或治疗靶点。
近年来,随着新一代测序技术的飞速发展,转录组测序已被广泛用于分子机制的研究。与微阵列相比,RNA-seq是一种具有较高准确性和灵敏度的测序技术,且不会受到交叉杂交和非特异性杂交的影响[7]。本研究通过RNA-seq,分析蓄脓犬子宫中的转录组水平变化,筛选差异表达基因、调控通路以及中枢基因,为了解子宫蓄脓的分子机制提供宝贵资源。
1 材料与方法 1.1 动物和样本采集对经超声诊断为子宫蓄脓的犬只,记录临床资料,包括名字或登记证号、品种、性别、绝育情况、最后发情时间、发病时间、年龄、体重、是否开放型子宫蓄脓、有无脓液流出等基本情况。在征得宠物主人的同意并去除脓液后,立即进行拍照记录。先用PBS洗涤组织,洗去表面的血液和宫内脓液,然后去除子宫系膜。将组织切成大约5 mm3的立方体。所有收集的子宫样本在液氮中快速冷冻或在4% PFA中固定并储存在-80 ℃。所有动物样本均来自广州奈谷动物医院和广州福懋动物医院。一共收集了19只患犬的组织,包括10只子宫蓄脓犬和9只健康犬。
1.2 基因文库构建与测序利用TRIzol RNA试剂(TaKaRa, 大连,中国)从组织中提取总RNA。使用ND-1000 Nanodrop和Agilent 2200 TapeStation(诺禾致源生物信息技术,北京,中国)评估总RNA的纯度和完整性具有以下质量控制参数:A260/A280>1.8,A260/A230>2.0,RNA完整性≥8.0。cDNA文库由TruSeq RNA样品制备试剂盒(Illumina,圣地亚哥,加利福尼亚州,美国)生成。使用Illumina HiSeqTM 2500测序平台进行RNA-seq。
1.3 RNA-Seq和数据分析RNA-seq生成的原始数据首先用Fast-QC做质量评估,删除3′端测序接头序列和低质量(质量低于20个碱基)的碱基。利用Tophat v1.4.0将干净读数序列与参考基因组Ensembl CanFam进行比对,用Cufflinks v1.3.0分析差异表达基因。原始数据保存在Gene Expression Omnibus (GEO)中,登录号为GSE208124。以log2 FC>2和FDR<0.05选择差异表达的基因。
1.4 GO、KEGG和网络分析利用DAVID工具进行GO term富集分析[8]。调整后的P值(Benjamini-Hochberg多重检验校正方法)的cut-off值设为0.01。Wordcloud R包用于生成显着富集的GO条目词云。每个富集的GO条目词云中的字体大小与-lg(P-adj)成正比。DAVID工具也用于通路富集分析,并采用与GO分析相同的cut-off值。用蛋白质相互作用分析数据库(STRING)v10.0于创建基因网络[9],最低综合得分设置为0.900(最高置信度)。用Cytoscape软件进行基因网络的可视化和分析,用Network Analyzer分析每个基因的连通性[10],关键中枢基因的连通阈值为平均值加上两个标准差。
1.5 免疫组织化学(IHC)石蜡切片(5 μm)用于免疫组织化学染色。在脱蜡和复水后,加入pH 6.0的柠檬酸钠溶液中在微波炉中进行抗原修复,用3%过氧化氢封闭15 min去除内源性过氧化物酶,一抗在4℃孵育过夜,之后与HRP的二抗(ORIGENE,北京,中国)在37℃孵育1 h,再用二氨基联苯胺(DAB)(ORIGENE,北京,中国)显色并用苏木精复染,最后将组织切片脱水封片。
1.6 qRT-PCR验证为验证犬子宫蓄脓差异表达基因的测序结果,选择CDK1、CDC6、PRKCB、PIEZO1、PRKCD、YWHAG、ESR1、ACTB基因进行qRT-PCR检测。根据NCBI中犬(Canis lupus familiaris)的参考序列使用Primer 5.0软件设计引物,GAPDH作为参考基因以标准化靶基因的转录水平,引物相关信息见表 1。使用TRIzol试剂(TaKaRa)提取RNA,用HiSuperscript II试剂盒将RNA逆转录成cDNA。使用SYBR方法进行Real-Time PCR扩增反应。qRT-PCR检测基因表达的数据采用相对定量2-ΔΔCt方法进行计算,使用Graph Pad Prism 8.0软件展开表达量分析。
|
|
表 1 qRT-PCR引物 Table 1 qRT-PCR primers |
使用图像分析软件Image J对ER α的免疫组化染色进行H-SCORE分析,如文献所述[11-12]。
1.8 统计分析利用双尾student-t检验进行统计分析,并由GraphPad Prism 8.0(GraphPad软件)执行。数据显示为“平均值±SEM”。P<0.05被认为差异是显著的。
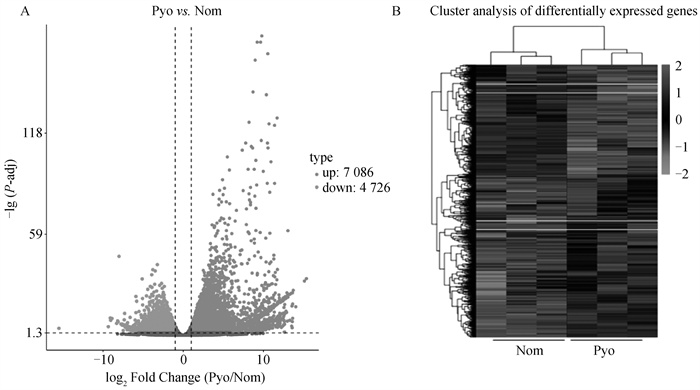
2 结果 2.1 犬子宫蓄脓的转录组差异表达的鉴定为全面了解患有子宫蓄脓犬的基因表达变化,分别从患子宫蓄脓犬和健康犬子宫取材进行RNA-seq测序,利用Tophat和Cufflinks进行转录组数据比对与差异表达分析,发现子宫蓄脓与健康犬的差异表达基因(DEGs)11 812个,其中上调7 086个,下调4 726个(图 1A、1B)。
|
A. 子宫蓄脓和健康狗差异基因表达变化的火山图。蓝色为未改变的基因,红色表示上调基因,绿色表示下调基因。B. 差异表达基因的聚类热图。Pyo.患子宫蓄脓犬;Nom.健康犬。下同 A. Volcano plot for differential gene expression changes of pyometra and healthy dogs. Non-changed genes were shown in blue color. Red color is indicative of up-regulated genes and green is indicative of down-regulated genes. B. Clustered heatmap of differentially expressed genes. Pyo. Canine with pyometra; Nom. Nomal canine. The same as below 图 1 子宫蓄脓转录组差异鉴定(扫描文章首页OSID码查看彩图) Fig. 1 Identification of transcriptomic differences associated with pyometra (scan the OSID code on the front page to view the color image) |
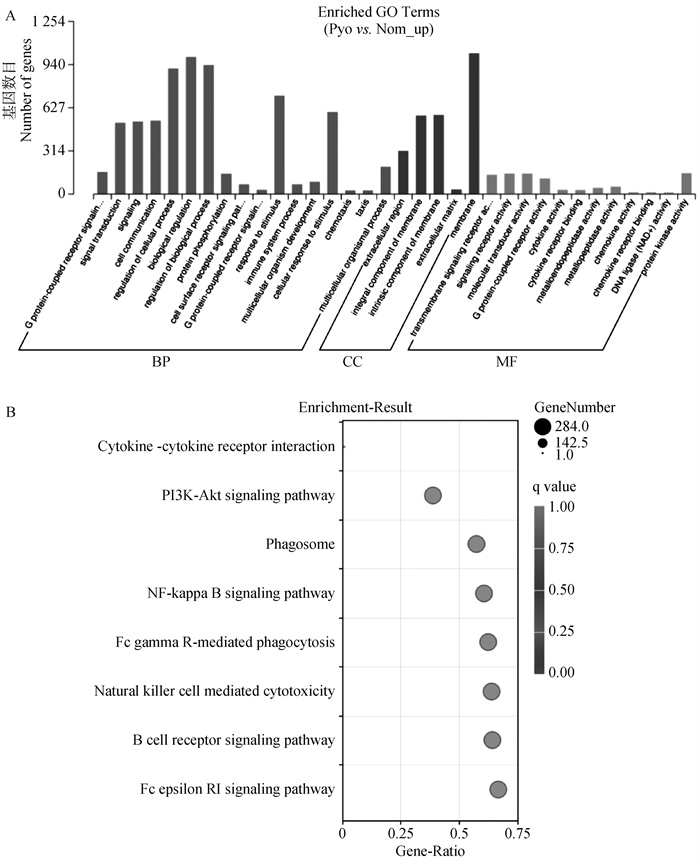
进一步探索DEGs在子宫蓄脓和健康犬的子宫中的功能差异,进行了GO和KEGG分析。富集的GO术语分为生物过程(Biological Process,BP)、细胞成分(Cell Component,CC) 和分子功能(Molecular Function,MF)(图 2A)。在BP类别中,有15个显著富集的条目,其中包括G蛋白偶联受体信号通路、信号转导、细胞通讯、细胞过程调节、生物调节、生物过程调节、蛋白磷酸化、细胞表面受体信号通路、对刺激的反应、免疫系统过程、细胞对刺激的反应、趋化性、趋向性等。富集的MF类别是跨膜信号受体活性、信号受体活性、分子转导活性、G蛋白偶联受体活性、细胞因子活性、细胞因子受体结合、金属内肽酶活性、金属肽酶活性、趋化因子活性、趋化因子受体结合、DNA连接酶(NAD+)活性、蛋白激酶活性。有趣的是,在所有排名靠前的富集GO术语中,来自BP的免疫系统过程和趋化性,以及来自MF的细胞因子活性、趋化因子活性及其受体结合均反映了子宫蓄脓过程中的炎症和免疫反应。此外,图 2B显示了丰富的KEGG通路,其中大量通路参与炎症反应,包括NF-κB信号通路、PI3K-Akt信号通路、B细胞受体信号通路、吞噬体和自然杀伤细胞介导的细胞毒性。
|
GO分析,红色、蓝色、绿色条柱分别为在BP、CC、MF类别中具有显著性富集的条目。B. KEGG-pathway分析 GO analysis. The enrichment terms in categories of BP, CC and MF are respectively colored in red, blue and green. B. KEGG-pathway analysis 图 2 GO功能注释的差异性分析和KEGG-pathway差异性分析(扫描文章首页OSID码查看彩图) Fig. 2 Gene ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) analysis of differentially expressed genes(scan the OSID code on the front page to view the color image) |
基因网络是使用STRING数据库生成的。将综合得分设置为0.9,获得了一个由132个节点组成的基因网络,这些节点通过275条边连接(图 3A)。拓扑分析表明,该基因网络是一个无标度网络(图 3B),网络中有一些节点与其他节点相比高度连接。这些高度连接的节点,也称为中枢基因,代表网络中的重要基因,一共确定了22个中枢基因(图 3C)。值得注意的是,CDK1、ESR1、SHC1、ACTG1、PRKCB、CCNA2、LYN、AKT1、KIF23、PRKCD和CDC6的连接数超过了平均值加上两个标准差,因此这11个基因可以被认为是这个网络的关键中枢基因。

|
A. 基因网络由STRING软件生成,每个节点的直径与其连接值成正比。上调基因为红色,下调基因为绿色。B. 网络的度分布。C. 22个中枢基因的条形图 A. The gene network is generated by the STRING software. The diameter of each node is proportional to its connectivity value. Up-regulated genes were colored in red and down-regulated genes were colored in green. B. Degree distribution of the network. C. Bar plot for 22 most connected genes 图 3 差异表达基因的相互作用网络(扫描文章首页OSID码查看彩图) Fig. 3 Interaction network of differentially expressed genes(scan the OSID code on the front page to view the color image) |
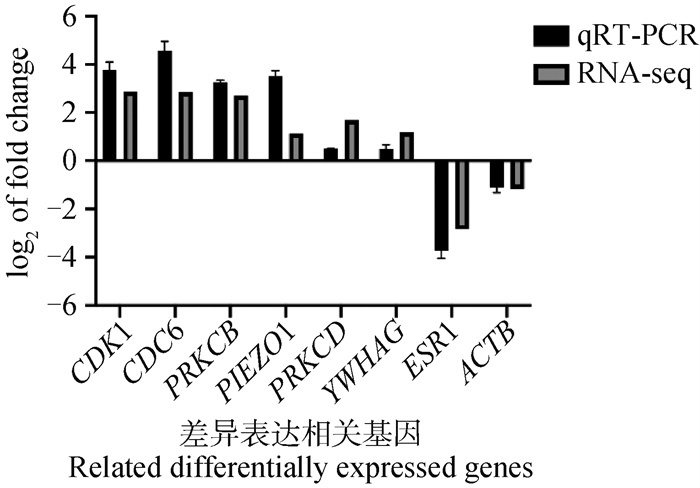
为验证犬子宫蓄脓差异表达基因的测序结果,以GAPDH为内参基因,选择CDK1、CDC6、PRKCB、PIEZO1、PRKCD、YWHAG、ESR1、ACTB进行qRT-PCR检测。结果如图 4所示,qRT-PCR检测结果与RNA-seq的结果趋势一致。
|
图 4 差异表达基因的qRT-PCR验证 Fig. 4 qRT-PCR validation of differentially expressed genes |
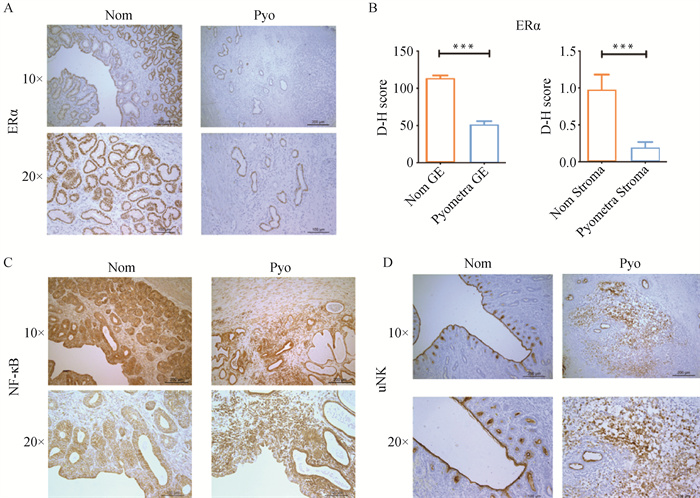
为了验证GO和KEGG分析,用免疫组织化学的方法对ERα、NF-κB和uNK进行染色。ERα是一种由性激素雌激素激活的核受体[13],染色结果证实,ERα在犬子宫蓄脓的间质和腺上皮中的表达均降低(图 5A、5B)。同时,确认NF-κB在健康犬子宫中的细胞质中表达,而在发生炎症时其易位至细胞核表达,该结果与先前研究结果一致[14](图 5C)。在小鼠和人类上,子宫自然杀伤细胞(uNK)被认为是实现胚胎植入和成功妊娠的关键[15],而目前对犬uNK细胞的发育及功能的研究仍不及其在人类与小鼠中的研究。本研究的染色结果显示uNK细胞在子宫蓄脓犬中的表达增加(图 5D)。
|
A、C、D. 子宫蓄脓犬的子宫中NF-κB、Erα和uNK的免疫组织化学结果。上行图比例尺=200 μm,下行图比例尺=100 μm。B. GE(腺上皮)和间质中ERα的H-score比较。P<0.001时,用***表示,代表差异极显著 A, C, D. The immunohistochemical results of the expression of NF-κB, Erα and uNK in the uteri of dogs with pyometra. The upper line in each picture scale bar=200 μm, the lower line in each picture scale bar=100 μm. B. Comparison of H score of ERα respectively in GE (glandular epithelium) and stroma. *** indicates that P<0.001. The difference is extremely significant 图 5 子宫蓄脓犬组织的免疫组织化学验证(扫描文章首页OSID码查看彩图) Fig. 5 Immunohistochemical verification of canine pyometra uterine tissue(scan the OSID code on the front page to view the color image) |
子宫蓄脓为发生于母犬的一种损伤生殖系统和其他系统的慢性或急性常见病,某些犬种中10岁以下有50%以上的母犬都会受其影响[5]。因此,确定用于诊断子宫蓄脓的分子标记具有重要意义,而犬子宫蓄脓时表达增加的基因产物是非常好的选择。以往的研究表明,蓄脓犬血清中多种免疫和炎症反应相关因子增加,如IL-6、CRP、TNF-α等[16]。然而,少有试验研究子宫蓄脓犬子宫内的基因表达情况。在本研究中,应用了具有高精确度和灵敏度的RNA-seq来识别受子宫蓄脓影响时犬子宫转录组表达的差异,一共发现了11 812个基因差异表达,其中7 086个基因在蓄脓子宫中上调,而4 726个基因下调。更重要的是,上调基因的模式反映了免疫和炎症反应,如与免疫和炎症系统过程相关的几个基因和通路的表达均上调,包括但不限于NF-κB信号通路、B细胞受体信号通路、吞噬体、自然杀伤细胞介导的细胞毒性等。
GO和KEGG-Pathway分析表明,免疫反应激活是犬子宫蓄脓的主要病理阶段。GO分析表明,免疫系统过程和趋化性的活性增加,包括细胞因子和趋化因子活性的分子功能,以及细胞因子受体结合和趋化因子受体结合。细胞因子几乎涉及免疫和炎症的各个方面,包括抗原呈递、细胞募集、激活、黏附分子表达等[17]。先前的研究报道,在大于94%的子宫蓄脓犬血清样本中检测到了IL-7、IL-8、IL-15、IL-18和TNF-α, 与对照组相比,在患有子宫蓄脓的犬血清中C-反应蛋白(CRP)浓度更高,且与血清内IL-15浓度相关, 同时,在由子宫蓄脓引起的全身炎症反应综合征的犬中检测到更高的血清IL-7浓度[16]。在另一项研究中,与其他母犬相比,在患有子宫蓄脓的母犬中检测到的更高水平的IL-4,并且与处于发情期和妊娠期的母犬相比,患有子宫蓄脓的母犬血清中IL-10显著增加[4]。这表明几种细胞因子在子宫蓄脓疾病发展中的作用以及诊断犬子宫蓄脓的可能价值。同时,本研究也显示趋化因子在蓄脓子宫中的激活,趋化因子是一组能够在各种细胞中诱导趋化作用的小分子,这些分子通过与G蛋白偶联受体超家族成员的相互作用来调节活性[17],其诱导的趋化性功能在本研究的GO分析结果中也显示为上调。与本研究一致,此前的研究在患有子宫蓄脓的犬的血清中检测到明显更高浓度的角质细胞衍生趋化因子(KC),并且KC浓度与住院天数、单核细胞数量、IL-8浓度以及带状中性粒细胞占比显著相关[18]。这些研究都表明需要进一步研究免疫细胞因子作为诊断犬子宫蓄脓生物标志物的可能性。
本研究中KEGG-Pathway分析显示,与健康犬科动物相比,患有子宫蓄脓的犬科动物子宫中自然杀伤细胞介导的细胞毒性有所增加。细胞毒性是免疫系统对抗感染的重要效应机制,在大多数情况下,细菌感染后免疫细胞衍生大量对抗感染的细胞因子,进一步活化NK细胞[19],也有越来越多的研究表明NK细胞通过直接识别细菌和细菌产物而被激活[20]。而在人和小鼠的研究中发现,uNK细胞只有在妊娠时会持续存在,组织驻留自然杀伤细胞和循环自然杀伤细胞被认为在怀孕期间有助于uNK细胞群的形成[21]。研究表明,uNK分泌的滋养细胞侵袭促进细胞因子(IL-8和IP-10)和重塑母体脊髓动脉所需的各种血管生成因子,对于支持妊娠后期胎盘的充分灌注有非常重要作用,而其细胞毒性较差[15, 22]。目前,在犬中对uNK细胞的发育和功能的研究远不及人类和小鼠。本研究免疫组化结果显示,与健康犬科动物相比,子宫蓄脓犬子宫中uNK细胞表达增加。对于uNK细胞在犬科动物中的功能仍需要进一步研究。
本研究使用STRING数据库构建了一个基因网络。该网络由通过275条边连接的132个节点组成,并在该网络中,确定了11个关键中枢基因。由于中心基因在网络中的关键位置,它们可能比其他基因更为重要。这11个关键中枢基因分别是ESR1(Estrogen Receptor 1),CDK1(Cyclin Dependent Kinase 1),SHC1(SHC Adapter Protein 1),ACTG1(Actin Gamma 1),PRKCD(Protein Kinase C Delta),CCNA2(Cyclin A2),LYN (LYN Proto-Oncogene),AKT1(AKT Serine/Threonine Kinase 1),KIF23(Kinesin Family Member 23),PRKCB(Protein Kinase C Beta)和CDC6(Cell Division Cycle 6)。
已有多项研究表明ESR1对于免疫反应基因的表达具有不一致的作用。研究表明,在红斑狼疮等自身免疫性疾病中ESR1促进促炎细胞因子的产生,以响应树突状细胞和巨噬细胞的TLR配体刺激[23-25]。相反,在其他几种感染性疾病模型中,高水平的雌二醇和雌三醇恰恰会降低促炎性免疫反应[26-28]。本研究结果与后者一致,观察到ESR1在患有子宫蓄脓的犬科动物中的下调表达伴随着促炎性免疫反应的增加。雌激素差异改变ER活性以影响免疫反应基因表达的机制尚不清楚。一种可能性是,低水平或高水平的雌二醇会诱导不同的含ER的转录复合物,从而导致促进或抑制炎症的功能通路中基因的不同模式的表观遗传标记[25]。同时研究表明,ERα参与NF-κB信号通路转录复合物,在许多情况下对ER和NF-κB介导的转录活性具有抑制作用[29],ERs对NF-κB通路的抑制通常会限制炎症反应的程度[30]。本研究观察到在患有子宫蓄脓的犬科动物中ESR1的表达下调以及NF-κB的富集。迄今为止,关于NF-κB在炎症反应中的调节作用的研究较多。作为炎症反应的关键介质,转录因子NF-κB调节先天性和适应性免疫功能的多个方面[31-32]。它诱导各种促炎基因的表达,包括编码细胞因子和趋化因子的基因,而在本研究中也发现了这些基因的富集。由于失调的NF-κB激活与炎症性疾病有关,因此靶向NF-κB信号通路可能是子宫蓄脓抗炎治疗的一种有力的方法。
此外,本研究GO分析还揭示了金属内肽酶和金属肽酶的活性富集。与此前的一项微阵列研究一致,许多基质金属蛋白酶(MMP) 成员在蓄脓犬子宫中上调,包括胶原酶MMP-1和MMP-13,以及明胶酶MMP-9和MMP-7/基质溶素[33]。其他的研究也类似地在子宫蓄脓中证实了编码MMP的基因转录增加[34]。
由于收集的子宫样本由复杂的细胞类型组成,本研究存在一定局限性。子宫壁由子宫内膜、子宫肌层和子宫外膜三层构成,而子宫外膜和子宫肌层厚度的差异可能会淡化子宫内膜基因表达的变化。之前的研究利用酶分离的方法对子宫腔上皮进行微阵列分析[35],这种方法的缺点在于酶分离细胞的转录组可能发生变化。也有研究使用激光捕获显微切割(LCM) 从小鼠子宫中分离管腔上皮[36]。迄今,RNA-seq技术的进步已使得研究单个细胞的转录组成为可能[37],毫无疑问单细胞测序技术的应用将为子宫转录组提供更好的分辨率。然而,与LCM一样,灵敏度的妥协是目前这种方法的限制因素[38]。
目前,本研究下一步扩展应评估是否有任何已识别的上调基因可以用作疾病的生物标志物或治疗靶点。此外,对于鉴定的基因产物是否与子宫细菌感染特异性相关、其上调是否是细菌损伤的一般结果仍需进一步研究。
4 结论运用RNA-seq探索了子宫蓄脓犬和健康犬的全面基因表达谱,鉴定出11 812个差异表达基因,其中7 086个基因在患犬的子宫中上调,4 726个基因下调。GO功能分析显示,差异表达基因主要涉及免疫系统过程、细胞因子活性、趋化因子活性、细胞因子受体结合等生物过程。KEGG-Pathway分析发现,差异表达基因参与炎症与免疫反应激活的信号通路,例如NF-κB信号通路、PI3K-Akt信号通路、B细胞受体信号通路、吞噬体和自然杀伤细胞介导的细胞毒性,说明炎症和免疫反应激活是犬子宫蓄脓的主要病理阶段。通过使用STRING数据库网络,确定了11个关键中枢基因,其产物可能作为诊断子宫蓄脓的分子标记。本研究为深入了解犬子宫蓄脓的机制提供了宝贵的资源。
| [1] |
HAGMAN R. Canine pyometra: what is new?[J]. Reprod Domest Anim, 2017, 52(S2): 288-292. DOI:10.1111/rda.12843 |
| [2] |
COX J E. Progestagens in bitches: a review[J]. J Small Anim Pract, 1970, 11(12): 759-778. DOI:10.1111/j.1748-5827.1970.tb05587.x |
| [3] |
WADÅS B, KVHN I, LAGERSTEDT A S, et al. Biochemical phenotypes of Escherichia coli in dogs: comparison of isolates isolated from bitches suffering from pyometra and urinary tract infection with isolates from faeces of healthy dogs[J]. Vet Microbiol, 1996, 52(3-4): 293-300. DOI:10.1016/S0378-1135(96)00067-3 |
| [4] |
HAGMAN R, GREKO C. Antimicrobial resistance in Escherichia coli isolated from bitches with pyometra and from urine samples from other dogs[J]. Vet Record, 2005, 157(7): 193-197. DOI:10.1136/vr.157.7.193 |
| [5] |
EGENVALL A, HAGMAN R, BONNETT B N, et al. Breed risk of pyometra in insured dogs in Sweden[J]. J Vet Intern Med, 2001, 15(6): 530-538. DOI:10.1111/j.1939-1676.2001.tb01587.x |
| [6] |
JITPEAN S, STRÖM-HOLST B, EMANUELSON U, et al. Outcome of pyometra in female dogs and predictors of peritonitis and prolonged postoperative hospitalization in surgically treated cases[J]. BMC Vet Res, 2014, 10(1): 6. DOI:10.1186/1746-6148-10-6 |
| [7] |
MORTAZAVI A, WILLIAMS B A, MCCUE K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J]. Nat Methods, 2008, 5(7): 621-628. DOI:10.1038/nmeth.1226 |
| [8] |
HUANG D W, SHERMAN B T, TAN Q N, et al. DAVID bioinformatics resources: expanded annotation database and novel algorithms to better extract biology from large gene lists[J]. Nucl Acids Res, 2007, 35(S2): W169-W175. DOI:10.1093/nar/gkm415 |
| [9] |
SZKLARCZYK D, FRANCESCHINI A, WYDER S, et al. STRING v10:protein-protein interaction networks, integrated over the tree of life[J]. Nucl Acids Res, 2015, 43(D1): D447-D452. DOI:10.1093/nar/gku1003 |
| [10] |
ASSENOV Y, RAMÍREZ F, SCHELHORN S E, et al. Computing topological parameters of biological networks[J]. Bioinformatics, 2008, 24(2): 282-284. DOI:10.1093/bioinformatics/btm554 |
| [11] |
FUHRICH D G, LESSEY B A, SAVARIS R F. Comparison of HSCORE assessment of endometrial β3 integrin subunit expression with digital HSCORE using computerized image analysis (ImageJ)[J]. Anal Quant Cytopathol Histopathol, 2013, 35(4): 210-216. |
| [12] |
SU R W, STRUG M R, JOSHI N R, et al. Decreased Notch pathway signaling in the endometrium of women with endometriosis impairs decidualization[J]. J Clin Endocrinol Metab, 2015, 100(3): E433-E442. DOI:10.1210/jc.2014-3720 |
| [13] |
HAMILTON K J, HEWITT S C, ARAO Y, et al. Estrogen hormone biology[J]. Curr Top Dev Biol, 2017, 125: 109-146. |
| [14] |
TRASK JR O J. Nuclear Factor Kappa B (NF-κB) translocation assay development and validation for high content screening[M]//MARKOSSIAN S, GROSSMAN A, BRIMACOMBE K, et al. The Assay Guidance Manual. National Library of Medicine, 2012.
|
| [15] |
DÍAZ-HERNÁNDEZ I, ALECSANDRU D, GARCÍA-VELASCO J A, et al. Uterine natural killer cells: from foe to friend in reproduction[J]. Hum Reprod Update, 2021, 27(4): 720-746. DOI:10.1093/humupd/dmaa062 |
| [16] |
KARLSSON I, HAGMAN R, JOHANNISSON A, et al. Cytokines as immunological markers for systemic inflammation in dogs with pyometra[J]. Reprod Domest Anim, 2012, 47(S6): 337-341. |
| [17] |
BORISH L C, STEINKE J W. 2.Cytokines and chemokines[J]. J Allergy Clin Immunol, 2003, 111(2): S460-S475. DOI:10.1067/mai.2003.108 |
| [18] |
KARLSSON I, HAGMAN R, JOHANNISSON A, et al. Multiplex cytokine analyses in dogs with pyometra suggest involvement of KC-like chemokine in canine bacterial sepsis[J]. Vet Immunol Immunopathol, 2016, 170: 41-46. DOI:10.1016/j.vetimm.2016.01.005 |
| [19] |
YUN C H, LUNDGREN A, AZEM J, et al. Natural killer cells and Helicobacter pylori infection: bacterial antigens and interleukin-12 act synergistically to induce gamma interferon production[J]. Infect Immun, 2005, 73(3): 1482-1490. DOI:10.1128/IAI.73.3.1482-1490.2005 |
| [20] |
CHALIFOUR A, JEANNIN P, GAUCHAT J F, et al. Direct bacterial protein PAMP recognition by human NK cells involves TLRs and triggers α-defensin production[J]. Blood, 2004, 104(6): 1778-1783. DOI:10.1182/blood-2003-08-2820 |
| [21] |
SOJKA D K, YANG L P, YOKOYAMA W M. Uterine natural killer cells[J]. Front Immunol, 2019, 10: 960. DOI:10.3389/fimmu.2019.00960 |
| [22] |
CUDIHY D, LEE R V. The pathophysiology of pre-eclampsia: current clinical concepts[J]. J Obstet Gynaecol, 2009, 29(7): 576-582. DOI:10.1080/01443610903061751 |
| [23] |
CUNNINGHAM M A, NAGA O S, EUDALY J G, et al. Estrogen receptor alpha modulates Toll-like receptor signaling in murine lupus[J]. Clin Immunol, 2012, 144(1): 1-12. DOI:10.1016/j.clim.2012.04.001 |
| [24] |
DOUIN-ECHINARD V, LAFFONT S, SEILLET C, et al. Estrogen receptor α, but not β, is required for optimal dendritic cell differentiation and CD40-induced cytokine production[J]. J Immunol, 2008, 180(6): 3661-3669. DOI:10.4049/jimmunol.180.6.3661 |
| [25] |
KOVATS S. Estrogen receptors regulate innate immune cells and signaling pathways[J]. Cell Immunol, 2015, 294(2): 63-69. DOI:10.1016/j.cellimm.2015.01.018 |
| [26] |
PAPENFUSS T L, POWELL N D, MCCLAIN M A, et al. Estriol generates tolerogenic dendritic cells in vivo that protect against autoimmunity[J]. J Immunol, 2011, 186(6): 3346-3355. DOI:10.4049/jimmunol.1001322 |
| [27] |
RELLOSO M, ARAGONESES-FENOLL L, LASARTE S, et al. Estradiol impairs the Th17 immune response against Candida albicans[J]. J Leukoc Biol, 2012, 91(1): 159-165. |
| [28] |
ROBINSON D P, LORENZO M E, JIAN W, et al. Elevated 17β-estradiol protects females from influenza A virus pathogenesis by suppressing inflammatory responses[J]. PLoS Pathog, 2011, 7(7): e1002149. DOI:10.1371/journal.ppat.1002149 |
| [29] |
FELDMAN I, FELDMAN G M, MOBARAK C, et al. Identification of proteins within the nuclear factor-κB transcriptional complex including estrogen receptor-α[J]. Am J Obstet Gynecol, 2007, 196(4): 394.e1-394.e13. DOI:10.1016/j.ajog.2006.12.033 |
| [30] |
KALAITZIDIS D, GILMORE T D. Transcription factor cross-talk: the estrogen receptor and NF-κB[J]. Trends Endocrinol Metab, 2005, 16(2): 46-52. DOI:10.1016/j.tem.2005.01.004 |
| [31] |
BALDWIN A S. The NF-κ B and I κ B proteins: new discoveries and insights[J]. Annu Rev Immunol, 1996, 14: 649-681. DOI:10.1146/annurev.immunol.14.1.649 |
| [32] |
LIU T, ZHANG L Y, JOO D, et al. NF-κB signaling in inflammation[J]. Signal Transduct Target Ther, 2017, 2(1): 17023. DOI:10.1038/sigtrans.2017.23 |
| [33] |
HAGMAN R, RÖNNBERG E, PEJLER G. Canine uterine bacterial infection induces upregulation of proteolysis-related genes and downregulation of homeobox and zinc finger factors[J]. PLoS One, 2009, 4(11): e8039. DOI:10.1371/journal.pone.0008039 |
| [34] |
CHU P Y, SALAMONSEN L A, LEE C S, et al. Matrix metalloproteinases (MMPs) in the endometrium of bitches[J]. Reproduction, 2002, 123(3): 467-477. DOI:10.1530/rep.0.1230467 |
| [35] |
CHEN Y, NI H, MA X H, et al. Global analysis of differential luminal epithelial gene expression at mouse implantation sites[J]. J Mol Endocrinol, 2006, 37(1): 147-161. DOI:10.1677/jme.1.02009 |
| [36] |
YOON S J, CHOI D H, LEE W S, et al. A molecular basis for embryo apposition at the luminal epithelium[J]. Mol Cell Endocrinol, 2004, 219(1-2): 95-104. DOI:10.1016/j.mce.2004.01.007 |
| [37] |
KOLODZIEJCZYK A A, KIM J K, SVENSSON V, et al. The technology and biology of single-cell RNA sequencing[J]. Mol Cell, 2015, 58(4): 610-620. DOI:10.1016/j.molcel.2015.04.005 |
| [38] |
SALIBA A E, WESTERMANN A J, GORSKI S A, et al. Single-cell RNA-seq: advances and future challenges[J]. Nucl Acids Res, 2014, 42(14): 8845-8860. DOI:10.1093/nar/gku555 |
(编辑 范子娟)



