2. 宁夏大学生命科学学院,银川 750021
2. School of Life Sciences, Ningxia University, Yinchuan 750021, China
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染所致的一种发病率与致死率均较高的人畜共患传染病[1]。据世界卫生组织报道,2020年,全球新增人结核病例约1 000万,死亡病例约140万,而且多重耐药性使结核病预防及治疗更加困难[2-3]。因此,了解Mtb感染的宿主反应对开发结核病新的治疗方法至关重要。巨噬细胞作为Mtb主要的宿主细胞和靶细胞,受到感染后会通过分泌炎性因子,启动自噬、凋亡等程序清除病原菌,但随着Mtb的不断增殖,巨噬细胞也会发生坏死并导致Mtb逃逸进而感染其他细胞[4-6]。其中,巨噬细胞凋亡作为抵抗Mtb感染的重要机制之一,在感染早期可以通过凋亡来清除胞内的Mtb,并通过加工、递呈抗原激活其他的免疫细胞,进一步增强机体的免疫应答反应[7]。因此,探究Mtb与细胞凋亡之间的博弈过程及选择性诱导细胞凋亡是抗Mtb感染的研究重点。
在Mtb感染的过程中,宿主的免疫应答受到表观遗传、代谢等多种因素的调控,这些调控机制提高了宿主抵抗Mtb的效率,也避免了因过度炎症反应而导致的组织损伤[8-10]。谷氨酰胺作为血液和肌肉中含量最丰富的循环氨基酸,在巨噬细胞的代谢过程中发挥着重要作用[11]。谷氨酰胺的分解代谢可以激活巨噬细胞代谢重编程,与细胞糖酵解相互协调共同提供M1型巨噬细胞的生物能量和生物合成前体,且谷氨酰胺分解后产生的脯氨酸和α-酮戊二酸(α-KG)也可以用于补充TCA循环、激活mTORC1、脯氨酸羟基化和表观遗传调控[12-13]。最新研究发现,谷氨酰胺可以通过促进组蛋白甲基化影响IPF成纤维细胞中抗凋亡基因的表达[13]。同时,在TRAIL参与诱导的MDA-MB-231细胞凋亡中,剥夺谷氨酰胺上调了ATF4和磷酸化eIF2α的表达,通过内质网应激促进了细胞凋亡的发生[14]。此外,谷氨酰胺也能促进肠上皮细胞的增殖,调控紧密连接蛋白,对正常及病理情况下细胞凋亡及细胞应激具有保护作用。但是,目前在结核分枝杆菌感染过程中,谷氨酰胺的代谢及其与宿主细胞凋亡的关系尚未阐明[15-16]。因此,本研究拟采用BCG感染巨噬细胞诱导凋亡,探究BCG感染的细胞内谷氨酰胺代谢的变化,利用无谷氨酰胺培养基构建谷氨酰胺剥夺模型,研究谷氨酰胺代谢对BCG诱导的巨噬细胞RAW264.7凋亡的调控作用,以期为结核病的发病机制研究提供新的依据。
1 材料与方法 1.1 试剂与仪器DMEM培养基、无谷氨酰胺培养基购于Gibco公司;小牛血清及胎牛血清购于BI公司;5×SDS-PAGE电泳缓冲液购于上海百赛生物技术公司;β-actin、Caspase 3、PARP、SLC1A5、GLS、GLUD单克隆抗体、荧光二抗均购自Proteintech公司;全蛋白提取试剂盒、细胞凋亡检测试剂盒均购自凯基生物;CCK 8试剂盒购于ApexBio;谷氨酰胺、谷氨酸、α酮戊二酸、谷胱甘肽ELISA检测试剂盒均购于晶美生物。
蛋白电泳装置、酶标仪、全自动细胞计数仪(美国,Bio-Rad公司);高速冷冻离心机(日本,日立公司);微量移液器、高速离心机(德国,Eppendofr); GE化学发光检测仪(美国,General Electric Company)。
1.2 细胞与菌株小鼠RAW264.7细胞株来自中国科学院典型培养物保藏委员会细胞库;牛结核分枝杆菌疫苗株(Bacillus Calmette-Guerin,BCG)购于上海生物制品研究所。
1.3 BCG培养选择Middlebrook7 H10固体培养基复苏BCG菌株,接着将复苏后的BCG接种到Middlebrook7 H9液体培养基中,最后将Middlebrook7 H9液体培养基放置在恒温培养箱中培养(37 ℃、50 mL·L-1 CO2),期间每三周进行一次传代培养。
1.4 细胞培养RAW264.7细胞培养采用含有10 mL·L-1胎牛血清的DMEM培养基,当细胞密集贴壁生长后,弃去培养液,用2 mL PBS冲洗2遍,然后加入2 mL胰酶消化2 min,1 000 r·min-1离心5 min,弃去培养液后,加入2 mL培养基重悬细胞,根据细胞数量在培养皿内分配细胞悬液并静置于37 ℃、50 mL·L-1 CO2的恒温培养箱中。
1.5 免疫印迹将细胞按1×106·孔-1接种在六孔板中,按照试验设计对细胞进行处理,根据全蛋白提取试剂盒的说明书进行蛋白提取,再经BCA对蛋白进行定量,最后选用适当浓度的SDS-PAGE胶进行电泳,电泳完成后选用300 mA转膜2 h,SuPerblock 37 ℃恒温摇床封闭1 h,4 ℃过夜孵育一抗(一抗1∶1 000稀释,β-actin作为内参1∶5 000稀释),再用TBST缓冲液清洗30 min(5 min·次-1),二抗(1∶5 000稀释)在室温孵育2 h,然后用TBST缓冲液冲洗30 min(6 min·次-1),最后加入显色液通过GE化学发光检测仪检测成像,检测结果利用Imagine J分析统计。
1.6 免疫荧光检测将细胞爬片放置在12孔板中,按照5×104·孔-1接种细胞,待细胞贴壁后吸出培养液,1 mLPBS润洗3遍后,用4%的多聚甲醛固定20 min,然后弃去固定液并用1 mL PBS润洗2遍,洗后用0.5%的TritonX-100通透30 min,用3%BSA封闭1 h,弃掉封闭液并加入一抗过夜孵育(3% BSA按照1∶200比例稀释一抗),孵育完成后再用PBS润洗3遍,接着37 ℃避光孵育荧光二抗1 h(PBS按照1∶500稀释二抗),用含有DAPI的封片剂封片,通过激光共聚焦显微镜采集成像。
1.7 代谢物检测在10 μL待测样品中加入40 μL样品稀释液,然后加入100 μL辣根过氧化物酶(HRP)标记的抗体进行抗体检测,将反应孔用封板膜封好,在37 ℃恒温培养箱中温育60 min,5次洗板后,分别加入50 μL底物A和50 μL底物B,37 ℃避光孵育15 min,加入50 μL终止液静置15 min,在波长450 nm处检测OD值。
1.8 CCK8法检测细胞活力将细胞悬浮液(100 μL·孔-1)接种于96孔板上,在恒温培养箱(37 ℃,50 mL·L-1 CO2)培育一段时间后,每孔加入10 μL CCK8溶液,将96孔板放置在恒温培养箱中孵育1~4 h,在450 nm处测定OD值。
1.9 统计学处理所得结果均通过Excel整理和分析后用GraphPad Prism 8.0作图,均值的显著性检验通过OneWay ANOVA分析,多组之间的显著性检验通过LSD分析,结果均采用“ x±s”表示。
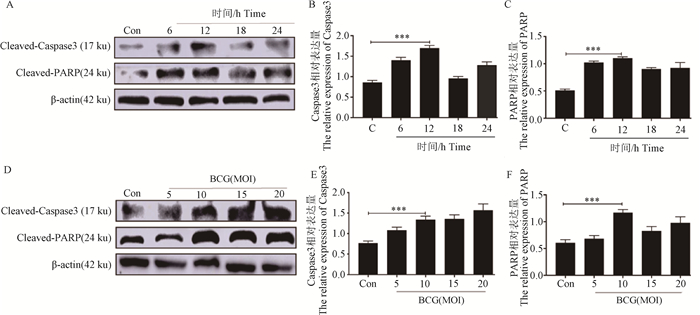
2 结果 2.1 BCG感染上调凋亡相关蛋白Caspase 3和PARP的表达为了探究BCG感染对巨噬细胞凋亡的影响,本研究设计了不同的感染时间及感染复数,并通过Western blot检测BCG感染后Caspase 3和PARP的蛋白表达差异。结果表明(图 1),BCG感染后,Caspase 3和PARP的表达极显著上调(P < 0.001),并且随时间和浓度逐渐升高,最佳感染复数为10 MOI,感染时间为12 h时。
|
A. Western blot检测BCG感染不同时间Caspase 3和PARP的表达情况;B、C. 定量分析结果;D. Western blot检测BCG感染不同复数Caspase 3和PARP的表达情况;E、F. 定量分析结果;*. P < 0.05; **. P < 0.01; ***. P < 0.001 A. Western blot analysis of caspase 3 and PARP in RAW264.7 cells infected with BCG for 6, 12, 18 and 24 h. B, C.The protein ratio was calculated by Image J densitometric analysis.; D. Western blot analysis of caspase 3 and PARP expression in RAW264.7 cells infected with BCG at MOI of 5, 10, 15 and 20 for 12 h.; E, F. Quantitative analysis results; *. P < 0.05; **. P < 0.01; ***. P < 0.001 图 1 BCG感染巨噬细胞后对Caspase3和PARP蛋白表达的影响 Fig. 1 Expression of Caspase 3 and PARP in RAW264.7 cells after BCG infection |
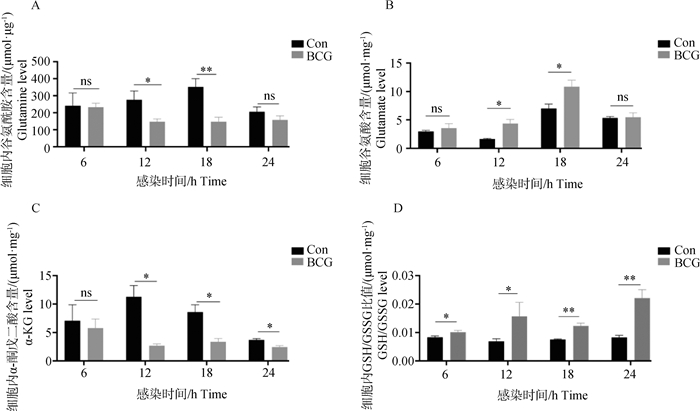
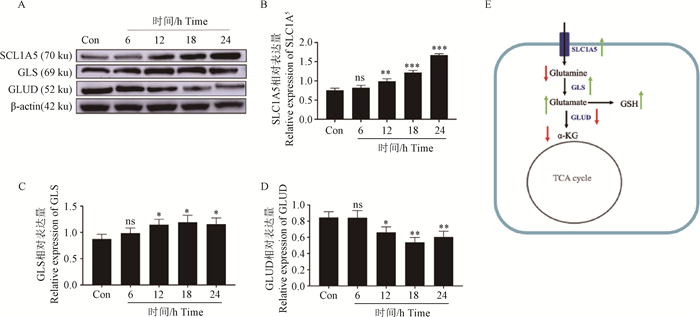
在宿主抵抗Mtb感染的过程中,巨噬细胞的代谢重编程在免疫应答的启动和调节中起着关键的作用,为了探究BCG感染的RAW264.7细胞内谷氨酰胺代谢的变化,采用ELISA检测了BCG感染不同时间细胞内谷氨酰胺及其代谢物的表达差异。结果如图 2所示,BCG感染促进了RAW264.7细胞内的谷氨酰胺代谢,在感染后24 h内,谷氨酰胺和α-KG含量随着感染时间降低,谷氨酸的含量随感染时间升高。为了进一步验证BCG感染对谷氨酰胺代谢的影响,采用Western blot检测谷氨酰胺代谢关键因子SCL1A5、GLS和GLUD的表达。结果如图 3所示,BCG感染后SLC1A5极显著上调(P < 0.001),GLS显著上调(P < 0.05)及GLUD极显著下调(P < 0.01),结果表明,BCG感染促进了细胞谷氨酰胺代谢为谷氨酸,同时抑制了谷氨酸的下游代谢,导致了谷氨酸的累积。
|
A. BCG感染的细胞内谷氨酰胺含量;B. BCG感染的细胞内谷氨酸含量;C.BCG感染的细胞内含量α-酮戊二酸含量; D. BCG感染的细胞内谷胱甘肽含量。*. P < 0.05; **.P < 0.01; ns. P>0.05 A. Intracellular glutamine content in BCG-infected cells; B. Intracellular glutamate content in BCG-infected cells; C. Intracellular content α-ketoglutarate content in BCG-infected cells; D. Intracellular glutathione content in BCG-infected cells. *. P < 0.05; **. P < 0.01; ns. P>0.05 图 2 BCG感染后巨噬细胞内谷氨酰胺分解途径相关代谢产物的含量变化 Fig. 2 Changes of glutaminolysis pathway related metabolites in macrophages after BCG infection |
|
A. Western blot检测BCG感染后谷氨酰胺分解途径关键蛋白的表达情况;B、C、D. 定量分析结果;E. BCG感染的细胞内谷氨酰胺分解途径示意图(红色箭头表示代谢产物/蛋白含量下调;绿色箭头表示代谢产物/蛋白含量上调)。*. P < 0.05; **.P < 0.01; ***.P < 0.001 A. Western blot detection of expression of key proteins of glutamine catabolic pathway after BCG infection; B, C, D.Results of quantitative analysis; E. Schematic diagram of intracellular glutamine catabolic pathway in BCG infection (red arrows indicate down-regulation of metabolite/protein content; green arrows indicate up-regulation of metabolite/protein content). *. P < 0.05; **.P < 0.01; ***.P < 0.001 图 3 BCG感染的巨噬细胞内谷氨酰胺分解途径关键酶的蛋白表达水平 Fig. 3 Protein expression levels of key enzymes of the glutaminolysis pathway in BCG-infected macrophages |
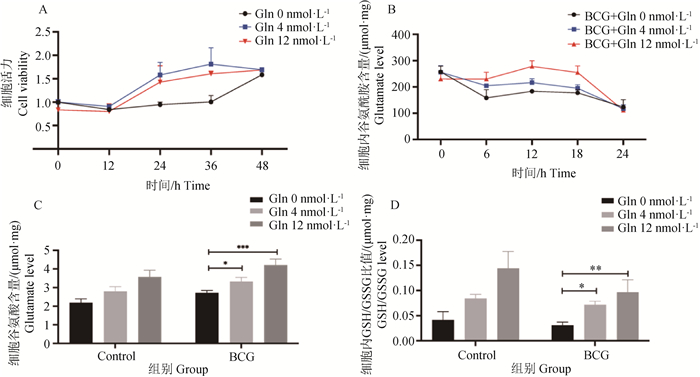
为了探究谷氨酰胺和凋亡之间的关系,利用无谷氨酰胺培养基构建谷氨酰胺剥夺模型,设置了Gln浓度分别为0、4和12 nmol·L-1,采用CCK8法检测了不同谷氨酰胺浓度下RAW264.7细胞的生长情况。结果如图所示(图 4A),在0~48 h,内细胞在谷氨酰胺浓度为4 nmol·L-1的培养基中生长状况最好,在谷氨酰胺浓度为12和8 nmol·L-1的培养基中次之,在无谷氨酰胺的培养基中生长最为缓慢,同时研究发现在48 h内剥夺谷氨酰胺并不会导致巨噬细胞死亡。因此,本研究通过外源添加谷氨酰胺,设置了谷氨酰胺浓度0、4、12 nmol·L-1,检测了BCG感染后巨噬细胞内谷氨酰胺及其代谢物的含量。结果发现,剥夺谷氨酰胺降低了细胞内谷氨酰胺、谷氨酸和谷胱甘肽的含量(图 4B~D),表明细胞对谷氨酰胺的摄取能力和浓度呈正相关。
|
A. 不同谷氨酰胺浓度下细胞的生长情况;B. 细胞对谷氨酰胺的摄取情况;C. 细胞内谷氨酸的含量;D.细胞内谷胱甘肽含量;*. P < 0.05; **. P < 0.01; ***.P < 0.001 A. Cell growth at different glutamine concentrations; B. Cell uptake of glutamine; C. Intracellular glutamate content; D. Intracellular glutathione content; *. P < 0.05; **. P < 0.01; ***.P < 0.001 图 4 剥夺谷氨酰胺对BCG感染的巨噬细胞内谷氨酰胺及其代谢产物的影响 Fig. 4 Effect of glutamine deprivation on intracellular glutamine and its metabolites in BCG-infected macrophages |
随后,为了探究谷氨酰胺及其代谢对RAW264.7细胞凋亡的调控作用,采用流式细胞术检测BCG感染后不同谷氨酰胺浓度下细胞的凋亡率,通过Western blot检测凋亡相关蛋白Caspase 3和PARP的蛋白表达差异。结果显示(图 5),在BCG感染条件下,剥夺谷氨酰胺可以极显著增加RAW264.7细胞的凋亡率(P < 0.01),促进Caspase 3和PARP的蛋白表达,同时免疫荧光的结果也得到了验证,以上研究均证明剥夺谷氨酰胺可以促进BCG感染的RAW264.7细胞凋亡。
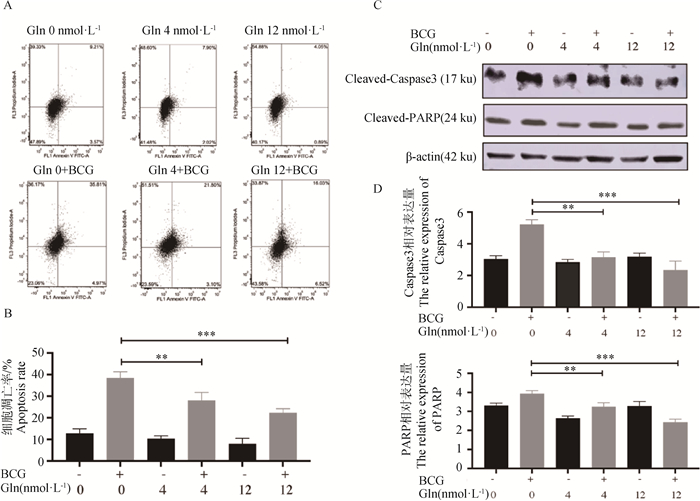
|
A. 流式细胞仪检测细胞凋亡率;C. Western blot检测Caspase 3和PARP的表达情况;B、D. 定量分析结果;*. P < 0.05; **. P < 0.01; ***.P < 0.001 A. Apoptosis rate by flow cytometry; C. Expression of Caspase3 and PARP; B, D. Results of quantitative analysis; *. P < 0.05; **. P < 0.01; ***.P < 0.001 图 5 剥夺谷氨酰胺对BCG诱导巨噬细胞凋亡的影响 Fig. 5 Effect of glutamine deprivation on BCG-induced apoptosis |
为了进一步明确剥夺谷氨酰胺对BCG感染巨噬细胞凋亡的调控机制,本研究通过流式细胞术和Western blot检测了细胞内ROS的含量和内源性凋亡蛋白Bcl-2、Bax和Cytc的蛋白表达水平,结果显示(图 7),剥夺谷氨酰胺极显著降低了抑凋亡蛋白Bcl-2(P < 0.001)的表达,极显著增加了Bax(P < 0.001)和Cytc(P < 0.01)蛋白的表达,同时促进了ROS的累积(P < 0.001)。结果表明,剥夺谷氨酰胺可能通过下调谷氨酰胺代谢产物谷胱甘肽,导致ROS累积,并通过内源途径促进了BCG感染的RAW264.7细胞凋亡。
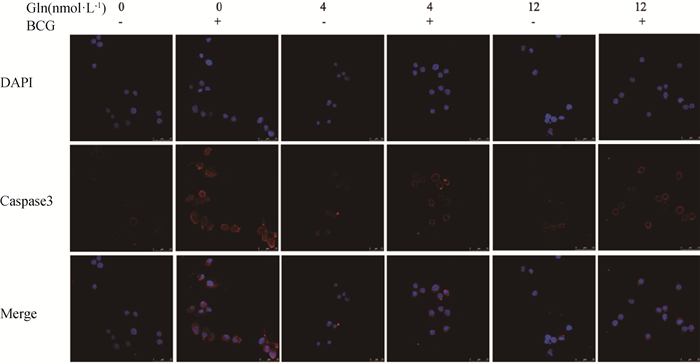
|
图 6 免疫荧光检测不同处理组巨噬细胞内Caspase 3的表达 Fig. 6 Immunofluorescence was used to detect the expression of Caspase 3 in macrophages of different treatment groups |
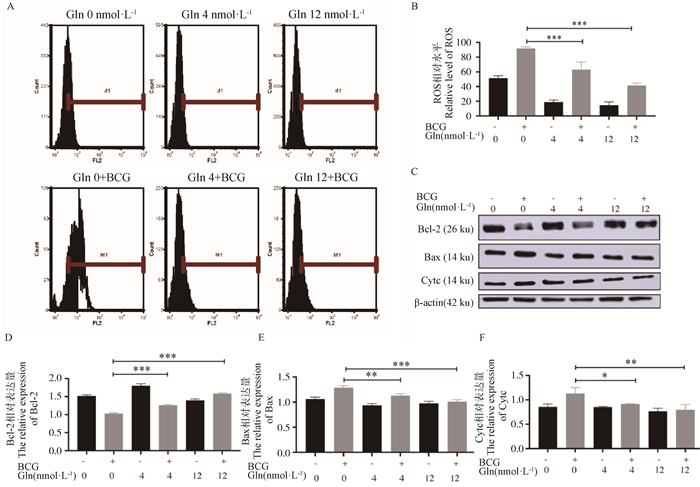
|
A. 流式细胞术检测ROS; B. A图的定量分析;C. Western blot检测Bcl-2、Bax和Cytc的表达情况;D、E、F. C图的定量分析结果;*. P < 0.05; **.P < 0.01; ***.P < 0.001 A. Flow cytometry detection of ROS; B. Quantitative analysis results of Fig.A; C. Western blot detection of Bcl-2, Bax and Cytc expression; D, E, F. Quantitative analysis results of Fig. C; *. P < 0.05; **. P < 0.01; ***. P < 0.001 图 7 剥夺谷氨酰胺对巨噬细胞内源性凋亡的影响 Fig. 7 Effect of glutamine deprivation on endogenous apoptosis of macrophages |
细胞凋亡是机体为了应对病原的感染而主动选择的一种程序性死亡方式,当Mtb感染巨噬细胞后,巨噬细胞可以通过凋亡来清除Mtb,阻止其在体内的进一步感染,但最终凋亡是否发生、Mtb能否存活则受到细胞内多种因子的调控。其中, Mtb和巨噬细胞之间的博弈过程复杂且仍未完全阐明[21]。机体在维持生存和抗感染的过程中,巨噬细胞为了有效地发挥自身的免疫功能会不断地改变和调整自身的代谢状态,同时病原菌会主动从宿主细胞摄取能量进而导致细胞的代谢重编程[22]。代谢重编程会引起细胞内外特定的代谢水平发生变化,从而影响基因的表达及细胞的状态,进而调控细胞的免疫反应,代谢和免疫之间相互影响共同维护机体的稳态[22-23]。
谷氨酰胺是许多代谢途径的关键底物,它可以通过GLS、GLUD等一系列关键酶分解成α-KG进入三羧酸循环向细胞提供能量,同时谷氨酰胺代谢中间产物也通过参与各种信号转导、转录通路调节细胞的免疫应答反应[24-25]。研究发现,在过敏性哮喘、炎症性肠病中,抑制谷氨酰胺代谢可以抑制参与炎性疾病和自身免疫疾病的T细胞发挥功能,减缓炎症反应,但谷氨酰胺对巨噬细胞的调控作用研究未见报道[26]。本研究拟从谷氨酰胺代谢角度解释Mtb诱导巨噬细胞凋亡的作用机制(图 8),前期研究发现BCG诱导RAW264.7细胞发生凋亡,且在感染BCG期间巨噬细胞对谷氨酰胺的消耗增加,并在抑制谷氨酸下游代谢的同时促进谷氨酰胺向谷氨酸及谷胱甘肽分解代谢,那么谷氨酰胺及其代谢的改变是否会影响宿主细胞的免疫应答,进而阻止Mtb的扩散呢?为了探究谷氨酰胺及其代谢对巨噬细胞凋亡的调控作用及机制,本研究首先设置不同时间和浓度的BCG感染RAW264.7,明确BCG感染的最佳条件,接着构建谷氨酰胺剥夺细胞模型,通过流式细胞术、免疫荧光、Western blot等多种方法证明了剥夺谷氨酰胺促进了BCG感染的巨噬细胞凋亡。试验结果与其他学者在p2/0小鼠杂交瘤细胞中“剥夺谷氨酰胺后上调了Cytc和SMAC,激活Caspase 9和Caspase 3,诱导细胞发生凋亡”的结果一致[27-28]。同时,谷胱甘肽可以中和胞内自由基以阻断细胞毒性作用及刺激外源性物质的外排,并且也可以作为一种信号分子直接或间接地调控细胞程序性死亡[29-31]。这些结果表明,抑制谷氨酰胺代谢通过降低细胞内谷胱甘肽的含量,导致ROS的累积,通过内源途径促进了细胞的凋亡。研究结果对揭示Mtb的致病机制提供了新的解读视角,并对抑制谷氨酰胺代谢是否作为潜在的治疗靶点提供了试验依据。
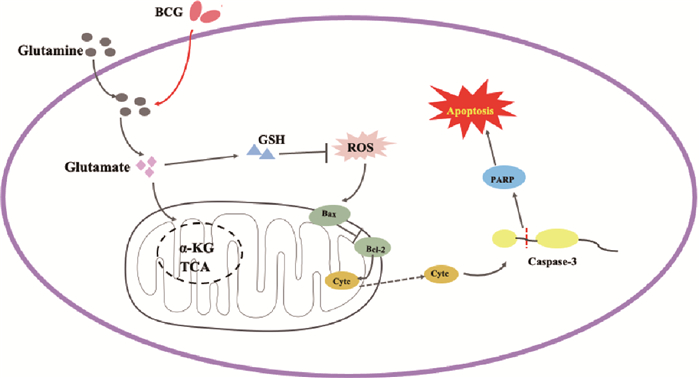
|
图 8 谷氨酰胺及其代谢影响BCG诱导的巨噬细胞凋亡的可能机制 Fig. 8 Possible mechanisms by which glutamine and its metabolism affect BCG-induced apoptosis in macrophages |
BCG感染促进了RAW264.7细胞的谷氨酰胺代谢,同时诱导细胞发生凋亡。在此过程中,抑制谷氨酰胺代谢可降低细胞内谷胱甘肽的含量,造成ROS的累积,促进Cytc(P < 0.01)、Bax(P < 0.001)蛋白的表达,进而通过内源途径促进了巨噬细胞的凋亡。
| [1] |
方舒, 张嘉美, 杨易, 等. 受体相互作用蛋白1(RIP1)对BCG诱导小鼠巨噬细胞凋亡的调控作用[J]. 畜牧兽医学报, 2019, 50(3): 645-653. FANG S, ZHANG J M, YANG Y, et al. Regulation of receptor-interacting protein 1 on apoptosis of macrophage induced by bacillus calmette-guerin[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(3): 645-653. (in Chinese) |
| [2] |
WHO. Global tuberculosis report 2020: executive summary[R]. Geneva: World Health Organization, 2020.
|
| [3] |
SIA J K, RENGARAJAN J. Immunology of Mycobacterium tuberculosis infections[J]. Microbiol Spectr, 2019, 7(4). |
| [4] |
EUM S Y, KONG J H, HONG M S, et al. Neutrophils are the predominant infected phagocytic cells in the airways of patients with active pulmonary TB[J]. Chest, 2010, 137(1): 122-128. DOI:10.1378/chest.09-0903 |
| [5] |
LAM A, PRABHU R, GROSS C M, et al. Role of apoptosis and autophagy in tuberculosis[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 313(2): L218-L229. DOI:10.1152/ajplung.00162.2017 |
| [6] |
ZHANG H Y, PUVIINDRAN V, NADESAN P, et al. Distinct roles of glutamine metabolism in benign and malignant cartilage tumors with IDH mutations[J]. J Bone Miner Res, 2022, 37(5): 983-996. DOI:10.1002/jbmr.4532 |
| [7] |
ELMORE S. Apoptosis: a review of programmed cell death[J]. Toxicol Pathol, 2007, 35(4): 495-516. DOI:10.1080/01926230701320337 |
| [8] |
JIANG L Y, WANG P S, SONG X R, et al. Salmonella typhimurium reprograms macrophage metabolism via T3SS effector SopE2 to promote intracellular replication and virulence[J]. Nat Commun, 2021, 12(1): 879. DOI:10.1038/s41467-021-21186-4 |
| [9] |
SCHUSTER S, EWALD J, KALETA C. Modeling the energy metabolism in immune cells[J]. Curr Opin Biotechnol, 2021, 68: 282-291. DOI:10.1016/j.copbio.2021.03.003 |
| [10] |
THOMAS K, ZONDLER L, LUDWIG N, et al. Glutamine prevents acute kidney injury by modulating oxidative stress and apoptosis in tubular epithelial cells[J]. JCI Insight, 2022, 7(21): e163161. DOI:10.1172/jci.insight.163161 |
| [11] |
CHOI Y K, PARK K G. Targeting glutamine metabolism for cancer treatment[J]. Biomol Ther (Seoul), 2018, 26(1): 19-28. DOI:10.4062/biomolther.2017.178 |
| [12] |
JIANG Q K, QIU Y P, KURLAND I J, et al. Glutamine is required for m1-like polarization of macrophages in response to Mycobacterium tuberculosis infection[J]. mBio, 2022, 13(4): e01274-22. |
| [13] |
SELVARAJAH B, AZUELOS I, ANASTASIOU D, et al. Fibrometabolism-an emerging therapeutic frontier in pulmonary fibrosis[J]. Sci Signal, 2021, 14(697): eaay1027. DOI:10.1126/scisignal.aay1027 |
| [14] |
CURI R, DE SIQUEIRA MENDES R, DE CAMPOS CRISPIN L A, et al. A past and present overview of macrophage metabolism and functional outcomes[J]. Clin Sci (Lond), 2017, 131(12): 1329-1342. DOI:10.1042/CS20170220 |
| [15] |
KIM M H, KIM H. The roles of glutamine in the intestine and its implication in intestinal diseases[J]. Int J Mol Sci, 2017, 18(5): 1051. DOI:10.3390/ijms18051051 |
| [16] |
JIANG B, ZHANG J, ZHAO G H, et al. Filamentous GLS1 promotes ROS-induced apoptosis upon glutamine deprivation via insufficient asparagine synthesis[J]. Mol Cell, 2022, 82(10): 1821-1835. DOI:10.1016/j.molcel.2022.03.016 |
| [17] |
D'ARCY M S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy[J]. Cell Biol Int, 2019, 43(6): 582-592. DOI:10.1002/cbin.11137 |
| [18] |
于嘉霖. 脂肪酸结合蛋白4对BCG诱导巨噬细胞凋亡的调控作用[D]. 银川: 宁夏大学, 2020. YU J L. Role of fatty acid binding protein 4 in regulating apoptosis of macrophage induced by bacillus calmette-guerin infection[D]. Yinchuan: Ningxia University, 2020. (in Chinese) |
| [19] |
CHAI Q Y, LU Z, LIU C H. Host defense mechanisms against Mycobacterium tuberculosis[J]. Cell Mol Life Sci, 2020, 77(10): 1859-1878. DOI:10.1007/s00018-019-03353-5 |
| [20] |
ALSHIRAIHI I, KATO T A. Apoptosis detection assays[J]. Methods Mol Biol, 2023, 2519: 53-63. |
| [21] |
KIM J K, SILWAL P, JO E K. Host-pathogen dialogues in autophagy, apoptosis, and necrosis during mycobacterial infection[J]. Immune Netw, 2020, 20(5): e37. DOI:10.4110/in.2020.20.e37 |
| [22] |
刘震超, 夏菲菲, 周明爱, 等. 代谢免疫学: 新兴的前沿[J]. 现代免疫学, 2018, 38(2): 166-169. LIU Z C, XIA F F, ZHOU M A, et al. Metabolic immunology: an emerging frontier[J]. Current Immunology, 2018, 38(2): 166-169. (in Chinese) |
| [23] |
HOTAMISLIGIL G S. Inflammation and metabolic disorders[J]. Nature, 2006, 444(7121): 860-867. DOI:10.1038/nature05485 |
| [24] |
MOHAMED A, DENG X M, KHURI F R, et al. Altered glutamine metabolism and therapeutic opportunities for lung cancer[J]. Clin Lung Cancer, 2014, 15(1): 7-15. DOI:10.1016/j.cllc.2013.09.001 |
| [25] |
YANG L F, VENNETI S, NAGRATH D. Glutaminolysis: a hallmark of cancer metabolism[J]. Annu Rev Biomed Eng, 2017, 19: 163-194. DOI:10.1146/annurev-bioeng-071516-044546 |
| [26] |
JOHNSON M O, WOLF M M, MADDEN M Z, et al. Distinct regulation of Th17 and Th1 cell differentiation by glutaminase-dependent metabolism[J]. Cell, 2018, 175(7): 1780-1795. DOI:10.1016/j.cell.2018.10.001 |
| [27] |
PAQUETTE J C, GUÉRIN P J, GAUTHIER E R. Rapid induction of the intrinsic apoptotic pathway by L-glutamine starvation[J]. J Cell Physiol, 2005, 202(3): 912-921. DOI:10.1002/jcp.20194 |
| [28] |
MATÉS J M, SEGURA J A, ALONSO F J, et al. Pathways from glutamine to apoptosis[J]. Front Biosci, 2006, 11(3): 3164-3180. |
| [29] |
HOWARD N C, KHADER S A. Immunometabolism during Mycobacterium tuberculosis infection[J]. Trends Microbiol, 2020, 28(10): 832-850. DOI:10.1016/j.tim.2020.04.010 |
| [30] |
ROBERT S M, SONTHEIMER H. Glutamate transporters in the biology of malignant gliomas[J]. Cell Mol Life Sci, 2014, 71(10): 1839-1854. |
| [31] |
YANG H H, HUA C, YANG X L, et al. Pterostilbene prevents LPS-induced early pulmonary fibrosis by suppressing oxidative stress, inflammation and apoptosis in vivo[J]. Food Funct, 2020, 11(5): 4471-4484. |
(编辑 白永平)



