2. 云南省畜牧兽医科学院,昆明 650224
2. Yunnan Academy of Animal Husbandry and Veterinary Sciences, Kunming 650224, China
断奶仔猪的肠道菌群是复杂多样的,多种菌群构成的微生物系统与猪的营养代谢密切相关。肠道菌群的组成、结构和功能受到日粮的影响[1]。仔猪在断奶后,由于食物的种类、来源等发生巨大的变化,肠道菌群环境也发生着变化,进而影响断奶仔猪的生长发育。通过营养性饲料添加剂来优化肠道环境,促进肠道微生物有益菌的增加和抑制有害菌的生长是改善仔猪早期生长水平的重要研究课题。
乳铁蛋白(lactoferrin,LF)是一种具有免疫功能的非血红素铁结合糖蛋白,是自然界含量最高的抗菌药物之一[2]。乳铁蛋白结合铁离子的能力很强,并且是唯一一种在很广泛的pH范围内都可以结合铁离子的转铁蛋白[3]。乳铁蛋白与铁强大的结合能力,使之能够增加机体对铁的吸收率和利用率,隔离游离铁,维持机体铁稳态[4-5]。乳铁蛋白能够保护肠道,调节肠道抗炎能力[6],调节肠道细胞的通透性,促进肠道细胞的生长[7]。还可以增强肠道的吸收能力,降低仔猪腹泻率,提高生产性能[8]。同时,乳铁蛋白也是先天性宿主防御屏障中的重要组成部分,在一定程度上具有抗菌、抗病、抗癌、抗氧化等多种功能[9-11]。研究表明,乳铁蛋白在抗生素相关性腹泻中表现出积极预防作用,可以有效防止坏死性小肠结肠炎[12];可以有效改善肠道菌群结构,抑制肠道有害菌(如肠杆菌、肠球菌等)入侵并降低有害菌的浓度,改善肠道结构;在一定程度上调节机体免疫,通过改善肠道环境促进肠道发育,增强肠道的屏障功能,提高抗菌抗病毒能力;是一种安全的抗菌促生长剂,是欧洲食品安全局认定的安全膳食补充剂[13]。
杆菌肽是一种相对窄谱的多肽类抗生素,主要抑制葡萄球菌、链球菌、梭菌和放线菌等革兰阳性菌,对部分革兰阴性菌也有抑制作用[14]。杆菌肽极不稳定,但当与亚甲基水杨酸共同存在时,二者可相互结合形成亚甲基水杨酸杆菌肽(BMD),进而增强杆菌肽稳定性和活性。BMD由一分子的杆菌肽和两分子的亚甲基水杨酸组合构成,于1954年研发,20世纪80年代开始在全球推广使用。BMD相较于杆菌肽有更好的肠溶性与药理活性。以BMD饲喂动物,有利于增加小肠绒毛高度,提高营养吸收,改善肠道环境[15],因此,BMD被作为饲料添加剂广泛使用。
可以预见,乳铁蛋白对断奶仔猪在断奶初期的生长发育和改善猪的肠道菌群有积极作用,将乳铁蛋白作为断奶仔猪饲料添加剂具有一定研究意义。目前,国内外关于乳铁蛋白的应用研究极少涉及添加后不同时段对仔猪肠道微生物菌群结构的影响,且大多数以三元杂交、杜洛克等商品猪种为试验动物。滇太猪是由云南本地原生品种滇南小耳猪和优良地方猪种太湖猪杂交培育而成,具有体型小、抗病力强、耐粗饲、繁殖率高、肉质好等特点。滇太猪肠道微生物研究属国内空白。本研究以滇太猪断奶仔猪为试验动物,研究日粮添加乳铁蛋白和杆菌肽对仔猪肠道微生物多样性的阶段性影响,为滇太猪肠道微生物特性研究奠定理论基础,同时为乳铁蛋白饲料添加剂的开发利用提供理论依据。
1 材料与方法 1.1 试验设计试验动物由云南省畜牧兽医科学院猪营养研究所提供,并在云南省畜牧兽医科学院进行试验。选取体况良好,日龄相同,体重为(6.12±0.54)kg的40日龄二元杂交滇太猪(滇南小耳猪×太湖猪)断奶仔猪12头(公母各半),随机分为3组,每组4个重复,每个重复1头猪。对照组饲喂基础日粮;杆菌肽组在基础日粮中添加0.5 g ·kg-1杆菌肽预混剂;乳铁蛋白组在基础日粮中添加150 mg ·kg-1乳铁蛋白。杆菌肽预混剂来自必恩迪公司的15%亚甲基水杨酸杆菌肽预混剂,乳铁蛋白来自DMV International Co.(爱尔兰),蛋白质含量为98.7%,乳铁蛋白含量为93.3%,铁饱和度为10.1%。试验期28 d,试验猪自由采食、自由饮水。按照猪场常规程序进行消毒、免疫和驱虫。
基础日粮参照NRC(2012)和中国猪饲养标准(2004)进行配制,日粮组成及营养水平见表 1。
|
|
表 1 基础日粮组成和营养水平 Table 1 The composition and nutrient content of diets |
在试验第7、21、28天,于早上6点开始使用无菌托盘接取粪便到8点,如不排粪则加长采粪时间,停止排便后于粪便中间部分采集粪便样品,装入5 mL无菌冻存管中,迅速置于液氮,随后转至-80 ℃冰箱保存,用于细菌16S rRNA基因测定。试验期共采集粪便样品36份。
1.3 细菌16SrRNA基因使用QIAamP ® Fast DNA Stool Mini Kit试剂盒提取粪便中微生物的总DNA,利用1%琼脂糖凝胶电泳检测所提DNA的浓度和质量,符合要求的DNA用于后续处理。引物341F (5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT -3′)被用来扩增编码细菌16S rRNA基因V3-V4区相对应的基因序列。PCR过程采用TransStart FastPfu DNA Polymerase 20 μL反应体系,反应程序为95 ℃预变性5 min(1×);95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸45 s(27×);72 ℃后延伸10 min。全部样本按照正式试验条件进行,每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。将纯化后的扩增片段构建文库,利用Ilumina公司的Miseq PF250平台进行测序。
1.4 生物信息学分析Illumina PE250测序:根据barcode得到所有样品的有效序列;然后对reads的质量进行质控过滤;接着根据PE reads之间的overlap关系,将成对的reads拼接(merge)成一条序列;最后按照barcode和引物序列拆分得到每个样本的优质序列,并在过程中根据正、反barcode和引物方向校正序列方向以及去除嵌合体。获取Clean Reads。
按照97%相似性对非重复序列(不含单序列)进行OTU聚类,去除嵌合体以得到代表序列。将优化序列映射至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列。
基于OTU结果,通过计算菌群相对丰度(Community richness)的指数:Chao指数。计算菌群多样性(Community diversity)的指数:Shannon指数、Simpson指数。进行Alpha多样性分析研究粪便微生物多样性。通过Venn图表示各组之间独有与共有的OTU,采用RDPclassifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在Phylum和Genus分类水平上统计各样本的群落组成。
1.5 统计分析试验数据采用Excel2013进行初步统计,用SPSS 21.0进行单因素方差分析,Duncan ’s法进行多重比较,结果以“平均数±标准误”表示,P < 0.05为差异显著。
2 结果 2.1 生长性能如表 2所示,各试验组断奶仔猪生长性能指标无显著性差异(P>0.05),其中乳铁蛋白组料重比较对照组降低12.24%,较杆菌肽组降低5.64%。以上数据说明,日粮添加乳铁蛋白对滇太断奶仔猪的生长性能没有显著影响。
|
|
表 2 日粮添加乳铁蛋白对断奶仔猪生产性能的影响 Table 2 Effects of lactoferrin supplementation on performance of weaned piglets |
如表 3所示,通过Illumina Miseq高通量测序技术分析表明,36个样品共产生了2 233 555条有效序列,其中98.21%的有效序列长度在401~450 bp之间,平均长度约为417.84 bp,覆盖率超过99%。
|
|
表 3 样品序列分布 Table 3 Sample sequence distribution |
根据每个样品中的OTUs,通过QIIME软件计算36个粪便细菌16S rRNA基因样品的alpha多样性指数。Chao指数范围为1 572~2 186;Shannon指数范围为4.1~5.53;Simpson指数范围为0.011 7~0.121 3。如表 4所示,在试验的7、21和28 d,三组的OTUs与alpha多样性指数无显著差异。
|
|
表 4 各组样品中OTU数目以及在97%相似水平下的alpha多样性指数 Table 4 The number of OTU in each group and the alpha diversity indexes at 97% similarity level |
仔猪粪便微生物物种组成差异分析如图 1所示,7 d时对照组独有的OTU有167个,杆菌肽组独有的OTU有132个,乳铁蛋白组独有的OTU有159个,3组共有的OTU有1 777个。21 d时对照组独有的OTU有137个,杆菌肽组独有的OTU有136个,乳铁蛋白组独有的OTU有166个,3组共有的OTU有1 775个。28 d时对照组独有的OTU有164个,杆菌肽组独有的OTU有138个,乳铁蛋白组独有的OTU有161个,3组共有的OTU有1 771个。
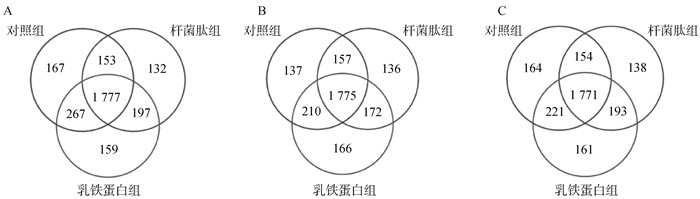
|
A.7 d粪便微生物OTU Venn图; B.21 d粪便微生物OTU Venn图; C.28 d粪便微生物OTU Venn图 A. OTU Venn diagram of fecal microorganism at 7 days; B. OTU Venn diagram of fecal microorganism at 21 days; C. OTU Venn diagram of fecal microorganism at 28 days 图 1 试验7、21与28 d粪便微生物OTU Venn图 Fig. 1 Excrement microbiota OTU Venn diagram on 7, 21 and 28 d of the experiment |
在试验期第7天,粪样细菌在门水平上共检测到19个门,其中相对丰度所占比例在前6的门如表 5与图 2所示,其中各组相对丰度占比均超过25%的有厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes),各组相对丰度占比均超过0.5%的有螺旋体门(Spirochaetes)、变形菌门(Proteobacteria)、广古菌门(Euryarchaeota)和放线菌门(Actinobacteria),其中优势菌门为厚壁菌门和拟杆菌门。在门水平上,各试验组粪便微生物之间无显著差异性(P>0.05),其中乳铁蛋白组比对照组厚壁菌门相对丰度降低了1.43%,拟杆菌门相对丰度增加了16.4%。
|
|
表 5 断奶第7天仔猪粪便菌群在门水平上的分布 Table 5 The distribution of piglets excrement flora at phylum level at 7th day of weaning |
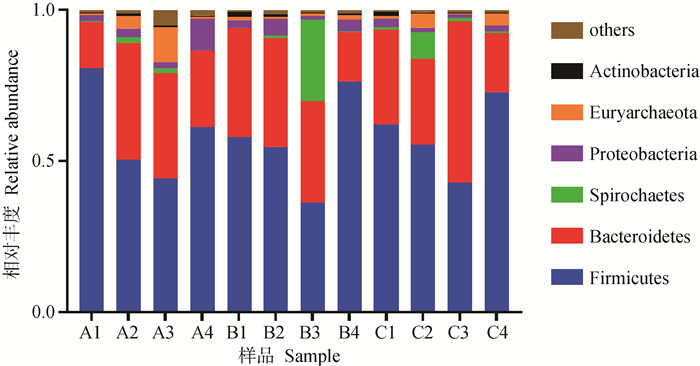
|
A1~4为对照组仔猪粪便样品,B1~4为杆菌肽组仔猪粪便样品,C1~4为乳铁蛋白组的仔猪粪便样品。下图同 A1-4 were fecal samples of piglets in Control group, B1-4 were fecal samples of Bacitracin group, and C1-4 were fecal samples of piglets in Lactoferrin group. The picture below is the same 图 2 断奶第7天仔猪粪便菌群在门水平上的分布 Fig. 2 Distribution of piglets excrement flora at phylum level at 7th day of weaning |
粪样细菌在属水平上共检测到263个属,其中相对丰度所占比例在前13的属如表 6与图 3所示,各组相对丰度占比均超过10%的有乳杆菌属(Lactobacillus),相对丰度均占比超过2%的有普雷沃氏菌科NK3B31群(Prevotellaceae NK 3B31 group)、Muribaculaceae_norank、普雷沃菌属9(Prevotella 9)、Ruminococcaceae UCG-005、巨球型菌属(Megasphaera)、Treponema 2、甲烷短杆菌(Methanobrevibacter)、Rikenellaceae RC 9 gut group、考拉杆菌属(Phascolarctobacterium)、普雷沃菌属1(Prevotella 1)、粪杆菌属(Faecalibacterium)和瘤胃球菌科UCG 002(Ruminococcaceae UCG-002)其中优势菌属为乳杆菌属。在属水平上,各试验组粪便微生物之间无显著差异性(P>0.05),其中乳铁蛋白组乳杆菌属相对丰度比对照组降低了50.21%。
|
|
表 6 断奶第7天仔猪粪便菌群在属水平上的分布 Table 6 Distribution of piglets excrement flora at genus level at 7th day of weaning |
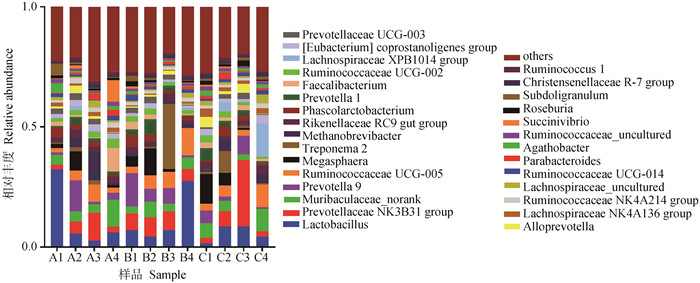
|
图 3 断奶第7天仔猪粪便菌群在属水平上的分布 Fig. 3 Distribution of piglets excrement flora at genus level at 7th day of weaning |
试验期第21天,粪样细菌在门水平上共检测到20个门,其中相对丰度所占比例在前7的门如表 7与图 4所示,各组相对丰度占比均超过25%的有其中相对丰度较高的有厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes),相对丰度占比均超过0.5%的有变形菌门(Proteobacteria),广古菌门(Euryarchaeota),蓝细菌门(Cyanobacteria),放线菌门(Actinobacteria),螺旋体门(Spirochaetes),其中优势菌门为厚壁菌门和拟杆菌门。在门水平上,乳铁蛋白组与对照组相比,厚壁菌门与拟杆菌门相对丰度无显著差异(P>0.05),其中厚壁菌门相对丰度降低了16.4%,拟杆菌门相对丰度增加了34.1%。与对照组相比,杆菌肽组厚壁菌门相对丰度降低(P<0.05),变形菌门和蓝细菌门相对丰度在杆菌肽组(P<0.05)增加。
|
|
表 7 断奶第21天仔猪粪便菌群在门水平上的分布 Table 7 Distribution of piglets excrement flora at phylum level at 21th day of weaning |
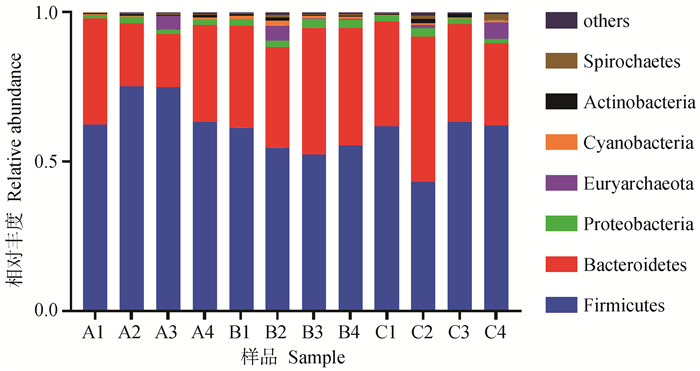
|
图 4 断奶第21天仔猪粪便菌群在门水平上的分布 Fig. 4 Distribution of piglets excrement flora at phylum level at 21th day of weaning |
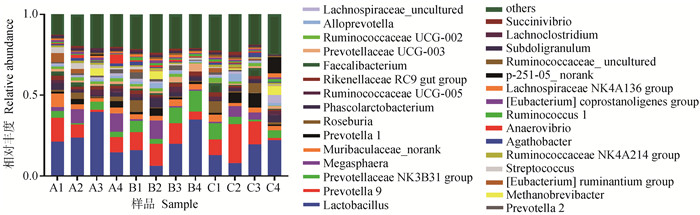
试验期第21天,粪样细菌在属水平上共检测到267个属,其中相对丰度所占比例在前11的门如表 8与图 5所示,各组相对丰度占比均超过10%的有乳杆菌属(Lactobacillus),相对丰度占比均超过2%的有普雷沃菌属9(Prevotella 9)、普雷沃氏菌科NK3B31群(Prevotellaceae NK3B31 group)、巨球型菌属(Megasphaera)、Muribaculaceae_norank、普雷沃菌属1(Prevotella 1)、罗斯氏菌属(Roseburia)、考拉杆菌属(Phascolarctobacterium),其中优势菌属为乳杆菌属。由表 6可知,在属水平上,第21天各试验组之间无显著差异性(P>0.05),其中乳铁蛋白组比对照组乳杆菌属相对丰度降低了8.42%。Prevotella 9相对丰度杆菌肽组高于对照组13.90%,乳铁蛋白组低于对照组20.87%。
|
|
表 8 断奶第21天仔猪粪便菌群在属水平上的分布 Table 8 Distribution of piglets excrement flora at genus level at 21th day of weaning |
|
图 5 断奶第21天仔猪粪便菌群在属水平上的分布 Fig. 5 Distribution of piglets excrement flora at genus level at 21th day of weaning |
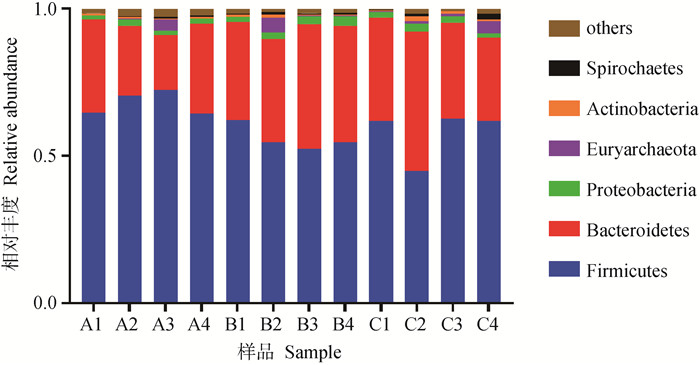
试验期第28天,粪样细菌在门水平上共检测到20个门,其中相对丰度所占比例在前6的门如表 9与图 6所示,各组相对丰度占比均超过25%的有其中相对丰度较高的有厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),相对丰度占比均超过0.5%的有变形菌门(Proteobacteria)、广古菌门(Euryarchaeota)、放线菌门(Actinobacteria)和螺旋体门(Spirochaetes),其中优势菌门为厚壁菌门和拟杆菌门。在门水平上,与对照组相比,乳铁蛋白组厚壁菌门相对丰度显著降低(P<0.05)。与对照组相比,杆菌肽组厚壁菌门相对丰度显著降低(P<0.05),拟杆菌门相对丰度显著提高(P<0.05)。
|
|
表 9 断奶第28天仔猪粪便菌群在门水平上的分布 Table 9 Distribution of piglets excrement flora at phylum level at 28th day of weaning |
|
图 6 断奶第28天仔猪粪便菌群在门水平上的分布 Fig. 6 Distribution of piglets excrement flora at phylum level at 28th days of weaning |
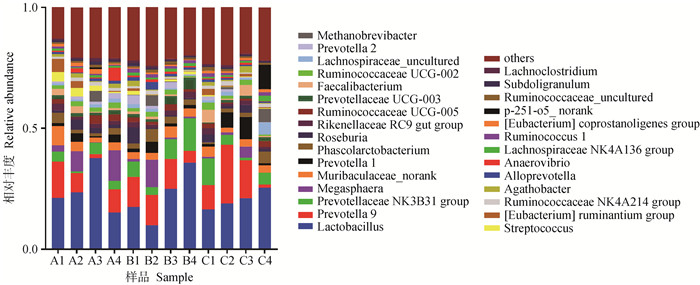
试验期第28天,粪样细菌在属水平上共检测到266个属,其中相对丰度所占比例在前8的属如表 10与图 7所示,各组相对丰度占比均超过10%的有乳杆菌属(Lactobacillus),相对丰度占比均超过2%的有普雷沃菌属9(Prevotella 9)、普雷沃氏菌科NK3B31群(Prevotellaceae NK3B31 group)、巨球型菌属(Megasphaera)、Muribaculaceae_norank、普雷沃菌属1(Prevotella 1)、考拉杆菌属(Phascolarctobacterium)、罗斯氏菌属(Roseburia),其中优势菌属为乳杆菌属。在属水平上,各试验组粪便微生物之间无显著差异性(P>0.05),其中乳铁蛋白组乳杆菌属相对丰度比对照组降低了16.09%。
|
|
表 10 断奶第28天仔猪粪便菌群在属水平上的分布 Table 10 Distribution of piglets excrement flora at genus level at 28th day of weaning |
|
图 7 断奶第28天仔猪粪便菌群在属水平上的分布 Fig. 7 Distribution of piglets excrement flora at genus level at 28th day of weaning |
仔猪的肠道菌群体系从出生开始建立,受环境、饮食、日龄、温度[16]等多种因素影响,在成熟时达到稳定[17]。Niu等[18]的研究表明,在仔猪断奶后,肠道微生物多样性随年龄的增加而增加。Hu等[19]的研究表明,断奶前期肠道微生物的多样性呈先下降后上升的趋势,从断奶到成年,总体呈上升趋势。郭晓红等[20]研究表明,随着仔猪的生长发育,仔猪结肠的微生物菌群多样性出现显著提高。赵方舟[21]研究发现,日粮添加乳铁蛋白会改变哺乳仔猪肠道菌群的多样性和丰富度,有益于维持肠道菌群稳态。本试验结果显示,三个组间不同日龄断奶仔猪的肠道微生物多样性指数无显著差异,对照组呈先上升后下降趋势,而杆菌肽和乳铁蛋白组均呈上升趋势,可见乳铁蛋白在维持断奶仔猪肠道菌群稳定性方面具有促进作用,能够帮助断奶仔猪肠道菌群的变化符合其年龄增长的规律,减少肠道菌群紊乱。
肠道微生物的组成影响着机体对营养物质的吸收,调节机体诸多代谢过程,包括能量代谢、糖代谢和脂质代谢等[22]。厚壁菌门和拟杆菌门是断奶仔猪肠道菌群中的常见优势菌门[23],且随着仔猪年龄的增加,仔猪肠道厚壁菌门的相对丰度逐渐增加,拟杆菌门的相对丰度逐渐降低[24-26]。厚壁菌门能帮助宿主从饮食中获取能量[27]。拟杆菌门能够产生大量活性酶,降解蛋白质等大分子有机化合物[28]、非淀粉多糖[29]、木质纤维素及其他众多难以消化的物质[30]。乳杆菌属是断奶仔猪肠道菌群中常见的优势菌属,是可使葡萄糖等糖类分解为乳酸的各种细菌的总称,在植物性食物的代谢中发挥着重要作用[31],可促进宿主脂质代谢[32],普雷沃氏菌可合成维生素B1[33],降解各种聚糖、多糖等难以消化的物质[34]。在本研究中,厚壁菌门与拟杆菌门为断奶仔猪肠道内的优势菌门,日粮添加乳铁蛋白与杆菌肽均降低了肠道内厚壁菌门的相对丰度,提高了拟杆菌门的相对丰度,且效果随着时间的增加而增加,这与正常仔猪肠道菌群随年龄变化的趋势相反,说明乳铁蛋白或能减缓断奶仔猪肠道微生物的变化,维持断奶仔猪肠道菌群稳定并处在一个相对年轻的水平。乳杆菌属为断奶仔猪肠道内的优势菌属,日粮添加乳铁蛋白与杆菌肽均降低了仔猪肠道内乳杆菌属的相对丰度,前人研究表明[35-37],乳铁蛋白会提高肠道内乳杆菌门的相对丰度,这与本试验结果不符,但日粮添加乳铁蛋白使乳杆菌属在仔猪断奶7~28 d之间增长幅度大于其他两组,可见乳铁蛋白对乳杆菌属有积极作用,其相对丰度的降低可能是由于遗传背景不同所导致的。总体而言,日粮添加乳铁蛋白与杆菌肽均能提高普雷沃氏菌的相对丰度。可见,日粮添加乳铁蛋白能够改善仔猪肠道菌群,进而提高断奶仔猪对多糖等大分子物质和纤维素等难消化物质的消化和吸收能力。研究表明,饲粮中添加LF可改善仔猪肠道功能,平衡肠道微生物菌群,进而改善肠道的消化能力与吸收能力,提高断奶仔猪的平均日增重,提升仔猪的生长性能,改善仔猪的发病率与腹泻率[38-40]。仔猪断奶后,从采食母乳变为采食饲料,肠道菌群的有益改变有利于提高仔猪消化饲料的能力,提高断奶仔猪在教槽期对饲料的适应能力,进而改善断奶仔猪的生产性能。同时,研究表明,厚壁菌门与拟杆菌门的相对丰度与肥胖有关[41-43]。目前,厚壁菌门/拟杆菌门的比值被认为是能够判断肥胖的指标,在肥胖动物中,厚壁菌门相对丰度增加,拟杆菌门相对丰度减小[44-45]。而乳铁蛋白或能够解决肥胖问题[46-48]。Li等[49]的研究表明,乳铁蛋白能够降低厚壁菌门与拟杆菌门的比值,维持肠道菌群稳定,解决小鼠肥胖问题。这与本研究的结果相似,说明乳铁蛋白不仅能提高仔猪对营养物质的吸收,更有可能改善断奶仔猪的肥胖问题,对提高瘦肉率具有重要作用。而日粮添加杆菌肽与添加乳铁蛋白结果类似,说明乳铁蛋白或能达到杆菌肽的效果,成为良好的杆菌肽替代物。
肠道微生物对仔猪健康有着重要的作用。早期肠道定植者的建立影响着猪只以后健康和生长性能[50]。变形菌门包括多种病原菌,如大肠杆菌、沙门菌等,会使机体产生诸多代谢疾病与炎症[51],是肠道菌群失调的标志性菌群[52]。Wang等(何涛译)[35]研究表明,乳铁蛋白减少了大肠杆菌和沙门杆菌的总活菌数。Wang等[36]在饲粮中补饲10 g ·kg-1乳铁蛋白发现,乳铁蛋白可以减少肠道病原菌大肠杆菌和沙门菌数。Hu等[37]向新生仔猪喂养含有重组人乳铁蛋白的牛转基因牛奶,结果表明乳铁蛋白降低了结肠中沙门菌属和整个肠道大肠杆菌的浓度。乳铁蛋白的功能类似转铁蛋白[53],在消化道中,乳铁蛋白能够与肠细胞上的特定受体结合,调节易受铁缺乏影响的细菌的生长,并促进受铁浓度限制的有益细菌生长[54]。同时,通过提供自由基产生所需的铁来增加中性粒细胞的杀菌活性[55]。1992年,Bellamy等[56]发现乳铁蛋白衍生出的抗菌肽能够破坏细菌细胞膜。Ohashi等[57]认为LF的抗菌作用可能是通过抑制细菌的半胱氨酸蛋白酶而实现的。可见,乳铁蛋白具有抗菌作用,能够降低仔猪肠道有害菌群的数量,尤其是降低肠道内的变形菌门相关丰度。本试验结果表明,日粮添加乳铁蛋白与杆菌肽均降低了7 d时断奶仔猪肠道变形菌门的相对丰度,这与前人的研究结果相同,说明乳铁蛋白能够降低断奶仔猪肠道有害菌的相对丰度,保护仔猪肠道健康。在28 d时,日粮添加杆菌肽,变形菌门相对丰度提高程度高于添加乳铁蛋白,说明乳铁蛋白能够更好地维持断奶仔猪肠道菌群的平衡。
4 结论本研究发现,日粮中添加添加乳铁蛋白不会显著影响滇太断奶仔猪的肠道微生物丰富度与多样性,断奶后7、21、28 d仔猪肠道微生物的优势菌门均为厚壁菌门与拟杆菌门,优势菌属为乳杆菌属。
| [1] |
陈巧慧, 蓝群, 潘家华, 等. 莆田黑猪肠道菌群的动态变化及其对平均日增重的影响[J]. 中国微生态学杂志, 2022, 34(8): 900-906. CHEN Q H, LAN Q, PAN J H, et al. Dynamic distribution of gut microbiota in Putian black pigs and effect on average daily gain[J]. Chinese Journal of Microecology, 2022, 34(8): 900-906. DOI:10.13381/j.cnki.cjm.202208005 (in Chinese) |
| [2] |
RAGLAND S A, CRISS A K. From bacterial killing to immune modulation: Recent insights into the functions of lysozyme[J]. PLoS Pathog, 2017, 13(9): e1006512. DOI:10.1371/journal.ppat.1006512 |
| [3] |
QUERINJEAN P, MASSON P L, HEREMANS J F. Molecular weight, single-chain structure and amino acid composition of human lactoferrin[J]. Eur J Biochem, 1971, 20(3): 420-425. DOI:10.1111/j.1432-1033.1971.tb01408.x |
| [4] |
CUTONE A, LEPANTO M S, ROSA L, et al. Aerosolized bovine lactoferrin counteracts infection, inflammation and iron dysbalance in a cystic fibrosis mouse model of Pseudomonas aeruginosa chronic lung infection[J]. Int J Mol Sci, 2019, 20(9): 2128. DOI:10.3390/ijms20092128 |
| [5] |
BONACCORSI DI PATTI M C, CUTONE A, POLTICELLI F, et al. The ferroportin-ceruloplasmin system and the mammalian iron homeostasis machine: regulatory pathways and the role of lactoferrin[J]. Biometals, 2018, 31(3): 399-414. DOI:10.1007/s10534-018-0087-5 |
| [6] |
FAN L L, YAO Q Q, WU H M, et al. Protective effects of recombinant lactoferrin with different iron saturations on enteritis injury in young mice[J]. J Dairy Sci, 2022, 105(6): 4791-4803. DOI:10.3168/jds.2021-21428 |
| [7] |
VEGA-BAUTISTA A, DE LA GARZA M, CARRERO J C, et al. The impact of lactoferrin on the growth of intestinal inhabitant bacteria[J]. Int J Mol Sci, 2019, 20(19): 4707. DOI:10.3390/ijms20194707 |
| [8] |
刘水灵, 安清聪. 乳铁蛋白的免疫功能及其在养猪生产上的应用[J]. 家畜生态学报, 2017, 38(11): 80-83. LIU S L, AN Q C. Application of lactoferrin and its immune function in swine production[J]. Acta Ecologae Animalis Domastici, 2017, 38(11): 80-83. (in Chinese) |
| [9] |
NIAZ B, SAEED F, AHMED A, et al. Lactoferrin (LF): A natural antimicrobial protein[J]. Int J Food Prop, 2019, 22(1): 1626-1641. DOI:10.1080/10942912.2019.1666137 |
| [10] |
LI H Y, LI P, YANG H G, et al. Investigation and comparison of the anti-tumor activities of lactoferrin, α-lactalbumin, and β-lactoglobulin in A549, HT29, HepG2, and MDA231-LM2 tumor models[J]. J Dairy Sci, 2019, 102(11): 9586-9597. DOI:10.3168/jds.2019-16429 |
| [11] |
HERING N A, LUETTIG J, KRUG S M, et al. Lactoferrin protects against intestinal inflammation and bacteria-induced barrier dysfunction in vitro[J]. Ann N Y Acad Sci, 2017, 1405(1): 177-188. DOI:10.1111/nyas.13405 |
| [12] |
SHERMAN M P. Lactoferrin and necrotizing enterocolitis[J]. Clin Perinatol, 2013, 40(1): 79-91. DOI:10.1016/j.clp.2012.12.006 |
| [13] |
SERRANO G, KOCHERGINA I, ALBORS A, et al. Liposomal lactoferrin as potential preventative and cure for COVID-19[J]. Int J Res Health Sci, 2020, 8(1): 8-15. |
| [14] |
CHEN Y, HU S S, LI J L, et al. Bacitracin methylene disalicylate improves intestinal health by modulating its development and microbiota in weaned rabbits[J]. Front Microbiol, 2021, 12: 579006. DOI:10.3389/fmicb.2021.579006 |
| [15] |
PROCTOR A, PHILLIPS G J. Differential effects of bacitracin methylene disalicylate (BMD) on the distal colon and cecal microbiota of young broiler chickens[J]. Front Vet Sci, 2019, 6: 114. DOI:10.3389/fvets.2019.00114 |
| [16] |
郭新羽, 沙玉柱, 蒲小宁, 等. 环境温度对动物肠道微生物菌群影响的研究进展[J]. 畜牧兽医学报, 2022, 53(9): 2858-2866. GUO X Y, SHA Y Z, PU X N, et al. Research progress on the effect of ambient temperature on intestinal microflora of animals[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(9): 2858-2866. (in Chinese) |
| [17] |
ZHAO W J, WANG Y P, LIU S Y, et al. The dynamic distribution of porcine microbiota across different ages and gastrointestinal tract segments[J]. PLoS One, 2015, 10(2): e0117441. DOI:10.1371/journal.pone.0117441 |
| [18] |
NIU Q, LI P H, HAO S S, et al. Dynamic distribution of the gut microbiota and the relationship with apparent crude fiber digestibility and growth stages in pigs[J]. Sci Rep, 2015, 5: 9938. DOI:10.1038/srep09938 |
| [19] |
HU J, NIE Y F, CHEN J W, et al. Gradual changes of gut microbiota in weaned miniature piglets[J]. Front Microbiol, 2016, 7: 1727. |
| [20] |
郭晓红, 郭玉龙, 刘亚丹, 等. 仔猪不同发育阶段结肠微生物菌群特征分析[J]. 畜牧兽医学报, 2019, 50(9): 1759-1774. GUO X H, GUO Y L, LIU Y D, et al. Characteristics of intestinal microflora of colon at different developmental stages in piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(9): 1759-1774. (in Chinese) |
| [21] |
赵方舟. 早期乳铁蛋白干预对哺乳仔猪后肠微生物组成和肠道功能的影响[D]. 南京: 南京农业大学, 2020. ZHAO F Z. Effects of early life lactoferrin intervention on the microbial community and intestinal function of the large intestine in suckling piglets[D]. Nanjing: Nanjing Agricultural University, 2020. (in Chinese) |
| [22] |
SCHOELER M, CAESAR R. Dietary lipids, gut microbiota and lipid metabolism[J]. Rev Endocr Metab Disord, 2019, 20(4): 461-472. DOI:10.1007/s11154-019-09512-0 |
| [23] |
KARASOVA D, CRHANOVA M, BABAK V, et al. Development of piglet gut microbiota at the time of weaning influences development of postweaning diarrhea-a field study[J]. Res Vet Sci, 2021, 135: 59-65. DOI:10.1016/j.rvsc.2020.12.022 |
| [24] |
司景磊. 大白猪饲料利用效率遗传和微生物标记挖掘及宿主遗传与肠道微生物互作关系的研究[D]. 南宁: 广西大学, 2020. SI J L. Identification of the genetic and microbial biomarkers of feed efficiency trait and the interaction between host genetics and intestinal microflora in large white pigs[D]. Nanning: Guangxi University, 2020. (in Chinese) |
| [25] |
杨伟平. 藏猪肠道细菌群落组成与纤维素分解菌的研究[D]. 杨凌: 西北农林科技大学, 2015. YANG W P. A study on the bacteria community and the cellulolytic bacterium in Tibetan Pigs[D]. Yangling: Northwest A&F University, 2015. (in Chinese) |
| [26] |
KIM H B, BOREWICZ K, WHITE B A, et al. Longitudinal investigation of the age-related bacterial diversity in the feces of commercial pigs[J]. Vet Microbiol, 2011, 153(1-2): 124-133. DOI:10.1016/j.vetmic.2011.05.021 |
| [27] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [28] |
THOMAS F, HEHEMANN J H, REBUFFET E, et al. Environmental and gut Bacteroidetes: the food connection[J]. Front Microbiol, 2011, 2: 93. |
| [29] |
LOW K E, XING X H, MOOTE P E, et al. Combinatorial glycomic analyses to direct CAZyme discovery for the tailored degradation of canola meal non-starch dietary polysaccharides[J]. Microorganisms, 2020, 8(12): 1888. DOI:10.3390/microorganisms8121888 |
| [30] |
POWER S E, O 'TOOLE P W, STANTON C, et al. Intestinal microbiota, diet and health[J]. Br J Nutr, 2014, 111(3): 387-402. DOI:10.1017/S0007114513002560 |
| [31] |
FILANNINO P, DI CAGNO R, GOBBETTI M. Metabolic and functional paths of lactic acid bacteria in plant foods: Get out of the labyrinth[J]. Curr Opin Biotechnol, 2018, 49: 64-72. DOI:10.1016/j.copbio.2017.07.016 |
| [32] |
HUANG X C, GAO J, ZHAO Y Z, et al. Dramatic remodeling of the gut microbiome around parturition and its relationship with host serum metabolic changes in sows[J]. Front Microbiol, 2019, 10: 2123. DOI:10.3389/fmicb.2019.02123 |
| [33] |
YOSHⅡ K, HOSOMI K, SAWANE K, et al. Metabolism of dietary and microbial vitamin B family in the regulation of host immunity[J]. Front Nutr, 2019, 6: 48. DOI:10.3389/fnut.2019.00048 |
| [34] |
张德明, 黄嘉訸, 李劲树, 等. 猪肠道微生物及其代谢产物与肠道屏障研究进展[J]. 畜牧兽医学报, 2022, 53(5): 1334-1344. ZHANG D M, HUANG J H, LI J S, et al. Research progress of gut microbiota, metabolites and gut barrier in pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(5): 1334-1344. (in Chinese) |
| [35] |
WANG Y Z, SHAN T Z, XU Z R, 等. 乳铁蛋白对断奶仔猪生长性能、肠道微生物菌群和肠形态的影响[J]. 何涛, 译. 饲料与畜牧, 2007(7): 49. WANG Y Z, SHAN T Z, XU Z R, et al. Effects of the lactoferrin (LF) on the growth performance, intestinal microflora and morphology of weanling pigs[J]. HE T, trans. Feed and Husbandry, 2007(7): 49. (in Chinese) |
| [36] |
WANG Y Z, SHAN T Z, XU Z R, et al. Effects of the lactoferrin (LF) on the growth performance, intestinal microflora and morphology of weanling pigs[J]. Anim Feed Sci Technol, 2007, 135(3-4): 263-272. DOI:10.1016/j.anifeedsci.2006.07.013 |
| [37] |
HU W P, ZHAO J, WANG J W, et al. Transgenic milk containing recombinant human lactoferrin modulates the intestinal flora in piglets[J]. Biochem Cell Biol, 2012, 90(3): 485-496. DOI:10.1139/o2012-003 |
| [38] |
HAO Y, WANG J H, TENG D, et al. A prospective on multiple biological activities of lactoferrin contributing to piglet welfare[J]. Biochem Cell Biol, 2021, 99(1): 66-72. DOI:10.1139/bcb-2020-0078 |
| [39] |
HU P, ZHAO F Z, ZHU W Y, et al. Effects of early-life lactoferrin intervention on growth performance, small intestinal function and gut microbiota in suckling piglets[J]. Food Funct, 2019, 10(9): 5361-5373. DOI:10.1039/C9FO00676A |
| [40] |
HU P, ZHAO F Z, WANG J, et al. Early-life lactoferrin intervention modulates the colonic microbiota, colonic microbial metabolites and intestinal function in suckling piglets[J]. Appl Microbiol Biotechnol, 2020, 104(14): 6185-6197. DOI:10.1007/s00253-020-10675-z |
| [41] |
DELZENNE N M, CANI P D. Interaction between obesity and the gut microbiota: relevance in nutrition[J]. Annu Rev Nutr, 2011, 31: 15-31. DOI:10.1146/annurev-nutr-072610-145146 |
| [42] |
GUO X, XIA X, TANG R, et al. Development of a real-time PCR method for Firmicutes and Bacteroidetes in faeces and its application to quantify intestinal population of obese and lean pigs[J]. Lett Appl Microbiol, 2008, 47(5): 367-373. DOI:10.1111/j.1472-765X.2008.02408.x |
| [43] |
PEDERSEN R, ANDERSEN A D, HERMANN-BANK M L, et al. The effect of high-fat diet on the composition of the gut microbiota in cloned and non-cloned pigs of lean and obese phenotype[J]. Gut Microbes, 2013, 4(5): 371-381. DOI:10.4161/gmic.26108 |
| [44] |
LEY R E, TURNBAUGH P J, KLEIN S, et al. Human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a |
| [45] |
田威龙, 司景磊, 刘笑笑, 等. 高脂高糖饮食对小型猪肠道微生物的影响[J]. 畜牧兽医学报, 2022, 53(4): 1143-1153. TIAN W L, SI J L, LIU X X, et al. Effects of high-fat and high-sugar diet on intestinal microbiota in mini-pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(4): 1143-1153. (in Chinese) |
| [46] |
MIN Q Q, QIN L Q, SUN Z Z, et al. Effects of metformin combined with lactoferrin on lipid accumulation and metabolism in mice fed with high-fat diet[J]. Nutrients, 2018, 10(11): 1628. DOI:10.3390/nu10111628 |
| [47] |
XIONG L, REN F Z, LV J Y, et al. Lactoferrin attenuates high-fat diet-induced hepatic steatosis and lipid metabolic dysfunctions by suppressing hepatic lipogenesis and down-regulating inflammation in C57BL/6J mice[J]. Food Funct, 2018, 9(8): 4328-4339. DOI:10.1039/C8FO00317C |
| [48] |
VENKATA RAO K V, USHA RANI M, GOPALA REDDY A, et al. Amelioration of CCl4 and high fat diet-induced haematological parameters of C57BL/6 mice through lactoferrin[J]. Pharma Innov J, 2022, SP-11(6): 2469-2477. |
| [49] |
LI L, MA C L, HURILEBAGEN, et al. Effects of lactoferrin on intestinal flora of metabolic disorder mice[J]. BMC Microbiol, 2022, 22(1): 181. DOI:10.1186/s12866-022-02588-w |
| [50] |
GUEVARRA R B, LEE J H, LEE S H, et al. Piglet gut microbial shifts early in life: Causes and effects[J]. J Anim Sci Biotechnol, 2019, 10: 1. DOI:10.1186/s40104-018-0308-3 |
| [51] |
RIZZATTI G, LOPETUSO L R, GIBⅡNO G, et al. Proteobacteria: A common factor in human diseases[J]. Biomed Res Int, 2017, 2017: 9351507. |
| [52] |
SHIN N R, WHON T W, BAE J W. Proteobacteria: microbial signature of dysbiosis in gut microbiota[J]. Trends Biotechnol, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
| [53] |
BROCK J H. Lactoferrin-50 years on[J]. Biochem Cell Biol, 2012, 90(3): 245-251. DOI:10.1139/o2012-018 |
| [54] |
WEINBERG E D. The Lactobacillus anomaly: Total iron abstinence[J]. Perspect Biol Med, 1997, 40(4): 578-583. DOI:10.1353/pbm.1997.0072 |
| [55] |
GRZYWACZ K, BUTCHER J, ROMAIN G, et al. The impact of probiotics and lactoferrin supplementation on piglet gastrointestinal microbial communities[J]. Biometals, 2019, 32(3): 533-543. DOI:10.1007/s10534-019-00195-3 |
| [56] |
BELLAMY W, TAKASE M, YAMAUCHI K, et al. Identification of the bactericidal domain of lactoferrin[J]. Biochim Biophys Acta, 1992, 1121(1-2): 130-136. DOI:10.1016/0167-4838(92)90346-F |
| [57] |
OHASHI A, MURATA E, YAMAMOTO K, et al. New functions of lactoferrin and β-casein in mammalian milk as cysteine protease inhibitors[J]. Biochem Biophys Res Commun, 2003, 306(1): 98-103. |
(编辑 范子娟)



