2. 青海大学 畜牧兽医科学院,西宁 810016
2. Qinghai Academy of Animal and Veterinary Science, Qinghai University, Xining 810016, China
犏牛是雌牦牛和雄黄牛的种间杂交后代,是典型的雄性不育动物。组织学研究发现,犏牛垂体前叶促性腺激素细胞发育不良,因而导致卵泡刺激素(FSH)分泌不足,影响了曲细精管的发育,从而使生精上皮发育受阻[1]。细胞学研究表明,犏牛精子发生在减数第一次分裂时期停滞,粗线期初级精母细胞发生凋亡,导致附睾中没有成熟的精子[2],并且犏牛支持细胞的增殖活性和生精细胞的分化关键功能基因的表达均存在缺陷[3]。遗传学研究发现,在精子发生过程中参与细胞增殖[4]、双链DNA断裂和修复[5-6]以及联会[7]的基因都有不同程度的下调和甲基化。
成纤维细胞生长因子对未分化精原细胞的自我更新和抑凋亡起重要作用。FGF2可以通过增加SSCs(spermatogonial stem cells)中Ras(mitogen-activated protein kinase 1)通路中ERK的磷酸化上调SSC中ETV5(ets translocation variant 5)和Bcl6b(B-cell/lymphoma 6 member B protein)的表达[8],促进SSCs的增殖[9]。FGF8与FGFR1结合后激活Ras信号通路诱导GFRα1(GDNF family receptor alpha 1)和RET(Ret proto-oncogene)的表达,抑制SSCs的分化[10]。FGF5通过激活Ras通路中的ERK信号增强ETV5、SHISA6(shisa family member 6)和ID4(inhibitor Of DNA binding 4)等基因的表达,抑制Ngn3(neurogenin 3)、Sox3(SRY-box transcription factor 3)和Piwil4(Piwi like RNA-mediated gene silencing 4)等基因的表达,从而促进SSCs的增殖[11]。体细胞表达的FGF9也能通过p38(mitogen-activated protein kinase 14)-MAPK信号通路上调ETV5和Bcl6b的表达,促进SSC的增殖[12]。FGF4和FGF21通过Ras通路[13-14]抑制未分化精原细胞的凋亡。
FGF家族成员能显著促进未分化精原细胞的增殖活性,而犏牛未分化精原细胞数量稀少[15],因此研究FGF家族成员对犏牛未分化精原细胞增殖的影响有重要意义。本研究通过CCK-8、EDU染色检测了牦牛和犏牛未分化精原细胞的增殖活性;通过RT-qPCR检测了6种FGF家族成员、3种FGF受体、FGF介导的Ras和MAPK信号通路基因和与未分化精原细胞增殖和分化相关基因的差异表达。本研究旨在为进一步解释犏牛生精停滞提供新的思路和线索。
1 材料与方法 1.1 试验材料二氧化碳培养箱(Model 3111,Thermo),倒置荧光显微镜(Axio Observer 3,Zeiss),实时荧光定量PCR仪(A28140,Thermo),细胞计数仪(Thermo Countess Ⅱ,Thermo),酶标仪(1510,Thermo);特级胎牛血清(FB25015,CLARK),DMEM高糖培养基(SH30021.01B,Hyclone),4%多聚甲醛(P1110,索莱宝)。
于四川省阿坝州红原县选取24月龄公麦洼牦牛和F1代公犏牛各3头,取其睾丸组织。用灭菌PBS将睾丸组织冲洗干净,去除附睾及睾丸白膜。经75% 酒精喷洒消毒后用灭菌的剪刀将睾丸组织沿纵膈切开,部分睾丸组织放入有4% 多聚甲醛的15 mL离心管中;部分睾丸组织进行玻璃化冷冻。本试验采用的牦牛和犏牛的未分化精原细胞是消化玻璃化冷冻睾丸组织得到的,是实验室已经鉴定过的细胞。
1.2 HE染色将睾丸组织从4%多聚甲醛中取出,自来水冲洗过夜。将组织切成大小合适的组织块,放入包埋盒中,并用铅笔做好标记。依次放入50% 乙醇、75% 乙醇、85% 乙醇、95% 乙醇和无水乙醇中各1 h。然后依次放入石蜡Ⅰ、石蜡Ⅱ和石蜡Ⅲ中各30 min。切片机切片,将石蜡切片依次放到二甲苯Ⅰ、二甲苯Ⅱ、二甲苯Ⅲ中各15 min,无水乙醇Ⅰ、无水乙醇Ⅱ、85% 乙醇、75% 乙醇中各5 min,并用蒸馏水清洗。石蜡切片入苏木素中染2 min,自来水漂洗,1%盐酸酒精分化数秒,自来水漂洗,然后1%氨水水溶液返蓝1 min,流水冲洗,放入伊红染液中染色1 min,流水漂洗。将切片依次置于75% 乙醇、85% 乙醇、95% 乙醇、无水乙醇和二甲苯中分别浸泡10 min,中性树胶封片,最后镜检。
1.3 ImageJ测量生精小管基底膜到管腔中细胞分布位置的距离将图片导入到ImageJ后,以图片中的标尺为基准,测量出牦牛和犏牛生精小管基底膜到管腔中细胞分布位置的距离(r)。如图 1B所示,生精小管的两条白色虚线互相垂直且等分,每个生精小管取4个值(r1、r2、r3、r4),以平均值作为该生精小管的r值。
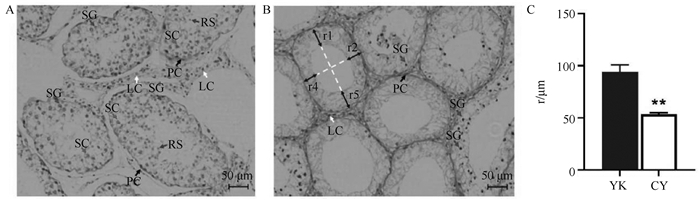
|
A. 牦牛;B. 犏牛。SG、SC、RS、LC和PC分别为精原细胞、精母细胞、圆形精子细胞、间质细胞和管周肌样细胞。C. 牦牛和犏牛生精小管基底膜到管腔的距离,即图 1B中r1-r4的均值。*. P < 0.05;**. P < 0.01,下同 A. Yak; B.Cattleyak. SG, SC, RS, LC and PC are spermatogonia, spermatocyte, round sperm cell, leydig cell and peritubular myoid cell, respectively. C.The distance from basal membrane of seminiferous tubule to lumen of yak and cattleyak, namely, the mean of r1-r4 in figure B. *. P < 0.05;**. P < 0.01, the same as below 图 1 牦牛和犏牛睾丸组织HE染色(40×) Fig. 1 HE staining of yak and cattleyak testis(40×) |
将牦牛和犏牛的试验组和对照组的未分化精原细胞接种于96孔板中,浓度为2×104个·mL-1,终体积为100 μL。分别于不同的培养基中进行培养。每种处理5个重复。在0、24、48、72和96 h时分别加入10 μL CCK-8 Solution (A311, Vazyme,中国),在37 ℃培养箱中孵育2 h,用酶标仪检测450 nm处的吸光值。
1.5 细胞群体倍增时间PDT(population doubling time)检测将牦牛和犏牛的试验组和对照组的未分化精原细胞接种于12孔板中,浓度为2×106个·mL-1,终体积为1.5 mL。分别于不同的培养基中进行培养。每种处理3个重复。在培养48 h后,用CountessⓇ Ⅱ进行细胞计数。按照公式(1)计算细胞群体倍增时间。
| $ \mathrm{PDT}=\left[\frac{\log 2}{\log \mathrm{Nt}-\log \mathrm{N} 0}\right] \times \mathrm{t} $ | (1) |
其中,t为培养时间,N0为初始培养的细胞数量,Nt为培养t时间后的细胞数量。
1.6 EDU染色牦牛和犏牛的未分化精原细胞用4%多聚甲醛固定30 min,用2 g·L-1甘氨酸中和,用PBS洗涤,然后种植在粘附载玻片上。0.5% Triton X-100 (100 μL)渗透10 min后,载玻片上的细胞用EdU染色30 min (100 μL)。用DAPI将细胞核染色30 min,然后于显微镜下记录图像。
1.7 RNA的提取悬浮生长的细胞收集后,500 G、4 ℃离心6 min,弃上清。加入1 mL PBS重悬浮细胞,将细胞稀释至1×107个·mL-1,每个1.5 mL Rnase-free离心管分装1 mL细胞悬液。500 G、4 ℃再次离心6 min,弃上清。加入1 mL Trizol,混匀后在室温下静置10 min。加入200 μL氯仿,涡旋振荡混匀15 s,室温下静置2 min。12 000 r·min-1、4 ℃离心10 min。将上层的透明相吸到新的1.5 mL Rnase-free离心管中,加入500 μL异丙醇,混匀后室温静置10 min。12 000 r·min-1、4 ℃离心10 min。弃上清,加入1 mL 75% 乙醇,轻轻洗涤沉淀。7 500 r·min-1、4 ℃离心5 min。弃上清,加50 μL Rnase-free H2O,溶解RNA。用超微量核酸蛋白测定仪检测RNA的浓度及纯度。将剩余RNA进行逆转录反应或置于-80 ℃保存。
1.8 逆转录PCR (RT-PCR)利用HiScriptⓇ Ⅲ RT SuperMix for qPCR (+ gDNA wiper) 试剂盒(R323-01,Vazyme,中国) 将“1.7”中提取的RNA逆转录为cDNA。
基因组DNA的去除:将4 μL 4×gDNA wiper Mix、1 μL 1 g·L-1 RNA和11 μL Rnase-free H2O在200 μL离心管中轻轻吹打混匀,42 ℃放置2 min。
逆转录反应:向上述16 μL反应液中加入4 μL 5×HiScript Ⅲ qRT SuperMix,在37 ℃放置15 min,85 ℃放置5 s。将最终的产物置于-20 ℃保存。
1.9 实时荧光定量PCR (RT-qPCR)利用ChamQ Universal SYBR qPCR Master Mix试剂盒(Q711,Vazyme,中国) 以“1.8”中逆转录得到的cDNA为模板,进行实时荧光定量PCR反应。本试验所用基因引物见表 1。
|
|
表 1 RT-qPCR引物序列 Table 1 RT-qPCR primer sequence |
在200 μL离心管中将10 μL 2×ChamQ Universal SYBR qPCR Master Mix、0.4 μL F-primer、0.4 μL R-primer、1 μL cDNA和8.2 μL ddH2O混匀。
RT-qPCR反应:95 ℃放置30 s;95 ℃放置10 s,退火温度放置30 s,40个循环;95 ℃放置15 s,60 ℃放置60 s,95 ℃放置15 s
1.10 统计分析RT-qPCR以β-actin为内参,采用ΔΔCt法分析。使用GraphPad Prism 9.0.0统计软件(GraphPad Inc.,美国)进行单因素方差分析,以确定是否具有统计学意义的差异(P < 0.05或P < 0.01)。除非另有说明,否则每组试验重复至少3次。
2 结果 2.1 牦牛和犏牛睾丸组织的HE染色通过对牦牛和犏牛睾丸组织的HE染色,发现牦牛的生精小管(图 1A)表现出正常的生理特征,从生精小管基底膜到管腔分布着类型丰富的生殖细胞,包括精原细胞、精母细胞和圆形精子细胞。而犏牛生精小管(图 1B)主要的生殖细胞为精原细胞,少见精母细胞。牦牛睾丸组织中生精小管与生精小管的间质部分的细胞数量也比犏牛丰富。另外,牦牛生精小管基底膜到管腔的距离((94.01±6.82) μm)显著高于犏牛((53.42±1.40) μm) (P < 0.01,图 1C),表明牦牛生精小管中的细胞数量比犏牛丰富。
2.2 牦牛和犏牛未分化精原细胞增殖活性的比较通过计算牦牛和犏牛48 h未分化精原细胞的细胞群体倍增时间,发现犏牛未分化精原细胞细胞群体倍增时间((20.10±0.46)h)显著大于牦牛((17.05±1.20)h,P < 0.05),即犏牛未分化精原细胞的增殖活性低于牦牛(P < 0.05,图 2A)。通过CCK-8试剂检测牦牛和犏牛未分化精原细胞增殖活性,发现牦牛和犏牛的增殖曲线整体呈S型,但牦牛未分化精原细胞的增殖速率及活性都高于犏牛,尤其是在48 h之后(P < 0.01,图 2B)。PDT和CCK-8的结果都表明,犏牛未分化精原细胞的增殖活性远低于牦牛未分化精原细胞。EDU染色试验也证明了犏牛未分化精原细胞增殖活性弱于牦牛(图 2C)。

|
A. 细胞群体倍增时间;B. CCK-8;C. EDU染色(200×) A. Cell population doubling time; B. CCK-8; C. EDU staining (200×) 图 2 牦牛和犏牛未分化精原细胞增殖活性的比较 Fig. 2 Comparison of the proliferative activity of undifferentiated spermatogonia in yak and cattleyak |
通过qPCR检测了FGFs家族成员FGF2、FGF4、FGF5、FGF8、FGF9和FGF21在牦牛和犏牛睾丸组织中的表达,发现FGF2、FGF8、FGF9和FGF21在犏牛睾丸组织中的表达约为牦牛睾丸组织中的一半(P < 0.01),而FGF4和FGF5则在犏牛中以极低的水平表达(P < 0.01,图 3A)。
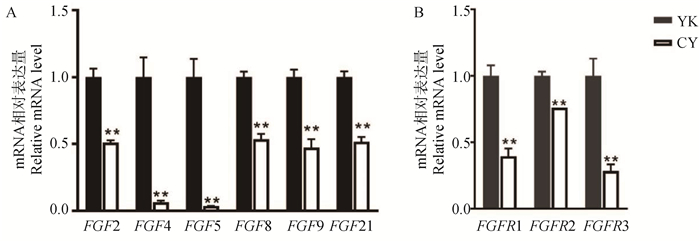
|
A. FGFs在牦牛和犏牛睾丸组织中的表达;B. FGFRs在牦牛和犏牛未分化精原细胞中的表达 A. Expression of FGFs in testis of yak and cattleyak; B. Expression of FGFRs in undifferentiated spermatogonia of yak and cattleyak 图 3 FGFs及FGFRs在牦牛和犏牛中的表达 Fig. 3 Expression of FGFs and FGFRs in yak and cattleyak |
通过RT-qPCR的方法检测了牦牛和犏牛未分化精原细胞中FGF受体家族成员FGFR1、FGFR2和FGFR3的表达情况。结果显示,3种FGFR在犏牛未分化精原细胞中的表达都显著低于牦牛未分化精原细胞中的表达(P < 0.01, 图 3B)。
2.5 FGFs/FGFRs介导的Ras和MAPK通路基因在牦牛和犏牛未分化精原细胞中的差异表达通过RT-qPCR检测了FGFs/FGFRs介导的Ras和MAPK信号通路中基因的差异表达。结果如图 4A所示,在Ras通路基因中,只有HRas在犏牛未分化精原细胞中的表达高于在牦牛未分化精原细胞中的表达(P < 0.01);ARaf(A-Raf proto-oncogene)在牦牛和犏牛未分化精原细胞中的表达没有明显差异;Raf1(Raf-1 proto-oncogene)、BRaf(B-Raf proto-oncogene)、MEK1(mitogen-activated protein kinase kinase 1)、ERK都是在牦牛未分化精原细胞中的高表达(P < 0.01,图 4A)。在MAPK通路基因中,p38、MEKK3 (mitogen-activated protein kinase kinase 3)、MEKK6(mitogen-activated protein kinase kinase 36)和ASK1(mitogen-activated protein kinase kinase kinase 5)都在牦牛未分化精原细胞中的表达显著高于在犏牛未分化精原细胞中的表达(P < 0.01,图 4B)。
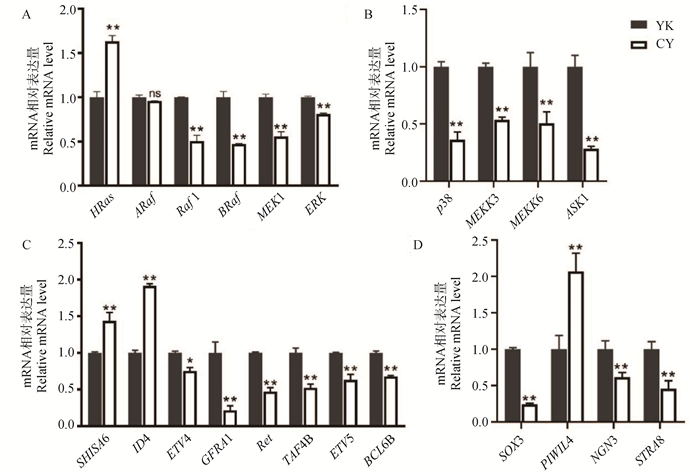
|
A. FGFs/FGFRs介导的Ras通路基因在牦牛和犏牛未分化精原细胞中的表达;B. FGFs/FGFRs介导的MAPK通路基因在牦牛和犏牛未分化精原细胞中的表达;C. 与增殖相关基因在牦牛和犏牛未分化精原细胞中的表达;D. 与分化相关基因在牦牛和犏牛未分化精原细胞中的表达。ns.无显著性差异 A. Expression of Ras pathway genes mediated by FGFs/FGFRs in undifferentiated spermatogonia of yak and cattleyak; B. Expression of MAPK pathway genes mediated by FGFs/FGFRs in undifferentiated spermatogonia of yak and cattleyak; C. Expression of genes related to proliferation in undifferentiated spermatogonia of yak and cattleyak; D. Expression of genes related to differentiation in undifferentiated spermatogonia of yak and cattleyak. ns. No significant difference 图 4 FGFs通路基因及与增殖和分化相关基因在牦牛和犏牛未分化精原细胞中的表达 Fig. 4 Expression of FGFS pathway genes and genes related to the proliferation and differentiation in undifferentiated spermatogonia of yak and cattleyak |
受Ras通路调控的与细胞增殖相关的基因中,SHISA6和ID4在犏牛未分化精原细胞中的表达明显高于在牦牛的表达(P < 0.01),而ETV4、GFRα1、Ret和TAF4B(TATA-Box binding protein associated factor 4b)都是在牦牛未分化精原细胞的表达量更高(P < 0.05,图 4C)。受Ras和MAPK通路共同调控的与细胞增殖相关的基因中,ETV5和BCL6B也在牦牛未分化精原细胞的高表达(P < 0.01,图 4C)。受Ras通路调控的与细胞分化相关的基因中,PIWIL4在犏牛未分化精原细胞中的表达量显著高于牦牛,而SOX3、Stra8(stimulated by retinoic acid 8)和NGN3则在牦牛未分化精原细胞中的表达量更高(P < 0.01, 图 4D)。
3 讨论对牦牛和犏牛睾丸组织的HE染色发现,犏牛睾丸组织中从生精小管基底膜到管腔的距离比牦牛薄得多,管腔中间出现空泡,而且生殖细胞类型较少,以精原细胞为主,表明犏牛雄性不育表现为生精小管发育异常,精子发生受阻,无法产生精子。另外,CCK-8、PDT和EDU染色结果也表明犏牛未分化精原细胞的增殖活性也明显低于牦牛。这可能会导致犏牛睾丸组织中用于维持自我更新的干细胞数量不足,进而减少了用于分化产生精子的干细胞数量,进一步加重了雄性犏牛的生精停滞。
成纤维细胞生长因子是一个庞大的家族,目前已经发现了23个家族成员(FGF1-23),它们与5种FGF细胞表面受体(FGFR1、FGFR2、FGFR3、FGFR4和FGFRL1)相结合,激活下游的信号通路,影响细胞的行为[16]。目前,已经证实了FGF2、FGF5、FGF8和FGF9在哺乳动物未分化精原细胞中与相应的受体结合,以维持未分化精原细胞的自我更新[8-11],而FGF4和FGF21具有抗凋亡的作用[13-14]。本研究结果显示,6种FGF家族成员在犏牛睾丸组织中的表达都明显低于其在牦牛中的表达,3种FGF受体也在犏牛未分化精原细胞中低表达。因此,以上的结果表明,FGFs及其受体FGFRs的表达量不足是犏牛未分化精原细胞增殖活性低的原因之一。
FGFs/FGFRs介导多条信号通路调节细胞的行为。FGF9与FGFR3结合,通过ASK1-MEKK3/6-p38信号的级联激活来维持未分化精原细胞的自我更新[12]。FGF2、FGF5、FGF8通过HRas-Raf1/ARaf/BRaf-MEK1-ERK信号的级联激活促进未分化精原细胞的增殖[9-11]。FGF4[13]及FGF21[14]通过Ras-Raf-ERK信号级联激活抑凋亡。本研究结果显示,只有Ras通路中的HRas的表达量是在犏牛未分化精原细胞中的表达量高于牦牛,ARaf的表达量在两种牛中没有差异。其余的通路基因,包括MAPK通路中的ASK1、MEKK3、MEKK6和p38以及Ras通路中的Raf1、BRaf、MEK1和ERK,都是在牦牛未分化精原细胞中的高表达。因此,犏牛未分化精原细胞增殖能力弱的另一个重要原因是FGFs/FGFrs介导的Ras和MAPK信号通路中的基因表达异常,导致FGFs/FGFRs介导的信号不能准确地调控与细胞增殖和分化相关的基因,降低了未分化精原细胞的增殖活性。
结果表明,受Ras通路调控的与未分化精原细胞增殖相关的基因中,ID4与SHISA6在犏牛未分化精原细胞中的表达量更高。ID4在小鼠中能决定未分化精原细胞的状态,ID4+的未分化精原细胞主要维持自我更新,ID4-的未分化精原细胞则趋向于分化产生精子[17]。SHISA6是一种细胞固有的因子,能够抑制Wnt的表达,而Wnt/β-catenin通路能促进未分化精原细胞的分化[18]。由于犏牛未分化精原细胞数量少,为维持用于自我更新的细胞的数量,犏牛未分化精原细胞通过上调SHISA6的表达以抑制分化,从而使得犏牛未分化精原细胞偏向自我更新而不是分化,间接导致了ID4表达的上调。
本研究也发现,与增殖相关的其他基因都是在牦牛未分化精原细胞中的表达更高。TAF4B是一种在性腺中特异表达的转录调节因子,能调控GFRα1和Ret的表达[19]。GFRα1和Ret是GDNF的受体[20-21],其介导的信号通路能促进未分化精原细胞的增殖,同时又能调控Etv5的表达[22]。Etv5既是FGF9和FGF5下游的调控基因[11-12],同时又参与调控Bcl6b的表达[23-24],用以维持未分化精原细胞的自我更新。Taf4b在犏牛未分化精原细胞中表达不足导致GFRα1和Ret表达下调,进而导致Etv5、Bcl6b的表达下调,降低了犏牛未分化精原细胞的增殖活性。ETV4与ETV5是同源蛋白,也与精原细胞增殖相关[25],其表达量不足也会降低犏牛未分化精原细胞的增殖活性。而犏牛未分化精原细胞增殖活性降低会导致未分化精原细胞数量少,没有足够的未分化精原细胞进入分化状态产生精子。
另外,本研究还发现受Ras通路调控的与未分化精原细胞分化相关的基因中,Piwil4在犏牛未分化精原细胞中高表达,但Sox3、Ngn3和Stra8在犏牛中低表达。PIWIL4属于Argonaute蛋白家族的Piwi分支,在动物生殖系中特异表达,其mRNA被提前转录,以mRNP的形式被存储[26]。Piwil4在犏牛未分化精原细胞中的表达量更高,可能是由于犏牛精子发生被阻滞在减数分裂时期,导致Piwil4的mRNA被大量积累。Sox3是一种转录因子,与Ngn3启动子区域中的保守区域结合,能直接调控NGN3的表达,以促进未分化精原细胞的分化[27]。NGN3+的细胞是准备进入分化的干细胞,其通过上调Stra8的表达促进减数分裂的进程[28]。犏牛未分化精原细胞数量少,不能进入分化态,下调与分化相关的基因Sox3的表达。Sox3的低表达导致没有足够的SOX3转录因子结合到的Ngn3启动子上,进而下调了Ngn3的表达,也进一步下调了Stra8的表达,抑制了犏牛精原细胞的分化。Ngn3在犏牛未分化精原细胞中的表达显著低于牦牛,表明犏牛未分化精原细胞群体中NGN3阳性的细胞占比较少,即犏牛未分化精原细胞更偏向于自我更新。
4 结论本研究发现,FGF家族成员(FGF2、FGF4、FGF5、FGF8、FGF9和FGF21)及其相应的受体(FGFR1、FGFR2和FGFR3)、FGFs所介导的信号通路中的基因(p38、Raf、B Raf、MEK1、ERK、MEKK3、MEKK6和ASK1)及与未分化精原细胞增殖相关的基因(ETV5、TAF4B、ETV4、BCL6B、GFRα1和Ret)都在犏牛的未分化精原细胞中的表达量不足导致犏牛未分化精原细胞的增殖活性显著低于牦牛的未分化精原细胞,而犏牛未分化精原细胞增殖活性会降低导致未分化精原细胞数量少(图 5)。另外,与未分化精原细胞增殖相关的基因(SHISA6和ID4)及与未分化精原细胞分化相关的基因(SOX3、NGN3和Stra8)在犏牛未分化精原细胞中的表达量低表明犏牛未分化精原细胞是用于维持自我更新而不是分化产生精子。因此,FGFs/FGFRs介导的Ras和MAPK通路基因在犏牛未分化精原细胞中的异常表达,降低了犏牛未分化精原细胞增殖活性,减少了未分化精原细胞的数量,导致犏牛睾丸中没有足够的未分化精原细胞进入分化阶段产生精子,这可能是犏牛生精停滞的一个重要原因(图 5)。

|
图 5 FGFs表达异常对犏牛生精停滞的影响 Fig. 5 Effect of abnormal expression of FGFs on spermatogenesis and stagnation of cattleyak |
| [1] |
张孝纯, 孙竹珑, 黄苾, 等. 从生殖器官及脑下垂体的组织结构探讨牦牛杂交一代雄性不育性[J]. 西南民族学院学报: 畜牧兽医版, 1983(3): 1-5. ZHANG X C, SUN Z L, HUANG B, et al. Discussion on the male sterility of the first hybrid generation in yak from the structure of reproductive organs and pituitary gland[J]. Journal of Southwest Minzu University: Natural Science Edition, 1983(3): 1-5. (in Chinese) |
| [2] |
ZHANG Q B, LI J H, LI Q F, et al. Cloning and characterization of the gene encoding the bovine BOULE protein[J]. Mol Genet Genomics, 2009, 281(1): 67-75. DOI:10.1007/s00438-008-0394-6 |
| [3] |
陈雪梅, 易川平, 罗辉, 等. 牦牛与犏牛睾丸支持细胞分离培养及生物学特性比较分析[J]. 畜牧兽医学报, 2021, 52(6): 1603-1615. CHEN X M, YI C P, LUO H, et al. Isolation, culture and comparison of biological characteristics of sertoli cells from yak and cattle-yak[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(6): 1603-1615. (in Chinese) |
| [4] |
董丽艳, 李齐发, 屈旭光, 等. 黄牛、牦牛和犏牛睾丸组织中Cdc2、Cdc25A基因mRNA表达水平[J]. 遗传, 2009, 31(5): 495-499. DONG L Y, LI Q F, QU X G, et al. Expression levels of Cdc2 and Cdc25A mRNA in cattle, yak, and cattle-yak testis[J]. Hereditas (Beijing), 2009, 31(5): 495-499. (in Chinese) |
| [5] |
李贤, 李齐发, 赵兴波, 等. 牦牛和犏牛Dmc1基因序列分析及睾丸组织转录水平研究[J]. 中国农业科学, 2010, 43(15): 3221-3229. LI X, LI Q F, ZHAO X B, et al. Sequence analysis and study on the expression level of Dmc1 mRNA in yak and cattle-yak testis[J]. Scientia Agricultura Sinica, 2010, 43(15): 3221-3229. (in Chinese) |
| [6] |
LI B J, WU W J, LUO H, et al. Molecular characterization and epigenetic regulation of Mei1 in cattle and cattle-yak[J]. Gene, 2015, 573(1): 50-56. DOI:10.1016/j.gene.2015.07.021 |
| [7] |
骆骅, 贾超, 屈旭光, 等. 黄牛、牦牛和犏牛b-Sycp2基因的克隆与睾丸组织mRNA的表达水平[J]. 中国农业科学, 2013, 46(2): 367-375. LUO H, JIA C, QU X G, et al. Cloning and testicular expression level of b-Sycp2 in cattle, yak and cattle-yak[J]. Scientia Agricultura Sinica, 2013, 46(2): 367-375. (in Chinese) |
| [8] |
ISHII K, KANATSU-SHINOHARA M, TOYOKUNI S, et al. FGF2 mediates mouse spermatogonial stem cell self-renewal via upregulation of Etv5 and Bcl6b through MAP2K1 activation[J]. Development, 2012, 139(10): 1734-1743. DOI:10.1242/dev.076539 |
| [9] |
CHOI J W, KIM S, KIM T M, et al. Basic fibroblast growth factor activates MEK/ERK cell signaling pathway and stimulates the proliferation of chicken primordial germ cells[J]. PLoS One, 2010, 5(9): e12968. DOI:10.1371/journal.pone.0012968 |
| [10] |
HASEGAWA K, SAGA Y. FGF8-FGFR1 signaling acts as a niche factor for maintaining undifferentiated spermatogonia in the mouse[J]. Biol Reprod, 2014, 91(6): 145. |
| [11] |
KITADATE Y, JÖRG D J, TOKUE M, et al. Competition for mitogens regulates spermatogenic stem cell homeostasis in an open niche[J]. Cell Stem Cell, 2019, 24(1): 79-92. DOI:10.1016/j.stem.2018.11.013 |
| [12] |
YANG F, WHELAN E C, GUAN X B, et al. FGF9 promotes mouse spermatogonial stem cell proliferation mediated by p38 MAPK signalling[J]. Cell Prolif, 2021, 54(1): e12933. DOI:10.1111/cpr.12933 |
| [13] |
HIRAI K, SASAKI H, YAMAMOTO H, et al. HST-1/FGF-4 protects male germ cells from apoptosis under heat-stress condition[J]. Exp Cell Res, 2004, 294(1): 77-85. DOI:10.1016/j.yexcr.2003.11.012 |
| [14] |
JIANG X, CHEN J, ZHANG C, et al. The protective effect of FGF21 on diabetes-induced male germ cell apoptosis is associated with up-regulated testicular AKT and AMPK/Sirt1/PGC-1α signaling[J]. Endocrinology, 2015, 156(3): 1156-1170. DOI:10.1210/en.2014-1619 |
| [15] |
WU S X, MIPAM T, XU C F, et al. Testis transcriptome profiling identified genes involved in spermatogenic arrest of cattleyak[J]. PLoS One, 2020, 15(2): e0229503. DOI:10.1371/journal.pone.0229503 |
| [16] |
ORNITZ D M, ITOH N. The Fibroblast Growth Factor signaling pathway[J]. Wiley Interdiscip Rev Dev Biol, 2015, 4(3): 215-266. DOI:10.1002/wdev.176 |
| [17] |
TOKUE M, IKAMI K, MIZUNO S, et al. SHISA6 confers resistance to differentiation-promoting Wnt/β-catenin signaling in mouse spermatogenic stem cells[J]. Stem Cell Rep, 2017, 8(3): 561-575. DOI:10.1016/j.stemcr.2017.01.006 |
| [18] |
HELSEL A R, YANG Q E, OATLEY M J, et al. ID4 levels dictate the stem cell state in mouse spermatogonia[J]. Development, 2017, 144(4): 624-634. |
| [19] |
CACALANO G, FARIÑAS I, WANG L C, et al. GFRα1 is an essential receptor component for GDNF in the developing nervous system and kidney[J]. Neuron, 1998, 21(1): 53-62. DOI:10.1016/S0896-6273(00)80514-0 |
| [20] |
VAN WEERING D H, BOS J L. Signal transduction by the receptor tyrosine kinase Ret[J]. Recent Results Cancer Res, 1998, 154: 271-281. |
| [21] |
HE Z P, JIANG J J, KOKKINAKI M, et al. Gdnf upregulates c-Fos transcription via the Ras/Erk1/2 pathway to promote mouse spermatogonial stem cell proliferation[J]. Stem Cells, 2008, 26(1): 266-278. DOI:10.1634/stemcells.2007-0436 |
| [22] |
WU X, GOODYEAR S M, TOBIAS J W, et al. Spermatogonial stem cell self-renewal requires ETV5-mediated downstream activation of Brachyury in mice[J]. Biol Reprod, 2011, 85(6): 1114-1123. DOI:10.1095/biolreprod.111.091793 |
| [23] |
TYAGI G, CARNES K, MORROW C, et al. Loss of Etv5 decreases proliferation and RET levels in neonatal mouse testicular germ cells and causes an abnormal first wave of spermatogenesis[J]. Biol Reprod, 2009, 81(2): 258-266. DOI:10.1095/biolreprod.108.075200 |
| [24] |
GASHAW I, GRVMMER R, KLEIN-HITPASS L, et al. Gene signatures of testicular seminoma with emphasis on expression of ets variant gene 4[J]. Cell Mol Life Sci, 2005, 62(19-20): 2359-2368. DOI:10.1007/s00018-005-5250-9 |
| [25] |
LOVASCO L A, GUSTAFSON E A, SEYMOUR K A, et al. TAF4b is required for mouse spermatogonial stem cell development[J]. Stem Cells, 2015, 33(4): 1267-1276. DOI:10.1002/stem.1914 |
| [26] |
DAI P, WANG X, LIU M F. A dual role of the PIWI/piRNA machinery in regulating mRNAs during mouse spermiogenesis[J]. Sci China Life Sci, 2020, 63(3): 447-449. DOI:10.1007/s11427-020-1632-5 |
| [27] |
MCANINCH D, MÄKELÄ J A, LA H M, et al. SOX3 promotes generation of committed spermatogonia in postnatal mouse testes[J]. Sci Rep, 2020, 10(1): 6751. DOI:10.1038/s41598-020-63290-3 |
| [28] |
SONG H W, WILKINSON M F. Transcriptional control of spermatogonial maintenance and differentiation[J]. Semin Cell Dev Biol, 2014, 30: 14-26. |
(编辑 孟培)



