2. 中南大学湘雅二医院胸心外科, 长沙 410011;
3. 云南 农业大学动物医学院 云南省小型猪基因编辑与异种器官移植重点实验室, 昆明 650201
2. Department of Cardiothoracic Surgery, The Second Xiang-ya Hospital, Central South University, Changsha 410011, China;
3. Yunnan Province Key Laboratory for Porcine Gene Editing and Xenotransplantation, College of Veterinary Medicine, Yunnan Agricultural University, Kunming 650201, China
模式动物是指科学家用特定的动物物种,揭示某种具有普遍规律的生命现象或药物作用的一类动物[1]。在人类疾病研究中,使用合适的动物模型是至关重要的。啮齿动物,如小鼠、大鼠等都是常用的模式动物。但由于遗传及解剖学差异,这些模式动物并不能完全反映人类病理生理特征,寻找新的更合适的模型是重要的研究思路之一。大量研究表明,小型猪在生理学、解剖学、营养代谢、药物代谢和疾病发展等方面相较于啮齿类动物与人类更相似[2-3]。且小型猪与人类共同拥有大量与肥胖、糖尿病、阅读障碍症、帕金森病和阿尔茨海默病等疾病相关的遗传变异[4]。由此可见,小型猪作为医用模式动物应用于人类疾病研究中有着巨大的潜在价值。但是医用小型猪的系统性综述还较少。因此,本文将系统综述小型猪的生物学特性、品种资源及选育方法,分析目前国内外小型猪的研究现状及主要应用进展,以期相关领域的同行系统了解医用模式动物及选育方法进展,明晰中国小型猪的种质资源保护及开发为医用模式动物的重要性,推动小型猪研究在医用模式动物领域的蓬勃发展。
1 小型猪生物学特性小型猪(miniature pig)属于哺乳纲、偶蹄目、野猪科、猪属、猪种动物,染色体数目2n=38。小型猪品种众多,由于遗传背景、地缘环境等因素的不同造成了生长和繁殖性能的差异。小型猪抗逆性强,对不良的生态和饲料条件有很强的适应能力,对饲料要求简单,饲养较粗放,自然环境下平均寿命超过10年,在15年左右[5]。小型猪和微型猪按照体重进行区分,一般12月龄体重为45~65 kg的猪为小型猪,12月龄体重在25~35 kg的猪称为微型猪。
1.1 解剖学差异比较小型猪与人类在心血管系统、消化系统、呼吸系统、代谢系统、泌尿系统有很大的相似之处。图 1展示了小型猪与人类的内脏结构对比,在心血管系统中,小型猪心脏的形状、解剖结构,大动脉的结构和位置关系,血流动力学特征及调节方式都与人类极为相似;此外,小型猪的冠状动脉也由单独发出的左冠脉系统及右冠脉系统构成,且大多数为右冠优势型,冠脉的走形、分布及营养心肌的范围与人类基本一致[6-7]。在消化系统上,有研究表明4月龄的五指山小型猪胃的形态以及十二指肠长度与人基本相似[7],其肝的大小虽有差异,但是肝的横径、纵径和厚度与人类基本一致[7]。在泌尿系统中,小型猪肾的大小与人类近似一致。广西巴马小型猪的输尿管略呈纡曲状,起始部位较粗,而后逐渐变细,连接膀胱处最细;人类的输尿管有3个狭窄处,与广西巴马小型猪略有差异[6]。在皮肤类疾病的研究中,小型猪与非人灵长类实验动物具有等同作用,郑必祥等[8]通过对比巴马小型猪与人的背部全层皮肤,发现二者的真皮厚度、表皮厚度近乎一致。此外,小型猪脖子和腿的活动范围有限,不能舔或挠它们自身的背,这相较于啮齿类、非人灵长类等模式动物具有明显优势。
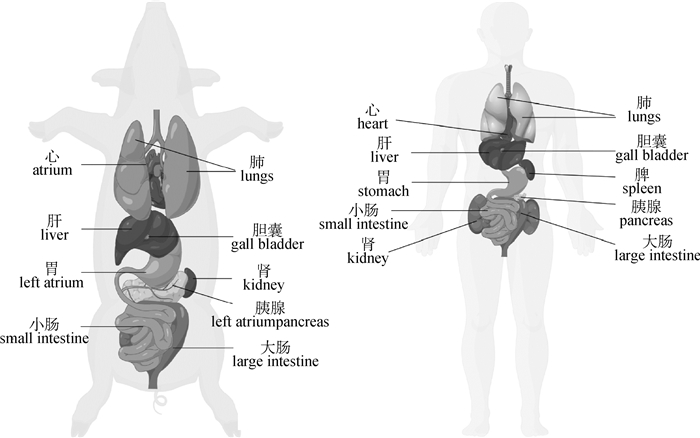
|
图 1 猪与人的解剖平面图 Fig. 1 Comparison for anatomical plane of pig and human |
小型猪相较于啮齿类实验动物和非人灵长类实验动物,虽然不如啮齿类实验动物体型小、生长快、便于实验操作,但也存在一些作为模式动物不可替代的优势。与啮齿类动物相比,小型猪和人的亲缘关系更近。在器官大小和生理构造上,小型猪可以补充许多啮齿类动物不适合开展的动物模型实验。例如,大鼠因没有胆囊而无法开展的部分消化试验;大鼠因食管与胃小弯的褶皱能阻止胃内容物反流而不能进行的呕吐试验[9]。小鼠因皮肤无汗腺,依赖尾巴的四根血管调节温度。豚鼠的心脏前端有出入心脏的大血管,与人类的心脏结构差异较大。再者,啮齿类动物生命周期较短,无法充分模拟一些病程长的疾病,而小型猪则更适合。世界各国食品和药物管理局规定,新药临床试验之前,必须在至少一种非啮齿类大动物(通常为猴、犬、猪)上进行安全性及毒性评估[10]。与非人灵长类动物相比,虽然非人灵长类动物是进化史上与人类亲缘关系最近的类群,在认知能力、繁殖和生育等方面与人类具有高度同源性。但是非人灵长类动物资源相对匮乏,造成实验费用高,加上对其进行遗传修饰的技术只有少数实验室掌握,还需要考虑诸多伦理问题,相比之下小型猪遗传资源和数量更丰富,更易于广泛应用。
1.2 生理学特点及血液生理生化指标分析小型猪为全年多发情动物,母猪性周期为(21±2.5)d,发情持续时间平均2.4 d,妊娠期114 d左右,产仔数2~10头,这相较于非人灵长类动物可以获得更多群体数量。小型猪正常体温为38~40 ℃,心率55~60次·分-1,血容量占体重的3.5%~5.6%,心排血量3.1 L·min-1,收缩压144~185 mmHg,舒张压98~120 mmHg,呼吸频率12~18次·分-1,通气率37 L·min-1,耗气量220 mm·g-1活体重,血液pH为7.36~7.79,尿比重1.102~1.022,尿pH为6.5~7.8[9]。
血液生理生化指标用以反映机体的内环境稳态、免疫能力、区分不同动物的生物学特性[11]。为探究小型猪和人体内生理学差异,本文通过“中国知网”、“谷歌学术”、“PubMed”数据库进行数据检索、筛选剔除及整合,分别选择五指山小型猪、巴马小型猪、版纳微型猪、哥廷根小型猪(Göttingen)4个品种(公布数据有限,选择年龄均为3~6月龄不等),对比血液中的蛋白质、糖类、无机离子、酶类、脂类、非蛋白含氮类化合物等共23种血液生理生化指标进行初步比较(表 1)。不同品种的小型猪血液生理生化指标存在差异,这可能与小型猪的品种、年龄、性别、饲养环境等因素有关。这也提示,有必要进一步细化区分不同品种、不同年龄段、不同性别、不同饲养环境下的小型猪血液生理生化数据。同时,对比分析发现,不同品种的小型猪均有与人体近似的指标,这也是小型猪作为人类疾病模型动物的理论基础。有趣的是,五指山小型猪、巴马小型猪、版纳微型猪的白细胞总数比人体正常范围高很多,而哥廷根小型猪的数值则接近,这可能与测定猪群的微生物净化等级、采样过程对猪的应激程度有关系,通常猪群发生疾病、应激等情况下均会造成白细胞数量的增加。4种小型猪的红细胞总数、血小板总数均远高于人,这可能是因为种属差异,而较高的血小板总数也有利于通过猪种构建血栓疾病模型。肌酸激酶与细胞内能量运转、肌肉收缩、ATP再生有直接关系,4种小型猪血液中肌酸激酶与人体存在显著差异,可能是因为种属间能量代谢不同而产生。
|
|
表 1 不同品种小型猪血液生理生化指标与人体对比 Table 1 Comparison of physiological and biochemical blood indexes of different breeds of miniature pigs with human body |
国外开展小型猪应用研究的国家主要有美国、日本、德国和法国等。美国小型猪品系较为丰富,主要有明尼苏达-霍麦尔品系(Minnesota Hormel)、皮特-曼摩尔品系(Pitman Moore)、海福特品系(Hanford)、尤卡坦品系(Yucatan)、奥萨博品系(Ossabaw)、辛克莱品系(Sinclair)等;日本小型猪品系主要有阿咪尼品系(Oh mini)、克劳恩咪尼品系(Clawn mini)以及会津品系(Huei Jin);德国小型猪有哥廷根品系(Göttingen);法国小型猪有科西嘉品系(Corsica)。表 2总结了上述10种国外小型猪品系的产地、主要特征及应用。不难发现,国外小型猪的培育、开发及研究较早,已形成了多个广泛应用于特定疾病研究领域的模式猪。例如尤卡坦品系(Yucatan),具有皮肤灰暗、被毛稀少或无、性情温和、容易肥胖等特点,是开展皮肤实验[18]、构建肥胖和糖尿病模型[19-21]的理想动物模型。哥廷根品系(Göttingen)具有体型小的特点,在器官移植[22]、皮肤疾病[23]等方面应用较多,在国际上声名显赫。明尼苏达-霍麦尔品系(Minnesota Hormel)是最早的小型猪培育品系,应用领域包括皮肤病[24]、肿瘤[24]、牙科[25]等。海福特品系(Hanford)的体型相比其他品系偏大,皮肤为白色,主要应用于皮肤疾病[26]领域。科西嘉品系(Corsica)主要应用于放射性研究[27]。日本的阿咪尼品系(Oh mini)、克劳恩咪尼品系(Clawn mini)以及会津品系(Huei Jin)的生物学特性、应用方面均较为相似,主要包括药物代谢、皮肤疾病、心血管疾病等[28]方面,克劳恩咪尼品系(Clawn mini)的应用相比其他两个品系更加广泛,推测这可能跟遗传背景、饲养数量有关。
|
|
表 2 国外小型猪品种情况 Table 2 Foreign breeds of miniature pigs |
目前国内的小型猪品种主要有五指山猪、贵州的香猪(包括从江香猪、剑白香猪、环江香猪)、广西巴马香猪、迪庆藏猪、蕨麻猪等地方品种,以及五指山小型猪近交系、巴马小型猪、中国实验用小型猪、版纳微型猪近交系(来源于滇南小耳猪)、合作小型猪等培育的小型猪新品系。表 3总结了我国主要的8种小型猪的产地、主要特征及应用。通过与国外小型猪对比发现,我国成年小型猪具有体型小、性成熟早、遗传性状稳定等优点,应用范围主要在动脉粥样硬化、心肌梗死、异种移植、药理学、毒代动力学、皮肤疾病等方面。其中,版纳微型猪近交系在2005年便通过国家鉴定委员会鉴定,报道称该版纳微型猪是世界上第一个大型哺乳动物近交系,其系谱完整,数据可靠,遗传背景清晰,基因高度纯合,个体之间近乎零差异,是异种器官移植的优质材料[29-30],巴马小型猪在构建糖尿病、肥胖等方面表现出较短的高糖高脂诱导时间[31]。
|
|
表 3 国内小型猪品种情况 Table 3 Domestic breeds of miniature pigs |
选育遗传背景清楚、个体差异小、微生物得到严格控制的品种是小型猪实验动物化的重要历程。表 4总结了10种外国小型猪的遗传背景,结合表 2不难发现,国外的地方品种缺乏体型小的特征,培育的小型猪品系多为体型大的地方品种与中国或越南的小型猪品种杂交而来。这种多品种杂交的繁育方式,使其遗传背景非常复杂,遗传及表型不稳定。相比较下,我国地方小型猪品种长期在封闭环境中进行繁育,形成了体型小、性成熟早、遗传性状稳定等优良特性。
|
|
表 4 国外小型猪遗传背景 Table 4 Genetic background of foreign miniature pigs |
实验动物通常要求遗传背景清楚、个体差异小,而培育近交系和封闭群是保证遗传质量的重要手段。近交系的培育通常要求连续20代及以上的全同胞或亲子近交,品系内所有个体都可追溯到起源于第20代或以后代数的一对共同祖先。近交系的近交系数应大于98.6%。近交系个体具有同源性(可追溯一对共同祖先),个体之间表型一致,是理想的实验材料。
以冯书堂团队(中国农业科学院)培育的五指山小型猪近交系为例,该近交系以五指山小型猪为祖系,参照近交系小鼠的培育方法,F23代近交系数达到99.3%,并建立完整系谱。该近交系培育技术路线包括近交繁育(仔母交配和全同胞交配)、近交验证、发掘特异等位基因、矮小型分子机理等[32-33]。该近交系通过了蛋白质检测、SNP位点分析、微卫星标记、特异性等位基因、皮肤移植等鉴定手段的验证[33]。王爱德团队(广西大学)培育的广西巴马小型猪以巴马香猪作为零世代和原始础群,育成有封闭群(A系)和近交系(B系),其中A系采用群内随机交配的方式(少量半同胞等近交方式)选育而成,B系在封闭群F10的基础上采用全同胞繁育(少量亲子交配)的方式选育而成[34]。中国农业科学院兰州兽医研究所培育合作小型猪以合作猪为系祖,采用近亲交配和异地实验动物化培育,培育的近交系合作小型猪是国际上首个高原型近交系小型猪[35]。合作小型猪封闭群的建立按照《实验用合作小型猪遗传质量控制》(DB62/T 4074—2019)封闭群的遗传标准和要求,达到种群60头,截至2021年,累计向社会生产提供800多头[35]。
此外,中国农业大学培育的中国实验用小型猪、曾养志团队(云南农业大学)培育的版纳微型猪近交系,以及甘世祥团队(贵阳中医学院)培育的贵州香猪(自然选育)等新培育品系,同样应用潜能巨大。
3.2 小型猪的微生物净化小型猪的生物净化技术主要包括剖腹产、仔猪寄养、隔离、体外受精-胚胎移植等[9]。采用的净化技术路线是检测排除垂直传播病原—筛选妊娠母猪—剖腹产或子宫切除—胎儿隔离器饲养—SPF级过渡饲养—清洁级饲养[36]。传统生物净化技术存在垂直传播病原难净化、人工哺乳技术差异大、代乳母猪拒哺乳等问题。体外受精-胚胎移植技术具备病原体净化、拒哺乳风险低、人为控制时间等优点,主要包括激素超排、体外受精、胚胎移植等流程。由于猪的子宫颈深,有很多褶皱,胚胎移植一般采用手术法。但是开创性手术会给受体母猪造成不同程度的创伤,往往后代成活率较低。因此,小型猪体外受精-胚胎移植技术仍然需要不断优化,比如改进手术过程中的无菌操作流程以及输入胚胎的方法等。在实际生产中,还要参照GB 14925—2010《实验动物环境及设施》和各地方微生物控制标准的规定,把生物安全防控制度化、常态化,保持病原体不侵入环境中。
小型猪的实验动物化,在控制遗传质量的同时,更重要的是进行微生物净化。例如哥廷根小型猪经过30余年的微生物净化,其高洁净度为实验工作的开展奠定了重要基础,这是我国小型猪所缺乏的。
3.3 基因工程选育自1985年Hammer等[37]成功培育世界上首例转基因猪开始,基因修饰技术在猪育种中被广泛应用,但是不同的基因修饰技术有着不同的优缺点。显微注射法存在外源基因插入位点随机性(位置效应),基因表达不稳定,但是因其外源基因的转移率和整合效率高等优点,通常作为转基因技术的常规操作[38]。而核移植转基因的方法是在细胞水平的改造,可以避免位置效应,但是存在效率低,需要大量的卵母细胞和受体动物等问题[39]。使用锌指核酸酶(zinc-finger nucleases, ZFN)、转录激活因子样效应因子核酸酶(transcription activator-like effector nucleases, TALEN)和规律成簇的间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)等基因编辑工具可以对基因组定点修饰,但是ZFN存在制备工艺复杂、毒性大、脱靶严重、成本高等问题[40-41]。TALEN识别域序列至少2 kb,设计构建难度大[38-39]。CRISPR/Cas9技术具有成本低、适用编辑范围广、打靶效率高、操作简单、可支持多位点操作等诸多优点[42-44],近年来CRISPR/Cas9技术在分子生物学领域得到广泛应用。Whitworth等[45]利用CRISPR/Cas9技术培育的CD163基因编辑猪在攻毒实验中可完全抵抗PRRSV感染,在疾病净化中具有重要的价值。Shi等[46]应用CRISPR/Cas9技术获得的BMP15基因编辑大白猪,表现出高产潜能。
由于第一代转基因猪呈杂合子状态,整合位点位置和数量、基因拷贝数大多不同,外源基因在不同个体中会产生不同的表达水平。每只原代F0阳性猪的基因型可能都不一样,在不同F0之间自交会产生多位点整合,目的外源基因出现不同表达方式。因此,原代F0阳性猪只有通过选种选配,和野生型猪(背景品系的猪)交配,获得整合位点相同的F1代。根据孟德尔定律,F1代中大约一半是杂合子,一半是野生型,F1代全同胞交配可以产生纯合子基因猪和杂合子基因猪,只有纯合子基因猪才不发生配子分离而能在后代中稳定遗传下去。
|
|
表 5 国内小型猪遗传背景 Table 5 Genetic background of domestic miniature pigs |
以“Miniature pig;Minipig;Animal models”为关键词,根据PubMed 2000年至2021年发表文章数量进行统计分析,小型猪作为医用模型动物的热度逐年上升。如图 2所示,小型猪作为模型应用主要集中在心血管、内分泌系统、消化代谢系统、肿瘤、异种器官移植、口腔;其中心血管系统应用最多,并呈现上升趋势。这可能是因为小型猪的心脏解剖结构和生理生化指标均与人类相似[47],利用小型猪作为模型研究人类心血管系统疾病结果更有效可靠。张燕华等[48]在构建植入式遥测动物模型时发现,与比格犬和食蟹猴相比,巴马小型猪更适合用于药物对心血管系统影响的评价。因此,下文主要对小型猪在心血管系统方面的研究及应用现状进行概述。
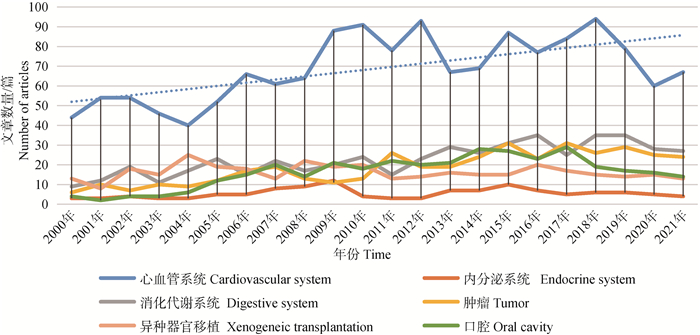
|
图 2 小型猪作为模型的研究领域及热度分析 Fig. 2 Research field and heat analysis of miniature pigs as models |
早期识别心肌缺血和建立再灌注是治疗心肌梗死的基石,通过建立缺血区域的再灌注可以显著降低死亡率和发病率[49]。心肌梗死模型的构建主要分为:急性心肌缺血模型与慢性心肌缺血模型。
4.1.1 急性心肌缺血模型 Goetzman等[49]使用尤卡坦小型猪建立急性心肌梗死模型,根据血清代谢组学,发现血清代谢物在缺血期间、再灌流早晚期表现出不同的特征,有助于识别不同的缺血和再灌注阶段,对于早期识别缺血和血运重建具有重大意义。马国钤[50]使用9头滇南小耳猪建立急性心肌梗死及缺血再灌注模型,检测心肌肌钙蛋白Ⅰ(cardiac troponin I, cTn-I)和心肌肌球蛋白结合蛋白C(cardiac myosin binding protei n-C, cMyBP-C)的浓度,发现cMyBP-C在急性心肌梗死后1 h开始升高。与cTn-I相比,cMyBP-C呈更早升高,可作为早期诊断急性心肌梗死的心肌标志物;同时,再灌注后cMyBP-C峰值提前出现,提示再灌注可加速其降解释放速度,可对缺血再灌注损伤、血管再通提供一定的指导作用。
传统急性心肌梗死动物模型主要采用开胸结扎冠状动脉的方法,但是该方法对实验动物的手术创伤大、病死率高。因此,更多的研究者采用了微创介入和电诱导等方法来构建小型猪急性心肌梗死模型。例如,田毅等[51]使用巴马小型猪,通过经皮冠状动脉球囊联合凝胶海绵联合栓塞的方法,建立了持久稳定的急性心肌梗死小型猪模型。Liu等[52]在研究重组葡糖激酶(r-Sak)对中国实验微型猪的冠状动脉血栓形成、心肌缺血和心肌梗死的实验中,通过电刺激损伤小型猪的动脉内膜,促进冠状动脉血栓形成,构建了急性心肌梗死模型,证明了r-Sak可溶解血栓。
4.1.2 慢性心肌缺血模型 慢性心肌缺血模型的构建方法主要包括:冠状动脉外慢性缩窄法、冠状动脉内膜增殖法、微循环栓塞法(机械栓塞法与化学损伤法)、高脂饮食法、次全结扎法等[53]。Miyagawa等[54]在Göttingen小型猪的冠状动脉左前降支外放置一条凝胶缩窄器4周,来构建慢性心肌缺血模型,评价合成前列环素激动剂(ONO-1301SR)给药系统的效应。Lopez等[55]在研究心肌梗死病变心室壁重构的时间演变和病理生理学的过程中,使用微型球囊造成10只尤卡坦小型猪的左前降支闭塞,构建出慢性心肌梗死模型。傅向华等[56]采用4F导管超选前降支,注入塑料微球,在10只五指山小型猪中构建慢性心肌缺血模型,且成功率为66.7%,证明了该方法的稳定性及可重复性。Schuleri等[57]在评估哥廷根小型猪与约克郡猪作为心肌梗死后慢性心力衰竭的模型中,也是采用微型球囊造成左前降支闭塞,同样证明哥廷根小型猪构建的慢性心肌缺血模型具有可重复性。过多的脂肪摄入可以引起冠状动脉损伤,造成冠脉狭窄。刘建勋等[58]在制备慢性心肌缺血模型中使用中国实验小型猪,采用高脂饲料饲喂与冠脉内皮损伤的综合方式,加速构建出慢性心肌缺血模型。李欣志[59]在研究痰瘀互结证的冠心病模型病理机制中,也使用了高脂饲料饲喂与冠脉内皮损伤的综合方式,揭示出痰瘀互结证候的演变过程。
4.2 动脉粥样硬化、高血脂、糖尿病模型动脉粥样硬化(atherosclerosis,AS) 是诱发心脑血管疾病的主要病理原因之一[60]。颈动脉粥样硬化比冠状动脉粥样硬化、大脑动脉粥样硬化的发病时间早,三者存在共同的病理基础和诱因[61]。高血压、高血脂、糖尿病是颈动脉粥样硬化的主要诱因,彼此间关系密切[62-64]。二型糖尿病发病期间由于糖脂代谢紊乱、P3K/AKT通路活性降低、MAPK通路被激活、血液处于慢性低度炎症状态,造成血管内皮被损伤、局部血管收缩、平滑肌细胞增殖与迁移、促血栓形成等后果,因此二型糖尿病大多合并颈动脉粥样硬化[65-66]。高血脂可引起血浆脂蛋白异常, 导致动脉管壁病变。高血压可以增加颈动脉内-中膜厚度,导致动脉弹性下降,继而引发颈动脉粥样硬化。因此,动脉粥样硬化、高血脂、糖尿病、高血压模型的构建具有较多相同之处。
一般通过高脂饮食的手段来构建AS动物模型。例如,沈利叶等[67]在比较五指山小型猪和西藏小型猪的动脉粥样硬化发病特征时,发现通过高脂饲喂的五指山小型猪和西藏小型猪AS开始形成于16周,而斑块成熟要在24周,腹主动脉和冠状动脉为主要病变部位。郁晨[68]在研究冠心宁片对西藏小型猪AS的作用及相关机制时,采用同样的方法构建出AS动物模型,并发现该药发挥抗AS作用与“肝-肠”轴途径密切相关。而潘嘉祥等[69]采用高脂饲喂结合机械损伤(微型球囊扩张)的综合方式,在巴马小型猪上构建出AS模型,冠状动脉血管内超声结果显示:AS组的狭窄率远高于对照组,血脂指标也趋于上升水平,HE染色显示:AS组冠状动脉内膜损伤严重。这种综合方式能够更快速地构建AS模型。此外,敲除脂代谢相关基因,如低密度脂蛋白受体(LDLR),可以导致高脂血症,能够在正常饮食的状态下形成动脉粥样斑块[70]。前蛋白转化酶枯草溶菌素9(PCSK9)是脂代谢过程中重要的调节蛋白之一,人PCSK9 D374Y功能获得性基因突变是一种常染色体显性遗传疾病,患者突变的PCSK9蛋白与低密度脂蛋白受体结合能力增强,造成低密度脂蛋白清除能力下降,从而出现高胆固醇血症。2013年,Al-Mashhadi等[71]利用基因重组的方式,将人PCSK9 D374Y基因突变导入尤卡坦小型猪的基因组中,构建D374Y-PCSK9转基因猪,使尤卡坦猪表达人D374Y-PCSK9蛋白,诱导出严重的高胆固醇血症。当以高脂/高胆固醇饲料喂养时,转基因猪1年后能形成典型的冠脉粥样斑块。
小型猪构建糖尿病模型通常采用高糖、高脂饲料饲喂的方法。但通过高脂饮食诱发猪糖尿病需要很长时间,而且不会表现出明显的高血糖。例如,Li等[72]在使用巴马小型猪构建二型糖尿病时,采用高脂饲料饲喂的方法,用时23个月才构建成功。啮齿类动物构建糖尿病模型通常采用高脂饲料联合小剂量链脲佐菌素诱导。因此,Zhao等[73]采用喂食高脂饲料并注射低剂量链脲佐菌素(Streptozotocin,STZ)的方法,在24头巴马小型猪中成功构建出二型糖尿病模型,成功率达到80%,其中高脂饲料饲喂时间为9个月,注射STZ诱导3个月。Avery等[19]使用化学物质四氧嘧啶(Alloxan,ALX),经过4个月的诱导处理,胰岛素维持在255~600 mg·dL-1的血糖水平,成功构建了4头尤卡坦小型猪的糖尿病模型。通过对比发现,国内外不同的小型猪对高糖、高脂饲料致糖尿病反应的敏感度不同,应当根据不同品种,调整高糖、高脂饲料的配方,也期待未来小型猪高糖、高脂饲料配方更加精细化,做到一品种一方案。
高血脂的模型构建通常也是采用高脂饲料饲喂的方法,谢忠忱等[74]利用五指山小型猪构建出高血脂症模型,3~4个月就达到很高的血脂水平,这说明五指山小型猪对高脂饲料敏感。Atiq等[75]在研究血管性血友病因子(VWF)和因子VIII(FVIII)水平是否是内皮功能障碍和动脉粥样硬化的生物标志物时,使用18头哥廷根小型猪构建出高血脂诱导糖尿病模型,在STZ和高脂饲料处理15个月后,出现内皮功能障碍和动脉粥样硬化。
4.3 基因工程小型猪模型基因工程小型猪动物模型在心血管疾病、糖尿病和神经系统疾病等研究中被广泛应用。载脂蛋白E(ApoE)和低密度脂蛋白受体(LDLR)基因与脂蛋白代谢、动脉粥样硬化有密切关系。Huang等[76]使用CRISPR/Cas技术培育了6头ApoE和LDLR双等位基因敲除的巴马小型猪,显著升高了转基因猪血清低密度脂蛋白胆固醇(LDL-C)、总胆固醇和载脂蛋白B的水平。随后,Burke等[77]利用ApoE和LDLR双等位基因敲除猪为模型,评价了苯哌酸降低血浆胆固醇和低密度脂蛋白胆固醇水平及减轻动脉粥样硬化的能力。张雪等[78]使用五指山小型猪近交系,成功获得人PCSK9基因D374Y突变体的克隆猪,可加快动脉血管的发病进程,比传统饮食、药物诱导小型猪动脉粥样硬化更加方便。诸多研究表明,人类PPARγ基因与很多慢性疾病有关, 例如类风湿性关节炎、动脉粥样硬化、阿尔茨海默病、糖尿病等[79]。2020年,吴彩霞等[80]采用体细胞核移植的方法成功构建8头PPARγ基因过表达西藏小型猪,对人类心血管疾病、糖尿病功能基因组学研究有重要意义。GIP/GIPR轴功能受损已成为糖尿病的发病机制之一,程俊霖[81]采用体细胞核移植技术建立过表达的显性抑制的GIPR转基因猪,发现其表现出糖耐量受损和胰腺发育障碍。
4.4 药物毒理、药效评价随着世界各国食品和药物管理局规定,新药临床试验之前,必须要通过在至少一种非啮齿类大动物(通常为猴、犬、猪)上进行安全性及毒性评估,小型猪在药物安全性评价中应用越来越广泛。Dorandeu等[82]在研究有机磷中毒的毒代动力学和药代动力学中,采用猪为模型,发现模型中出现不同程度的麻醉和不同类型的休克,对于评估有机磷中毒患者的麻醉和合并损伤有重要参考价值。放射性皮炎是放射治疗癌症中不可避免的副作用,Zhao等[83]通过建立Ⅳ级放射性皮炎猪模型,证实了维生素B12具有明显的抗辐射、抗炎和抗纤维化作用。Karlsson等[84]在评估创伤性脑损伤(TBI)药物疗效的试验中,使用受控皮质冲击装置诱导猪脑损伤,环孢素连续静脉输液5 d,发现弥散张量成像和基于生物流体的生物标志物可以作为一项评估环孢素治疗TBI疗效的指标。在异生素测试中似乎没有理想的物种,使用犬和非人灵长类动物仍然是常态,而小型猪也是一种可靠的非啮齿动物测试模型[85]。
4.5 异种器官移植心血管疾病的死亡率高,但可用于心脏移植的同种供心数量非常有限,替代疗法是研究热点。随着基因编辑技术的快速发展,基因编辑猪被广泛应用在性状改良育种、人类疾病模型、药物开发、生产人源蛋白、器官移植供体等方面,有可能为终末期器官衰竭患者提供无限数量的移植供体。但是,异种器官移植会存在内源病毒跨种传播、免疫排斥等问题。为解决该问题,2017年,云南农业大学魏红江教授团队与美国eGenesis公司杨璐菡、哈佛医学院教授乔治·丘奇(George Church)、丹麦奥胡斯大学组建联合课题组,用新一代基因技术打靶方法根除了猪细胞里面所有的内源性病毒活性后,利用其成纤维细胞制造出猪胚胎,并植入母猪体内,最终在西南生物多样性实验室制备出世界首批内源性逆转录病毒被灭活的猪[29]。Ross和Coates[86]在2018年使用CRISPR-cas9技术获取的基因编辑猪,其中所有内源性逆转录病毒都被灭活。2022年1月7日,在美国马里兰州巴尔的摩,Muhammad Mohiuddin医生和Bartley Griffith医生领导的马里兰大学医学院(UMSOM)的异种心脏团队,将经过基因编辑的猪心脏移植到一名终末期心力衰竭患者体内,这是世界上首例成功的猪到人的异种心脏移植,这名患者接受了高剂量的免疫抑制剂治疗,存活了两个月(2022年3月8日死亡),是异种心脏移植中存活时间最长的患者[87-90]。由此可见,通过有效的基因编辑猪,有望降低异种移植的免疫排斥反应,也为通过异种器官移植解决重大疾病难题提供了良好的基础。
5 总结与展望猪作为一种大型模式动物,无论是从解剖学结构、器官大小和生理学及生化特点,还是从基因组等方面都与人类高度相似,可弥补啮齿类模式动物不具备的研究部分人类疾病的短板,且小型猪的繁殖能力更高,较非人灵长类模式动物更易满足对模式动物群体数量的需求。因此,相较于啮齿类动物和非人灵长类模式动物,猪在人类生物医学研究中具有更大的优势,医用模式小型猪的开发与利用具有巨大前景。然而,我国小型猪开发应用尚处于初始阶段,依然存在着种质资源保护力度小、近交衰退、育成品系少等问题。在近交系和封闭群中,长期近亲繁殖、地域隔离、封闭群数量过小等问题均会引起遗传漂变,虽然很多省市出台了遗传质量检测的地方标准,但是还有很多小型猪品种没有相应的标准,建立不同品种(品系)遗传质量监测的位点体系是亟待解决的问题。相较于国外经过几十年微生物净化选育的高清洁度小型猪,我国小型猪微生物净化程度普遍不高。在实际生产中,因为微生物净化跟场区生物安全防控、免疫计划、硬件设施、猪舍设计等方面都有关系,大部分养殖场不具备净化的条件,很少能达到国家和地方关于微生物净化的标准。而在基因工程培育中,后代成活率低和传代遗传不稳定依然是突出的问题。由此可见,小型猪实验动物化还有很长的路要走。
全球范围内,实验用小型猪呈现出数量需求快速增长、质量需求亟待提高的趋势,未来有必要充分发掘各小型猪品种的生物学特性和应用潜能。我国可以结合心血管、代谢等重大人类疾病研究需求,通过转基因、基因编辑、分子设计等现代精准分子育种技术手段,培育自发性疾病模型的小型猪、定向培育特有表型的小型猪,为全面了解人类相关疾病的遗传基础和发病机制提供更好的平台,也为新的诊疗药物与技术的面市做好临床前试验,进而助力人类疾病的研究。
| [1] |
田勇. 动物模型与生物医药研究[J]. 生物化学与生物物理进展, 2022, 49(5): 827-828. TIAN Y. Animal model and biomedical research[J]. Progress in Biochemistry and Biophysics, 2022, 49(5): 827-828. DOI:10.16476/j.pibb.2022.0212 (in Chinese) |
| [2] |
HELKE K L, MEYERHOLZ D K, BECK A P, et al. Research relevant background lesions and conditions: ferrets, dogs, swine, sheep, and goats[J]. ILAR J, 2021, 62(1-2): 133-168. DOI:10.1093/ilar/ilab005 |
| [3] |
DONANDT T, HINTZE S, KRAUSE S, et al. Isolation and characterization of primary DMD pig muscle cells as an in vitro model for preclinical research on duchenne muscular dystrophy[J]. Life (Basel), 2022, 12(10): 1668. |
| [4] |
GROENEN M A M, ARCHIBALD A L, UENISHI H, et al. Analyses of pig genomes provide insight into porcine demography and evolution[J]. Nature, 2012, 491(7424): 393-398. DOI:10.1038/nature11622 |
| [5] |
宋修春, 王磊, 李玉春. 小型猪种质资源引进培育及生物学特性研究进展[J]. 中国畜禽种业, 2021, 17(5): 89-90. SONG X C, WANG L, LI Y C. Research progress on introduction, cultivation and biological characteristics of miniature pig Germplasm resources[J]. The Chinese Livestock and Poultry Breeding, 2021, 17(5): 89-90. (in Chinese) |
| [6] |
江雨航, 申玉建, 张其伟, 等. 广西巴马小型猪全身CT影像学观察[J]. 南方农业学报, 2020, 51(3): 677-685. JIANG Y H, SHEN Y J, ZHANG Q W, et al. Observation of whole body CT tomography of Guangxi Bama mini-pigs[J]. Journal of Southern Agriculture, 2020, 51(3): 677-685. (in Chinese) |
| [7] |
靳二辉, 单同领, 张勇, 等. 近交系五指山小型猪消化器官的解剖学研究[J]. 中国畜牧兽医, 2007, 34(12): 66-69. JIN E H, SHAN T L, ZHANG Y, et al. The anatomic study on the digestive organs in the Wuzhishan Miniature Pig inbred-line[J]. China Animal Husbandry & Veterinary Medicine, 2007, 34(12): 66-69. (in Chinese) |
| [8] |
郑必祥, 彭代智, 左海斌, 等. 巴马小型猪与人真皮的组织形态学和生物力学基本特征比较研究[J]. 第三军医大学学报, 2010, 32(8): 754-758. ZHENG B X, PENG D Z, ZUO H B, et al. Comparative study on dermal histomorphologic and biomechanical properties between Bama miniature pig and human[J]. Acta Academiae Medicinae Militaris Tertiae, 2010, 32(8): 754-758. DOI:10.16016/j.1000-5404.2010.08.010 (in Chinese) |
| [9] |
李伊为, 张延英. 实验动物学[M]. 3版. 北京: 科学出版社, 2022: 44-261. LI Y W, ZHANG Y Y. Laboratory animal science[M]. 3rd ed. Beijing: Science Press, 2022: 44-261. (in Chinese) |
| [10] |
刘薇, 贾俊双, 唐华, 等. 慢病毒载体法制备遗传工程猴和小型猪的现状及应用前景展望[J]. 中国实验动物学报, 2012, 20(5): 84-89. LIU W, JIA J S, TANG H, et al. Genetically engineered monkeys and minipigs generated by lentivirus-mediated gene delivery: current status and application perspective[J]. Acta Laboratorium Animalis Scientia Sinica, 2012, 20(5): 84-89. DOI:10.3969/j.issn.1005-4847.2012.05.019 (in Chinese) |
| [11] |
SON Y B, BHARTI D, KIM S B, et al. Hematological patterns and histopathological assessment of Miniature Pigs in the experiments on human mesenchymal stem cell transplantation[J]. Int J Med Sci, 2021, 18(5): 1259-1268. DOI:10.7150/ijms.53036 |
| [12] |
靳洪涛, 凡春荣, 李慧, 等. 实验用五指山小型猪正常生理值测定[J]. 实验动物科学, 2007, 24(6): 69-73. JIN H T, FAN C R, LI H, et al. Determination of clinical normal physiological parameters in Chinese Wuzhishan Pig[J]. Laboratory Animal Science, 2007, 24(6): 69-73. (in Chinese) |
| [13] |
邓俊成, 苏小华, 吕明, 等. 正常巴马小型猪与高血糖家系F5代血液生理生化指标比较研究[J]. 中国比较医学杂志, 2018, 28(10): 36-41. DENG J C, SU X H, LYU M, et al. Comparison of blood physiological and biochemical indexes between normal Bama minipigs and an F5 generation with hyperglycemia[J]. Chinese Journal of Comparative Medicine, 2018, 28(10): 36-41. DOI:10.3969/j.issn.1671-7856.2018.10.006 (in Chinese) |
| [14] |
王爱德, 郭亚芬, 李柏, 等. 巴马小型猪血液生理指标[J]. 上海实验动物科学, 2001, 21(2): 75-78. WANG A D, GUO Y F, LI B, et al. Determination of some haemal physiological parameters in Bama Mini-Pig[J]. Shanghai Laboratory Animal Science, 2001, 21(2): 75-78. (in Chinese) |
| [15] |
杨李厂, 周文兵, 丁隽, 等. 四个品种小型猪血液学指标测定及比较[J]. 实验动物与比较医学, 2016, 36(6): 441-446. YANG L C, ZHOU W B, DING J, et al. Investigation on biological characteristics of blood for four breeds of minipigs[J]. Laboratory Animal and Comparative Medicine, 2016, 36(6): 441-446. (in Chinese) |
| [16] |
DUAN Y, YAN X X, WEI L H, et al. Acute and subacute toxicity studies of CMICE-013, a novel iodinated rotenone-based myocardial perfusion tracer, in Sprague Dawley rats and Gottingen minipigs[J]. Regul Toxicol Pharmacol, 2016, 80: 195-209. DOI:10.1016/j.yrtph.2016.05.011 |
| [17] |
夏薇, 陈婷梅, 王霄霞. 临床血液学检验技术[M]. 北京: 人民卫生出版社, 2015: 363. XIA W, CHEN T M, WANG X X. Clinical hematologic laboratory technology[M]. Beijing: People's Medical Publishing House, 2015: 363. (in Chinese) |
| [18] |
KUZMA B A, SENEMAR S, RAMEZANLI T, et al. Evaluation of local bioavailability of metronidazole from topical formulations using dermal microdialysis: Preliminary study in a Yucatan mini-pig model[J]. Eur J Pharm Sci, 2021, 159: 105741. DOI:10.1016/j.ejps.2021.105741 |
| [19] |
AVERY J T, QIAO J Z, MEDEIROS E, et al. Bi-layered living cellular construct resulted in greater healing in an alloxan-induced diabetic porcine model[J]. Int Wound J, 2023, 20(2): 403-412. DOI:10.1111/iwj.13889 |
| [20] |
AL-MASHHADI R H, AL-MASHHADI A L, NASR Z P, et al. Local pressure drives low-density lipoprotein accumulation and coronary atherosclerosis in Hypertensive Minipigs[J]. J Am Coll Cardiol, 2021, 77(5): 575-589. DOI:10.1016/j.jacc.2020.11.059 |
| [21] |
JOHNSON L L, JOHNSON J, OBER R, et al. Novel receptor for advanced glycation end products-blocking antibody to treat diabetic peripheral artery disease[J]. J Am Heart Assoc, 2021, 10(1): e016696. DOI:10.1161/JAHA.120.016696 |
| [22] |
HALECKER S, KRABBEN L, KRISTIANSEN Y, et al. Rare isolation of human-tropic recombinant porcine endogenous retroviruses PERV-A/C from Göttingen minipigs[J]. Virol J, 2022, 19(1): 30. DOI:10.1186/s12985-022-01742-0 |
| [23] |
FOUBERT P, DOYLE-EISELE M, GONZALEZ A, et al. Development of a combined radiation and full thickness burn injury minipig model to study the effects of uncultured adipose-derived regenerative cell therapy in wound healing[J]. Int J Radiat Biol, 2017, 93(3): 340-350. DOI:10.1080/09553002.2017.1242814 |
| [24] |
BERGEN W G. Pigs (Sus scrofa) in biomedical research[M]//WU G Y. Recent Advances in Animal Nutrition and Metabolism. Cham: Springer, 2022: 335-343.
|
| [25] |
WANG S, LIU Y, FANG D, et al. The miniature pig: a useful large animal model for dental and orofacial research[J]. Oral Dis, 2007, 13(6): 530-537. DOI:10.1111/j.1601-0825.2006.01337.x |
| [26] |
KAMEGAYA Y, FARINELLI W A, VILA ECHAGUE A, et al. Evaluation of photochemical tissue bonding for closure of skin incisions and excisions[J]. Lasers Surg Med, 2005, 37(4): 264-270. DOI:10.1002/lsm.20221 |
| [27] |
DABURON F, VILLIERS P A, FAGNIEZ P L, et al. Research on the therapeutics of intense abdominal irradiations in pigs[J]. Radiat Environ Biophys, 1979, 17(1): 67-83. DOI:10.1007/BF01323121 |
| [28] |
ISOBE A, TASAKI M, INOUE T, et al. Histopathological background data of the systemic organs of CLAWN miniature swine with coronary artery stent implantation[J]. J Toxicol Pathol, 2017, 30(1): 25-38. DOI:10.1293/tox.2016-0024 |
| [29] |
NIU D, WEI H J, LIN L, et al. Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9[J]. Science, 2017, 357(6357): 1303-1307. DOI:10.1126/science.aan4187 |
| [30] |
叶雷, 李红, 魏红江, 等. 成年版纳微型猪近交系克隆猪的制备[J]. 畜牧兽医学报, 2012, 43(9): 1491-1498. YE L, LI H, WEI H J, et al. Production of cloning adult Banna Miniature inbred pig[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(9): 1491-1498. (in Chinese) |
| [31] |
陈华, 刘亚千, 李春海, 等. 三个品系小型猪Ⅱ型糖尿病模型的比较研究[J]. 实验动物科学, 2007, 24(6): 49-55. CHEN H, LIU Y Q, LI C H, et al. Comparison of three strains of minipigs with induced type Ⅱ diabetes mellitus[J]. Laboratory Animal Science, 2007, 24(6): 49-55. DOI:10.3969/j.issn.1006-6179.2007.06.012 (in Chinese) |
| [32] |
李凯, 牟玉莲, 韩建林, 等. 五指山小型猪近交系微卫星等位基因遗传规律的研究[J]. 畜牧兽医学报, 2009, 40(3): 296-302. LI K, MU Y L, HAN J L, et al. Study on genetic variation of inbred families of Wuzhishan Miniature pig using microsatellite DNA loci[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(3): 296-302. DOI:10.3321/j.issn:0366-6964.2009.03.003 (in Chinese) |
| [33] |
冯书堂, 李奎, 刘岚, 等. 小型猪近交系新品种的培育与开发利用[J]. 农业生物技术学报, 2015, 23(2): 274-280. FENG S T, LI K, LIU L, et al. Cultivation and application of miniature pig (Sus scrofa) Inbred[J]. Journal of Agricultural Biotechnology, 2015, 23(2): 274-280. DOI:10.3969/j.issn.1674-7968.2015.02.016 (in Chinese) |
| [34] |
王爱德, 兰干球, 郭亚芬. 广西巴马小型猪的培育[J]. 实验动物科学, 2010, 27(1): 60-63. WANG A D, LAN G Q, GUO Y F. Genetic breeding of Guangxi Bama mini pig[J]. Laboratory Animal Science, 2010, 27(1): 60-63. (in Chinese) |
| [35] |
景志忠, 房永祥, 陈国华, 等. 高原型实验小型猪——合作小型猪的培育与应用[J]. 甘肃畜牧兽医, 2021, 51(11): 5-14. JING Z Z, FANG Y X, CHEN G H, et al. Breeding and application of plateau experimental miniature pig-cooperative miniature pig[J]. Gansu Animal Husbandry Veterinarian, 2021, 51(11): 5-14. DOI:10.15979/j.cnki.cn62-1064/s.2021.11.001 (in Chinese) |
| [36] |
赵继勋, 张国中. 中国小型猪实验动物化研究[C]//中国生物多样性保护基金会. 第四届生物多样性保护与利用高新科学技术国际研讨会论文集. 北京: 北京科学技术出版社, 2003: 178-184. ZHAO J X, ZHANG G Z. Study on experimental animalization of Chinese miniature pigs[C]//China Biodiversity Conservation Foundation. Proceedings of the 4th International Symposium on Biodiversity Conservation and Utilization. Beijing: Beijing Science and Technology Press, 2003: 178-184. (in Chinese) |
| [37] |
HAMMER R E, PURSEL V G, REXROAD C E JR, et al. Production of transgenic rabbits, sheep and pigs by microinjection[J]. Nature, 1985, 315(6021): 680-683. DOI:10.1038/315680a0 |
| [38] |
吴梦, 刘作华, 林保忠, 等. 转基因猪研究进展[J]. 中国生物工程杂志, 2015, 35(3): 92-98. WU M, LIU Z H, LIN B Z, et al. Recent progress in transgenic pigs[J]. China Biotechnology, 2015, 35(3): 92-98. (in Chinese) |
| [39] |
刘奂. Rosa26位点整合eGFP转基因猪的制备及eGFP在组织器官内的表达分析[D]. 长春: 吉林大学, 2021. LIU H. Generation of eGFP pigs at Rosa26 site and analysis eGFP expression in various tissues[D]. Changchun: Jilin University, 2021. (in Chinese) |
| [40] |
ZHANG H X, ZHANG Y, YIN H. Genome editing with mRNA encoding ZFN, TALEN, and Cas9[J]. Mol Ther, 2019, 27(4): 735-746. DOI:10.1016/j.ymthe.2019.01.014 |
| [41] |
TOWNSEND J A, WRIGHT D A, WINFREY R J, et al. High-frequency modification of plant genes using engineered zinc-finger nucleases[J]. Nature, 2009, 459(7245): 442-445. DOI:10.1038/nature07845 |
| [42] |
HSU P D, LANDER E S, ZHANG F. Development and applications of CRISPR-Cas9 for genome engineering[J]. Cell, 2014, 157(6): 1262-1278. DOI:10.1016/j.cell.2014.05.010 |
| [43] |
DOUDNA J A, CHARPENTIER E. The new frontier of genome engineering with CRISPR-Cas9[J]. Science, 2014, 346(6213): 1258096. DOI:10.1126/science.1258096 |
| [44] |
王欢, 邹惠影, 朱化彬, 等. CRISPR/Cas9基因编辑技术在家畜育种新材料创制中的研究进展[J]. 畜牧兽医学报, 2021, 52(4): 851-861. WANG H, ZOU H Y, ZHU H B, et al. Advances in evaluation of livestock breeding new materials by using the CRISPR/Cas9 gene editing technology[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(4): 851-861. (in Chinese) |
| [45] |
WHITWORTH K M, ROWLAND R R R, EWEN C L, et al. Gene-edited pigs are protected from porcine reproductive and respiratory syndrome virus[J]. Nat Biotechnol, 2016, 34(1): 20-22. DOI:10.1038/nbt.3434 |
| [46] |
SHI X, TANG T, LIN Q Y, et al. Efficient generation of bone morphogenetic protein 15-edited Yorkshire pigs using CRISPR/Cas9[J]. Biol Reprod, 2020, 103(5): 1054-1068. DOI:10.1093/biolre/ioaa138 |
| [47] |
陈雨荣, 安星兰, 汪正铸, 等. 猪作为人类疾病模型的研究进展[J]. 中国比较医学杂志, 2020, 30(7): 110-119. CHEN Y R, AN X L, WANG Z Z, et al. Research progress on pigs as human disease models[J]. Chinese Journal of Comparative Medicine, 2020, 30(7): 110-119. (in Chinese) |
| [48] |
张燕华, 刘天斌, 曲庆美, 等. 巴马小型猪植入式遥测动物模型的建立及应用[J]. 药物评价研究, 2022, 45(10): 2049-2053. ZHANG Y H, LIU T B, QU Q M, et al. Establishment and application on implantable telemetry animal model of Bama miniature pigs[J]. Drug Evaluation Research, 2022, 45(10): 2049-2053. (in Chinese) |
| [49] |
GOETZMAN E, GONG Z W, RAJASUNDARAM D, et al. Serum metabolomics reveals distinct profiles during ischemia and reperfusion in a porcine model of myocardial ischemia-reperfusion[J]. Int J Mol Sci, 2022, 23(12): 6711. |
| [50] |
马国钤. cMyBP-C在猪急性心肌梗死模型中的研究[D]. 昆明: 昆明医科大学, 2021. MA G Q. The study of cMyBP-C in porcine acute myocardial infarction model[D]. Kunming: Kunming Medical University, 2021. (in Chinese) |
| [51] |
田毅, 李巨波, 张宝杰, 等. 经皮冠状动脉球囊结合凝胶海绵联合栓塞法建立急性心肌梗死小型猪模型方法探讨[J]. 心肺血管病杂志, 2020, 39(9): 1122-1126, 1133. TIAN Y, LI J B, ZHANG B J, et al. Establishment of acute myocardial infarction model by percutaneous coronary balloon combined with gelfoam embolization in miniature pigs[J]. Journal of Cardiovascular and Pulmonary Diseases, 2020, 39(9): 1122-1126, 1133. (in Chinese) |
| [52] |
LIU J X, SHANG X H, FU J H, et al. Effects of recombinant staphylokinase on coronary thrombosis in Chinese experimental miniature swine[J]. Acta Pharmacol Sin, 2002, 23(6): 509-515. |
| [53] |
宋健, 赵磊, 刘挨师. 小型猪心肌缺血模型的构建及应用现状[J]. 中国组织工程研究, 2023, 27(5): 772-778. SONG J, ZHAO L, LIU A S. Construction and application of myocardial ischemia model in miniature pigs[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(5): 772-778. (in Chinese) |
| [54] |
MIYAGAWA S, MIZOGUCHI H, FUKUSHIMA S, et al. New regional drug delivery system by direct epicardial placement of slow-release prostacyclin agonist promise therapeutic angiogenesis in a porcine chronic myocardial infarction[J]. J Artif Organs, 2021, 24(4): 465-472. |
| [55] |
LOPEZ D, PAN J A, POLLAK P M, et al. Multiparametric CMR imaging of infarct remodeling in a percutaneous reperfused Yucatan mini-pig model[J]. NMR Biomed, 2017, 30(5): e3693. |
| [56] |
傅向华, 刘晓堃, 谷新顺, 等. 应用4F导管冠状动脉内注入塑料微球建立慢性心力衰竭小型猪模型[C]//中华医学会第11次心血管病学术会议论文摘要集. 大连: 中华医学会, 2009: 318-319. FU X H, LIU X K, GU X S, et al. Establishment of a miniature pig model of chronic heart failure by intracoronary injection of plastic microspheres with 4F catheter[C]//Abstracts of the 11th Chinese Medical Association Conference on Cardiovascular Diseases. Dalian: Chinese Medical Association, 2009: 318-319. (in Chinese) |
| [57] |
SCHULERI K H, BOYLE A J, CENTOLA M, et al. The adult Gottingen minipig as a model for chronic heart failure after myocardial infarction: focus on cardiovascular imaging and regenerative therapies[J]. Comp Med, 2008, 58(6): 568-579. |
| [58] |
刘建勋, 李欣志, 于震. 疾病模型动物拟临床研究概念的形成及其在药理学研究中的应用——长期高脂饲料喂养加冠脉内皮损伤制备小型猪慢性心肌缺血模型的研究[C]//中国药理学会第十次全国学术会议专刊. 天津: 中国药理学会, 2009: 123-126. LIU J X, LI X Z, YU Z. The formation of the concept of disease model animal quasi-clinical research and its application in pharmacological research—the preparation of chronic myocardial ischemia model in miniature pigs by long-term high-fat diet and coronary endothelial injury[C]//Special issue of the 10th National Academic Conference of Chinese Pharmacological Society. Tianjin: Chinese Pharmacological Society, 2009: 123-126. (in Chinese) |
| [59] |
李欣志. 痰瘀互结证冠心病模型的病理机制及方证相应基础研究[D]. 北京: 中国中医科学院, 2008. LI X Z. Explorations on the mechanisms of coronary heart diseases inmodels with the syndrome of phlegm and stagnated blood and the correlation between Fang and Zheng[D]. Beijing: China Academy of Chinese Medical Sciences, 2008. (in Chinese) |
| [60] |
MOHAMMAD M A, STONE G W, KOUL S, et al. On the Natural history of coronary artery disease: a longitudinal nationwide serial angiography study[J]. J Am Heart Assoc, 2022, 11(21): e026396. |
| [61] |
赵茜, 高宇, 杜思成, 等. 2型糖尿病患者颈动脉粥样硬化程度与血清ADAM10水平的相关性[J]. 中国临床研究, 2021, 34(3): 289-293. ZHAO X, GAO Y, DU S C, et al. Relationship between carotid atherosclerosis and serum ADAM10 level in patients with type 2 diabetes mellitus[J]. Chinese Journal of Clinical Research, 2021, 34(3): 289-293. (in Chinese) |
| [62] |
JELLINGER P S. American association of clinical Endocrinologists/American college of endocrinology management of dyslipidemia and prevention of cardiovascular disease clinical practice guidelines[J]. Diabetes Spectr, 2018, 31(3): 234-245. |
| [63] |
MAHMOOD S S, LEVY D, VASAN R S, et al. The Framingham Heart Study and the epidemiology of cardiovascular disease: a historical perspective[J]. Lancet, 2014, 383(9921): 999-1008. |
| [64] |
HIRSCH A T, HARTMAN L, TOWN R J, et al. National health care costs of peripheral arterial disease in the Medicare population[J]. Vasc Med, 2008, 13(3): 209-215. |
| [65] |
OLVER T D, GRUNEWALD Z I, GHIARONE T, et al. Persistent insulin signaling coupled with restricted PI3K activation causes insulin-induced vasoconstriction[J]. Am J Physiol Heart Circ Physiol, 2019, 317(5): H1166-H1172. |
| [66] |
林珍, 王琦, 周艳辉, 等. 不同性别2型糖尿病患者动脉粥样硬化指标的影响因素研究[J]. 中国全科医学, 2021, 24(9): 1066-1070. LIN Z, WANG Q, ZHOU Y H, et al. Sex-specific risk factors for indicators of atherosclerosis in patients with type 2 diabetes mellitus[J]. Chinese General Practice, 2021, 24(9): 1066-1070. (in Chinese) |
| [67] |
沈利叶, 潘永明, 徐雁云, 等. 高脂高糖饮食诱导五指山小型猪动脉粥样硬化模型肠道菌群的变化[J]. 中国实验动物学报, 2022, 30(3): 299-308. SHEN L Y, PAN Y M, XU Y Y, et al. Changes in intestinal flora in a Wuzhishan minipig atherosclerosis modelinduced by high-fat and high-sugar diet[J]. Acta Laboratorium Animalis Scientia Sinica, 2022, 30(3): 299-308. (in Chinese) |
| [68] |
郁晨. 基于"肝—肠"轴探讨冠心宁片抗西藏小型猪AS的作用及机制[D]. 杭州: 浙江中医药大学, 2020. YU C. Study on the mechanism of Guanxinning tablets on Tibet minipigs withatherosclerosis based on the "liver-gut" axis[D]. Hangzhou: Zhejiang Chinese Medical University, 2020. (in Chinese) |
| [69] |
潘嘉祥, 张哲, 尹妮, 等. 高脂喂饲联合机械损伤术建立巴马小型猪冠状动脉粥样硬化模型[J]. 中华中医药杂志, 2020, 35(3): 1207-1212. PAN J X, ZHANG Z, YIN N, et al. Establishment of coronary atherosclerosis model in Bama miniature pig byhigh-fat diet combined with mechanical injury[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(3): 1207-1212. (in Chinese) |
| [70] |
THIM T, HAGENSEN M K, DROUET L, et al. Familial hypercholesterolaemic downsized pig with human-like coronary atherosclerosis: a model for preclinical studies[J]. EuroIntervention, 2010, 6(2): 261-268. |
| [71] |
AL-MASHHADI R H, S∅RENSEN C B, KRAGH P M, et al. Familial hypercholesterolemia and atherosclerosis in cloned minipigs created by DNA transposition of a human PCSK9 gain-of-function mutant[J]. Sci Transl Med, 2013, 5(166): 166ra1. |
| [72] |
LI L, ZHAO Z Z, XIA J H, et al. A long-term high-fat/high-sucrose diet promotes kidney lipid deposition and causes apoptosis and glomerular hypertrophy in Bama Minipigs[J]. PLoS One, 2015, 10(11): e0142884. |
| [73] |
ZHAO Y Q, NIU M M, JIA Y X, et al. Establishment of type 2 diabetes mellitus models using streptozotocin after 3 months high-fat diet in Bama Minipigs[J]. Anim Biotechnol, 2022. DOI:10.1080/10495398.2022.2088548 |
| [74] |
谢忠忱, 黄广勇, 陈华, 等. 五指山小型猪高血脂症模型的建立[C]//中国实验动物学会第七届学术年会论文集. 桂林: 中国实验动物学会, 2006: 57. XIE Z C, HUANG G Y, CHEN H, et al. Establishment of hyperlipidemia model in Wuzhishan miniature pig[C]//Proceedings of the 7th Annual Academic Conference of Chinese Society of Laboratory Animals. Guilin: Chinese Association for Laboratory Animal Sciences, 2006: 57. (in Chinese) |
| [75] |
ATIQ F, VAN DE WOUW J, SOROP O, et al. Endothelial dysfunction, atherosclerosis, and increase of Von Willebrand factor and factor Ⅷ: a randomized controlled trial in swine[J]. Thromb Haemost, 2021, 121(5): 676-686. |
| [76] |
HUANG L, HUA Z D, XIAO H W, et al. CRISPR/Cas9-mediated ApoE-/- and LDLR-/- double gene knockout in pigs elevates serum LDL-C and TC levels[J]. Oncotarget, 2017, 8(23): 37751-37760. |
| [77] |
BURKE A C, TELFORD D E, SUTHERLAND B G, et al. Bempedoic acid lowers low-density lipoprotein cholesterol and attenuates atherosclerosis in low-density lipoprotein receptor-deficient (LDLR+/- and LDLR-/-) Yucatan Miniature Pigs[J]. Arterioscler Thromb Vasc Biol, 2018, 38(5): 1178-1190. |
| [78] |
张雪, 黄雷, 阮进学, 等. PCSK9基因D374Y突变体转基因猪的制备与分析[J]. 中国农业科学, 2017, 50(19): 3808-3816. ZHANG X, HUANG L, RUAN J X, et al. Production of transgenic pigs over-expressed PCSK9 D374Y Mutant[J]. Scientia Agricultura Sinica, 2017, 50(19): 3808-3816. (in Chinese) |
| [79] |
晏昆, 蒙凌, 陈玉芳. PPARγ基因多态性与动脉粥样硬化性脑梗死的相关性研究[J]. 中国现代药物应用, 2020, 14(9): 31-33. YAN K, MENG L, CHEN Y F. Correlation between PPAR γ genetic polymorphism and atherosclerotic cerebral infarction[J]. Chinese Journal of Modern Drug Application, 2020, 14(9): 31-33. (in Chinese) |
| [80] |
吴彩霞, 刘朝明, 颜泉梅, 等. 糖尿病和心血管病相关的重要靶点基因PPARγ过表达转基因克隆猪模型的建立[J]. 中国兽医学报, 2020, 40(7): 1366-1371. WU C X, LIU C M, YAN Q M, et al. Establishment of transgenic pig model of PPAR γ overexpression, an important target gene related to diabetes mellitus and cardiovascular disease[J]. Chinese Journal of Veterinary Science, 2020, 40(7): 1366-1371. (in Chinese) |
| [81] |
程俊霖. GIPR功能显性抑制的2型糖尿病转基因猪模型的建立[D]. 南京: 南京医科大学, 2014. CHENG J L. Establishment of type 2 diabetic transgenic pig model with dominant inhibition of GIPR function[D]. Nanjing: Nanjing Medical University, 2014. (in Chinese) |
| [82] |
DORANDEU F, MIKLER J R, THIERMANN H, et al. Swine models in the design of more effective medical countermeasures against organophosphorus poisoning[J]. Toxicology, 2007, 233(1-3): 128-144. |
| [83] |
ZHAO Y C, WANG H Y, LI Y F, et al. The action of topical application of Vitamin B12 ointment on radiodermatitis in a porcine model[J]. Int Wound J, 2023, 20(2): 516-528. |
| [84] |
KARLSSON M, YANG Z H, CHAWLA S, et al. Evaluation of diffusion tensor imaging and fluid based biomarkers in a large animal trial of cyclosporine in focal traumatic brain injury[J]. J Neurotrauma, 2021, 38(13): 1870-1878. |
| [85] |
HELKE K L, SWINDLE M M. Animal models of toxicology testing: the role of pigs[J]. Expert Opin Drug Metab Toxicol, 2013, 9(2): 127-139. |
| [86] |
ROSS M J, COATES P T. Using CRISPR to inactivate endogenous retroviruses in pigs: an important step toward safe xenotransplantation?[J]. Kidney Int, 2018, 93(1): 4-6. |
| [87] |
HAWTHORNE W J. World first pig-to-human cardiac xenotransplantation[J]. Xenotransplantation, 2022, 29(1): e12733. |
| [88] |
MEHRA M R. Cardiac xenotransplantation: rebirth amidst an uncertain future[J]. J Card Fail, 2022, 28(5): 873-874. |
| [89] |
FARR M, STEHLIK J. Heart xenotransplant: a door that is finally opening[J]. Circulation, 2022, 145(12): 871-873. |
| [90] |
SHAH A M, HAN J J. First successful porcine to human heart transplantation performed in the United States[J]. Artif Organs, 2022, 46(4): 543-545. |
(编辑 郭云雁)



