毛囊(hair follicle, HF)是主导哺乳动物毛发生成的主要皮肤附属器官,是哺乳动物典型特征之一。作为机体干细胞库与毛干工厂,HF能帮助重塑包括神经支配及血管分布在内的皮肤微环境,具有物理保护、防寒、散热、感知外界信息等功能[1]。胚胎毛囊从表面上皮细胞发育而来,这些细胞经历细胞命运的变化,侵入真皮并分化成毛干、毛囊和根鞘的各种细胞类型[2]。在胚胎皮肤发育过程中,分泌的表皮Wnt激活广泛的真皮Wnt信号活性后,HF的形态发生开始[3]。HF具有周期循环的特点,随季节变化反复经历生长期、退行期和休止期3个阶段,每一个阶段都受到复杂的信号网络调控并呈现出相似的规律,即基因转录、细胞增殖和分化的明显变化[4]。
转录因子(transcription factors, TFs)是一类DNA结合蛋白,具有强大的基因调控能力,对细胞的增殖、分化以及通过信号通路实现对外界干扰具有重要意义[5]。Forkhead box(Fox)蛋白家族是一类DNA结合域转录因子,首次在果蝇中发现,其结构呈现独特的螺旋翼状,该蛋白在各种细胞过程中起着重要作用,包括细胞分化、增殖、代谢和衰老的调节[6]。已有研究表明, 部分转录因子对毛囊干细胞(HFSCs)在整个细胞周期内的静息、自我更新和分化具有重要意义。Foxe1缺失的皮肤会形成异常的毛发[7]。Foxi3缺失会阻止HF向下生长,阻碍毛囊周期循环进展,导致毛发再生不良[8]。Foxc1的丢失可导致HFSCs的过早活化和耗尽[9]。Foxp1可作为促氧化剂调节氧化应激,当其缺失时,生长期氧化应激受损,HFSCs活性增强[10]。而Foxq1作为Fox家族一员,经辐射诱导后会产生67 bp缺失和2 bp的突变,形成Foxq1突变等位基因,而这种突变导致小鼠毛干髓质细胞发育异常,引起小鼠毛色浅淡并呈缎纹状[11]。
Wnt信号参与了广泛的皮肤生物学过程,具有调控上皮形态发生、调节毛囊发育及相关细胞分化的功能[12-13],对毛发生长的启动至关重要[14]。许多FOX转录因子充当Wnt信号传导的激活剂或抑制剂,如FOXB2调节大多数Wnt分子的表达[15],WNT5A转录在不同情况下受FOXC1、FOXE1和FOXF1/2的调控[16],Foxq1也与癌细胞中的β-catenin发生物理相互作用[17]。但大多数FOX蛋白在Wnt途径中的功能尚不完全清楚,这其中就包括了Foxq1。因此,本研究通过过表达Foxq1后检测其对HFSCs增殖及Wnt信号通路相关基因表达的影响,阐释转录因子调控毛囊生长发育的分子机理,并为绒山羊分子育种等工作提供理论依据。
1 材料与方法 1.1 试验对象本研究选择年龄(2岁)、体重基本一致的健康妊娠陕北白绒山羊母羊,在胚胎期66 d(n=3)和120 d(n=3)时分别采集胎儿背部皮肤组织。
1.2 腺病毒包装将目的基因序列克隆到穿梭载体(pAd-track-CMV)上(引物序列如表 1),经酶切处理转入BJ5183感受态细胞中,产生稳定的重组腺病毒载体,利用PacⅠ酶切得到重组腺病毒载体pAd- Foxq1。将pAd-Foxq1和对照载体pAd-Blank转染至HEK293A细胞进行包装。待观测到彗星尾这一明显现象后,采用反复冻融法收取病毒。
|
|
表 1 Foxq1全长引物信息 Table 1 Foxq1 full-length primer information |
HEK293A细胞由实验室前期冻存,HFSCs为课题组前期分离的陕北白绒山羊原代细胞[18]。HFSCs在DMEM/F-12培养基(10%胎牛血清,2%双抗)中于37 ℃、50 mL ·L-1 CO2培养箱中培养。当细胞培养至60%~70%汇合时,转染pAd-Foxq1与pAd-Blank过表达腺病毒,12 h后换液继续于培养箱中培养至48 h。
1.4 细胞功能试验将HFSCs接种于6孔板,pAd-Foxq1与pAd-Blank过表达腺病毒分别转染HFSCs 48 h,按照细胞周期染色试剂盒(SeaBiotech, Shanghai, China)通过流式细胞术检测Foxq1对细胞周期的影响,分别设置3个生物重复及3个技术重复。另将HFSCs接种于96孔板,pAd-Foxq1与pAd-Blank过表达腺病毒分别转染HFSCs 48 h。按照EdU细胞增殖检测试剂盒(c10310-1,广州锐博)检测Foxq1对细胞增殖的影响,分别设置3个生物重复和3个技术重复。参照本课题组MTT研究方法检测Foxq1对细胞活力的影响[19],分别设置8个生物重复和3个技术重复。
1.5 qPCR检测相关基因表达TRIzol法提取细胞中总RNA,使用PrimerScript RT试剂盒(TaKaRa,大连)反转录获得cDNA,引物利用Primer Premier 6.0软件设计,由上海生工合成,引物序列信息见表 2。qPCR反应体系和反应程序参考PerfectStart® Green Qpcr SuperMix (AQ601-1, TRANS)试剂盒说明书。
|
|
表 2 Foxq1等基因的qPCR引物信息 Table 2 Real-time PCR primers information for Foxq1 and other genes |
绒山羊HFSCs培养至融合度约为70%后,按照本课题组细胞免疫荧光研究方法进行操作[20]。
1.7 数据分析利用SPSS软件(version 18.0,美国)进行基因表达水平的显著性检验,结果以“平均值±标准误(mean±SE)”表示。使用GraphPad 8.3.0绘制基因表达柱状图以及EdU量化结果;使用Image J对EdU阳性细胞数进行统计。*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。
2 结果 2.1 Foxq1腺病毒的包装前期测序数据发现, Foxq1在绒山羊E 66(毛囊诱导期)皮肤组织中的表达量显著低于E 120(细胞分化期),因此通过qPCR对Foxq1在E 66、E 120皮肤组织中的表达量进行了验证,结果表明Foxq1在E 66皮肤组织中的表达量显著低于E 120(图 1a,P<0.001),与测序结果一致。酶切鉴定结果表明, pAd-Foxq1重组腺病毒过表达载体构建成功(图 1b)。将pAd-Foxq1载体转染到HEK293A细胞,在荧光显微镜下观察到彗星尾状荧光出现,表明Foxq1腺病毒包装成功(图 1c)。为了确定pAd-Foxq1侵染HFSCs的滴度,使其在HFSCs中的感染效率与pAd-Blank保持一致,将其添加到HFSCs中,观察绿色荧光表达情况,结果显示, 当1 mL DMEM/DF12完全培养基中添加85 μL pAd-Foxq1和50 μL pAd-Blank时,98%以上的HFSCs中会有绿色荧光表达(图 1d)。将85 μL pAd-Foxq1和50 μL pAd-Blank转入HFSCs中提取RNA,定量检测Foxq1过表达效率,结果显示, 转染pAd-Foxq1后HFSCs中Foxq1的表达量是对照组的40 000多倍(图 1e,P<0.000 1),表明Foxq1在HFSCs中过表达成功。
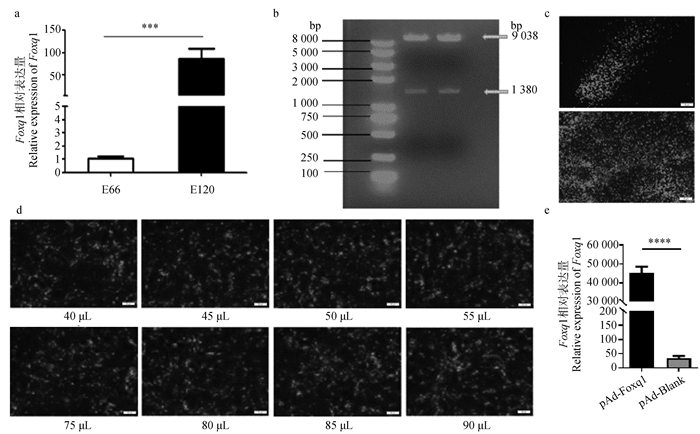
|
a. Foxq1在绒山羊毛囊诱导期(E 66)和细胞分化期(E 120)皮肤组织中的相对表达量(***.P<0.001);b. pAd-Foxq1载体的酶切鉴定;c. pAd-Foxq1腺病毒包装(标尺=50 μm);d. pAd-Foxq1腺病毒滴度测定(标尺=50 μm);e. Foxq1过表达效率检测(****.P<0.000 1) a. Relative expression of Foxq1 in the skin tissue of hair follicle at induction stage (E 66) and cytodifferentiation stage (E 120) (***.P < 0.001); b. Enzymatic digestion and identification of pAd-Foxq1 vector; c. pAd-Foxq1 adenovirus packaging (bar=50 μm); d. Determine the titer of pAd-Foxq1 adenovirus (bar=50 μm); e. Detection of Foxq1 overexpression efficiency(****.P < 0.000 1) 图 1 Foxq1基因的表达及其腺病毒过表达载体构建 Fig. 1 The expression of Foxq1 gene and construction of its adenovirus overexpression vector |
向HFSCs中转染pAd-Foxq1与pAd-Blank 48 h后,流式细胞结果表明过表达Foxq1后S期细胞比率显著升高,由1.66%升高到2.67%(图 2a);MTT结果表明,与对照组相比,过表达Foxq1后HFSCs的活力显著提高(图 2b,P<0.05);EdU试验进一步表明过表达Foxq1后阳性细胞数量明显增加(图 2c,P<0.01)。

|
a. Foxq1对HFSCs细胞周期的影响;b. Foxq1对HFSCs细胞活力的影响(*.P<0.05);c. Foxq1对HFSCs细胞增殖的影响(**.P<0.01,标尺=50 μm) a. Effect of Foxq1 on cell cycle of HFSCs. b. Effect of Foxq1 on the viability of HFSCs (*.P < 0.05). c. Effect of Foxq1 on the proliferation of HFSCs (**.P < 0.01, bar=50 μm) 图 2 Foxq1对HFSCs周期、活力及增殖的影响 Fig. 2 Effects of Foxq1 on cycle, viability and proliferation of HFSCs |
pAd-Foxq1与pAd-Blank转染HFSCs 48 h后,免疫荧光结果表明,与对照组相比,过表达Foxq1后Wnt信号通路激活的标记因子CTNNB1荧光强度明显增加,qPCR结果表明过表达Foxq1后CTNNB1表达量明显增加(图 3a,P<0.05)。免疫荧光及qPCR的结果表明过表达Foxq1后Wnt信号下游相关基因TCF3的荧光强度及mRNA表达量均显著增加(图 3b,P<0.05),且CYCLIND1的荧光强度及mRNA表达量也显著增加(图 3c,P<0.05)。
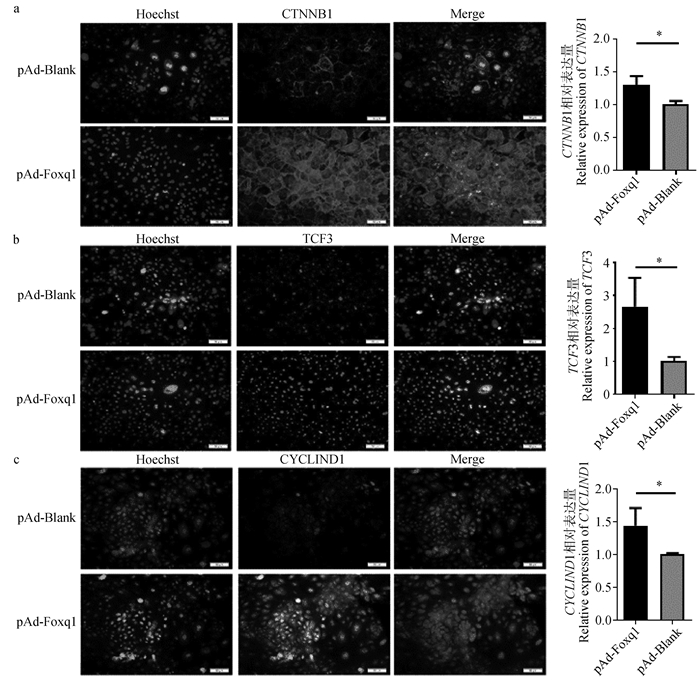
|
a. Foxq1对HFSCs中CTNNB1表达的影响(*.P<0.05);b. Foxq1对HFSCs中TCF3表达的影响(*.P<0.05);c. Foxq1对HFSCs中CYCLIND1表达的影响(*.P<0.05) a. Effect of Foxq1 on CTNNB1 expression in HFSCs (*.P < 0.05); b. Effect of Foxq1 on TCF3 expression in HFSCs (*.P < 0.05); c. Effect of Foxq1 on the expression of CYCLIND1 in HFSCs (*.P < 0.05) 图 3 Foxq1对HFSCs中Wnt信号通路的影响(标尺=50 μm) Fig. 3 Effect of Foxq1 on Wnt signaling pathway in HFSCs (bar=50 μm) |
HF是皮肤的组成部分,毛发的再生依赖于HFSCs的活化,它的生长受HFSCs生态位附近各种细胞的调控。毛囊的周期循环由HFSCs提供动力,一旦HFSCs被激活,细胞恢复活跃状态,使毛囊重新进入生长模式[21],因此HFSCs在整个毛囊生长周期中发挥至关重要的作用。
转录因子在绝大部分细胞基因组调节中发挥基础性作用,在多细胞生物中,它可以通过调节共同的遗传密码来决定单个细胞的身份和命运,并作为细胞信号网络的端点,快速并准确的对内外刺激做出反应[22]。转录因子主要通过蛋白质与DNA互作、蛋白质与蛋白质互作两种方式来发挥作用[23]。目前,针对Foxq1的研究已证实它在多种癌症中均有上调[24-25]。已有研究表明,Foxq1对毛囊基质细胞具有特殊作用,能够促进髓质细胞的发育,激活形成毛发正常结构所需的下游因子[26]。课题组前期的绒山羊皮肤组织转录组测序结果表明,转录因子Foxq1在E 120高表达,提示其可能在调控绒山羊毛囊干细胞生长和增殖中发挥重要作用。因此,本研究首先通过qPCR技术验证了Foxq1在E 66和E 120的相对表达量,与测序结果一致。进一步对其功能研究发现,过表达Foxq1后EdU阳性细胞数目和细胞活力明显增加,表明Foxq1促进了HFSCs的增殖,因此推测Foxq1在绒山羊毛囊生长发育过程中起重要作用。
毛囊干细胞的激活取决于其生态位中所有激活和抑制信号的总和,这一过程依赖于多种信号通路组成的复杂网络,如Wnt、Shh、Notch、BMP等,其中BMP和Wnt/β-catenin是主要的信号通路。BMP信号传导可抑制HFSCs活性,而Wnt/β-catenin信号传导可促进HFSCs激活并维持HFSCs生长[27-28]。Wnt信号通路是促进毛囊从休止期向生长期转换的中枢信号通路,与毛囊的形态发生、毛干分化等密切相关[29],通过靶向多种关键因子在激活毛干发育和启动毛囊基质形成中发挥重要作用[30]。CTNNB1是Wnt信号通路激活的关键因子,其表达情况能够揭示Wnt信号通路的激活情况。CYCLIND1、TCF3等是Wnt信号通路下游关键调控因子,调控毛囊发生发育过程中相关干细胞的生物活性[31]。Fox家族转录因子是促进器官发育和维持内环境稳态的关键调控因子,可以与Wnt信号靶蛋白特异性结合。Foxs1作为癌基因,通过Wnt/β-catenin信号通路促进结直肠癌细胞增殖、迁移、侵袭和转移[32]。Foxf2可能通过破坏β-catenin来抑制Wnt信号发生。而Foxq1作为Fox家族的一员,与癌细胞中的β-catenin相互作用,当Foxq1缺失时可抑制β-catenin核易位[33],其在结直肠癌(CRC)中的诱导可能会将Wnt信号从干细胞稳态和增殖转变为EMT和转移[34]。因此,本研究过表达Foxq1后检测HFSCs中Wnt信号通路相关基因的表达是否受到影响,发现Wnt信号通路相关基因CTNNB1、TCF3及CYCLIND1的mRNA及蛋白表达水平均显著增加,表明Foxq1可通过激活Wnt信号通路进而促进HFSCs的增殖。
先前的研究表明,Foxq1表达是由Wnt/β-catenin介导的,Foxq1沉默可防止β-catenin的核易位,从而减少Wnt/β-catenin信号传导[35]。本研究进一步证实了这一观点,但具体的机制尚不清楚。有研究表明,Foxq1可通过与膜联蛋白A2(ANXA2)结合,通过Wnt/β-catenin信号传导促进骨间充质干细胞的成骨分化[36]。Foxq1是TGF-β信号传导的下游靶标,TGF-β可在上皮细胞分化和EMT期间诱导Foxq1表达,进而促进β-catenin的核易位[37]。研究也发现,部分非编码RNA参与调控Foxq1的表达,如miR-106a过表达诱导结直肠癌细胞中Foxq1表达降低,同时增加了Wnt靶基因的表达,包括血管内皮生长因子-A和基质金属蛋白酶2,而这些基因均受Foxq1调控[38]。miR-133b可以通过靶向负调控FGFR1和灭活Wnt/β-catenin途径来抑制三阴性乳腺癌(TNBC)细胞的生长,且miR-133b可抑制Foxq1的表达[39]。miRNA与转录因子间存在反馈作用,即miRNA可调控转录因子的表达,转录因子也可反作用于miRNA[40]。因此推测,Foxq1影响绒山羊HFSCs的增殖可能有多种途径的参与,包括与相关蛋白协同作用,或通过相关非编码RNA的作用,但这需要更深入的研究证明。
4 结论本研究成功构建了Foxq1腺病毒过表达载体,过表达Foxq1后能够明显促进Wnt/β-catenin信号通路相关基因的表达,激活Wnt/β-catenin信号通路,从而促进绒山羊HFSCs的活力与增殖,揭示Foxq1在HFSCs增殖中的功能。同时为进一步探索Foxq1调控HFSCs增殖的机制提供研究基础。
| [1] |
JI S F, ZHU Z Y, SUN X Y, et al. Functional hair follicle regeneration: an updated review[J]. Signal Transduct Target Ther, 2021, 6(1): 66. DOI:10.1038/s41392-020-00441-y |
| [2] |
ABREU C M, MARQUES A P. Recreation of a hair follicle regenerative microenvironment: Successes and pitfalls[J]. Bioeng Transl Med, 2021, 7(1): e10235. |
| [3] |
CHEN D M, JARRELL A, GUO C T, et al. Dermal β-catenin activity in response to epidermal Wnt ligands is required for fibroblast proliferation and hair follicle initiation[J]. Development, 2012, 139(8): 1522-1533. DOI:10.1242/dev.076463 |
| [4] |
WANG J, QU J W, LI Y J, et al. miR-149-5p regulates goat hair follicle stem cell proliferation and apoptosis by targeting the CMTM3/AR axis during superior-quality brush hair formation[J]. Front Genet, 2020, 11: 529757. DOI:10.3389/fgene.2020.529757 |
| [5] |
SIMICEVIC J, DEPLANCKE B. Transcription factor proteomics—Tools, applications, and challenges[J]. Proteomics, 2017, 17(3-4): 1600317. DOI:10.1002/pmic.201600317 |
| [6] |
NEWMAN J A, AITKENHEAD H, GAVARD A E, et al. The crystal structure of human forkhead box N1 in complex with DNA reveals the structural basis for forkhead box family specificity[J]. J Biol Chem, 2020, 295(10): 2948-2958. DOI:10.1074/jbc.RA119.010365 |
| [7] |
BRANCACCIO A, MINICHIELLO A, GRACHTCHOUK M, et al. Requirement of the forkhead gene Foxe1, a target of sonic hedgehog signaling, in hair follicle morphogenesis[J]. Hum Mol Genet, 2004, 13(21): 2595-2606. DOI:10.1093/hmg/ddh292 |
| [8] |
SHIROKOVA V, BIGGS L C, JUSSILA M, et al. Foxi3 deficiency compromises hair follicle stem cell specification and activation[J]. Stem Cells, 2016, 34(7): 1896-1908. DOI:10.1002/stem.2363 |
| [9] |
LAY K, KUME T, FUCHS E. FOXC1 maintains the hair follicle stem cell niche and governs stem cell quiescence to preserve long-term tissue-regenerating potential[J]. Proc Natl Acad Sci U S A, 2016, 113(11): E1506-E1515. |
| [10] |
ZHAO J Z, LI H J, ZHOU R J, et al. Foxp1 regulates the proliferation of hair follicle stem cells in response to oxidative stress during hair cycling[J]. PLoS One, 2015, 10(7): e0131674. DOI:10.1371/journal.pone.0131674 |
| [11] |
WU B J, HERBERT PRATT C, POTTER C S, et al. R164C mutation in FOXQ1 H3 domain affects formation of the hair medulla[J]. Exp Dermatol, 2013, 22(3): 234-236. DOI:10.1111/exd.12106 |
| [12] |
GENTILE P, GARCOVICH S. Advances in regenerative stem cell therapy in androgenic Alopecia and Hair Loss: Wnt pathway, growth-factor, and mesenchymal stem cell signaling impact analysis on cell growth and hair follicle development[J]. Cells, 2019, 8(5): 466. DOI:10.3390/cells8050466 |
| [13] |
李凡, 陈晓阳, 杨国雨, 等. Wnt/β-连环蛋白信号通路在哺乳动物毛囊发育中的调控作用[J]. 畜牧兽医学报, 2019, 50(11): 2186-2194. LI F, CHEN X Y, YANG G Y, et al. The regulatory role of Wnt/β-catenin signaling pathway in the development of mammalian hair follicles[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(11): 2186-2194. DOI:10.11843/j.issn.0366-6964.2019.11.002 (in Chinese) |
| [14] |
FENG Y, GUN S B. Melatonin supplement induced the hair follicle development in offspring rex rabbits[J]. J Anim Physiol Anim Nutr (Berl), 2021, 105(1): 167-174. DOI:10.1111/jpn.13417 |
| [15] |
MOPARTHI L, PIZZOLATO G, KOCH S. Wnt activator FOXB2 drives the neuroendocrine differentiation of prostate cancer[J]. Proc Natl Acad Sci U S A, 2019, 116(44): 22189-22195. DOI:10.1073/pnas.1906484116 |
| [16] |
KOCH S. Regulation of Wnt signaling by FOX transcription factors in cancer[J]. Cancers (Basel), 2021, 13(14): 3446. DOI:10.3390/cancers13143446 |
| [17] |
BAGATI A, BIANCHI-SMIRAGLIA A, MOPARTHY S, et al. Melanoma suppressor functions of the carcinoma oncogene FOXQ1[J]. Cell Rep, 2017, 20(12): 2820-2832. DOI:10.1016/j.celrep.2017.08.057 |
| [18] |
GE W, WANG S H, SUN B, et al. Melatonin promotes cashmere goat (Capra hircus) secondary hair follicle growth: a view from integrated analysis of long non-coding and coding RNAs[J]. Cell Cycle, 2018, 17(10): 1255-1267. DOI:10.1080/15384101.2018.1471318 |
| [19] |
刘丽华, 钟震宇, 郑玉杰, 等. lncRNA EPB41L4A-AS通过调控ErbB3抑制奶牛乳腺上皮细胞增殖的研究[J]. 畜牧兽医学报, 2022, 53(7): 2152-2159. LIU L H, ZHONG Z Y, ZHENG Y J, et al. lncRNA EPB41L4A-AS inhibits the proliferation of bovine mammary epithelial cells by regulating the expression of ErbB3 gene[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7): 2152-2159. (in Chinese) |
| [20] |
王妞. FGF5和FGF21影响绒山羊毛乳头细胞增殖及其调控机制研究[D]. 杨凌: 西北农林科技大学, 2022. WANG N. Study on the proliferation and regulation mechanism of FGF5 and FGF21 in dermal papilla cells in cashmere goats[D]. Yangling: Northwest A&F University, 2022. (in Chinese) |
| [21] |
HU X M, LI Z X, ZHANG D Y, et al. A systematic summary of survival and death signalling during the life of hair follicle stem cells[J]. Stem Cell Res Ther, 2021, 12(1): 453. DOI:10.1186/s13287-021-02527-y |
| [22] |
HENLEY M J, KOEHLER A N. Advances in targeting 'undruggable' transcription factors with small molecules[J]. Nat Rev Drug Discov, 2021, 20(9): 669-688. DOI:10.1038/s41573-021-00199-0 |
| [23] |
WEIDEMVLLER P, KHOLMATOV M, PETSALAKI E, et al. Transcription factors: bridge between cell signaling and gene regulation[J]. Proteomics, 2021, 21(23-24): e2000034. DOI:10.1002/pmic.202000034 |
| [24] |
CHRISTENSEN J, BENTZ S, SENGSTAG T, et al. FOXQ1, a novel target of the wnt pathway and a new marker for activation of Wnt signaling in solid tumors[J]. PLoS One, 2013, 8(3): e60051. DOI:10.1371/journal.pone.0060051 |
| [25] |
EARLEY A M, DIXON C T, SHIAU C E. Genetic analysis of zebrafish homologs of human FOXQ1, foxq1a and foxq1b, in innate immune cell development and bacterial host response[J]. PLoS One, 2018, 13(3): e0194207. DOI:10.1371/journal.pone.0194207 |
| [26] |
HONG H K, NOVEROSKE J K, HEADON D J, et al. The winged helix/forkhead transcription factor Foxq1 regulates differentiation of hair in satin mice[J]. Genesis, 2001, 29(4): 163-171. DOI:10.1002/gene.1020 |
| [27] |
CHEN C L, HUANG W Y, WANG E H C, et al. Functional complexity of hair follicle stem cell niche and therapeutic targeting of niche dysfunction for hair regeneration[J]. J Biomed Sci, 2020, 27(1): 43. DOI:10.1186/s12929-020-0624-8 |
| [28] |
PLIKUS M V. New activators and inhibitors in the hair cycle clock: targeting stem cells' state of competence[J]. J Invest Dermatol, 2012, 132(5): 1321-1324. DOI:10.1038/jid.2012.38 |
| [29] |
ALBRECHT L V, TEJEDA-MUÑOZ N, DE ROBERTIS E M. Cell biology of canonical Wnt signaling[J]. Annu Rev Cell Dev Biol, 2021, 37: 369-389. DOI:10.1146/annurev-cellbio-120319-023657 |
| [30] |
XING Y Z, MA X G, GUO H Y, et al. Wnt5a suppresses β-catenin signaling during hair follicle regeneration[J]. Int J Med Sci, 2016, 13(8): 603-610. DOI:10.7150/ijms.15571 |
| [31] |
HOWARD J M, NUGUID J M, NGOLE D, et al. Tcf3 expression marks both stem and progenitor cells in multiple epithelia[J]. Development, 2014, 141(16): 3143-3152. DOI:10.1242/dev.106989 |
| [32] |
ZHANG L, REN C F, YANG Z, et al. Forkhead Box S1 mediates epithelial-mesenchymal transition through the Wnt/β-catenin signaling pathway to regulate colorectal cancer progression[J]. J Transl Med, 2022, 20(1): 327. DOI:10.1186/s12967-022-03525-1 |
| [33] |
ZHANG J, ZHANG C X, SANG L, et al. FOXF2 inhibits proliferation, migration, and invasion of Hela cells by regulating Wnt signaling pathway[J]. Biosci Rep, 2018, 38(5): BSR20180747. DOI:10.1042/BSR20180747 |
| [34] |
PIZZOLATO G, MOPARTHI L, SÖDERHOLM S, et al. The oncogenic transcription factor FOXQ1 is a differential regulator of Wnt target genes[J]. J Cell Sci, 2022, 135(19): jcs260082. DOI:10.1242/jcs.260082 |
| [35] |
GAO Y H, HUANG E Y, ZHANG H M, et al. Crosstalk between Wnt/β-catenin and estrogen receptor signaling synergistically promotes osteogenic differentiation of mesenchymal progenitor cells[J]. PLoS One, 2013, 8(12): e82436. DOI:10.1371/journal.pone.0082436 |
| [36] |
XIANG L S, ZHENG J M, ZHANG M D, et al. FOXQ1 promotes the osteogenic differentiation of bone mesenchymal stem cells via Wnt/β-catenin signaling by binding with ANXA2[J]. Stem Cell Res Ther, 2020, 11(1): 403. DOI:10.1186/s13287-020-01928-9 |
| [37] |
PENG X D, LUO Z, KANG Q J, et al. FOXQ1 mediates the crosstalk between TGF-β and Wnt signaling pathways in the progression of colorectal cancer[J]. Cancer Biol Ther, 2015, 16(7): 1099-1109. DOI:10.1080/15384047.2015.1047568 |
| [38] |
LIU Z H, QIN Y, DONG S X, et al. Overexpression of miR-106a enhances oxaliplatin sensitivity of colorectal cancer through regulation of FOXQ1[J]. Oncol Lett, 2020, 19(1): 663-670. |
| [39] |
LIN Y, LIN F K, ANUCHAPREEDA S, et al. Effect of miR-133b on progression and cisplatin resistance of triple-negative breast cancer through FGFR1-Wnt-β-catenin axis[J]. Am J Transl Res, 2021, 13(6): 5969-5984. |
| [40] |
付强, 岳巧娴, 锡建中, 等. 绵羊miR-127/FOXO4反馈环路及其对卵泡颗粒细胞凋亡相关基因表达的影响[J]. 畜牧兽医学报, 2022, 53(1): 66-75. FU Q, YUE Q X, XI J Z, et al. Effect of oar-miR-127/FOXO4 feedback loop on genes associated with apoptosis of sheep granulosa cells[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(1): 66-75. (in Chinese) |
(编辑 郭云雁)



