2. 扬州大学兽医学院 江苏省动物预防 医学重点实验室, 扬州 225009;
3. 扬州大学兽医学院 江苏高校动物重要疫病与人畜共患病防控协同控制中心, 扬州 225009;
4. 扬州大学 教育部农业与农产品安全国际合作联合实验室, 扬州 225009
2. Jiangsu Province Key Laboratory of Preventive Veterinary Medicine, College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, China;
3. Jiangsu Co-Innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, China;
4. Joint International Research Laboratory of Agriculture and Agri-Product Safety, the Ministry of Education of China, Yangzhou University, Yangzhou 225009, China
细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4或CD152)是免疫球蛋白超家族的Ⅰ型跨膜糖蛋白,主要表达于活化的T淋巴细胞上,属于免疫检查点分子[1-4]。CTLA-4与CD28是免疫球蛋白超家族的同源糖蛋白,两者均可特异性地结合抗原呈递细胞(antigen-presenting cells, APC)表面的B7分子配体,包括B7-1(CD80)和B7-2(CD86)[5-7]。由于CTLA-4与B7分子结合的亲和力比CD28与B7分子结合的亲和力高20多倍,CTLA-4通过与CD28竞争性地结合B7分子,从而抑制T细胞的增殖与活化,下调T细胞免疫应答[7-8]。
一些禽类病原通过抑制或损伤免疫系统功能和降低机体的免疫力,从而实现致病作用。T细胞介导的免疫反应在禽类疾病如马立克氏病、禽白血病、新城疫、传染性法氏囊病、禽流感等均具有重要作用,但目前研究很少[9-10]。CTLA-4、PD-1等免疫检查点分子的表达在禽病病毒感染过程中存在一定的差异性,提示这些免疫检查点分子在病毒致病机制和诱导机体细胞免疫中发挥了不同作用[11-12]。而CTLA-4作为T细胞免疫应答中的负调节因子之一,它的表达强度和生物学功能是T细胞应答负调控过程中的关键。目前,有关CTLA-4单克隆抗体阻断CTLA-4/B7信号通路的研究范围比较广泛,包括同种异体移植、病毒感染性疾病、免疫抑制性疾病、肿瘤治疗等[13-15]。CTLA-4抗体还可与疫苗联合使用治疗疾病。研究表明,疫苗诱导的保护性免疫可以通过诱导其抑制分子配体来调节。Tang等[16]在建立日本血吸虫病感染小鼠模型的研究中发现,CTLA-4抗体可以作为佐剂,通过诱导Th1型免疫反应来增强GAPDH疫苗的免疫保护。Liu等[17]在三阴性乳腺癌的体内研究中发现,抗CTLA-4抗体与mRNA疫苗联合使用与单独使用抗体或疫苗相比,可显著增强机体的抗肿瘤免疫应答能力。这些结果均表明,抗CTLA-4单抗可能作为一种有效的佐剂,以增强疫苗的免疫保护效果,但在禽病研究领域与CTLA-4的相关报道较少。
本研究首次以体外表达的鸡的CTLA-4蛋白为免疫原制备了抗鸡CTLA-4的单克隆抗体,并对其生物学活性进行研究。通过体外试验验证其与鸡CTLA-4蛋白的反应性和鸡外周血淋巴细胞(peripheral blood mononuclear cell,PBMC)的结合情况。本研究为后续探究抗鸡CTLA-4单克隆抗体干预机体免疫微环境,对禽类疾病的辅助性治疗作用提供了基础。
1 材料与方法 1.1 主要材料杆状病毒供体质粒pFastBacHTA、大肠杆菌DH10Bac感受态细胞购自Invitrogen公司;真核表达载体质粒pCAGGS-CTLA-4-Flag、DF-1细胞、SP2/0细胞和Sf9昆虫细胞由江苏省扬州大学动物预防医学重点实验室保存;Balb/c小鼠和ICR小鼠购于扬州大学比较医学中心;预染蛋白Marker、DL2000 DNA Marker、限制性核酸内切酶(EcoR Ⅰ和Hind Ⅲ)购自Thermo公司;鸡外周血淋巴细胞分离液购自Solarbio公司;FITC标记山羊抗鼠IgG、HRP标记山羊抗鼠IgG均购于Sigma公司;AxyPrep总RNA小量制备试剂盒购自AXYGEN公司;6×His Tag Antibody购自Invitrogen公司;RPMI-1640培养基、胎牛血清购自Gibco公司;HT培养基、氨基蝶呤(A)、刀豆球蛋白A(Con A) 购自Sigma公司;亚类快速鉴定试剂盒购自SouthernBiotech公司;Mouse Anti-Chicken CD3-SPRD流式抗体购自SouthernBiotech公司。
1.2 目的基因CTLA-4的获得根据NCBI上鸡CTLA-4基因序列CDS区设计一对特异性引物(参考序列:NM_001040091.1),以EcoR Ⅰ和Hind Ⅲ为酶切位点(下划线处),送华大基因合成,预期扩增目的片段大小618 bp。引物序列如下:F: 5′-CGGAATTCatgctctcagcatgggtc-3′;R: 5′-CCCAAGCTTtcagttaacagtgatgtgaaatggaat-3′。以鸡的PBMC基因组为模板,经PCR扩增得到目的基因CTLA-4。
1.3 重组杆状病毒穿梭质粒rBacmid-CTLA-4的构建参考杆状病毒表达系统说明[18],将目的基因CTLA-4插入到pFastBacHTA载体中构建获得重组供体质粒pFastBacHTA-CTLA-4,然后将pFastBacHTA-CTLA-4转座入大肠杆菌DH10Bac感受态细胞中。经X-gal蓝白斑筛选、抗生素抗性筛选(庆大霉素、卡那霉素、四环素)及菌液PCR鉴定获得重组杆状病毒穿梭质粒rBacmid-CTLA-4,并提取质粒DNA作为备用。
1.4 鸡CTLA-4蛋白在Sf9昆虫细胞中的表达将鉴定正确的rBacmid-CTLA-4 DNA质粒转染Sf9昆虫细胞制备重组杆状病毒rBac-CTLA-4,最后扩增高滴度的P3代重组杆状病毒用于鸡CTLA-4蛋白的体外高效表达。按MOI=1接种P3代重组杆状病毒于Sf9昆虫细胞中,至细胞开始出现病变时,通过间接免疫荧光(indirect immunoinfluscent assay,IFA)和蛋白免疫印迹(Western blot)的方法检测鸡CTLA-4蛋白在昆虫细胞中的表达情况。
1.5 小鼠免疫取2.5×106个P3代重组毒rBac-CTLA-4感染的Sf9昆虫细胞,超声波破碎,与弗氏完全佐剂混合,经腹腔注射免疫8周龄的Balb/c小鼠,每隔12 d后取同样抗原量与弗氏不完全佐剂混合进行二免和三免。三免后第8天测定小鼠血清效价,并对血清效价较高的小鼠用不含佐剂的抗原进行加强免疫。
1.6 细胞融合及阳性杂交瘤细胞的筛选加强免疫72~96 h内,分离小鼠的脾淋巴细胞,选择生长状态良好、处于对数生长期的SP2/0细胞进行细胞融合。融合后的细胞用15% HAT培养基于37 ℃、5% CO2培养箱内培养,待杂交瘤细胞培养上清变黄后通过IFA进行阳性杂交瘤细胞的筛选。复检后仍为阳性的细胞孔进行亚克隆,直至亚克隆后的细胞孔阳性率达100%,将杂交瘤细胞扩大培养并建株。
1.7 单克隆抗体的亚型鉴定将获得的单克隆抗体按照Southern Biotech免疫球蛋白标准亚类快速鉴定试剂盒进行亚类鉴定。于ELISA酶标板上4 ℃过夜包被Goat Anti-Mouse Ig抗体,次日用含1% BSA的PBS封闭1 h,PBS洗涤后,依次加入待检抗体和HRP二抗37 ℃孵育1 h,PBS洗涤后,加入显色液,酶标仪读取OD405 nm的值。
1.8 单克隆抗体与CTLA-4蛋白的反应性分析将获得的单克隆抗体分别与转染真核表达载体质粒pCAGGS-CTLA-4-Flag的DF-1细胞和感染重组杆状病毒rBac-CTLA-4的Sf9昆虫细胞进行IFA,分析抗鸡CTLA-4单克隆抗体与CTLA-4重组蛋白的反应性。
1.9 单克隆抗体与鸡PBMC的结合性分析CTLA-4属于弱表达指标,在静息的T细胞中微弱表达,在激活和进入细胞周期后表达上调[19]。本研究选用刀豆球蛋白A(Con A)体外刺激鸡PBMC以诱导CTLA-4的表达。收集Con A(终浓度10 μg·mL-1)处理48 h后的鸡PBMC(1×107个)于2 mL离心管中。依次孵育抗鸡CTLA-4单克隆抗体和羊抗鼠IgG-FITC,流式细胞仪上机检测单抗与PBMC细胞的结合情况。根据流式细胞术(FCM)的结果,将刺激后的PBMC固定于细胞爬片上,以抗鸡CTLA-4多抗血清作为阳性对照,ICR鼠血清作为阴性对照,进行IFA分析单克隆抗体与PBMC的结合效果。
1.10 CD3+CTLA-4+T淋巴细胞的检测收集刺激过的PBMC于2 mL离心管中,加入抗鸡CTLA-4单克隆抗体,室温孵育45 min,PBS洗2遍;加入羊抗鼠IgG-FITC,避光条件下室温孵育30 min,PBS洗2遍;加入Mouse Anti-Chicken CD3流式抗体,室温避光孵育30 min,PBS洗3遍。流式细胞仪上机检测CD3+CTLA-4+T淋巴细胞的占比,分析单抗与CD3+T淋巴细胞的结合情况。
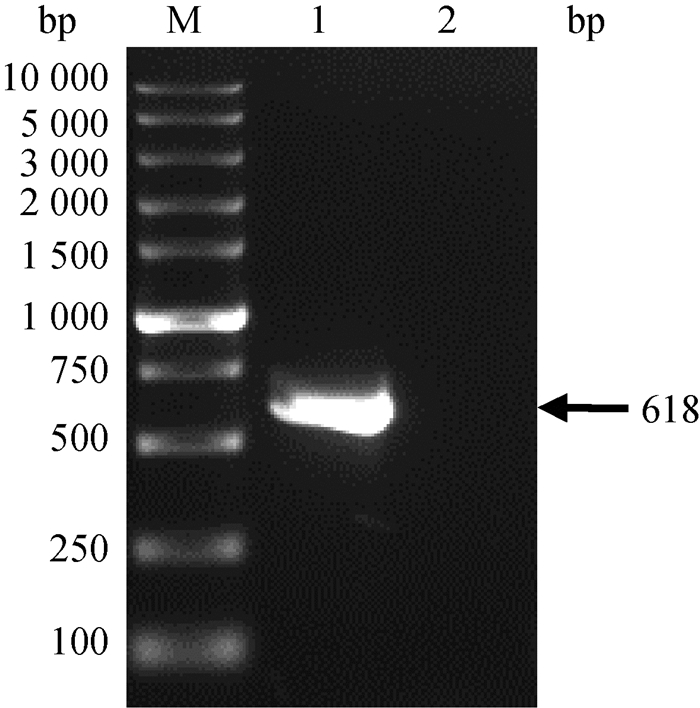
2 结果 2.1 CTLA-4基因PCR扩增结果以鸡外周血淋巴细胞分离液分离得到的鸡PBMC基因组为模板,利用设计的特异性引物通过PCR扩增,经1%琼脂糖凝胶电泳后成功获得一段与预期相符的618 bp大小的CTLA-4目的基因条带(图 1)。
|
M. DL2000 DNA Marker;1. CTLA-4基因PCR产物;2. 阴性对照 M. DL2000 DNA Marker; 1. PCR amplification of CTLA-4 gene; 2. Negative control 图 1 CTLA-4基因的PCR扩增 Fig. 1 PCR amplification of CTLA-4 gene |
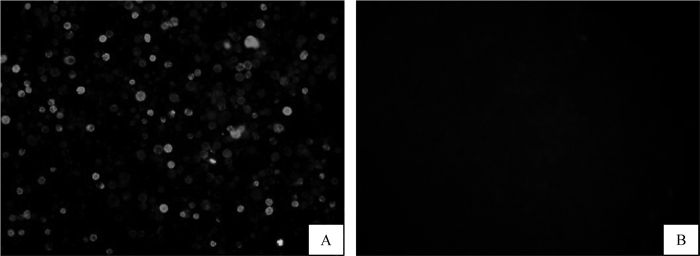
按上述方法,将制备的P3代重组杆状病毒rBac-CTLA-4感染对数生长期内的Sf9昆虫细胞,待细胞出现明显病变时进行IFA和Western blot分析,使用6×His Tag Antibody进行CTLA-4蛋白表达的检测。IFA和Western blot结果均显示:感染rBac-CTLA-4的Sf9细胞出现亮绿色的荧光,而感染野生型病毒的Sf9细胞无荧光(图 2);且感染细胞裂解产物中有与CTLA-4目的片段预期大小相符、约26 ku的特异性目的条带(图 3)。
|
A. 感染rBac-CTLA-4的Sf9细胞;B. 感染野生型病毒的Sf9细胞 A. Sf9 cells infected with rBac-CTLA-4; B. Sf9 cells infected with wild virus 图 2 Sf9细胞表达重组CTLA-4的IFA鉴定(400×) Fig. 2 IFA identification of recombinant CTLA-4 expressed in Sf9 cells (400×) |

|
M. 预染蛋白Marker;1~5. 感染rBac-CTLA-4的Sf9细胞;6. 感染野生型病毒的Sf9细胞 M. Marker; 1-5. Sf9 cells infected with rBac-CTLA-4;6. Sf9 cells infected with wild virus 图 3 重组鸡CTLA-4表达产物的Western blot分析 Fig. 3 Western blot analysis of recombinant chicken CTLA-4 expressed protein |
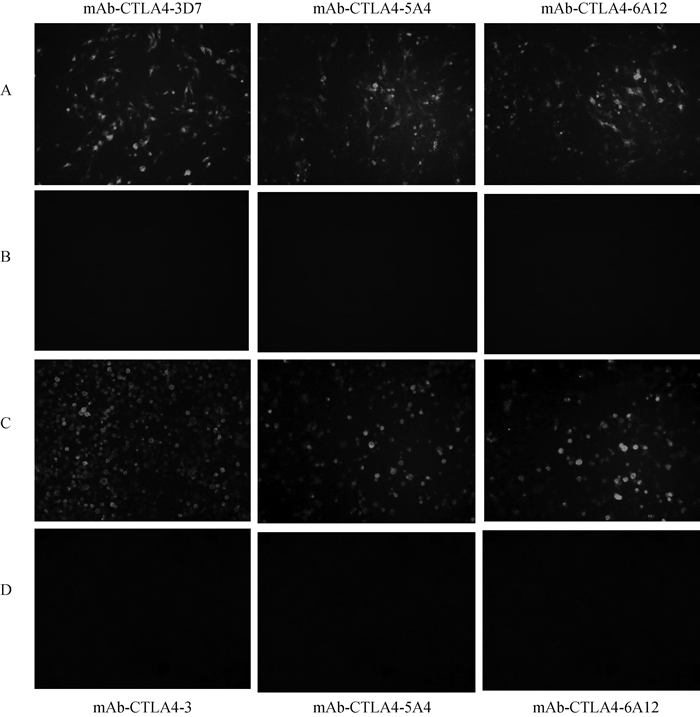
按上述方法,通过连续3次亚克隆最终获得了3株单克隆抗体,分别命名为:mAb-CTLA4-3D7;mAb-CTLA4-5A4;mAb-CTLA4-6A12。将3株克隆抗体分别与转染pCAGGS-CTLA-4-Flag的DF-1细胞和感染重组杆状病毒的Sf9细胞反应。结果显示:3株单克隆抗体均能够有效识别pCAGGS-CTLA-4-Flag真核表达系统和杆状病毒表达系统的CTLA-4蛋白(图 4)。
|
A.转染pCAGGS-CTLA4-Flag的DF-1细胞; B.转染pCAGGS-Flag的DF-1细胞; C.感染rBac-CTLA-4的的Sf9细胞; D.感染野生型杆状病毒的Sf9细胞 A. DF-1 cells transfected with pCAGGS-CTLA4-Flag; B. DF-1 cells transfected with pCAGGS-Flag; C.Sf9 cells infected with rBac-CTLA-4; D.Sf9 cells infected with wild virus 图 4 抗CTLA-4单克隆抗体的IFA鉴定(400×) Fig. 4 Identification of monoclonal antibodies against CTLA-4 in IFA(400×) |
免疫球蛋白标准亚类快速鉴定试剂盒对3株单克隆抗体的亚类检测结果显示:3株单克隆抗体均为IgG亚型(表 1)。
|
|
表 1 单克隆抗体的亚类鉴定 Table 1 Identification of subclasses of monoclonal antibodies |
利用IFA和FCM检测mAb-CTLA4-3D7与鸡PBMC的结合情况,IFA结果显示:抗鸡CTLA-4多抗血清处理组及mAb-CTLA4-3D7抗体处理组均出现特异性荧光,ICR小鼠血清对照组无荧光(图 5);FCM结果显示:以鼠源IgG同型抗体为对照,mAb-CTLA4-3D7抗体处理组有阴阳性群体分峰,呈低水平表达(图 6),与CTLA-4的表达情况相符。说明所得mAb-CTLA4-3D7抗体可以与鸡PBMC发生有效结合。

|
A. 抗鸡CTLA-4多抗血清作为一抗与鸡PBMC进行IFA鉴定;B. mAb-CTLA4-3D7作为一抗与鸡PBMC进行IFA鉴定;C. ICR小鼠血清作为一抗与鸡PBMC进行IFA鉴定 A. IFA identification of polyclonal antibody to CTLA-4 reacted with chicken PBMC; B.IFA identification of mAb-CTLA4-3D7 reacted with chicken PBMC; C. IFA identification of ICR mouse serum reacted with chicken PBMC 图 5 mAb-CTLA4-3D7与鸡PBMC的结合性分析(400×) Fig. 5 Reactivity analysis of mAb-CTLA4-3D7 with chicken PBMC in IFA(400×) |

|
A. IgG同型抗体作为一抗与鸡PBMC进行FCM鉴定;B. mAb-CTLA4-3D7作为一抗与鸡PBMC进行FCM鉴定 A. FCM analysis of isotype IgG antibody reacted with chicken PBMC; B. FCM analysis of mAb-CTLA4-3D7 reacted with chicken PBMC 图 6 FCM分析mAb-CTLA4-3D7与鸡PBMC的结合 Fig. 6 FCM analysis of mAb-CTLA4-3D7 reacted with chicken PBMC |
为进一步验证mAb-CTLA4-3D7是否能够与T淋巴细胞结合,本研究用Mouse Anti-Chicken CD3流式抗体标记T淋巴细胞,通过FCM分析mAb-CTLA4-3D7与CD3+T淋巴细胞的结合活性。结果显示:鼠源IgG同型抗体不与CD3+T淋巴细胞结合,mAb-CTLA4-3D7能够与部分CD3+T淋巴细胞进行结合,结合率约为16%(图 7)。

|
A. IgG同型抗体作为一抗与鸡CD3+T淋巴细胞进行FCM分析;B. mAb-CTLA4-3D7作为一抗与鸡CD3+T淋巴细胞进行FCM分析 A. FCM analysis of isotype IgG antibody reacted with chicken CD3+T lymphocyte; B. FCM analysis of mAb-CTLA4-3D7 reacted with chicken CD3+T lymphocyte 图 7 mAb-CTLA4-3D7与CD3+T细胞反应的FCM分析 Fig. 7 FCM analysis of mAb-CTLA4-3D7 reacted with CD3+T cells |
CTLA-4作为T细胞激活和增殖的负调控因子,在直接调控T淋巴细胞应答及间接影响B细胞应答中发挥了重要作用[20-21]。人类医学研究中已利用杂交瘤技术成功制备出CTLA-4 mAb[22],体内外试验显示CTLA-4 mAb可有效刺激T细胞增殖,诱导IL-2产生,提示CTLA-4 mAb可以阻断CTLA-4与其天然配体结合[23-25]。禽类病毒性免疫抑制病导致机体的免疫系统尤其是免疫器官损伤或功能降低,发生明显的免疫抑制现象,产生疫苗免疫失败及发病率增加等诸多问题[26]。T细胞上的CTLA-4/B7负性信号通路在禽类疾病的发病机制中可能发挥了重要作用。
目前市场上具有代表性的CTLA-4单抗药物有Ipilimumab和Tremelimumab,广泛应用于前列腺癌、肾癌、黑色素瘤等的治疗[27]。另外,因CTLA-4抗体发挥的是免疫增强作用,其通过提高机体免疫细胞的杀伤作用来达到治疗效果,通常与其他免疫检查点抑制剂(如PD-1抗体)或治疗性药物联合使用[28]。联合用药已在多项临床研究中取得了显著疗效,这也为禽类肿瘤性疾病、免疫抑制性疾病的治疗和致病机制的研究提供了新思路。体外表达CTLA-4蛋白或制备CTLA-4抗体阻断剂在禽类疫苗研发方向上存在巨大潜力。本研究通过Bac to Bac系统成功构建了含有鸡CTLA-4基因片段的重组杆状病毒,并在Sf9昆虫细胞进行了大量表达,并进一步以此表达产物免疫小鼠研制出特异性抗鸡CTLA-4的单克隆抗体。用杆状病毒表达系统是真核表达系统,与大肠杆菌原核表达系统不同,杆状病毒表达系统表达的外源蛋白能进行后加工如糖基化、乙酰化、磷酸化等翻译后修饰,更能呈现构象抗原表位[29]。本研究研制的3株单克隆抗体表现出不同的反应性可能与CTLA-4在T细胞上的表位差异有关,相关研究正在继续。
Yao等[30]发现在有丝分裂原刺激物的作用下,北京鸭PBMC中CTLA-4蛋白的表达有适度提高。基于此,本研究使用Con A对新鲜分离的鸡PBMC进行体外刺激,诱导鸡PBMC中CTLA-4 mRNA水平上调,并通过FCM和IFA等方法验证鸡CTLA-4单克隆抗体与鸡PBMC的结合效率,结果显示mAb-CTLA4-3D7能结合约16%的T细胞,其余2株单抗基本不与鸡PBMC发生反应。另有文献报道,在正常人的外周血淋巴细胞中CD4+CTLA-4+细胞和CD8+CTLA-4+细胞分别为7.28%和7.78%[31],由于存在种属差异,表达CTLA-4的禽类T细胞亚群分布还需进一步的试验验证。以上结果为后续评估病毒作用机制下CTLA-4抗体对禽类机体免疫水平的影响奠定了基础。
4 结论本研究在昆虫细胞中成功表达了鸡CTLA-4蛋白,研制出3株抗鸡CTLA-4蛋白的单克隆抗体,其中mAb-CTLA4-3D7与鸡的CD3+T淋巴细胞有较好的结合活性,为免疫检查点在禽病的发病机制、信号通路、疫苗研发等研究领域中提供了基础。
| [1] |
LINSLEY P S, GREENE J L, TAN P, et al. Coexpression and functional cooperation of CTLA-4 and CD28 on activated T lymphocytes[J]. J Exp Med, 1992, 176(6): 1595-1604. DOI:10.1084/jem.176.6.1595 |
| [2] |
GOUGH S C L, WALKER L S K, SANSOM D M. CTLA4 gene polymorphism and autoimmunity[J]. Immunol Rev, 2005, 204(1): 102-115. DOI:10.1111/j.0105-2896.2005.00249.x |
| [3] |
LINSLEY P S, BRADY W, URNES M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7[J]. J Exp Med, 1991, 174(3): 561-569. DOI:10.1084/jem.174.3.561 |
| [4] |
ZHANG Y P, ZHENG J K. Functions of immune checkpoint molecules beyond immune evasion[M]//XU J. Regulation of Cancer Immune Checkpoints. Singapore: Springer, 2020: 201-226.
|
| [5] |
MITSUIKI N, SCHWAB C, GRIMBACHER B. What did we learn from CTLA-4 insufficiency on the human immune system?[J]. Immunol Rev, 2019, 287(1): 33-49. DOI:10.1111/imr.12721 |
| [6] |
ZHANG A L, REN Z H, TSENG K F, et al. Dual targeting of CTLA-4 and CD47 on Treg cells promotes immunity against solid tumors[J]. Sci Transl Med, 2021, 13(605): eabg8693. DOI:10.1126/scitranslmed.abg8693 |
| [7] |
ROWSHANRAVAN B, HALLIDAY N, SANSOM D M. CTLA-4:a moving target in immunotherapy[J]. Blood, 2018, 131(1): 58-67. DOI:10.1182/blood-2017-06-741033 |
| [8] |
WALUNAS T L, LENSCHOW D J, BAKKER C Y, et al. CTLA-4 can function as a negative regulator of T cell activation[J]. Immunity, 1994, 1(5): 405-413. DOI:10.1016/1074-7613(94)90071-X |
| [9] |
PARVIZI P, ANDRZEJEWSKI K, READ L R, et al. Expression profiling of genes associated with regulatory functions of T-cell subsets in Marek's disease virus-infected chickens[J]. Avian Pathol, 2010, 39(5): 367-373. DOI:10.1080/03079457.2010.508776 |
| [10] |
JARAHIAN M, WATZL C, FOURNIER P, et al. Activation of natural killer cells by newcastle disease virus hemagglutinin-neuraminidase[J]. J Virol, 2009, 83(16): 8108-8121. DOI:10.1128/JVI.00211-09 |
| [11] |
YU H L, ZOU W B, MI C H, et al. Research Note: Expression of T cell-related cytokines in chicken cecal and spleen tissues following Eimeria tenella infection in vivo[J]. Poult Sci, 2021, 100(7): 101161. DOI:10.1016/j.psj.2021.101161 |
| [12] |
RUAN Y, WANG Y, GUO Y P, et al. T cell subset profile and inflammatory cytokine properties in the gut-associated lymphoid tissues of chickens during infectious bursal disease virus (IBDV) infection[J]. Arch Virol, 2020, 165(10): 2249-2258. DOI:10.1007/s00705-020-04735-y |
| [13] |
MO X, ZHANG H H, PRESTON S, et al. Interferon-γ signaling in melanocytes and melanoma cells regulates expression of CTLA-4[J]. Cancer Res, 2018, 78(2): 436-450. DOI:10.1158/0008-5472.CAN-17-1615 |
| [14] |
LEE E Q. Immune checkpoint inhibitors in GBM[J]. J Neurooncol, 2021, 155(1): 1-11. DOI:10.1007/s11060-021-03859-8 |
| [15] |
WOLCHOK J D, NEYNS B, LINETTE G, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: A randomised, double-blind, multicentre, phase 2, dose-ranging study[J]. Lancet Oncol, 2010, 11(2): 155-164. DOI:10.1016/S1470-2045(09)70334-1 |
| [16] |
TANG C L, YANG J F, PAN Q, et al. Anti-CTLA-4 monoclonal antibody improves efficacy of the glyceraldehyde-3-phosphate dehydrogenase protein vaccine against Schistosoma japonicum in mice[J]. Parasitol Res, 2019, 118(7): 2287-2293. DOI:10.1007/s00436-019-06363-1 |
| [17] |
LIU L N, WANG Y H, MIAO L, et al. Combination immunotherapy of MUC1 mRNA Nano-vaccine and CTLA-4 blockade effectively inhibits growth of triple negative breast cancer[J]. Mol Ther, 2018, 26(1): 45-55. DOI:10.1016/j.ymthe.2017.10.020 |
| [18] |
IRONS S L, CHAMBERS A C, LISSINA O, et al. Protein production using the baculovirus expression system[J]. Curr Protoc Protein Sci, 2018, 91: 5.5.1-5.5.22. |
| [19] |
SCHNEIDER H, SMITH X, LIU H B, et al. CTLA-4 disrupts ZAP70 microcluster formation with reduced T cell/APC dwell times and calcium mobilization[J]. Eur J Immunol, 2008, 38(1): 40-47. DOI:10.1002/eji.200737423 |
| [20] |
周艳, 董文. CTLA-4单克隆抗体——靶向被动免疫治疗肿瘤[J]. 临床肿瘤学杂志, 2013, 18(3): 268-272. ZHOU Y, DONG W. CTLA-4 monoclonal antibody-targeted passive immunotherapy for tumor[J]. Chinese Clinical Oncology, 2013, 18(3): 268-272. DOI:10.3969/j.issn.1009-0460.2013.03.018 (in Chinese) |
| [21] |
CARLINO M S, LARKIN J, LONG G V. Immune checkpoint inhibitors in melanoma[J]. Lancet, 2021, 398(10304): 1002-1014. DOI:10.1016/S0140-6736(21)01206-X |
| [22] |
OWONIKOKO T K, PARK K, GOVINDAN R, et al. Nivolumab and ipilimumab as maintenance therapy in extensive-disease small-cell lung cancer: CheckMate 451[J]. J Clin Oncol, 2021, 39(12): 1349-1359. DOI:10.1200/JCO.20.02212 |
| [23] |
LEACH D R, KRUMMEL M F, ALLISON J P. Enhancement of antitumor immunity by CTLA-4 blockade[J]. Science, 1996, 271(5256): 1734-1736. DOI:10.1126/science.271.5256.1734 |
| [24] |
ZHENG P, WU Y, GUO Y, et al. B7-CTLA4 interaction enhances both production of antitumor cytotoxic T lymphocytes and resistance to tumor challenge[J]. Proc Natl Acad Sci U S A, 1998, 95(11): 6284-6289. DOI:10.1073/pnas.95.11.6284 |
| [25] |
HURWITZ A A, FOSTER B A, KWON E D, et al. Combination immunotherapy of primary prostate cancer in a transgenic mouse model using CTLA-4 blockade[J]. Cancer Res, 2000, 60(9): 2444-2448. |
| [26] |
YANG Y, DONG M L, HAO X L, et al. Revisiting cellular immune response to oncogenic Marek's disease virus: the rising of avian T-cell immunity[J]. Cell Mol Life Sci, 2020, 77(16): 3103-3116. DOI:10.1007/s00018-020-03477-z |
| [27] |
唐春莲, 王金松. CTLA-4单克隆抗体的研究进展[J]. 细胞与分子免疫学杂志, 2013, 29(7): 769-771. TANG C L, WANG J S. Research progress of CTLA-4 monoclonal antibody[J]. Chinese Journal of Cellular and Molecular Immunology, 2013, 29(7): 769-771. (in Chinese) |
| [28] |
ROTTE A. Combination of CTLA-4 and PD-1 blockers for treatment of cancer[J]. J Exp Clin Cancer Res, 2019, 38(1): 255. DOI:10.1186/s13046-019-1259-z |
| [29] |
CHAMBERS A C, AKSULAR M, GRAVES L P, et al. Overview of the baculovirus expression system[J]. Curr Protoc Protein Sci, 2018, 91: 5.4.1-5.4.6. |
| [30] |
YAO Q X, FISCHER K P, MOTYKA B, et al. Identification of cytotoxic T-lymphocyte-associated antigen-4 (CTLA-4) isoforms in the Pekin duck[J]. Dev Comp Immunol, 2010, 34(7): 749-758. DOI:10.1016/j.dci.2010.02.004 |
| [31] |
WANG C, HAO C F, DAI K, et al. Occupational low-dose radiation affects the expression of immune checkpoint of medical radiologists[J]. Int J Environ Res Public Health, 2022, 19(12): 7105. DOI:10.3390/ijerph19127105 |
(编辑 范子娟)



