2. 四川省畜牧科学研究院, 成都 610066;
3. 动物遗传育种四川省重点实验室, 成都 610066
2. Sichuan Animal Science Academy, Chengdu 610066, China;
3. Animal Breeding and Genetics Key Laboratory of Sichuan Province, Chengdu 610066, China
斯氏艾美耳球虫(Eimeria stiedae)是对兔致病性强、危害性大的虫种,主要危害断奶后至3月龄间的幼兔,可引发严重的肝组织病变和功能障碍,严重者可导致死亡,对养兔业造成极大的经济损失[1-3]。目前兔球虫病的防控仍以化学药物为主要手段,但药物防控存在易产生耐药性、食品中药物残留以及环境污染等问题,寻求免疫学方向的防控策略具有重要意义。目前已报道物理方法致弱的斯氏艾美耳球虫弱毒株[4],但尚无商业化的兔球虫疫苗。借助基因工程手段来研制安全、有效的兔球虫新型疫苗是一个很有吸引力的选择。其中,重组亚单位疫苗的表达系统较为成熟,且具有生产周期短、产量高和生产成本相对较低等优点,而筛选具有良好免疫保护效果的重组蛋白,无疑是重组亚单位疫苗研制的关键[5]。
三磷酸甘油醛脱氢酶(GAPDH)是催化糖酵解反应中的一个关键酶,该酶在真核生物以及原核生物中广泛存在,表达水平高[6-7]。文献报道日本血吸虫[8-11]、曼氏血吸虫[12-14]、旋盘尾丝虫[15-16]、捻转血矛线虫[17]和鸡巨型艾美耳球虫[18]的GAPDH可作为候选疫苗抗原。
目前有关兔球虫的GAPDH尚无研究报道。本研究基于实验室测定的斯氏艾美耳球虫转录组数据,筛选出Es-GAPDH,克隆测序后采用相对荧光定量PCR分析了该基因在不同发育阶段的转录水平,原核表达获得了重组蛋白rEs-GAPDH,通过动物试验评价了rEs-GAPDH的免疫保护效果,为兔斯氏艾美耳球虫重组亚单位疫苗的研制奠定基础。
1 材料与方法 1.1 试验用虫株及动物斯氏艾美耳球虫四川株由四川农业大学动物寄生虫病研究中心提供。
四川农业大学动物寄生虫病研究中心繁育的无球虫新西兰兔42只(雌雄各半),体重为1.1 kg±0.2 kg。幼兔于18日龄断奶,使用人用婴儿奶粉饲喂至30日龄后,提供高温处理且不含抗球虫药物的兔饲料,每日定时和定量饲喂。
1.2 主要试剂与仪器限制性内切酶(EcoRI/SalI)购自宝生物工程(大连)有限公司;HRP标记羊抗兔IgG抗体购自武汉博士德生物工程有限公司;兔谷丙转氨酶ELISA试剂盒,兔谷草转氨酶ELISA试剂盒购自北京RXbio生物工程有限公司;Rabbit IFN-γ ELISA development kit (HRP)试剂盒,购自瑞典Mabtech公司;Rabbit IL-2、IL-4、IL-17、IL-10 ELISA Kit试剂盒,Rabbit Transforming Growth factor β1, TGF-β ELISA Kit试剂盒,购自武汉CUSABIO BIOTECH公司。
PCR仪:Mastercycler Gradient,eppendorf,美国;荧光定量PCR仪:LightCycler®96,Roche,瑞士;中高压层析系统:NGCTM10,Bio-Rad,美国;McMaster计数板,富士平工业株式会社,日本;数字病理扫描仪:VS120-S6-W,OLYMPUS,日本。
1.3 斯氏艾美耳球虫不同阶段虫体收集、总RNA的提取和反转录参考文献[19],以8×104个卵囊·只-1的剂量经口感染35日龄无球虫幼兔4只,分别于感染后10 d收集裂殖生殖阶段虫体,感染后13 d收集配子生殖阶段虫体,感染后28 d收集未孢子化卵囊,于液氮中保存。同时,将收集的部分未孢子化卵囊进行培养发育至孢子化卵囊后,置于4 ℃保存。取适量各阶段虫体用RNA抽提试剂盒分别进行RNA抽提,产物保存于-80 ℃超低温冰箱;取适量各阶段虫体总RNA,用反转录试剂盒在PCR仪上进行反转录,产物cDNA于-80 ℃超低温冰箱保存。
1.4 Es-GAPDH克隆、生物信息学分析及不同发育阶段转录水平分析1.4.1 Es-GAPDH克隆测序与生物信息学分析 利用BLAST检测,结合转录组数据筛选出Es-GAPDH,利用生物信息学软件对氨基酸序列进行分析,使用ExPASy ProtParam工具预测分子量(MW)和等电点(pI),使用SignalP5.0 Server和TMHMM Server v. 2.0.预测该基因信号肽和跨膜区的存在。
1.4.2 qRT-PCR引物设计和反应 根据目的基因序列设计特异性qRT-PCR引物并参考GenBank中公布的Es-18S rRNA(HQ173 837.1)基因序列结合转录组数据库中的Es-β-actin的基因序列设计内参基因的特异性qRT-PCR引物(表 1)。
|
|
表 1 目的基因和内参基因的qPCR引物 Table 1 The qPCR primers of genes and internal reference genes |
采用实时定量聚合酶链反应(qRT-PCR)技术检测目的基因在斯氏艾美耳球虫不同发育阶段的转录水平,参考GenBank中公布的Es-18S rRNA(HQ173 837.1)基因序列结合转录组数据库中的Es-β-actin、Es-GAPDH为内参基因进行比较。采用2-ΔΔCt法对斯氏艾美耳球虫各发育阶段的相对转录量进行分析。试验结果以3次平行重复的“平均值±标准差”的形式展示,各组之间的统计学差异通过SPSS Statistics 20.0单因素方差分析进行。
1.5 Es-GAPDH原核表达、纯化、免疫印迹分析和蛋白稳定性1.5.1 Es-GAPDH的表达与纯化 用Primer Premier 5.0软件设计引物(上游5′-CGGAATTCATGGCTTGCAAATTGGG-3′,EcoRI;下游5′-GCGTCGACTCATTTGCACCTGCTTG-3′,SalI),取虫体cDNA混合液为模板,对目的片段进行PCR扩增。将目的条带与pMD19-T载体连接,将目的基因经测序鉴定为阳性的菌液进行扩大培养,提取T克隆质粒,和pET32a(+)质粒一起双酶切20 min,酶切后产物在琼脂糖凝胶进行电泳,回收的目的片段酶切产物进行T4连接,并将测序正确的质粒,转入表达感受态BL21(DE3)中,扩培出1 L的阳性克隆菌液。37 ℃、130 r·min-1条件下培养至菌液OD590 nm为0.6左右,加入IPTG 8 mL,并于18~22 ℃、110 r·min-1诱导表达12 h。随后进行可溶性分析,将菌液7 000 r·min-1离心10 min,于菌体沉淀中加入20 mL裂解液(20 mmol·L-1 Tris-Cl,pH=8.0)重悬菌体,反复冻融3次后超声破碎。将超声产物7 000 r·min-1离心10 min,收集上清并先后使用2、4、6、8 mol·L-1尿素溶解沉淀。各取40 μL上清和沉淀进行SDS-PAGE判断原核表达重组蛋白的可溶性。最后采用镍离子亲和层析的方法纯化重组蛋白,SDS-PAGE分析纯化效果。
1.5.2 rEs-GAPDH的免疫印迹分析 一抗为0.01 mol·L-1 PBS稀释至1∶200斯氏艾美耳球虫阳性兔血清,二抗为1∶1 000稀释辣根过氧化物酶(HRP)标记的羊抗兔抗体(武汉博士德),按常规方法进行免疫印迹分析。
1.5.3 rEs-GAPDH的稳定性试验 选择纯化后的重组蛋白rEs-GAPDH,分别保存于4、-20和-80 ℃,每周于固定时间分别制样,持续7周。使用聚丙烯酰胺凝胶电泳(SDS-PAGE)法对比7周的蛋白浓度变化。
1.6 斯氏艾美耳球虫rEs-GAPDH对兔的免疫保护效果观察1.6.1 分组和免疫程序 本试验中,42只45日龄的无球虫幼兔(雌雄各半)分组情况如下(表 2)。免疫方式为颈部皮下注射,免疫接种2次,两次免疫时间间隔14 d。加强免疫后14 d, 除空白对照组外,其余各组实验兔分别经口感染1×104个斯氏艾美耳球虫孢子化卵囊。
|
|
表 2 实验动物分组和免疫程序 Table 2 Groups of Experimental animal and immunization program |
1.6.2.1 临床观察 首免、二免和攻虫后每天观察各实验组兔的临床表现。
1.6.2.2 增重情况、相对增重率和料肉比 免疫后攻虫前增重=攻虫前体重-首免前体重;攻虫后增重=剖杀前体重-攻虫前体重;相对增重率=(试验各组平均攻虫后增重/不感染不免疫平均攻虫后增重)×100%;料肉比=(饲喂前饲料总量-剖杀后剩余饲料总量)/感染后增重总量。
1.6.2.3 肝指数和卵囊减少率 试验兔宰杀前进行称重,剖检后观察并记录肝的重量。肝指数=肝重/体重×100%。参考动物球虫病诊断技术国家标准(GB/T18647—2020),剖检时收集适量直肠粪样进行卵囊排出量的定量检查,统计各组平均每克粪便卵囊数(oocyst per gram, OPG),并计算卵囊减少率。卵囊减少率=[(攻虫对照组OPG-免疫组OPG)/攻虫对照组OPG]×100%。
1.6.2.4 生化指标、细胞因子及抗体水平的检测 从首免前开始,到攻虫后直至剖杀,每周定时采集实验兔血清。分别使用相应的ELISA试剂盒,对生化指标丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和细胞因子(IL-2、IL-4、IL-10、IL-17、TGF-β、IFN-γ)进行测定,根据试剂盒说明书进行操作。使用基于重组蛋白rEs-GAPDH的间接ELISA方法检测实验兔血清中特异性IgG抗体水平(蛋白稀释比1∶100,二抗稀释比1∶3 000)。
1.6.2.5 病理切片 剖杀后摘取肝制作病理切片,进行HE染色,按照常规操作进行[20]。使用数字病理扫描仪对肝组织切片进行扫描拍摄。
1.7 数据处理使用GraphPad软件(GraphPad Prism版本5.0)制作生成所有图形。使用SPSS Statistics 20.0确定组间的统计学差异,对每个因变量(肝指数、平均增重、卵囊排出量、料肉比)的重复测量进行单因素方差分析(ANOVA),数据用“平均数±标准差(SD)”表示,P<0.05认为差异有显著性。
2 结果 2.1 Es-GAPDH克隆、生物信息学分析及不同发育阶段转录水平分析克隆测序的Es-GAPDH与转录组数据中的Es-GAPDH序列相似性为100%(GenBank:OK337683)。Es-GAPDH序列包含1 020 bp的开放阅读框,编码339个氨基酸,预测相对分子量为36.80 ku,计算等电点(pI)为7.97。将Es-GAPDH氨基酸序列与堆形艾美耳球虫、柔嫩艾美耳球虫、巨型艾美耳球虫、毒害艾美耳球虫、隐孢子虫、弓形虫和贝诺孢子虫的GAPDH氨基酸序列进行多序列比对,可见Es-GAPDH与其他原虫氨基酸同源性均在70%以上,与鸡堆型艾美耳球虫(GenBank:XP_013 251 305.1)氨基酸相似性最高,达73.16%(图 1)。

|
E.a:鸡堆型艾美耳球虫;E.m:鸡巨型艾美耳球虫;C.m:火鸡隐孢子虫;E.t:鸡柔嫩艾美耳球虫;T.g:弓形虫;E.n:鸡毒害艾美耳球;B.b:牛贝氏贝诺孢子虫。Eimeria stiedae氨基酸序列标注为:红色方块:α螺旋; 绿色箭头:β折叠; 黑色方框:B抗原表位 E.a: Eimeria acervuline; E.m: Eimeria maxima; C.m: Cryptosporidium meleagridis; E.t: Eimeria tenella; T.g: Toxoplasma gondii; E.n: Eimeria necatrix; B.b: Besnoitia besnoiti. Eimeria stiedae amino acid sequences are labeled as follows: red squares: alpha helix; green arrows: beta fold; black boxes: B antigen epitopes 图 1 Es-GAPDH与其他原虫GAPDH的氨基酸序列比对 Fig. 1 Amino acid sequence comparison of Es-GAPDH with other protozoan GAPDH |
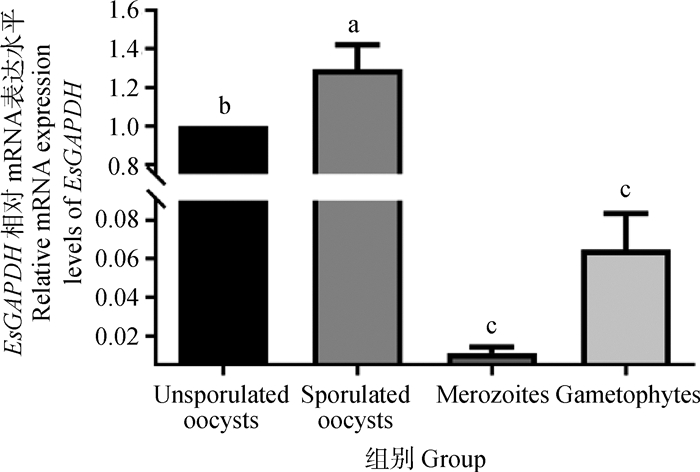
Es-GAPDH在斯氏艾美耳球虫4个发育阶段均有转录,且转录水平存在差异,其中Es-GAPDH在孢子化阶段相对于其他阶段转录水平最高,且差异极显著(P<0.01,图 2)。
|
横坐标的发育阶段由左至右依次为未孢子化卵囊、孢子化卵囊、裂殖体和配子体。不同的字母标注的数据间存在显著差异(P < 0.05),相同字母标注的数据间无显著差异(P>0.05) Development stages of the abscissa from left to right are unsporulated oocysts, sporulated oocysts, merozoites, gametophytes, respectively. There is a statistically significant difference between data labeled with different letters (P < 0.05), and there is no statistically significant difference between data labeled with the same letters (P>0.05) 图 2 Es-GAPDH在斯氏艾美耳球虫不同发育阶段的相对表达量 Fig. 2 Relative mRNA expression levels of Es-GAPDH at different developmental stages of Eimeria stiedae |
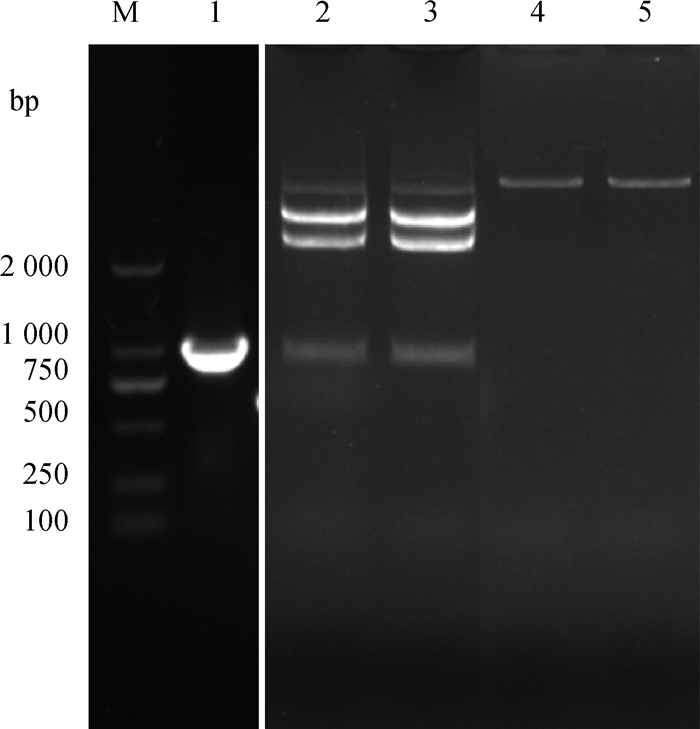
以斯氏艾美耳球虫cDNA为模板扩增出Es-GAPDH基因,以测序成功的菌液扩培后提取质粒,将基因克隆菌的质粒与pET32a(+)质粒一起在37 ℃条件下进行双酶切30 min(图 3)。并成功与pET-32a(+)载体连接,经转化、涂板及单菌落鉴定,成功构建了pET-32a(+)-Es-GAPDH。
|
泳道:M. DNA分子质量标准; 1. 基因Es-GAPDH扩增结果;2~3. 基因克隆菌质粒的酶切;4~5. pET32a(+)载体质粒的酶切 Lane: M. DNA marker; 1. Amplification of Es-GAPDH; 2-3. Enzymatic cleavage of Es-GAPDH; 4-5. Enzymatic cleavage of gene cloning bacterial plasmid. 图 3 基因Es-GAPDH的克隆 Fig. 3 Cloning of the gene Es-GAPDH |
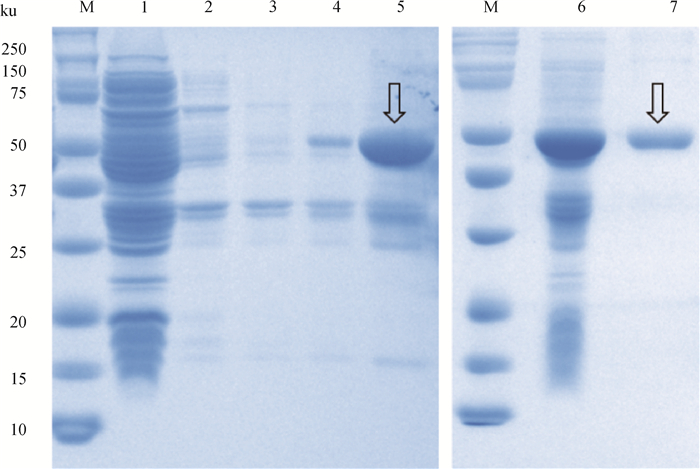
重组蛋白rEs-GAPDH在诱导剂IPTG终浓度为1.0 mmol·L-1,37 ℃诱导表达12 h(130 r·min-1)的条件下表达量最高,大小在55 ku左右,且大部分表达在包涵体。重组蛋白经镍离子亲和层析后的纯化效果良好,无明显杂条带(图 4)。同时,rEs-GAPDH能识别阳性兔血清(图 5),具有良好的免疫反应性。
|
泳道:M. 蛋白质分子量标记(ku);1. 重组菌诱导表达后菌体裂解物上清;2~5. 菌体裂解物先后溶解于2、4、6、8 mol·L-1尿素;6. 诱导表达后未经纯化的rEs-GAPDH;7. 经纯化的rEs-GAPDH Lanes: M. Protein molecular weight markers (in ku); 1. Soluble protein; 2-5. Inclusion body in 2, 4, 6, 8 mol·L-1 urea; 6. Non-purified rEs-GAPDH; 7. Purified rEs-GAPDH 图 4 重组蛋白rEs-GAPDH的可溶性分析 Fig. 4 SDS-PAGE of solubility analysis of recombinant protein rEs-GAPDH |

|
泳道:M. 蛋白质分子量标记(ku);1. 经纯化的rEs-GAPDH与自然感染斯氏艾美耳球虫兔血清识别反应;2. 经纯化的rEs-GAPDH与健康兔血清识别反应 Lanes: M. Protein molecular weight markers (in ku); 1. Purified rEs-GAPDH detected by serum from naturally infested with Eimeria stiedae; 2. Purified rEs-GAPDH detected by healthy rabbit's serum 图 5 纯化后重组蛋白rEs-GAPDH的免疫印迹 Fig. 5 Western blot of purified recombinant protein |
纯化后重组蛋白各加5%的甘油,混匀后分别保存于-80、-20、4 ℃ 3种温度下,持续观察7周。由SDS-PAGE结果可知,重组蛋白在7周时间内未出现降解(图 6),重组蛋白rEs-GAPDH的稳定性良好。

|
泳道:M. 蛋白质分子量标记(ku);1~7. 保存于-80 ℃下纯化后蛋白0~7周的制样;8~14. 保存于-20 ℃下纯化后蛋白0~7周的制样;15~21. 保存于4 ℃下纯化后蛋白0~7周的制样 Lanes: M. Protein molecular weight markers (in ku); 1-7. stored at -80℃ for 0-7 weeks of purified protein preparation; 8-14. Stored at -20 ℃ for 0-7 weeks of purified protein preparation; 15-21. Sored at 4 ℃ for 0-7 weeks of purified protein preparation 图 6 纯化后重组蛋白rEs-GAPDH在不同温度下0~7周制样的SDS-PAGE图 Fig. 6 SDS-Page of purified recombinant protein rEs-GAPDH samples prepared at different temperatures for 0-7 weeks |
2.4.1 临床表现 在攻虫前各组实验兔体况表现正常,在经口感染1×104个·只-1孢子化卵囊后,前2周未有明显症状,感染后第3周不免疫攻虫组出现兔肝球虫病典型症状:食欲减退,精神沉郁,喜卧;消瘦,腹泻;黏膜黄染,腹围增大;而rEs-GAPDH免疫组兔的肝球虫病临床症状不明显,感染后第3周偶有食欲稍减退,腹围略有增大。经口攻虫感染后各试验组兔均未出现死亡。
2.4.2 相对增重 初次免疫、二次免疫和攻虫时各组体重无明显差异。感染21 d后,空白对照组平均增重为(536.88±48.32)g,不免疫攻虫组平均增重(234.00±47.91)g,Trx-His-S tag对照组平均增重(248.75±49.12)g,Quil-A saponin对照组平均增重(258.25±21.78)g,这4组实验兔的平均增重间呈现显著差异(P<0.05)。rEs-GAPDH免疫组平均增重(375.00±57.30)g,与空白对照组和攻虫对照组之间存在明显差异(P<0.05)。其中,不免疫攻虫组的相对增重率仅为空白对照的43.59%,感染后2~3周甚至有个别试验兔体重出现负增长;而rEs-GAPDH免疫组的相对增重率为69.85%(表 3)。
|
|
表 3 rEs-GAPDH针对斯氏艾美耳球虫感染的保护效果评价 Table 3 Protective effects of rEs-GAPDH against Eimeria stiedae infection under different evaluation indicators |
2.4.3 卵囊排出量 感染后21 d进行卵囊排出量的检查,空白对照组的粪便样本中未检查到斯氏艾美耳球虫卵囊;不免疫攻虫组平均OPG达1.49×105,Trx-His-S tag对照组平均OPG达1.48×105,Quil-A saponin对照组平均OPG达1.47×105,均不存在显著差异(P>0.05)。而rEs-GAPDH免疫组的平均OPG为0.19×105,与不免疫攻虫组相比显著减少(P<0.05),免疫组的卵囊减少率达87.09%(表 3)。
2.4.4 料肉比和肝指数 不免疫攻虫组、Trx-His-S tag对照组和Quil-A saponin对照组间的平均肝指数差异不显著。而rEs-GAPDH免疫组的平均肝指数为3.10,与各个对照组之间存在显著差异(表 3)。同时,自攻虫起至攻虫后21 d,rEs-GAPDH免疫组料肉比为4.48∶1,与各个对照组之间存在显著差异(表 3)。
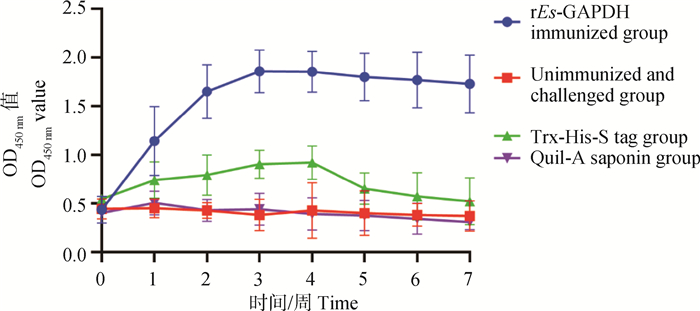
2.4.5 血清中特异性IgG抗体水平的变化 免疫接种后,rEs-GAPDH免疫组实验兔的血清平均特异性IgG抗体水平升高,其平均水平极显著的高于不免疫攻虫组、Trx-His-S tag对照组和Quil-A saponin对照组的血清平均特异性IgG抗体水平(P<0.01)。rEs-GAPDH免疫组的血清平均特异性IgG抗体水平在第二次免疫后达到最高水平,为1.86,抗体水平见顶后略有下降,但在攻虫3周后仍可以保持高水平(图 7)。
|
实验兔分别在第0和2周进行首次免疫和加强免疫。在第4周,除空白组外,每只实验兔口服感染斯氏艾美耳球虫孢子化卵囊1×104个 The rabbits were immunized at week 0 and boostered with same dose at week 2. Except for the blank control group, each rabbit was orally inoculated with 1×104 E. stiedae sporulated oocysts at week 4 图 7 实验兔血清中特异性IgG抗体水平的变化情况 Fig. 7 Variation of specific IgG antibody levels in sera of immunized rabbits |
2.4.6 血清中ALT/AST值 攻虫3周后,可见免疫组和对照组的ALT值无统计学差异,但AST值存在显著差异;不免疫攻虫组的AST值均高于Trx-His-S tag、Quil-A saponin对照组和rEs-GAPDH免疫组,差异具有统计学意义(表 4)。
|
|
表 4 实验兔攻虫后3周肝功能数值 Table 4 Liver function of experimental rabbits 3 weeks after challenged with E.stiedaeU·L-1 |
2.4.7 细胞因子 rEs-GAPDH免疫组除IL-17水平无明显变化外,其他细胞因子(IL-2、IFN-γ、IL-4、IL-10和TGF-β)水平均显著高于不免疫攻虫组和Quil-A saponin对照组(图 8)。
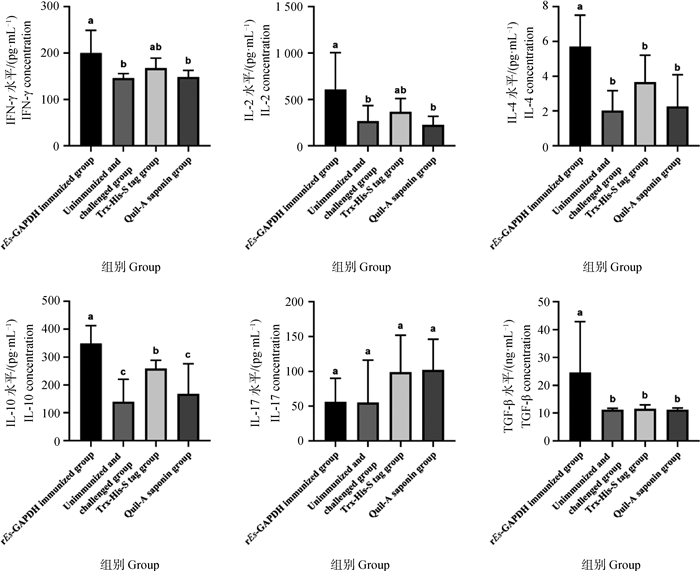
|
不同的字母标注的数据间存在显著差异(P < 0.05),相同字母标注的数据间不存在显著差异(P>0.05) There is a statistically significant difference between data labeled with different letters (P < 0.05), and there is no statistically significant difference between data labeled with the same letters (P>0.05) 图 8 两次免疫后实验兔血清中IFN-γ、IL-2、IL-4、IL-10、IL-17、TGF-β的变化情况 Fig. 8 The changes of IFN-γ, IL-2, IL-4, IL-10, IL-17 and TGF-β in serum of experimental rabbits after two immunizations |
2.4.8 剖解病变及组织病理学 剖检发现空白对照组肝健康,大小正常无病变。不免疫攻虫组出现兔肝球虫病典型病理变化:肝充血肿胀,挤占大部分腹内空间,且表面布满白黄色豆状结节;胆囊扩张,充满黄色渗出物。rEs-GAPDH免疫组病变较轻微,肝肿胀不明显,有一定数量的粟粒状或豆状结节,部分有少许泡状结节。
使用数字病理扫描仪对实验兔的肝组织切片进行扫描拍摄,可见空白对照组肝切片未见明显异常,胆管大小匀称,结构完整,管壁的胆管单层柱状上皮细胞排列整齐有序,肝细胞呈放射排列,结构清晰完整,可见明显的红染胞质和深色细胞核(图 9a~b)。
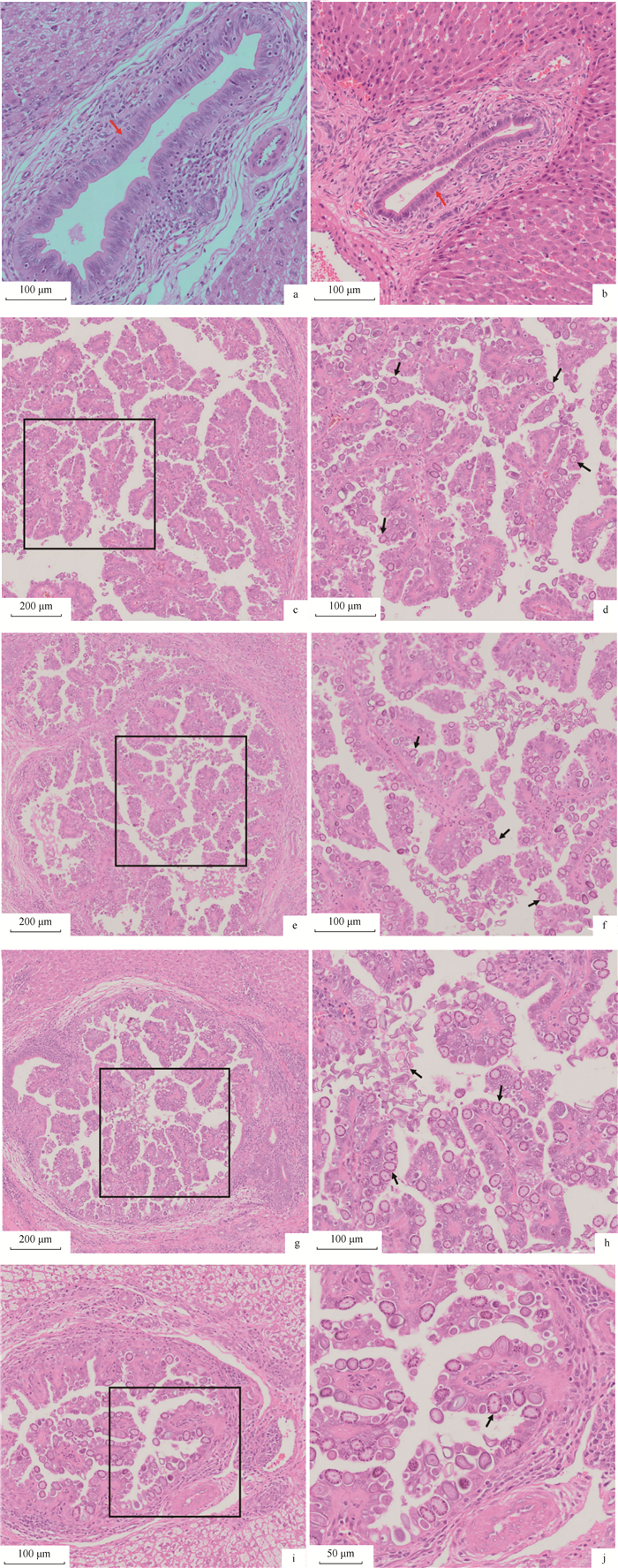
|
a~b.空白对照组; c~d.不免疫攻虫组; e~f.Quil-A saponin对照组; g~h.Trx-His-S tag对照组; i~j.rEs-GAPDH免疫组。d、f、h、j分别为c、e、g、i方框内的放大图。红色箭头.排列整齐有序的胆管上皮细胞; 黑色箭头.不同发育阶段的虫体 a-b. Unimmunized and unchallenged group; c-d. Unimmunized and challenged group; e-f. Quil-A saponin group; g-h. Trx-His-S tag group; i-j. rEs-GAPDH immunization group. d, f, h, and j are enlarged views in boxes c, e, g, and i respectively. Red arrows. Neatly arranged and ordered bile duct epithelial cells; black arrows. Worms at different developmental stages 图 9 对照组和免疫组的实验兔肝组织病理切片(HE染色) Fig. 9 Pathological sections of the liver of control and immunized rabbits (HE staining) |
不免疫攻虫组的试验兔肝组织则明显受到破坏,尤其是胆管上皮细胞排列紊乱,结构支离破碎,有大量炎性细胞浸润。胆管中充斥着不同发育阶段的虫体:孢子囊、裂殖体、配子体等,它们正不断侵蚀肝细胞(图 9c~h)。其中,rEs-GAPDH免疫组的肝组织也受到一定程度的破坏,可见胆管中存在各阶段虫体,使胆管内壁扩张。但相较其余攻虫组,虫体数量较少,胆管上皮细胞被破坏程度较低(图 9i~j)。说明实验兔经重组蛋白免疫后,对于斯氏艾美耳球虫具有一定保护作用。
3 讨论随着科技发展,考虑到生产活疫苗的成本较高,基因工程苗逐渐成为研究热门,因其具有安全稳定、易于大规模生产、生产成本较低的优势。兔球虫基因工程苗的研究主要集中在核酸疫苗[21]、活载体疫苗[22-23]和重组亚单位疫苗[24-25]上,而基因工程苗研究的关键在于筛选具有良好免疫保护作用的候选抗原。
三磷酸甘油醛脱氢酶(GAPDH)除了在糖酵解反应中起到关键作用外,还具有其他多种功能[26-27]。事实上,已经有许多物种的GAPDH被证明存在于细胞表面,它们与基质蛋白结合,调节宿主免疫反应,在毒力和表面定位中发挥作用,引发了人们对于GAPDH作为疫苗靶标基因的兴趣[28-30]。最近有研究报道在鸡的柔嫩艾美耳球虫(Eimeria tenella)子孢子感染过程中,宿主的GAPDH对子孢子入侵的过程起到正向调控,这说明鸡球虫子孢子入侵过程中可能会利用宿主GAPDH为其提供能量[31]。同时,已知包括恶性疟原虫(Plasmodium falciparum)在内的几种致病原虫不存在三羧酸循环,只依赖糖酵解产生能量,其代谢过程所需的ATP完全来自糖酵解反应[32]。还有研究人员鉴定了3种多肽,它们与Kupffer细胞(一种排列在肝血管上的巨噬细胞类型细胞)表面的CD68结合,从而抑制子孢子穿越,且这种抑制作用不会与宿主本身的GAPDH发生交叉反应[33]。人们继而发现这些Kupffer细胞多肽的抗体可以识别子孢子表面的Pf-GAPDH。同时,研究者进一步通过试验证明了疟原虫子孢子GAPDH是CD68的配体,这两者的相互作用在抑制子孢子穿越和肝感染中起到关键作用[34]。来自其他病原体的GAPDH也已被证明是宿主细胞识别的配体,因此被评估为疫苗候选基因[30]。本研究通过转录水平分析,发现Es-GAPDH主要在斯氏艾美耳球虫孢子化卵囊阶段转录水平最高,可能是GAPDH催化产生ATP,为球虫子孢子入侵宿主提供能量。同时,GAPDH作为子孢子的表面抗原,可被宿主细胞识别,引起免疫反应。本研究利用动物试验证明了重组蛋白rEs-GAPDH免疫实验兔能够有效抵抗斯氏艾美耳球虫的感染,卵囊减少率达87.09%,为兔球虫疫苗的研制提供了候选抗原。
细胞免疫在预防艾美耳球虫感染的保护性免疫反应中发挥着关键作用[35]。鸡体内的IFN-γ可以通过抑制鸡球虫子孢子的生长发育、参与抗原呈递等过程增强宿主的抗球虫感染能力[36]。IL-2也是参与细胞免疫的主要细胞因子,对球虫子孢子和裂殖子均产生反应[37-38]。抑制鸡体内的IL-2产生,鸡抵抗球虫的能力会下降[39]。IL-4、IL-10是介导Th2型反应的细胞因子,在弓形虫感染中,它们能够降低炎症反应,减少宿主的病理变化[40]。鸡巨噬细胞面对鸡柔嫩艾美耳球虫刺激时,会产生IL-10以平衡过度强烈的炎症反应,避免宿主产生过量的病理损伤[41]。TGF-β是一种抗炎性的细胞因子,参与修复受损伤的黏膜上皮细胞,降低宿主的炎性反应[42]。IL-17是一种新鉴定的细胞因子,发现在鸡球虫感染期间,IL-17在盲肠等组织显著提高,表明它能在球虫免疫反应中发挥作用[43]。本研究中检测了细胞因子(IL-2、IL-4、IL-10、IL-17、TGF-β、IFN-γ),除IL-17的浓度水平与其余攻虫组无显著差异外,免疫组其余细胞因子水平都存在统计学差异,说明免疫组的重组蛋白能引发细胞因子水平的变化,IFN-γ、IL-2等细胞因子浓度的上调,可能在抗斯氏艾美耳球虫感染的过程中起到了一定作用。
研究表明兔球虫子孢子移行时通过血液循环进入肝,故而在兔球虫免疫应答中,体液免疫也应当被考虑[44]。本研究中检测到免疫组的特异性IgG抗体水平较对照组显著上升,在攻虫后仍能维持在较高水平。重组蛋白rEs-GAPDH诱发产生的特异性IgG抗体可能引起宿主的免疫保护作用。
在鸡球虫疫苗研究中,GAPDH已经被证明是鸡的堆型艾美耳球虫(Eimeria acervulina)和巨型艾美耳球虫(Eimeria maxima)的共同抗原[18]。在鸡柔嫩艾美耳球虫、堆型艾美耳球虫、巨型艾美耳球虫分别感染及3种球虫混合感染的情况下呈现出较好的保护效果(ACI>160),其中, 卵囊减少率最高可达79%[45]。而本研究显示, rEs-GAPDH可引发了宿主体内的细胞免疫和体液免疫应答,免疫组的卵囊减少率达87.09%,具有一定免疫保护作用。Es-GAPDH能否成为对多种兔球虫产生共同保护效果的疫苗抗原,未来还可深入研究。
4 结论斯氏艾美耳球虫GAPDH基因在孢子化卵囊阶段转录水平最高。免疫保护试验结果显示,rEs-GAPDH免疫兔后能减少增重损失和卵囊排出,减轻肝组织病变,可以引发宿主体内的细胞免疫和体液免疫应答。表明rEs-GAPDH可以作为斯氏艾美耳球虫基因重组亚单位疫苗的候选抗原。
| [1] |
INDRASANTI D, INDRADJI M, HASTUTI S, et al. Body weight, oocyte elimination and blood profile of rabbit after challenge test using Eimeria stiedai[J]. Anim Prod, 2019, 20(1): 53-59. DOI:10.20884/1.jap.2018.20.1.621 |
| [2] |
DARZI M M, MIR M S, KAMIL S A, et al. Pathological changes and local defense reaction occurring in spontaneous hepatic coccidiosis in rabbits (Oryctolagus cuniculus)[J]. World Rabbit Sci, 2007, 15(1): 23-28. |
| [3] |
YAKHCHALI Y, TEHRANI A. Eimeriidosis and pathological findings in New Zealand white rabbits[J]. J Biol Sci, 2007, 7(8): 1488-1491. DOI:10.3923/jbs.2007.1488.1491 |
| [4] |
赵孝民. γ-射线辐射对兔球虫孢子化卵囊致病性及免疫原性的影响[J]. 山东农业大学学报, 1986, 17(2): 1-10. ZHAO X M. The effects of gamma rays on the pathogenicity and immunogenicity of sporulated oocysts of Eimeria sliedai[J]. Journal of Shandong Agricultural University, 1986, 17(2): 1-10. (in Chinese) |
| [5] |
GUPTA S K, SHUKLA P. Advanced technologies for improved expression of recombinant proteins in bacteria: Perspectives and applications[J]. Crit Rev Biotechnol, 2016, 36(6): 1089-1098. DOI:10.3109/07388551.2015.1084264 |
| [6] |
SIROVER M A. New insights into an old protein: The functional diversity of mammalian glyceraldehyde-3-phosphate dehydrogenase[J]. Biochim Biophys Acta, 1999, 1432(2): 159-184. DOI:10.1016/S0167-4838(99)00119-3 |
| [7] |
SIROVER M A. On the functional diversity of glyceraldehyde-3-phosphate dehydrogenase: Biochemical mechanisms and regulatory control[J]. Biochim Biophys Acta, 2011, 1810(8): 741-751. DOI:10.1016/j.bbagen.2011.05.010 |
| [8] |
WAINE G J, BECKER M, YANG W, et al. Cloning, molecular characterization, and functional activity of Schistosoma japonicum glyceraldehyde-3-phosphate dehydrogenase, a putative vaccine candidate against schistosomiasis japonica[J]. Infect Immun, 1993, 61(11): 4716-4723. DOI:10.1128/iai.61.11.4716-4723.1993 |
| [9] |
TANG C L, YANG J F, PAN Q, et al. Anti-CTLA-4 monoclonal antibody improves efficacy of the glyceraldehyde-3-phosphate dehydrogenase protein vaccine against Schistosoma japonicum in mice[J]. Parasitol Res, 2019, 118(7): 2287-2293. DOI:10.1007/s00436-019-06363-1 |
| [10] |
TANG C L, XIE Y P, YU W H, et al. Effects of regulatory T cells on glyceraldehyde-3-phosphate dehydrogenase vaccine efficacy against Schistosoma japonicum[J]. Acta Trop, 2020, 202: 105239. DOI:10.1016/j.actatropica.2019.105239 |
| [11] |
HUANG W L, GU M J, CHENG W J, et al. Mechanism by which the combination of SjCL3 and SjGAPDH protects against Schistosoma japonicum infection[J]. Parasitol Res, 2021, 120(1): 173-185. DOI:10.1007/s00436-020-06916-9 |
| [12] |
ARGIRO L, KOHLSTÄDT S, HENRI S, et al. Identification of a candidate vaccine peptide on the 37 kDa Schistosoma mansoni GAPDH[J]. Vaccine, 2000, 18(19): 2039-2048. DOI:10.1016/S0264-410X(99)00521-6 |
| [13] |
ARGIRO L, HENRI S, DESSEIN H, et al. Induction of a protection against S.mansoni with a MAP containing epitopes of Sm37-GAPDH and Sm10-DLC.Effect of coadsorbtion with GM-CSF on alum[J]. Vaccine, 2008, 18(19): 2033-2038. |
| [14] |
TALLIMA H, DVO?ÁK J, KAREEM S, et al. Protective immune responses against Schistosoma mansoni infection by immunization with functionally active gut-derived cysteine peptidases alone and in combination with glyceraldehyde 3-phosphate dehydrogenase[J]. PLoS Negl Trop Dis, 2017, 11(3): e0005443. DOI:10.1371/journal.pntd.0005443 |
| [15] |
ERTTMANN K D, KLEENSANG A, SCHNEIDER E, et al. Cloning, characterization and DNA immunization of an Onchocerca volvulus glyceraldehyde-3-phosphate dehydrogenase (Ov-GAPDH)[J]. Biochim Biophys Acta, 2004, 1741(1-2): 85-94. |
| [16] |
STEISSLINGER V, KORTEN S, BRATTIG N W, et al. DNA vaccine encoding the moonlighting protein Onchocerca volvulus glyceraldehyde-3-phosphate dehydrogenase (Ov-GAPDH) leads to partial protection in a mouse model of human filariasis[J]. Vaccine, 2015, 33(43): 5861-5867. DOI:10.1016/j.vaccine.2015.07.110 |
| [17] |
HAN K K, XU L X, YAN R F, et al. Vaccination of goats with glyceraldehyde-3-phosphate dehydrogenase DNA vaccine induced partial protection against Haemonchus contortus[J]. Vet Immunol Immunopathol, 2012, 149(3-4): 177-185. DOI:10.1016/j.vetimm.2012.06.016 |
| [18] |
LIU L R, HUANG X M, LIU J H, et al. Identification of common immunodominant antigens of Eimeria tenella, Eimeria acervulina and Eimeria maxima by immunoproteomic analysis[J]. Oncotarget, 2017, 8(21): 34935-34945. DOI:10.18632/oncotarget.16824 |
| [19] |
李祥瑞, 汪志楷. 斯氏艾美耳球虫生活史的研究[J]. 南京农业大学学报, 1989, 12(2): 97-101. LI X R, WANG Z K. Study on life cycle of Eimeria stiedai[J]. Journal of Nanjing Agricultural University, 1989, 12(2): 97-101. (in Chinese) |
| [20] |
SHEN N X, ZHANG H J, REN Y J, et al. A chitinase-like protein from Sarcoptes scabiei as a candidate anti-mite vaccine that contributes to immune protection in rabbits[J]. Parasit Vectors, 2018, 11(1): 599. DOI:10.1186/s13071-018-3184-y |
| [21] |
田依凡, 赵权, 信彩岩, 等. 斯氏艾美耳球虫Rhomboid基因抗原优势区的筛选与鉴定[J]. 黑龙江畜牧兽医, 2017(3): 156-159. TIAN Y F, ZHAO Q, XIN C Y, et al. Screening and identification of antigenic dominant region of the Rhomboid gene of Eimeria stiedai[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(3): 156-159. (in Chinese) |
| [22] |
孟庆玲, 乔军, 才学鹏, 等. 斯氏艾美耳球虫MIC-5与兔IL-15基因在真核细胞中的共表达[J]. 中国农业科学, 2011, 44(19): 4096-4101. MENG Q L, QIAO J, CAI X P, et al. Co-expression of MIC-5 gene of Eimeria stiedai and rabbit IL-15 in eucaryotic cell line[J]. Scientia Agricultura Sinica, 2011, 44(19): 4096-4101. (in Chinese) |
| [23] |
孟庆玲, 乔军, 才学鹏, 等. 携带兔斯氏艾美耳球虫MIC-5基因减毒鼠伤寒沙门菌活疫苗的安全性、稳定性与免疫原性[J]. 中国兽医学报, 2011, 31(5): 659-662. MENG Q L, QIAO J, CAI X P, et al. Safety, stability and immunogenicity of attenuated Salmonella typhimurium carrying MIC-5 gene of Eimeria stieda[J]. Chinese Journal of Veterinary Science, 2011, 31(5): 659-662. (in Chinese) |
| [24] |
景瑾, 张帅, 仇保丰, 等. 斯氏艾美耳球虫热休克蛋白70基因的克隆及表达分析[J]. 黑龙江畜牧兽医, 2017(4): 11-16. JING J, ZHANG S, QIU B F, et al. Cloning and expression analysis of heat shock protein 70 (HSP70) gene from Eimeria stiedai[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(4): 11-16. (in Chinese) |
| [25] |
罗跃军, 任永军, 白鑫, 等. 斯氏艾美耳球虫重组表面抗原SAG13和SAG14对兔的免疫保护效果初步观察[J]. 畜牧兽医学报, 2022, 53(3): 883-893. LUO Y J, REN Y J, BAI X, et al. Preliminary observation on the immunoprotective effects of recombinant surface antigens SAG13 and SAG14 of Eimeria stiedae in rabbits[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(3): 883-893. (in Chinese) |
| [26] |
TERAO Y, YAMAGUCHI M, HAMADA S, et al. Multifunctional glyceraldehyde-3-phosphate dehydrogenase of Streptococcus pyogenes is essential for evasion from neutrophils[J]. J Biol Chem, 2006, 281(20): 14215-14223. DOI:10.1074/jbc.M513408200 |
| [27] |
JIN H, AGARWAL S, AGARWAL S, et al. Surface export of GAPDH/SDH, a glycolytic enzyme, is essential for Streptococcus pyogenes virulence[J]. mBio, 2011, 2(3): e00068-11. DOI:10.1128/mBio.00068-11 |
| [28] |
LAMA A, KUCKNOOR A, MUNDODI V, et al. Glyceraldehyde-3-phosphate dehydrogenase is a surface-associated, fibronectin-binding protein of Trichomonas vaginalis[J]. Infect Immun, 2009, 77(7): 2703-2711. DOI:10.1128/IAI.00157-09 |
| [29] |
ROSINHA G M S, MYIOSHI A, AZEVEDO V, et al. Molecular and immunological characterisation of recombinant Brucella abortus glyceraldehyde-3-phosphate-dehydrogenase, a T- and B-cell reactive protein that induces partial protection when co-administered with an interleukin-12-expressing plasmid in a DNA vaccine formulation[J]. J Med Microbiol, 2002, 51(8): 661-671. DOI:10.1099/0022-1317-51-8-661 |
| [30] |
PEREZ-CASAL J, POTTER A A. Glyceradehyde-3-phosphate dehydrogenase as a suitable vaccine candidate for protection against bacterial and parasitic diseases[J]. Vaccine, 2016, 34(8): 1012-1017. DOI:10.1016/j.vaccine.2015.11.072 |
| [31] |
王璐, 朱顺海, 赵其平, 等. 宿主GAPDH对柔嫩艾美耳球虫子孢子入侵细胞的影响[J]. 畜牧兽医学报, 2019, 50(10): 2088-2096. WANG L, ZHU S H, ZHAO Q P, et al. Effects of host glyceraldehyde-3-phosphate dehydrogenase on Eimeria tenella sporozoites invasion of cells[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(10): 2088-2096. (in Chinese) |
| [32] |
BRUNO S, MARGIOTTA M, PINTO A, et al. Selectivity of 3-bromo-isoxazoline inhibitors between human and Plasmodium falciparum glyceraldehyde-3-phosphate dehydrogenases[J]. Bioorg Med Chem, 2016, 24(12): 2654-2659. |
| [33] |
CHA S J, PARK K, SRINIVASAN P, et al. CD68 acts as a major gateway for malaria sporozoite liver infection[J]. J Exp Med, 2015, 212(9): 1391-1403. |
| [34] |
CHA S J, KIM M S, PANDEY A, et al. Identification of GAPDH on the surface of Plasmodium sporozoites as a new candidate for targeting malaria liver invasion[J]. J Exp Med, 2016, 213(10): 2099-2112. |
| [35] |
CHAPMAN H D. Milestones in avian coccidiosis research: a review[J]. Poult Sci, 2014, 93(3): 501-511. |
| [36] |
YUN C H, LILLEHOJ H S, CHOI K D. Eimeria tenella infection induces local gamma interferon production and intestinal lymphocyte subpopulation changes[J]. Infect Immun, 2000, 68(3): 1282-1288. |
| [37] |
LI G X, LILLEHOJ E P, LILLEHOJ H S. Interleukin-2 production in SC and TK chickens infected with eimeria tenella[J]. Avian Dis, 2002, 46(1): 2-9. |
| [38] |
MIYAMOTO T, MIN W, LILLEHOJ H S. Kinetics of interleukin-2 production in chickens infected with Eimeria tenella[J]. Comp Immunol Microbiol Infect Dis, 2002, 25(3): 149-158. |
| [39] |
ISOBE T, LILLEHOJ H S. Dexamethasone suppresses T cell-mediated immunity and enhances disease susceptibility to Eimeria mivati infection[J]. Vet Immunol Immunopathol, 1993, 39(4): 431-446. |
| [40] |
GAZZINELLI R T, WYSOCKA M, HIENY S, et al. In the absence of endogenous IL-10, mice acutely infected with Toxoplasma gondii succumb to a lethal immune response dependent on CD4+ T cells and accompanied by overproduction of IL-12, IFN-gamma and TNF-alpha[J]. J Immunol, 1996, 157(2): 798-805. |
| [41] |
蒋保余, 王文青, 曲自刚, 等. 柔嫩艾美耳球虫在鸡巨噬细胞中的培养及子孢子感染巨噬细胞细胞因子的mRNA水平[J]. 动物医学进展, 2020, 41(11): 33-40. JIANG B Y, WANG W Q, QU Z G, et al. Cultivation of Eimeria tenella in chicken macrophages and mRNA levels of macrophage cytokines infected by sporozoites[J]. Progress in Veterinary Medicine, 2020, 41(11): 33-40. (in Chinese) |
| [42] |
ROBINSON P, OKHUYSEN P C, CHAPPELL C L, et al. Transforming growth factor β1 is expressed in the jejunum after experimental Cryptosporidium parvum infection in humans[J]. Infect Immun, 2000, 68(9): 5405-5407. |
| [43] |
MIN W, LILLEHOJ H S. Isolation and characterization of chicken interleukin-17 cDNA[J]. J Interferon Cytokine Res, 2002, 22(11): 1123-1128. |
| [44] |
索勋, 孔繁瑶, 李安兴, 等. 斯氏艾美耳球虫子孢子的移行途径[J]. 畜牧兽医学报, 1994, 25(3): 252-255. SUO X, KONG F Y, LI A X, et al. Migration of the sporozoies of eimeria stiedai (sporozoa: eimeriidae)[J]. Acta Veterinaria et Zootechnica Sinica, 1994, 25(3): 252-255. (in Chinese) |
| [45] |
TIAN L, LI W Y, HUANG X M, et al. Protective efficacy of coccidial common antigen glyceraldehyde 3-phosphate dehydrogenase (GAPDH) against challenge with three Eimeria species[J]. Front Microbiol, 2017, 8: 1245. |
(编辑 范子娟)



