2. 河南科技大学功能微生物与畜禽健康实验室,洛阳 471003;
3. 河南科技大学动物科技学院,洛阳 471003
2. Laboratory of Functional Microbiology and Animal Health, Henan University of Science and Technology, Luoyang 471003, China;
3. College of Animal Science and Technology, Henan University of Science and Technology, Luoyang 471003, China
沙门菌是一类革兰阴性、不形成孢子的兼性厌氧杆菌,在自然界宿主感染谱广泛,可感染鸟类、啮齿动物和人等,在医学、兽医学以及公共卫生学研究中具有重要意义[1]。细菌分泌系统的功能是将分泌性蛋白质或毒素转运到胞外并与其它宿主细胞互作进而发挥作用。截至目前,已经在沙门菌中发现了存在至少5种主要类型的分泌系统,即T1SS、T3SS、T4SS、T5SS和T6SS[2]。其中,T6SS由Pukatzki等[3]于2006年在霍乱弧菌中首次报道,其能够参与霍乱弧菌杀灭阿米巴原虫,并进一步证实该功能需要细菌-变形虫、细胞-细胞接触以及VAS(与毒力相关的分泌)分泌系统参与。此后,在其它革兰氏阴性菌中也相继发现T6SS[4-6]。
近年来,T6SS成为众多学者关注的热点科学问题[7-9]。T6SS最初由IAHP簇(IcmF-associated homologous proteins,IcmF相关同源蛋白)基因组所编码[10],这些基因簇特征是在IcmF同源蛋白附近存在大约15个开放性阅读框(open reading frames,ORFs)编码蛋白,而IcmF与嗜肺军团菌T6SS分泌相关[11]。IHAP在不同细菌中呈现出一定规律性遗传结构,但不同细菌中相关系统基因之间同源性较低,阻碍了新T6SS位点鉴定。人们利用计算机模拟分析出由13种保守蛋白质构成T6SS核心组分[12],这些组分均包含独特的同源蛋白质簇,其中大部分是T6SS所特有[13]。此外,T6SS基因座中还存在15个保守辅助蛋白,包括特定的转录和转录后调节因子等[12]。
有研究证实,T6SS在沙门菌感染期间被激活,是导致沙门菌发病的重要因素[14]。T6SS与沙门菌多种生物学功能密切相关,广泛参与细菌黏附、致细胞毒性、生物被膜形成以及在巨噬细胞中持续性存活等生物学过程[15-17]。另外,T6SS还在沙门菌持续性感染过程中发挥关键作用,Monack团队[18]研究发现沙门菌SPI-6所编码的T6SS对鼠伤寒沙门菌在小鼠肠道中竞争性优势定殖至关重要,并且优势是由T6SS依赖方式杀死其它共生细菌所形成。进一步研究发现,在此过程中沙门菌利用其T6SS核心组分-溶血素共调节蛋白1(hemolysin-coregulated protein,Hcp1)来发挥功能,Hcp1能够与其自身抗菌酰胺酶4(type Ⅵ amidase effector 4,Tae4)发生特异性相互作用,而这类酰胺酶效应蛋白可以水解肠道其它共生细菌肽聚糖进而杀死竞争细菌。对于沙门菌自身来说,其基因组能够编码抗菌蛋白Tae4的免疫蛋白4(type Ⅵ amidase immunity 4,Tai4),二者构成效应蛋白-免疫蛋白对复合物,Tae4-Tai4蛋白复合物晶体结构研究发现,Tai4能够插入Tae4的催化中心,Tae4活性中心loop区在结合Tai4之后,由开放状态变成了闭合状态,进而屏蔽了底物进入催化中心通道,从而保护自身不被Tae4伤害[19]。在都柏林沙门菌SPI-22编码的T6SS中也鉴定出一组效应蛋白-免疫蛋白对复合物(TseV1-4和TsiV1-4),具有和Tae4-Tai4相类似的杀菌机制[7]。然而,在此过程中沙门菌是如何利用Hcp1和Tae4介导的相互作用将毒性蛋白注射至其它细菌中仍不清楚。因此,本文对沙门菌T6SS组装、基因组结构特征及其相关的分泌调控网络等进行综述,旨在为进一步研究T6SS在沙门菌致病过程中作用及其调控的分子机制提供理论指导。
1 沙门菌T6SS的组装细菌分泌蛋白质以促进其与周围环境相互作用。在革兰阴性菌中,蛋白质跨细胞膜运输通常需要使用细胞包膜内特殊分泌装置,其中一个途径是T6SS。在许多细菌种类中,T6SS是一种通过细菌双膜延伸的分泌纳米机器,其广泛存在于绝大多数革兰阴性菌,如沙门菌、大肠杆菌、铜绿假单胞菌以及霍乱弧菌等[20]。目前研究较多的是铜绿假单胞菌,T6SS主要由两部分组成:内外膜复合物和细胞质中类噬菌体尾状复合物,后者包含一个管状结构,由多个堆叠的六聚体环状溶血素调节蛋白(Hcp)组成,其顶部是缬氨酸-甘氨酸重复蛋白G(VgrG)的单一同源三聚体[21-22]。这些蛋白组装在一起,就像尾管和收缩噬菌体表面刺突[23]。此外,VgrG蛋白与一个锥形的脯氨酸-丙氨酸-丙氨酸-精氨酸(PAAR)结构域的蛋白相互作用,形成类似于VgrG样“针头”复合体[24]。细菌在正常生长情况下,TagA被聚集至内外膜复合物上来抑制T6SS的组装,一旦细菌受到外界环境刺激,T6SS启动激活机制,TssA通过与TagA相互作用来抑制TagA与膜复合物的结合,从而启动T6SS的组装[25]。在鼠柠檬酸杆菌中,tssM基因受到转录框架转移的影响。tssM基因被一个过早的终止密码子中断,但位于终止密码子上游的ploy(A)滑束诱导RNA中附加的腺苷结合,因此合成了两个tssM长度变体,这两个变体都是T6SS活性所必需的[26]。然而, 在假单胞菌和农杆菌属中发现的编码磷酸化依赖翻译后途径的基因,并不存在于沙门菌基因组中,除了那些编码与沙门菌SPI-19簇相关的FHA蛋白,这些系统的组装或激活尚未在沙门菌中报道[27]。总的来说,PAAR、Hcp和VgrG对T6SS功能是必要的,在分泌过程中这些成分本身被运送到目标细胞[28-30],利用形成针管状结构来介导细菌种间竞争、金属离子结合和运输等。在沙门菌的研究中发现,抑制T6SS的表达能降低细菌的竞争性[31]、杀菌活性[18, 32]以及金属离子摄取等[14],在其编码基因组中发现了与铜绿假单胞菌T6SS组装相关蛋白Hcp、ClpV、VgrG以及PAAR[33-34]等,同时Hcp[18]、ClpV[14, 35]、VgrG[36]和PAAR[7]在沙门菌具有和铜绿假单胞菌相应效应蛋白类似功能。最近研究发现二者伴侣蛋白Eag都同样能够介导沙门菌和铜绿假单胞菌T6SS效应蛋白稳定分泌[37]。根据目前研究报道沙门菌和铜绿假单胞菌T6SS编码效应蛋白功能相似,对于二者的功能区别未见报道。作者根据已报道沙门菌T6SS效应蛋白功能,绘制出其T6SS简易组装模式图(图 1),但是目前对于沙门菌T6SS组装和调控机制仍不明确。
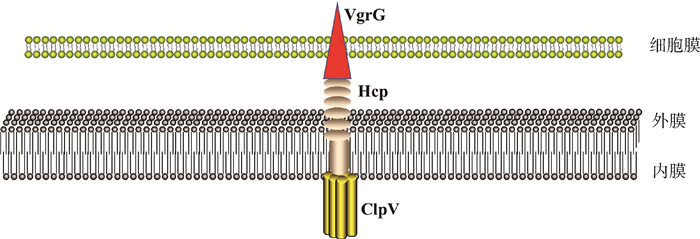
|
图 1 沙门菌T6SS的组装及分泌简单示意图 Fig. 1 Schematic representation of assembly and secretion of T6SS in Salmonella |
由SPI-6编码的T6SS(T6SSSPI-6)与沙门菌的抗菌竞争、致病力和宿主定殖能力相关,然而关于不同血清型沙门菌中相应基因簇编码效应蛋白研究较少。T6SSSPI-6在不同血清型沙门菌基因组中高度保守,最早被称为7号染色体岛(SCI),它与tRNA编码的aspV基因相邻。T6SSSPI-6大小约47 kb,包括黏附蛋白和入侵蛋白基因,如pagN和safABCD鞭毛簇以及转录调节因子sinR,呈现出以saf和tcf纤毛操纵子为特征镶嵌结构。对纤毛操纵子上游区域分析发现可能存在大量ORFs编码的基质、外膜和分泌蛋白,表明T6SSSPI-6编码了一种新分泌系统。STM0285(IcmF同源体)缺失导致鼠伤寒沙门菌在巨噬细胞内增殖能力以及小鼠致病力均明显升高[38],而STM0272(ClpV同源体)和STM0291(Rhs元件)缺失显著降低鼠伤寒沙门菌侵入细胞以及在细胞中增殖的能力[39]。
2.2 T6SSSPI-19由SPI-19编码的T6SS(T6SSSPI-19)是肠道沙门菌(S. enterica)亚种(Ⅰ)中的第二个T6SS基因簇,大小约45 kb,位于编码糖运输和利用的蛋白质基因簇附近,且不直接与tRNA编码基因连接[11]。虽然T6SSSPI-19的平均G+C含量与全基因组的平均G+C含量相似,但核苷酸含量的分布并不均匀。T6SSSPI-19编码约30个ORFs,包含所有T6SS核心元件,其中有两个ORFs均编码Hcp样蛋白(Hcp-1和Hcp-2),但它们的序列一致性只有27%。Hcp-1编码在一个假定的操纵子中,该操作子包含了T6SS的大部分功能;Hcp-2编码在毒力岛另一端的VgrG同源体上游。该VgrG蛋白没有C端延伸,也没有假定的效应域。此外,T6SS其它位点上该毒力岛还包括两个远缘的ImpA同源基因[40]。T6SSSPI-19不编码其他T6SS基因簇中的转录和转录后调控因子,但编码一个含有叉头相关(forkhead-associated,FHA)结构域的蛋白[3, 41]。已有研究表明,在铜绿假单胞菌中,含FHA结构域的蛋白与丝氨酸/苏氨酸激酶(PpkA)和磷酸酶(PppA)相互作用调节其T6SS[41]。虽然T6SSSPI-19不编码激酶和磷酸酶,但不能排除含FHA结构域的蛋白与其他激酶和磷酸酶相互作用调节T6SS分泌的可能性。除了与T6SS相关的元件,T6SSSPI-19中还发现了一个小的“Sel1样重复蛋白”[11]。T6SSSPI-19在都柏林、韦太夫雷登、阿哥纳和鸡伤寒血清型中遗传结构高度保守,主要结构差异局限在毒力岛的右端,该区域编码了数量不定且功能未知的蛋白,两侧是Rhs元件。该区域的基因含量变化是由于Rhs元件之间的缺失和重组。与都柏林、韦太夫雷登、阿哥纳和鸡伤寒血清型中的毒力岛相比,在肠炎血清型中,T6SSSPI-19有内部缺失,大小只有约24 kb。肠炎血清型的毒力岛只编码16个ORFs,其中3个对应于T6SS的核心成分:SEN1002(Hcp-1蛋白)、SEN1003(ImpA同系物)和SEN1004(IcmF的截断形式)。基本成分的缺失表明该血清型中编码的T6SS没有功能。在对鸡伤寒和肠炎血清型的比较基因组分析中发现,肠炎血清型中缺失的T6SSSPI-19内部区域被定义为“差异9区”(ROD9)[42]。因此推测出T6SS的活跃性与这些血清型所呈现的宿主适应差异有关。鸡伤寒沙门菌和都柏林沙门菌的T6SSSPI-19在感染过程中发挥不同的作用[43]。T6SSSPI-19被证实是鸡白痢沙门菌在禽巨噬细胞内存活以及通过抑制宿主免疫反应在鸡体内初步定殖所必需的[15]。
2.3 T6SSSPI-20由SPI-20编码的T6SS(T6SSSPI-20)是一个大小约34 kb的基因岛,编码28个ORFs,平均G+C含量为53.1%。在该毒力岛上共鉴定出17个与T6SS功能相关的ORFs,其中13个编码核心元件[11]。在T6SS相关元件中,该毒力岛编码了一个Hcp样蛋白和一个没有C末端扩展的VgrG蛋白。此外,该毒力岛还存在3个ImpA同源序列。T6SSSPI-20既不编码转录/转录后调控因子,也不编码其他T6SS基因座中含有的FHA结构域蛋白[3, 41]。与T6SSSPI-19相同,T6SSSPI-20的G+C含量分布并不均匀。大部分毒力岛的G+C含量为55%~60%,但也有编码功能未知蛋白的低G+C含量区域(~42%)。虽然T6SSSPI-20位于tRNA编码基因aspV附近,但毒力岛的两侧并没有明显的直接重复。此外,aspV在许多肠道沙门菌血清型中与T6SSSPI-6的插入位点相对应,这表明在沙门菌进化过程中,在同一基因组位置获得了不同的T6SS。
2.4 T6SSSPI-21由SPI-21编码的T6SS(T6SSSPI-21)是血清型Ⅲa 62:z4, z23:-基因组中编码T6SS的第二个毒力岛[11]。该毒力岛大小约55 kb,由转座酶残基为界限。同样,该毒力岛的平均G+C含量(49.6%)分布是不均匀的,包含编码未知功能假定蛋白的G+C低含量(41.3%)区域和编码T6SS相关ORFs的G+C高含量(54.3%)区域[41]。此外,在T6SSSPI-21左侧交界处发现了编码8个ORFs的小基因岛。其中5个ORFs与SPI-14中的ORFs具有广泛的同源性,最初被称为鸡伤寒血清型毒力基因位点[44]。T6SSSPI-21共编码57个ORFs,其中, 20个ORFs编码T6SS相关的元件。在与T6SS不相关的ORFs中,鉴定出一个假定的几丁质酶和一个含有青霉素结合蛋白和Ser/Thr激酶相关结构域的蛋白[45]。此外,T6SSSPI-21除了与T6SSSPI-20共享的核心元件外,还编码与T6SS相关额外的ORFs。因此,该毒力岛编码的不是一个而是两个没有C末端扩展的VgrG蛋白。此外,T6SSSPI-21编码一个进化的VgrG蛋白,包含一个C端延伸,含有两个保守的结构域:COG5529(S型脓杆菌素家族)和PF01844(HNH内切酶)。这不仅是沙门菌中首个进化的VgrG,也是首个进化的包含脓杆菌蛋白结构域的VgrG[46]。T6SSSPI-21中存在假定的细菌素免疫蛋白和具有潜在细菌素活性的进化VgrG,这首次表明细菌可以利用T6SS杀死其他细菌[45]。
2.5 T6SSSPI-22由SPI-22编码的T6SS(T6SSSPI-22)是一种新型毒力岛。如上文所述,目前沙门菌有四种不同的T6SS,编码在T6SSSPI-6、T6SSSPI-19、T6SSSPI-20和T6SSSPI-21上。邦戈尔沙门菌(S. bongori)缺乏以上4种系统,但存在一个新的T6SS位点(~20 kb),即T6SSSPI-22 [47-48]。T6SSSPI-22上携带的T6SS基因与最近发现的啮齿类柠檬酸杆菌ICC168的CTS2 T6SS位点和的铜绿假单胞菌PA01的毒力相关位点HSⅠ~Ⅲ有广泛相似性[49]。T6SSSPI-22编码所有T6SS核心元件,包括DotU和IcmF的同系物,这是T6SS分泌和膜稳定所必需的,ATP酶ClpV为系统提供能量,以及与T6SS相关的其它基本功能,包括VgrG、Hcp和gp25样蛋白[50]。
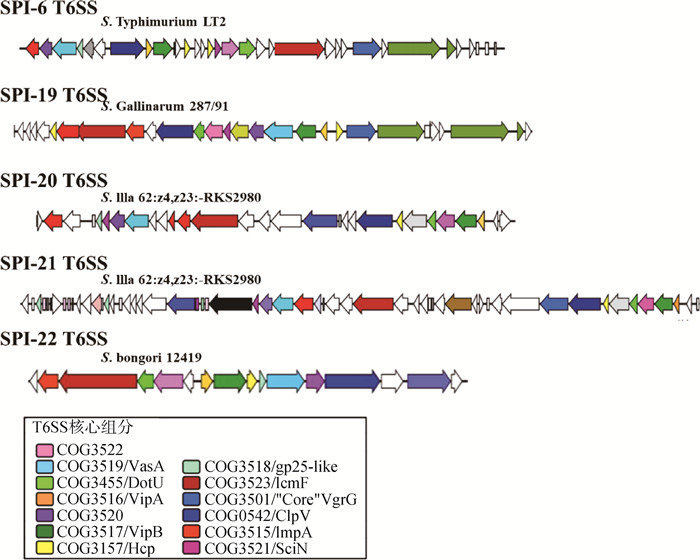
|
每个T6SS编码毒力岛的代表被标出,ORFs表示为显示其转录方向的阻断箭头。保守的核心元件及附加元件分别用不同的颜色表示 One representative of each T6SS-encoding island is shown. ORFs are represented as blocked arrows showing the direction of their transcription. Conserved core, accessory and additional components are represented with a different color 图 2 沙门菌T6SS基因位点组成示意图[11, 47] Fig. 2 Schematic representation of gene organization of T6SS gene clusters in Salmonella[11, 47] |
T6SS的功能在转录、转录后和翻译后水平受到多种机制的调控[51],其中转录调节是最常见的一种方式。一些T6SS由转录调控因子(TRs)直接结合并将RNA聚合酶(RNAP)聚集到启动子区域来调控的。还有一些TRs将环境刺激传递给细菌并诱导基因表达变化,环境信号包括细菌群体感应(QS)、金属离子、温度、pH以及渗透压等。TRs可以作为激活因子或阻遏因子发挥作用,有些作为全局调控因子,控制许多毒力基因协同表达,包括T3SS、T6SS、鞭毛合成、QS和生物膜形成相关基因。
目前, 证实的调控因子包括Sigma因子54(σ54)和双组分系统(TCSs)[52]。σ54是许多动植物病原体中启动毒力基因RNA合成所需的一个替代σ因子,它与RNAP相互作用,并通过全酶形成参与启动子识别,同时σ54启动子转录也需要一个依赖于σ54的TR(VasH)协助。TCSs在细菌中广泛存在并调节多种过程,是细菌最重要信号传导系统,它能够将外界不利环境翻译成化学信号并传递至胞内,使细菌能够及时作出响应并快速调整以适应外界环境。TCSs作为一种转录调控因子,常由定位于细胞内膜的感应分子以及胞质中的相关反应调控蛋白构成,沙门菌的TRs还能够介导T6SS和T3SS之间的彼此联系和互相调控作用,以确保基因精确转录。在沙门菌中,T3SS能够被TRs复杂的网络进行调控,T3SS激活或抑制后又能够反过来调控T6SS的功能,目前最经典的沙门菌TCSs双组分系统主要包括PhoP/PhoQ、EnvZ/OmpR和SsrA/SarB,并且发现TCSs双组分系统之间也具有一定关联性[53]。
3.1 环境信号调控3.1.1 QS调控系统 QS是细菌基于细胞密度变化而进行特定的细胞间通信方式。QS细菌能产生分泌自体诱导物信号分子(AI)。细菌AI分泌随着细菌细胞密度升高而增加,从而调控基于细菌密度相关基因表达[54]。细菌用于细胞间通信的信号化合物可分为四种类别,其中,革兰阴性菌包括三种:1)脂肪酸衍生物N-酰基高丝氨酸内酯(AHLs),通常称为AI-1,主要用于种内交流[55];2)呋喃基硼酸二酯,由S-腺苷-同型半胱氨酸循环转化为同型半胱氨酸,也称为AI-2,是种间和种内交流的通用信号;3)AI-3,其功能是与哺乳动物肾上腺素宿主细胞信号系统进行交互作用。
LuxI/LuxR系统是一种典型QS系统,最早发现于海洋费氏弧菌的发光现象中[56],是目前研究最为广泛和深入的QS系统[57-58]。沙门菌基因组编码一种名为SdiA的LuxR同源物,SdiA是一种AI-1受体,但不能合成AHL。目前沙门菌中使用三种QS系统:AHL介导的Ⅰ型QS系统,LuxS/AI-2介导的Ⅱ型QS系统, AI-3/Epi/NE介导的Ⅲ型QS系统[59]。这些信号系统大多参与物种间交流,AI-3信号系统也参与跨界交流[60]。SdiA结合其他细菌产生的AHLs时会激活rck操纵子基因座和srgE基因座。rck操纵子参与沙门菌Pef(plasmid-encoded fimbriae)菌毛生物合成,还具有侵袭宿主细胞并抵御补体杀伤功能。srgE编码沙门菌T3SS效应子并通过T3SS2输入至宿主细胞[54]。在每个群体感应系统中,通过作为转录调节因子的受体蛋白与其同源的QS信号分子结合而激活与毒力因子、次级代谢和生物被膜发育有关的多种基因的转录。这些信号系统在沙门菌体内交织成一个复杂的多层次调控网络,其中沙门菌T3SS的表达也受QS的差异调控[54, 61]。而T3SS与T6SS之间又存在着密切的调控互作,因此推测沙门菌T6SS的表达也受QS的差异调控[62]。在不同细菌中,即使是功能相同或相近的基因之间,其调控作用也可能是不同的。霍乱弧菌QS系统luxS基因能显著影响T6SS主要效应蛋白转录水平,但QS系统LuxS蛋白并不影响或直接调控沙门菌T6SS核心组分转录及表达[63]。QS作为一个具有全局调控功能的系统,在沙门菌中可能与T6SS之间存在复杂调控网络,某些基因代偿了luxS缺失对T6SS影响。因此,沙门菌中T6SS系统调控有待进一步研究。
3.1.2 其它环境调控方式 细菌T6SS除了受到上述调控因子的调控外,还受其它环境信号调节。例如,在氧化应激的条件下,释放效应物到外环境中,利于细菌吸收营养素,维持胞内羟基自由基水平,起到抗氧化胁迫作用[64]。假结核耶尔森菌OxyR蛋白响应氧化胁迫,激活T6SS基因表达,将Zn2+结合蛋白转移到胞外,获得金属离子,进而消除体内自由基,达到抗氧化胁迫[65]。在严重氧化胁迫压力下,泰国伯克霍尔德菌T6SS分泌TseZ蛋白,也能结合环境中Zn2+,并与血红素转运蛋白HmuR相互作用加强Zn2+能力,增强氧化应激抗性[66-67]。肠出血性大肠杆菌的T6SS效应物KatN过氧化氢酶,可以降低宿主细胞的活性氧(ROS)水平,促进吞噬细胞中肠出血性大肠杆菌存活[68]。
在沙门菌的研究中也发现渗透压参与其T6SS调控,沙门菌基因组编码蛋白YfhA(FlrC同源物)参与了T6SS的渗透调节,在低水平的渗透压下,未磷酸化YfhA作为sciS和rcsB基因σ54依赖性转录因子,并负责激活T6SS表达[62];而在高水平渗透压下,YfhA能够被EnvZ磷酸化,它又会负反馈结合到sciS和rcsB的ORFs上,从而限制这两个基因的转录。SsrAB和SciS通过不同的途径(直接或间接)感知相似的环境信号(如低渗透压、低水平的镁和钙),进而在巨噬细胞内环境中激活T6SS[62]。以上结果表明拥有T6SS和相关效应蛋白细菌,相较其他菌更具竞争性优势。
3.2 PhoP/PhoQ双组分调节系统PhoP/PhoQ由两部分构成,包括定位于细胞内膜上具有跨膜功能组氨酸蛋白激酶PhoQ和胞内反应调控蛋白PhoP。当外界环境发生变化时,PhoQ会迅速接受相应外界信号,继而发生自磷酸化, 并且继续将磷酸基团转移至胞内反应调控蛋白PhoP的天冬氨酸残基上。此外,PhoQ除了具有磷酸激酶活性外还具有磷酸酶活性,它能够根据外界环境中信号分子不同来切换自身的磷酸化和去磷酸化。磷酸化的PhoP由于自身构象改变成为具有转录活性的转录因子,进而精确调控下游效应蛋白的转录和表达,PhoP在转录后还能够调控SsrA,并通过与SsrB启动子结合直接激活ssrB基因的表达[69],同时PhoP的活性还能够负调控hilA基因的表达[70],从而抑制T3SS-1的激活(图 3)。
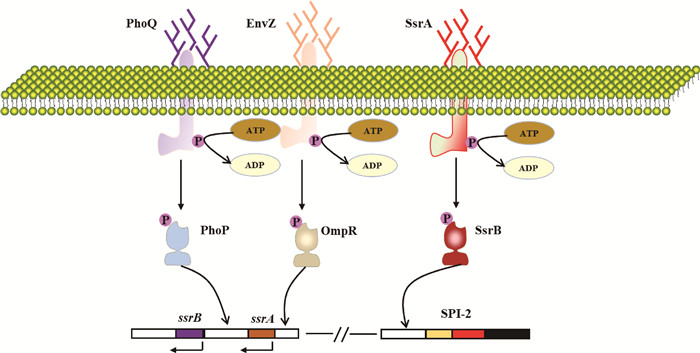
|
图 3 沙门菌T6SS的分泌调控网络示意图 Fig. 3 Schematic representation of secretion regulatory networks of T6SS in Salmonella |
EnvZ-OmpR为沙门菌所特有,由位于细胞质膜中的传感器激酶(EnvZ)和位于细胞质中的响应调节因子DNA结合蛋白(OmpR)组成,传感器激酶EnvZ感受到外在刺激后使OmpR发生磷酸化,磷酸化OmpR参与许多信号转导,OmpR对细菌的渗透压调节、酸应激以及对细胞的黏附过程均起着重要作用[71]。并且有活性的OmpR还能与hilA基因的启动子结合,促进HliA效应分子表达[72],再进一步激活T3SS-1的效应分子的表达(图 3)。然而T3SS-1与T6SS的调控作用目前仍不清楚。
3.4 SsrA-SsrB双组分调节系统SPI-2基因表达最重要和必不可少的调控系统是双组分调控系统SsrA-SsrB。SsrA是膜定位的传感器激酶,而SsrB是下游转录调节因子。该系统对于T3SS-2编码效应蛋白的表达极为重要,如SifA和SifB。一旦外界环境发生变化时,SsrA接收外界信号促使下游的反应调控蛋白SsrB发生磷酸化,SsrB由于自身构象改变成为具有转录活性的转录因子,进而精确调控T3SS-2上效应分子的表达[73],SsrB磷酸化或T3SS-2效应蛋白表达又会反过来抑制T6SS编码效应蛋白表达[74](图 3),但是具体作用机制尚不清楚。有研究显示鼠伤寒沙门菌T6SS基因在感染后期,即SPI-2分泌蛋白水平降低时,在宿主巨噬细胞中表达。此外,SPI-2和T6SS之间的这种反向调节,通过防止病原体的过度生长和随后宿主细胞的快速死亡,帮助病原体在巨噬细胞内持续存在[62, 75]。在慢性感染的进展过程中按照T3SS-1、T3SS-2和T6SS的顺序激活(图 4),最终的结果就是导致沙门菌在体内的持续性感染。
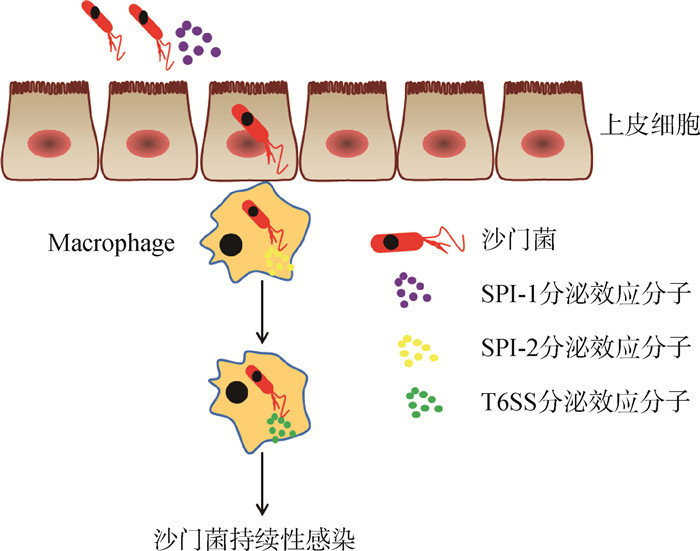
|
图 4 沙门菌持续性感染示意图 Fig. 4 Schematic representation of persistent infection in Salmonella |
沙门菌T6SS通过接触依赖方式将效应蛋白分泌到靶细胞,在感染宿主、生物被膜的形成以及细菌之间的竞争中发挥着不可替代的作用。除了在基础研究方面得到广泛关注,沙门菌T6SS在生物技术领域也有一些潜在的重要应用价值。近年来,细菌耐药性问题已成为全球公共健康领域的重大挑战。2018年报道显示,全球猪传染病病原排在前两位分别是沙门菌和大肠杆菌[76],而沙门菌和大肠杆菌也是重要人畜共患病原菌,给人类健康带来巨大威胁。因此,开发有效针对沙门菌和大肠杆菌类新型抗菌药物是亟待解决的关键科学问题。目前科学家设计合成一种类似于T6SS毒性蛋白的短肽,使其能与同源毒性蛋白结合抑制毒性蛋白作用来预防铜绿假单胞菌的感染[77],并且在沙门菌中也发现T6SS分泌的一种毒性效应蛋白Tlde1能够被与其同源的免疫蛋白Tldi1中和,以消除细菌毒性[32]。这些研究成果为T6SS在新型抗菌药物研发领域提供了新希望。
此外,虽然对沙门菌T6SS生物学功能、作用机制以及应用方面取得了很大进展,但是仍然有很多问题有待明确。比如,沙门菌T3SS系统是如何释放信号去激活T6SS?具体的信号转导机制如何?沙门菌T6SS如何识别“自我”还是“异已”,以及它不同分泌蛋白是否存在一定选择性机制?T6SS除了目前已知的细菌竞争、金属铁离子的摄取、生物膜形成以及致病力功能之外,是否还存在着其它未知的生物学功能?铜绿假单胞菌T6SS通过分泌Mn离子结合效应蛋白TssS,螯合宿主细胞cGAS-STING天然免疫通路激活因子Mn离子,从而抑制宿主天然免疫[17]。并且在最近发现沙门菌的T6SS上发现潜在的免疫相关基因簇[78],那么沙门菌T6SS是否也存在着同样的机制?沙门菌T6SS基因簇能够被组蛋白样结构的H-NS蛋白沉默[31],那么具体的作用机制以及对于设计沙门菌感染小分子抑制剂又有何启示?相信针对这些问题的深入研究将对防控沙门菌持续性感染问题具有极大推动作用。
| [1] |
FERNANDES S A, TAVECHIO A T, GHILARDI Â C R, et al. Salmonella enterica serotypes from human and nonhuman sources in Sao Paulo State, Brazil, 2004-2020[J]. Rev Inst Med Trop Sao Paulo, 2022, 64: e66. DOI:10.1590/s1678-9946202264066 |
| [2] |
王晓利, 杜付玉, 廖成水. Ⅲ型分泌系统在沙门菌囊泡形成中的作用研究进展[J]. 中国预防兽医学报, 2021, 43(1): 106-109. WANG X L, DU F Y, LIAO C S. Research progress on the role of the type Ⅲ secretion system in Salmonella-containing vacuole[J]. Chinese Journal of Preventive Veterinary Medicine, 2021, 43(1): 106-109. (in Chinese) |
| [3] |
PUKATZKI S, MA A T, STURTEVANT D, et al. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system[J]. Proc Natl Acad Sci U S A, 2006, 103(5): 1528-1533. DOI:10.1073/pnas.0510322103 |
| [4] |
LU D, SHANG G, YU Q, et al. Expression, purification and preliminary crystallographic analysis of the T6SS effector protein Tse3 from Pseudomonas aeruginosa[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2013, 69((Pt 5): 524-527. |
| [5] |
MARCHI M, BOUTIN M, GAZENGEL K, et al. Genomic analysis of the biocontrol strain Pseudomonas fluorescens Pf29Arp with evidence of T3SS and T6SS gene expression on plant roots[J]. Environ Microbiol Rep, 2013, 5(3): 393-403. DOI:10.1111/1758-2229.12048 |
| [6] |
WANG X, WANG Q Y, XIAO J F, et al. Edwardsiella tarda T6SS component evpP is regulated by esrB and iron, and plays essential roles in the invasion of fish[J]. Fish Shellfish Immunol, 2009, 27(3): 469-477. DOI:10.1016/j.fsi.2009.06.013 |
| [7] |
HESPANHOL J T, SANCHEZ-LIMACHE D E, NICASTRO G G, et al. Antibacterial T6SS effectors with a VRR-Nuc domain are structure-specific nucleases[J]. Elife, 2022, 11: e82437. DOI:10.7554/eLife.82437 |
| [8] |
JURĖNAS D, CASCALES E. T6SS: killing two bugs with one stone[J]. Trends Microbiol, 2022, 30(1): 1-2. DOI:10.1016/j.tim.2021.10.006 |
| [9] |
LI C F, ZHU L F, WANG D D, et al. T6SS secretes an LPS-binding effector to recruit OMVs for exploitative competition and horizontal gene transfer[J]. ISME J, 2022, 16(2): 500-510. DOI:10.1038/s41396-021-01093-8 |
| [10] |
杨建社, 王帅涛, 牛艳婷, 等. 铜绿假单胞菌T6SS的组装、分泌、功能和调控[J]. 微生物学报, 2021, 61(9): 2607-2627. YANG J S, WANG S T, NIU Y T, et al. Assembly, secretion, function, and regulation of T6SS in Pseudomonas aeruginosa[J]. Acta Microbiologica Sinica, 2021, 61(9): 2607-2627. (in Chinese) |
| [11] |
BLONDEL C J, JIMÉNEZ J C, CONTRERAS I, et al. Comparative genomic analysis uncovers 3 novel loci encoding type six secretion systems differentially distributed in Salmonella serotypes[J]. BMC Genomics, 2009, 10: 354. DOI:10.1186/1471-2164-10-354 |
| [12] |
BOYER F, FICHANT G, BERTHOD J, et al. Dissecting the bacterial type Ⅵ secretion system by a genome wide in silico analysis: what can be learned from available microbial genomic resources?[J]. BMC Genomics, 2009, 10: 104. DOI:10.1186/1471-2164-10-104 |
| [13] |
BINGLE L E H, BAILEY C M, PALLEN M J. Type Ⅵ secretion: a beginner's guide[J]. Curr Opin Microbiol, 2008, 11(1): 3-8. DOI:10.1016/j.mib.2008.01.006 |
| [14] |
WANG S H, YANG D H, WU X J, et al. The ferric uptake regulator represses type Ⅵ secretion system function by binding directly to the clpV promoter in Salmonella enterica serovar typhimurium[J]. Infect Immun, 2019, 87(10): e00562-19. |
| [15] |
XIAN H H, YUAN Y, YIN C, et al. The SPI-19 encoded T6SS is required for Salmonella pullorum survival within avian macrophages and initial colonization in chicken dependent on inhibition of host immune response[J]. Vet Microbiol, 2020, 250: 108867. DOI:10.1016/j.vetmic.2020.108867 |
| [16] |
YU K W, XUE P, FU Y, et al. T6SS mediated stress responses for bacterial environmental survival and host adaptation[J]. Int J Mol Sci, 2021, 22(2): 478. DOI:10.3390/ijms22020478 |
| [17] |
ZHU L F, XU L, WANG C G, et al. T6SS translocates a micropeptide to suppress STING-mediated innate immunity by sequestering manganese[J]. Proc Natl Acad Sci U S A, 2021, 118(42): e2103526118. DOI:10.1073/pnas.2103526118 |
| [18] |
SANA T G, FLAUGNATTI N, LUGO K A, et al. Salmonella typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut[J]. Proc Natl Acad Sci U S A, 2016, 113(34): E5044-E5051. |
| [19] |
ZHANG H, ZHANG H, GAO Z Q, et al. Structure of the type Ⅵ effector-immunity complex (Tae4-Tai4) provides novel insights into the inhibition mechanism of the effector by its immunity protein[J]. J Biol Chem, 2013, 288(8): 5928-5939. DOI:10.1074/jbc.M112.434357 |
| [20] |
NAVARRO-GARCIA F, RUIZ-PEREZ F, CATALDI Á, et al. Type Ⅵ secretion system in pathogenic Escherichia coli: structure, role in virulence, and acquisition[J]. Front Microbiol, 2019, 10: 1965. DOI:10.3389/fmicb.2019.01965 |
| [21] |
MOUGOUS J D, CUFF M E, RAUNSER S, et al. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus[J]. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [22] |
SPÍNOLA-AMILIBIA M, DAVÓ-SIGUERO I, RUIZ F M, et al. The structure of VgrG1 from Pseudomonas aeruginosa, the needle tip of the bacterial type Ⅵ secretion system[J]. Acta Crystallogr D Struct Biol, 2016, 72(Pt 1): 22-33. |
| [23] |
RENAULT M G, BEAS J Z, DOUZI B, et al. The gp27-like hub of VgrG serves as adaptor to promote Hcp tube assembly[J]. J Mol Biol, 2018, 430(18 Pt B): 3143-3156. |
| [24] |
SHNEIDER M M, BUTH S A, HO B T, et al. PAAR-repeat proteins sharpen and diversify the type Ⅵ secretion system spike[J]. Nature, 2013, 500(7462): 350-353. DOI:10.1038/nature12453 |
| [25] |
姚丰华, 张钰, 朱国强. 沙门菌Ⅵ型分泌系统研究进展[J]. 中国预防兽医学报, 2014, 36(6): 493-497. YAO F H, ZHANG Y, ZHU G Q. Research process on Salmonella secretion systems[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(6): 493-497. DOI:10.3969/j.issn.1008-0589.2014.06.19 (in Chinese) |
| [26] |
GUEGUEN E, WILLS N M, ATKINS J F, et al. Transcriptional frameshifting rescues Citrobacter rodentium type Ⅵ secretion by the production of two length variants from the prematurely interrupted tssM gene[J]. PLoS Genet, 2014, 10(12): e1004869. DOI:10.1371/journal.pgen.1004869 |
| [27] |
JOURNET L, CASCALES E. The type Ⅵ secretion system in Escherichia coli and related species[J]. EcoSal Plus, 2016. DOI:10.1128/ecosalplus.ESP-0009-2015 |
| [28] |
CIANFANELLI F R, MONLEZUN L, COULTHURST S J. Aim, load, fire: the type Ⅵ secretion system, a bacterial nanoweapon[J]. Trends Microbiol, 2016, 24(1): 51-62. DOI:10.1016/j.tim.2015.10.005 |
| [29] |
LIANG X Y, PEI T T, LI H, et al. VgrG-dependent effectors and chaperones modulate the assembly of the type Ⅵ secretion system[J]. PLoS Pathog, 2021, 17(12): e1010116. DOI:10.1371/journal.ppat.1010116 |
| [30] |
宋祥军, 沈啸, 蒋胡艳, 等. 禽致病性大肠杆菌Hcp2b对雏鸡气管黏膜细胞因子-细胞因子受体相互作用通路的影响[J]. 畜牧兽医学报, 2021, 52(3): 742-751. SONG X J, SHEN X, JIANG H Y, et al. Effect of avian pathogenic Escherichia coli Hcp2b on the cytokine-cytokine receptor interaction pathway in chick tracheal mucosa[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(3): 742-751. (in Chinese) |
| [31] |
BRUNET Y R, KHODR A, LOGGER L, et al. H-NS silencing of the Salmonella pathogenicity island 6-encoded type Ⅵ secretion system limits Salmonella enterica serovar typhimurium interbacterial killing[J]. Infect Immun, 2015, 83(7): 2738-2750. DOI:10.1128/IAI.00198-15 |
| [32] |
SIBINELLI-SOUSA S, HESPANHOL J T, NICASTRO G G, et al. A family of T6SS antibacterial effectors related to l, d-transpeptidases targets the peptidoglycan[J]. Cell Rep, 2020, 31(12): 107813. DOI:10.1016/j.celrep.2020.107813 |
| [33] |
WANG P, DONG J F, LI R Q, et al. Roles of the Hcp family proteins in the pathogenicity of Salmonella typhimurium 14028s[J]. Virulence, 2020, 11(1): 1716-1726. DOI:10.1080/21505594.2020.1854538 |
| [34] |
ZHENG L M, WANG S H, LING M Y, et al. Salmonella enteritidis Hcp distribute in the cytoplasm and regulate TNF signaling pathway in BHK-21 cells[J]. 3 Biotech, 2020, 10(7): 301. DOI:10.1007/s13205-020-02296-0 |
| [35] |
SCHLIEKER C, ZENTGRAF H, DERSCH P, et al. ClpV, a unique Hsp100/Clp member of pathogenic proteobacteria[J]. Biol Chem, 2005, 386(11): 1115-1127. |
| [36] |
MULDER D T, COOPER C A, COOMBES B K. Type Ⅵ secretion system-associated gene clusters contribute to pathogenesis of Salmonella enterica serovar Typhimurium[J]. Infect Immun, 2012, 80(6): 1996-2007. DOI:10.1128/IAI.06205-11 |
| [37] |
AHMAD S, TSANG K K, SACHAR K, et al. Structural basis for effector transmembrane domain recognition by type Ⅵ secretion system chaperones[J]. Elife, 2020, 9: e62816. DOI:10.7554/eLife.62816 |
| [38] |
PARSONS D A, HEFFRON F. sciS, an icmF homolog in Salmonella enterica serovar Typhimurium, limits intracellular replication and decreases virulence[J]. Infect Immun, 2005, 73(7): 4338-4345. DOI:10.1128/IAI.73.7.4338-4345.2005 |
| [39] |
KLUMPP J, FUCHS T M. Identification of novel genes in genomic islands that contribute to Salmonella typhimurium replication in macrophages[J]. Microbiology (Reading), 2007, 153(Pt 4): 1207-1220. |
| [40] |
SHRIVASTAVA S, MANDE S S. Identification and functional characterization of gene components of Type Ⅵ secretion system in bacterial genomes[J]. PLoS One, 2008, 3(8): e2955. DOI:10.1371/journal.pone.0002955 |
| [41] |
MOUGOUS J D, GIFFORD C A, RAMSDELL T L, et al. Threonine phosphorylation post-translationally regulates protein secretion in Pseudomonas aeruginosa[J]. Nat Cell Biol, 2007, 9(7): 797-803. DOI:10.1038/ncb1605 |
| [42] |
THOMSON N R, CLAYTON D J, WINDHORST D, et al. Comparative genome analysis of Salmonella Enteritidis PT4 and Salmonella gallinarum 287/91 provides insights into evolutionary and host adaptation pathways[J]. Genome Res, 2008, 18(10): 1624-1637. DOI:10.1101/gr.077404.108 |
| [43] |
SCHROLL C, HUANG K S, AHMED S, et al. The SPI-19 encoded type-six secretion-systems (T6SS) of Salmonella enterica serovars Gallinarum and Dublin play different roles during infection[J]. Vet Microbiol, 2019, 230: 23-31. DOI:10.1016/j.vetmic.2019.01.006 |
| [44] |
SHAH D H, LEE M J, PARK J H, et al. Identification of Salmonella gallinarum virulence genes in a chicken infection model using PCR-based signature-tagged mutagenesis[J]. Microbiology (Reading), 2005, 151(Pt 12): 3957-3968. |
| [45] |
YEATS C, FINN R D, BATEMAN A. The PASTA domain: a β-lactam-binding domain[J]. Trends Biochem Sci, 2002, 27(9): 438-440. DOI:10.1016/S0968-0004(02)02164-3 |
| [46] |
PARRET A H A, DE MOT R. Escherichia coli's uropathogenic-specific protein: a bacteriocin promoting infectivity?[J]. Microbiology (Reading), 2002, 148(Pt 6): 1604-1606. |
| [47] |
FOOKES M, SCHROEDER G N, LANGRIDGE G C, et al. Salmonella bongori provides insights into the evolution of the Salmonellae[J]. PLoS Pathog, 2011, 7(8): e1002191. DOI:10.1371/journal.ppat.1002191 |
| [48] |
WANG X Y, ZHU S L, ZHAO J H, et al. Genetic boundaries delineate the potential human pathogen Salmonella bongori into discrete lineages: divergence and speciation[J]. BMC Genomics, 2019, 20(1): 930. DOI:10.1186/s12864-019-6259-z |
| [49] |
LESIC B, STARKEY M, HE J, et al. Quorum sensing differentially regulates Pseudomonas aeruginosa type Ⅵ secretion locus Ⅰ and homologous loci Ⅱ and Ⅲ, which are required for pathogenesis[J]. Microbiology (Reading), 2009, 155(Pt 9): 2845-2855. |
| [50] |
ZHENG J, LEUNG K Y. Dissection of a type Ⅵ secretion system in Edwardsiella tarda[J]. Mol Microbiol, 2007, 66(5): 1192-1206. DOI:10.1111/j.1365-2958.2007.05993.x |
| [51] |
CHEN L H, ZOU Y R, SHE P F, et al. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa[J]. Microbiol Res, 2015, 172: 19-25. DOI:10.1016/j.micres.2015.01.004 |
| [52] |
LEUNG K Y, SIAME B A, SNOWBALL H, et al. Type Ⅵ secretion regulation: crosstalk and intracellular communication[J]. Curr Opin Microbiol, 2011, 14(1): 9-15. DOI:10.1016/j.mib.2010.09.017 |
| [53] |
LEE A K, DETWEILER C S, FALKOW S. OmpR regulates the two-component system SsrA-ssrB in Salmonella pathogenicity island 2[J]. J Bacteriol, 2000, 182(3): 771-781. DOI:10.1128/JB.182.3.771-781.2000 |
| [54] |
戴鹏, 扬溢, 赵亚荣, 等. 沙门氏菌群体感应系统研究进展[J]. 生物加工过程, 2019, 17(3): 257-263, 323. DAI P, YANG Y, ZHAO Y R, et al. Research progress in quorum sensing system in Salmonella[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(3): 257-263, 323. DOI:10.3969/j.issn.1672-3678.2019.03.005 (in Chinese) |
| [55] |
SHOLPAN A, LAMAS A, CEPEDA A, et al. Salmonella spp. quorum sensing: an overview from environmental persistence to host cell invasion[J]. AIMS Microbiol, 2021, 7(2): 238-256. DOI:10.3934/microbiol.2021015 |
| [56] |
DUNLAP P V. Quorum regulation of luminescence in Vibrio fischeri[J]. J Mol Microbiol Biotechnol, 1999, 1(1): 5-12. |
| [57] |
LI S J, WU S J, REN Y X, et al. Characterization of differentiated autoregulation of LuxI/LuxR-type quorum sensing system in Pseudoalteromonas[J]. Biochem Biophys Res Commun, 2022, 590: 177-183. DOI:10.1016/j.bbrc.2021.12.107 |
| [58] |
WANG W J, ZHANG J, TAO H, et al. E. coli biosensor based on modular GFP and luxI/luxR cyclic amplification circuit for sensitive detection of lysine[J]. Anal Bioanal Chem, 2022, 414(29-30): 8299-8307. DOI:10.1007/s00216-022-04364-1 |
| [59] |
ZHANG X J, LIU B B, DING X Y, et al. Regulatory mechanisms between quorum sensing and virulence in Salmonella[J]. Microorganisms, 2022, 10(11): 2211. DOI:10.3390/microorganisms10112211 |
| [60] |
WALTERS M, SPERANDIO V. Quorum sensing in Escherichia coli and Salmonella[J]. Int J Med Microbiol, 2006, 296(2-3): 125-131. DOI:10.1016/j.ijmm.2006.01.041 |
| [61] |
HEGAZY W A H, SALEM I M, ALOTAIBI H F, et al. Terazosin interferes with quorum sensing and type three secretion system and diminishes the bacterial espionage to mitigate the Salmonella typhimurium pathogenesis[J]. Antibiotics (Basel), 2022, 11(4): 465. DOI:10.3390/antibiotics11040465 |
| [62] |
DAS C, DUTTA A, RAJASINGH H, et al. Understanding the sequential activation of Type Ⅲ and Type Ⅵ secretion systems in Salmonella typhimurium using Boolean modeling[J]. Gut Pathog, 2013, 5(1): 28. DOI:10.1186/1757-4749-5-28 |
| [63] |
杨登辉. 沙门菌密度感应系统对六型分泌系统调控的相关研究[D]. 洛阳: 河南科技大学, 2015. YANG D H. Study on regulation of Type Ⅵ secretion system by the quorum sensing system[D]. Luoyang: Henan University of Science and Technology, 2015. (in Chinese) |
| [64] |
钟璐嘉, 蒋文灿, 李鑫, 等. 细菌Ⅵ型分泌系统结构和功能的研究进展[J]. 中国兽医学报, 2021, 41(7): 1419-1424, 1443. ZHONG L J, JIANG W C, LI X, et al. Research progress of structure and function of bacterial type Ⅵ secretion system[J]. Chinese Journal of Veterinary Science, 2021, 41(7): 1419-1424, 1443. DOI:10.16303/j.cnki.1005-4545.2021.07.29 (in Chinese) |
| [65] |
WANG T T, SI M R, SONG Y H, et al. Type Ⅵ secretion system transports Zn2+ to combat multiple stresses and host immunity[J]. PLoS Pathog, 2015, 11(7): e1005020. DOI:10.1371/journal.ppat.1005020 |
| [66] |
DESHAZER D. A novel contact-independent T6SS that maintains redox homeostasis via Zn2+ and Mn2+ acquisition is conserved in the Burkholderia pseudomallei complex[J]. Microbiol Res, 2019, 226: 48-54. DOI:10.1016/j.micres.2019.05.007 |
| [67] |
SI M R, WANG Y, ZHANG B, et al. The Type Ⅵ secretion system engages a redox-regulated dual-functional heme transporter for zinc acquisition[J]. Cell Rep, 2017, 20(4): 949-959. DOI:10.1016/j.celrep.2017.06.081 |
| [68] |
BERAUD M, KOLB A, MONTEIL V, et al. A proteomic analysis reveals differential regulation of the σS-dependent yciGFE(katN) locus by YncC and H-NS in Salmonella and Escherichia coli K-12[J]. Mol Cell Proteomics, 2010, 9(12): 2601-2616. DOI:10.1074/mcp.M110.002493 |
| [69] |
GROISMAN E A, DUPREY A, CHOI J. How the PhoP/PhoQ system controls virulence and Mg2+ homeostasis: lessons in signal transduction, pathogenesis, physiology, and evolution[J]. Microbiol Mol Biol Rev, 2021, 85(3): e0017620. DOI:10.1128/MMBR.00176-20 |
| [70] |
PALMER A D, KIM K, SLAUCH J M. PhoP-mediated repression of the SPI1 Type 3 secretion system in Salmonella enterica serovar typhimurium[J]. J Bacteriol, 2019, 201(16): e00264-19. |
| [71] |
KO D, CHOI S H. Mechanistic understanding of antibiotic resistance mediated by EnvZ/OmpR two-component system in Salmonella enterica serovar Enteritidis[J]. J Antimicrob Chemother, 2022, 77(9): 2419-2428. DOI:10.1093/jac/dkac223 |
| [72] |
RODRIGUEZ C R, SCHECHTER L M, LEE C A. Detection and characterization of the S. typhimurium HilA protein[J]. BMC Microbiol, 2002, 2: 31. DOI:10.1186/1471-2180-2-31 |
| [73] |
TOMLJENOVIC-BERUBE A M, MULDER D T, WHITESIDE M D, et al. Identification of the regulatory logic controlling Salmonella pathoadaptation by the SsrA-SsrB two-component system[J]. PLoS Genet, 2010, 6(3): e1000875. DOI:10.1371/journal.pgen.1000875 |
| [74] |
GARMENDIA J, BEUZON C R, RUIZ-ALBERT J, et al. The roles of SsrA-SsrB and OmpR-EnvZ in the regulation of genes encoding the Salmonella typhimurium SPI-2 type Ⅲ secretion system[J]. Microbiology (Reading), 2003, 149(Pt 9): 2385-2396. |
| [75] |
RAY S, PANDEY N K, KUSHWAHA G S, et al. Structural investigation on SPI-6-associated Salmonella typhimurium VirG-like stress protein that promotes pathogen survival in macrophages[J]. Protein Sci, 2022, 31(4): 835-849. DOI:10.1002/pro.4272 |
| [76] |
VANDERWAAL K, DEEN J. Global trends in infectious diseases of swine[J]. Proc Natl Acad Sci U S A, 2018, 115(45): 11495-11500. DOI:10.1073/pnas.1806068115 |
| [77] |
GAO X P, MU Z X, QIN B, et al. Structure-based prototype peptides targeting the Pseudomonas aeruginosa type Ⅵ secretion system effector as a novel antibacterial strategy[J]. Front Cell Infect Microbiol, 2017, 7: 411. DOI:10.3389/fcimb.2017.00411 |
| [78] |
BARRETTO L A F, FOWLER C C. Identification of a putative T6SS immunity islet in Salmonella typhi[J]. Pathogens, 2020, 9(7): 559. DOI:10.3390/pathogens9070559 |
(编辑 白永平)



