2. 扬州大学兽医学院, 扬州 225009;
3. 江苏高校动物重要疫病与人畜共患病防控协同创新中心, 扬州 225009
2. College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, China;
3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
雌性动物在出生前,卵巢中一半的卵母细胞被淘汰,使得成年雌性卵巢中卵母细胞的数量极其有限[1]。动物初情期以后,一部分原始卵泡被激活,但只有少数卵母细胞能够到达成熟期[2]。一旦卵母细胞被激活或丢失,卵巢中不再产生新的卵母细胞;因此成熟卵母细胞的数量和质量是雌性动物繁殖效率的重要指标[3]。然而,在卵泡发育和成熟过程中,各种内源性和外源性应激因素作用于卵母细胞,使其DNA发生不同程度的损伤。这种损伤可能会导致卵母细胞或早期胚胎中线粒体功能障碍、ATP水平下降和活性氧水平升高[4]。过量活性氧会加剧DNA损伤,进而引起染色体畸变、表观重编程异常和细胞凋亡[5-8]。卵母细胞具有多个不同的通路来检测和修复各种不同类型的DNA损伤。其中最常见的是DNA单链断裂,它能加速基因突变和染色体畸变,并导致基因组稳定性下降和细胞存活率降低[9]。此外,DNA单链断裂还可能会诱发DNA双链断裂,从而改变细胞命运[10]。已经证明,卵母细胞和合子能够有效修复受损的DNA,当受损DNA没有被修复时,卵母细胞则更容易发生凋亡[3, 11-12]。然而,卵母细胞修复受损DNA的确切机制尚不完全清楚。
目前的研究表明,从发育早期卵泡一直到成熟卵母细胞以及早期胚胎中,几乎所有参与DNA修复的基因均有表达[13-16]。蛋白质组学分析显示,参与DNA单链断裂修复的蛋白质在成熟卵母细胞和合子中表达水平很高[17]。哺乳动物细胞中DNA单链断裂修复的途径包括损伤检测、末端处理、间隙填充和连接等[18]。碱基切除修复通路在DNA单链修复中发挥重要作用,但其确切分子机制尚未明确。X射线修复交叉互补蛋白1(XRCC1)是一种支架蛋白,是碱基切除修复通路的一个下游蛋白,负责修复过程中其它多肽的招募和协调[19]。XRCC1在胚胎发育过程中的确切作用尚不明确,因为XRCC1敲除的胚胎大约在受精后第7天就发生死亡[20]。组织学和细胞学研究显示,XRCC1敲除后细胞中DNA断裂和凋亡水平增加,细胞对诱变剂的的反应增强[20-21]。转基因互补试验表明,即便XRCC1的表达低于正常水平,也足以挽救其敲除后的胚胎致死性并产生后代[22]。最新的研究表明,XRCC1介导的碱基切除修复的增强可以降低细胞重编程中的核苷酸变异,进而提高诱导多能干细胞的基因组稳定性和多能性[23]。所有这些均说明XRCC1对基因组稳定性和细胞存活至关重要。
本研究的目的是探究XRCC1在小鼠卵母细胞和早期胚胎中的分布及其作用。采用免疫荧光染色技术检测XRCC1在细胞中的表达和定位;通过显微注射特异性抗体来封闭XRCC1后,研究其对卵母细胞减数分裂和早期胚胎发育的影响。
1 材料与方法 1.1 实验动物8周龄ICR小鼠(封闭群)购买自扬州大学比较医学中心。本研究经扬州大学动物保护与使用委员会批准,完全按照国家研究委员会《实验动物护理与使用指南》进行。
1.2 主要试剂兔源XRCC1抗体(美国Santa Cruz公司,货号sc-11429);驴抗兔-488二抗(美国Thermo-Fisher公司,货号A-21206);鼠源5-mC抗体(德国Merck公司,货号NA81);eCG和hCG(宁波第二激素厂);其他试剂均为美国Sigma公司或国产分析纯。
1.3 卵母细胞的采集和免疫荧光染色雌性小鼠腹腔注射10 IU的eCG,48 h后安乐死,分离卵巢置于M2操作液中,用1 ml注射器针头撕裂卵巢,在体式显微镜下收集卵丘卵母细胞复合体(cumulus oocyte complexes,COCs),用M2操作液洗涤后,在提前预热的M16培养液中培养。分别在培养0、2、8、14 h时收集COCs(对应GV期、GVBD期、MI期、MII期),用300 μg·mL―1的透明质酸酶处理5 min去除颗粒细胞;用4%多聚甲醛固定30 min,经洗涤后,用含3% BSA的PBS进行封闭,之后用1:200稀释的XRCC1抗体室温孵育1 h,经洗涤后,用1:500稀释的驴抗兔-488二抗室温孵育1 h,经洗涤后,用10 μg·mL―1的碘化丙啶(propidium iodide,PI)室温孵育30 min;封片后,用激光共聚焦显微镜观察拍照(Leica TCS SP8)。
1.4 受精卵的采集培养和免疫荧光染色雌性小鼠腹腔注射10 IU的eCG,48 h后腹腔注射10 IU的hCG,之后与雄鼠合笼过夜;第二日早晨,将见栓雌鼠安乐死后从输卵管冲出受精卵;经洗涤后,在KSOMaa培养液中连续培养5 d,每隔24 h收集不同发育阶段的胚胎,经固定后,分别用XRCC1抗体、驴抗兔-488二抗和PI进行孵育,用激光共聚焦显微镜观察拍照。
1.5 抗体的显微注射和免疫荧光染色分别收集GV期(用2.5 μmol·L-1的milrinone阻止GVBD的发生)和MII期卵母细胞以及受精卵,用显微注射仪(Narishige MMN-1)注射大约7 pL的XRCC1抗体(200 μg·mL-1)至细胞质,对照组注射等量的兔IgG;之后将显微注射过的GV期卵母细胞用M16继续培养2 h后,观察GVBD发生率;将显微注射过的MII期卵母细胞用M16继续培养8 h后,分别用5-mC抗体、驴抗鼠-488二抗和PI进行免疫荧光染色后,用激光共聚焦显微镜观察拍照,用Leica软件分析荧光强度;将显微注射过的受精卵用KSOMaa培养24 h后,统计2-细胞胚胎数目,并用5-mC抗体、驴抗鼠-488二抗和PI进行免疫荧光染色后,用激光共聚焦显微镜观察拍照,用Leica软件分析荧光强度。
1.6 统计学处理统计结果以“x±s”表示,应用SPSS软件进行t检验分析,P < 0.05表示差异显著,P < 0.01表示差异极显著。
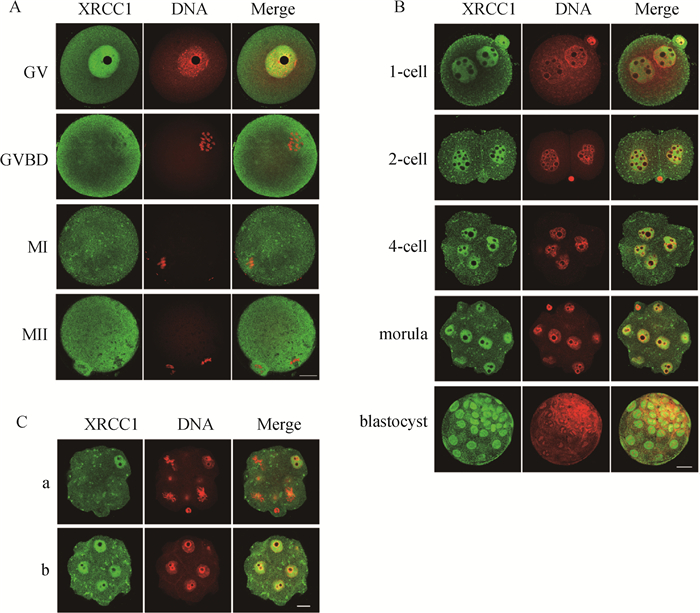
2 结果 2.1 小鼠卵子减数分裂成熟和早期胚胎发育过程中XRCC1的亚细胞分布为了研究XRCC1在卵母细胞减数分裂成熟过程中的作用,首先检测了其在卵母细胞中的亚细胞定位。在体外培养的不同时间点,分别收集GV、GVBD、MI和MII阶段的卵母细胞,用免疫荧光染色检测XRCC1在减数分裂不同阶段卵母细胞中的亚细胞分布模式,结果如图 1A所示。在GV期卵母细胞中,XRCC1浓缩在细胞核内,GVBD之后,XRCC1分散在整个细胞质中;在GVBD期和MII期卵母细胞中,XRCC1在细胞膜附近较为集中;与其它阶段相比,MI期卵母细胞中XRCC1的荧光信号较弱。
|
A. 用免疫荧光分析XRCC1在小鼠卵子减数分裂过程中的亚细胞分布,结果显示其在GV期卵子中主要浓缩在细胞核,之后分散在整个细胞质中;B. 用免疫荧光分析XRCC1在小鼠早期胚胎发育过程中的亚细胞分布,结果显示其在不同阶段的早期胚胎中均浓缩在细胞核;C. 在8细胞胚胎中,由于细胞发育的不同步性,处于有丝分裂中期的3个卵裂球(a)没有XRCC1,而其他处于有丝分裂间期(b)的卵裂球中存着XRCC1。标尺=20 μm A. The subcellular distribution of XRCC1 during meiosis of mouse oocytes was analyzed by immunofluorescence. The results showed that XRCC1 mainly concentrated in the nuclei in GV-oocyte, and then dispersed in the whole cytoplasm. B. The subcellular distribution of XRCC1 during the development of early embryos was analyzed by immunofluorescence. The results showed that XRCC1 was concentrated in the nuclei of early embryos at different stages. C. Due to the asynchrony of cell development, XRCC1 was not found in the 3 blastomeres (a) at metaphase of mitosis, while XRCC1 was found in the other blastomeres at interphase (b) within one 8-cell embryos. Bar=20 μm 图 1 小鼠卵子减数分裂成熟和早期胚胎发育过程中XRCC1的亚细胞分布 Fig. 1 Subcellular localization of XRCC1 during meiotic maturation of mouse oocyte and early development of mouse embryos |
进一步检测了XRCC1在早期胚胎发育过程中的亚细胞定位。在体外培养5 d的过程中,分别收集不同阶段的胚胎,用免疫荧光染色进行检测,结果如图 1B所示。在受精卵(1-cell)中,XRCC1定位于双原核和极体中,同时也分布在细胞膜附近;在2-细胞胚胎之后,XRCC1主要定位在细胞核。由于在大部分时间中,细胞处于细胞周期的间期,考虑到XRCC1在减数分裂不同阶段的分布差异性,作者检测了在有丝分裂阶段XRCC1的亚细胞定位,结果如图 1C所示。在同一个8细胞胚胎中,XRCC1仅分布在处于有丝分裂间期的5个卵裂球中(图 1Cb),而处于有丝分裂中期的3个卵裂球中没有XRCC1(图 1Ca),这说明XRCC1的亚细胞分布具有细胞周期依赖性。
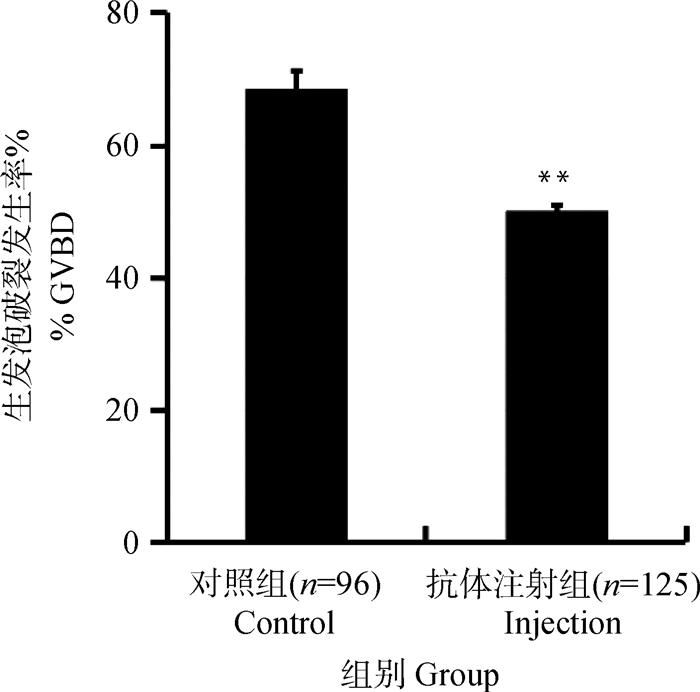
2.2 阻断XRCC1对卵母细胞GVBD发生的影响为了研究XRCC1在卵母细胞减数分裂恢复中的作用,采用显微注射XRCC1抗体的方法阻断XRCC1后,观察GVBD的发生情况。如图 2所示,抗体注射组的GVBD率(50.3% ± 0.8%)显著低于对照组(68.7% ± 2.4%)。这说明阻断XRCC1会在一定程度上干扰小鼠卵母细胞减数分裂的恢复。
|
括号内数字为所分析卵母细胞的样本量。**.P < 0.01 The sample size of the oocytes are given in parentheses. **. P < 0.01 图 2 阻断XRCC1对小鼠卵母细胞GVBD率的影响 Fig. 2 Effect of blocking XRCC1 on GVBD rates in mouse oocytes |
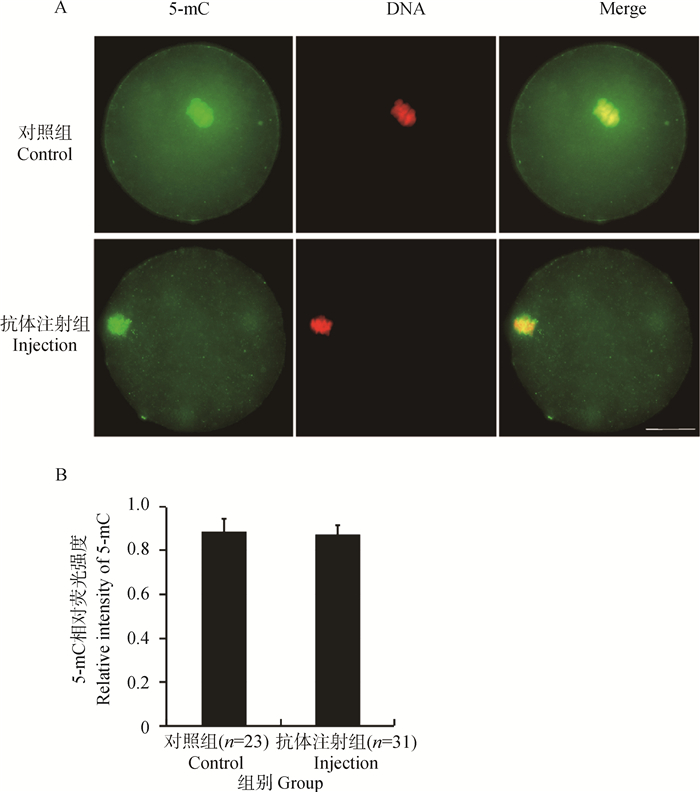
MII期卵母细胞中基因组DNA甲基化程度很高,而在受精后胚胎发育过程中母本DNA甲基化水平逐步降低。由于XRCC1在卵子和早期胚胎发育中的表达和分布,检测了阻断XRCC1是否会影响MII期卵母细胞中的DNA甲基化状态。MII期卵母细胞经显微注射XRCC1抗体后,体外培养8 h,再用5-mC抗体标记基因组DNA甲基化,结果如图 3所示。抗体注射组和对照组的MII卵母细胞中5-mC水平没有显著性差异,这表明阻断XRCC1不会影响MII期卵母细胞中的基因组DNA甲基化水平。
|
A. MII期卵母细胞经显微注射XRCC1抗体后培养8 h,用免疫荧光分析5-mC水平,标尺=20 μm;B. 用软件分析荧光强度,与对照进行比较,差异不显著,括号内数字为所分析卵母细胞的样本量 A. The MII-oocytes were incubated for 8 hours after microinjection of XRCC1 antibody, then the 5-mC level was analyzed by immunofluorescence, Bar=20 μm; B. The fluorescence intensity was analyzed by software, and was compared between two groups. The results showed that there was no significant difference. The sample size of the oocytes are given in parentheses 图 3 阻断XRCC1对MII期卵母细胞中5-mC的影响 Fig. 3 Effect of Blocking XRCC1 on 5-mC in MII oocytes |
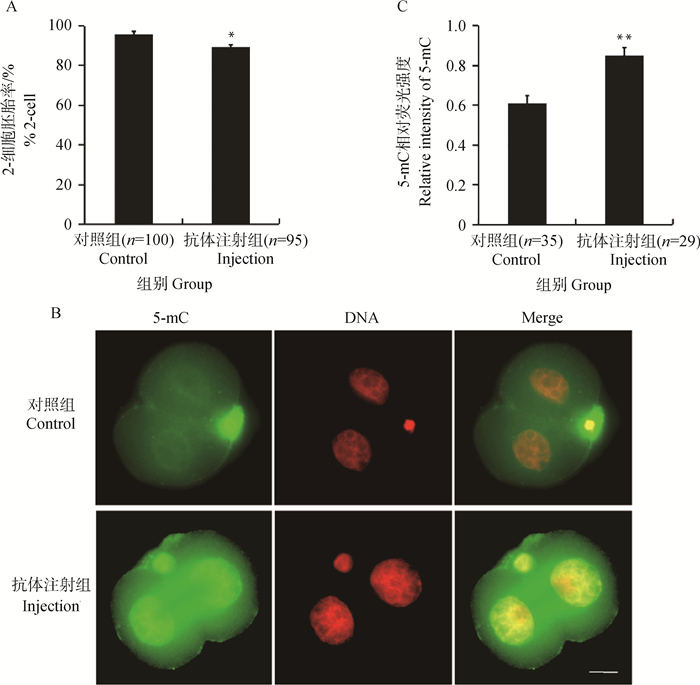
由于XRCC1在MII卵母细胞和合子中的分布存在明显的差异性,因此检测了阻断XRCC1后,受精卵的发育情况。受精卵经显微注射XRCC1抗体后,体外培养24 h,统计2-细胞率,结果如图 4A所示。抗体注射组的2细胞率(89.5% ± 0.9%)显著低于对照组(95.7% ± 1.6%)。进一步分析了2细胞胚胎中基因组DNA甲基化水平,如图 4B、4C所示。在抗体注射组,细胞核中5-mC的荧光强度与极体中的荧光强度相当;而对照组细胞核中5-mC的荧光强度显著弱于极体。统计分析显示,抗体注射组的5-mC的荧光强度(0.85 ± 0.038)显著高于对照组(0.61 ± 0.038)。结果表明,阻断XRCC1可以降低受精卵的卵裂并干扰受精后胚胎的DNA去甲基化过程。
|
A. 受精卵经显微注射XRCC1抗体,体外培养24 h,统计2-细胞胚胎的百分比,结果显示其显著低于对照组(P < 0.05),括号内数字为所分析胚胎的样本量;B. 用免疫荧光分析两组2-细胞胚胎中的5-mC水平,结果显示,注射XRCC1抗体组的2-细胞胚胎中,细胞核中的5-mC荧光强度与极体中的相当,而对照组2-细胞胚胎中,细胞核中的的5-mC荧光强度显著弱于极体中的荧光强度,标尺=20 μm;C. 统计分析显示,注射XRCC1抗体组2-细胞胚胎中的5-mC荧光强度极显著强于对照组中的荧光强度(P < 0.01),括号内数字为所分析胚胎的样本量 A. After microinjection of XRCC1 antibody, the fertilized eggs were cultured for 24 hours in vitro, and the percentage of 2-cell embryos was analyzed. The results showed that the percentage of 2-cell embryos was significantly lower in the microinjection group than in the control group. The sample size of the embryos are given in parentheses. B. The 5-mC level in the 2-cell embryos was analyzed by immunofluorescence. The results showed that the fluorescence intensity of 5-mC in the nuclei was equivalent to that in the polar body in the microinjection group. While in the control group, the fluorescence intensity of 5-mC in the nuclei was significantly weaker than that in the polar body. Bar=20 μm. (C) Statistical analysis showed that the fluorescence intensity of 5-mC in the microinjection group was significantly higher than that in control group. The sample size of the embryos are given in parentheses 图 4 阻断XRCC1对胚胎卵裂和2-细胞胚胎中5-mC的影响 Fig. 4 Effect of blocking XRCC1 on embryo cleavage and 5-mC in 2-cell embryos |
卵母细胞在卵泡发育和成熟过程中积累了各种不同程度的DNA损伤[3]。XRCC1是碱基切除修复系统中负责招募其他多肽的主要蛋白[24-25]。本研究中,XRCC1主要分布在GV期卵母细胞的细胞核中,这个结果进一步证明了碱基切除修复通路在卵泡发育中发挥作用。显微注射抗体阻断XRCC1后,GVBD的发生受到部分干扰,表明XRCC1可能参与小鼠卵母细胞减数分裂恢复的启动。有研究表明,人类体细胞中线粒体能够利用碱基切除修复系统来修复细胞中受损的DNA[26-27]。本研究显示,XRCC1在GVBD后分布在卵母细胞的胞质中,这与卵母细胞中线粒体的分布类似[28-29],这可能暗示出在卵母细胞减数分裂过程中,XRCC1与线粒体DNA修复之间存在联系。
由于精子中不表达XRCC1[30],所以成熟精子中修复DNA损伤的碱基切除修复通路发挥的作用有限。但是,精子中携带的DNA损伤能在受精后被受精卵轻易识别[31]。因此,受精卵中来源于母本的碱基切除修复通路是修复来源于精子的父本DNA损伤所必须的。在本研究中,XRCC1主要分布在受精卵的双原核中,进一步说明受精的过程能够启动XRCC1的翻译后修饰和核定位[32]。由于小鼠胚胎基因的转录起始于2-细胞到4-细胞阶段[33],而且精子中不表达XRCC1,所以受精后浓缩在双原核中的XRCC1只可能来源于MII卵母细胞的胞质中。
受精后,早期胚胎经历全基因组重编程来重建细胞的全能性,DNA甲基化和组蛋白修饰是这一重编程过程中最主要的表观遗传修饰[34]。从受精开始,DNA甲基化发生全基因组范围的去甲基化,在早期囊胚阶段达到最低值[35]。已有研究表明,DNA链的断裂和修复是DNA去甲基化的其中一个方式[31, 36]。本研究中,XRCC1定位于合子到囊胚期的细胞核中,这表明该蛋白可能与早期胚胎中DNA断裂修复有关。另外,由于卵裂的不同步性,胚胎卵裂球可能处于细胞周期的不同阶段;本研究显示XRCC1在早期胚胎中的亚细胞分布具有细胞周期依赖性,仅在间期卵裂球中聚集。有研究显示,XRCC1介导的碱基切除修复对于G1期受精卵中父本DNA损伤的修复是必须的[37]。因此,我们认为XRCC1的细胞周期依赖性分布与早期胚胎中的DNA重编程有关。本研究结果在一定程度上扩展了在早期胚胎发育中对XRCC1功能的研究。
基于XRCC1在受精卵中的双原核定位,以及阻断XRCC1后GVBD率的下降,可以推测出阻断XRCC1可能会干扰胚胎卵裂,本研究验证了这一点。早期胚胎发育中,基因组DNA甲基化的重编程不仅可以防止遗传突变,而且能避免将异常表观修饰传递给后代[3, 38-39]。阻断XRCC1后,2-细胞胚胎中保持了较高水平的DNA甲基化,这表明阻断XRCC1在一定程度上干扰了DNA去甲基化过程。但是,在MII卵母细胞中阻断XRCC1时,DNA甲基化则保持不变,这说明XRCC1可能不直接参与DNA去甲基化的过程。
4 结论在小鼠卵母细胞减数分裂成熟过程中和早期胚胎有丝分裂中,XRCC1的亚细胞分布表现出细胞周期依赖性。通过显微注射抗体阻断XRCC1,在一定程度上降低了卵母细胞减数分裂成熟和胚胎卵裂的启动,其中阻断XRCC1降低胚胎卵裂的原因可能与其引起的DNA去甲基化异常有关。
| [1] |
ENE A C, PARK S, EDELMANN W, et al. Caspase 9 is constitutively activated in mouse oocytes and plays a key role in oocyte elimination during meiotic prophase progression[J]. Dev Biol, 2013, 377(1): 213-223. DOI:10.1016/j.ydbio.2013.01.027 |
| [2] |
ZHANG H, LIU K. Cellular and molecular regulation of the activation of mammalian primordial follicles: somatic cells initiate follicle activation in adulthood[J]. Hum Reprod Update, 2015, 21(6): 779-786. DOI:10.1093/humupd/dmv037 |
| [3] |
VAN DEN BERG M M J, VAN MAARLE M C, VAN WELY M, et al. Genetics of early miscarriage[J]. Biochim Biophys Acta, 2012, 1822(12): 1951-1959. DOI:10.1016/j.bbadis.2012.07.001 |
| [4] |
ROTH Z. Symposium review: reduction in oocyte developmental competence by stress is associated with alterations in mitochondrial function[J]. J Dairy Sci, 2018, 101(4): 3642-3654. DOI:10.3168/jds.2017-13389 |
| [5] |
JONES K T, LANE S I R. Chromosomal, metabolic, environmental, and hormonal origins of aneuploidy in mammalian oocytes[J]. Exp Cell Res, 2012, 318(12): 1394-1399. DOI:10.1016/j.yexcr.2012.02.012 |
| [6] |
ZHU J Q, LIU J H, LIANG X W, et al. Heat stress causes aberrant DNA methylation of H19 and Igf-2r in mouse blastocysts[J]. Mol Cells, 2008, 25(2): 211-215. |
| [7] |
KALISCH-SMITH J I, MORITZ K M. Detrimental effects of alcohol exposure around conception: putative mechanisms[J]. Biochem Cell Biol, 2018, 96(2): 107-116. DOI:10.1139/bcb-2017-0133 |
| [8] |
KARUPUTHULA N B, CHATTOPADHYAY R, CHAKRAVARTY B, et al. Oxidative status in granulosa cells of infertile women undergoing IVF[J]. Syst Biol Reprod Med, 2013, 59(2): 91-98. DOI:10.3109/19396368.2012.743197 |
| [9] |
BREM R, HALL J. XRCC1 is required for DNA single-strand break repair in human cells[J]. Nucleic Acids Res, 2005, 33(8): 2512-2520. DOI:10.1093/nar/gki543 |
| [10] |
KUZMINOV A. Single-strand interruptions in replicating chromosomes cause double-strand breaks[J]. Proc Natl Acad Sci U S A, 2001, 98(15): 8241-8246. DOI:10.1073/pnas.131009198 |
| [11] |
HANOUX V, PAIRAULT C, BAKALSKA M, et al. Caspase-2 involvement during ionizing radiation-induced oocyte death in the mouse ovary[J]. Cell Death Differ, 2007, 14(4): 671-681. DOI:10.1038/sj.cdd.4402052 |
| [12] |
KERR J B, BROGAN L, MYERS M, et al. The primordial follicle reserve is not renewed after chemical or γ-irradiation mediated depletion[J]. Reproduction, 2012, 143(4): 469-476. DOI:10.1530/REP-11-0430 |
| [13] |
GOVINDARAJ V, KRISHNAGIRI H, CHAKRABORTY P, et al. Age-related changes in gene expression patterns of immature and aged rat primordial follicles[J]. Syst Biol Reprod Med, 2017, 63(1): 37-48. DOI:10.1080/19396368.2016.1267820 |
| [14] |
PAN H, O'BRIEN M J, WIGGLESWORTH K, et al. Transcript profiling during mouse oocyte development and the effect of gonadotropin priming and development in vitro[J]. Dev Biol, 2005, 286(2): 493-506. DOI:10.1016/j.ydbio.2005.08.023 |
| [15] |
JAROUDI S, KAKOUROU G, CAWOOD S, et al. Expression profiling of DNA repair genes in human oocytes and blastocysts using microarrays[J]. Hum Reprod, 2009, 24(10): 2649-2655. DOI:10.1093/humrep/dep224 |
| [16] |
ZENG F Y, BALDWIN D A, SCHULTZ R M. Transcript profiling during preimplantation mouse development[J]. Dev Biol, 2004, 272(2): 483-496. DOI:10.1016/j.ydbio.2004.05.018 |
| [17] |
WANG S F, KOU Z H, JING Z Y, et al. Proteome of mouse oocytes at different developmental stages[J]. Proc Natl Acad Sci U S A, 2010, 107(41): 17639-17644. DOI:10.1073/pnas.1013185107 |
| [18] |
CALDECOTT K W. DNA single-strand break repair[J]. Exp Cell Res, 2014, 329(1): 2-8. DOI:10.1016/j.yexcr.2014.08.027 |
| [19] |
DAVID S S, O'SHEA V L, KUNDU S. Base-excision repair of oxidative DNA damage[J]. Nature, 2007, 447(7147): 941-950. DOI:10.1038/nature05978 |
| [20] |
TEBBS R S, FLANNERY M L, MENESES J J, et al. Requirement for the Xrcc1 DNA base excision repair gene during early mouse development[J]. Dev Biol, 1999, 208(2): 513-529. DOI:10.1006/dbio.1999.9232 |
| [21] |
LEE Y, KATYAL S, LI Y, et al. The genesis of cerebellar interneurons and the prevention of neural DNA damage require XRCC1[J]. Nat Neurosci, 2009, 12(8): 973-980. DOI:10.1038/nn.2375 |
| [22] |
TEBBS R S, THOMPSON L H, CLEAVER J E. Rescue of Xrcc1 knockout mouse embryo lethality by transgene-complementation[J]. DNA Repair (Amst), 2003, 2(12): 1405-1417. DOI:10.1016/j.dnarep.2003.08.007 |
| [23] |
ZHAO K, SUN X X, ZHENG C H, et al. Enhancement of Xrcc1-mediated base excision repair improves the genetic stability and pluripotency of iPSCs[J]. Sci Bull (Beijing), 2022, 67(11): 1126-1130. DOI:10.1016/j.scib.2022.04.003 |
| [24] |
THOMPSON L H, WEST M G. XRCC1 keeps DNA from getting stranded[J]. Mutat Res, 2000, 459(1): 1-18. DOI:10.1016/S0921-8777(99)00058-0 |
| [25] |
VIDAL A E, BOITEUX S, HICKSON I D, et al. XRCC1 coordinates the initial and late stages of DNA abasic site repair through protein-protein interactions[J]. EMBO J, 2001, 20(22): 6530-6539. DOI:10.1093/emboj/20.22.6530 |
| [26] |
AKBARI M, VISNES T, KROKAN H E, et al. Mitochondrial base excision repair of uracil and AP sites takes place by single-nucleotide insertion and long-patch DNA synthesis[J]. DNA Repair (Amst), 2008, 7(4): 605-616. DOI:10.1016/j.dnarep.2008.01.002 |
| [27] |
LIU P F, QIAN L M, SUNG J S, et al. Removal of oxidative DNA damage via FEN1-dependent long-patch base excision repair in human cell mitochondria[J]. Mol Cell Biol, 2008, 28(16): 4975-4987. DOI:10.1128/MCB.00457-08 |
| [28] |
ZHU J Q, LIU Y, ZHANG J H, et al. Cadmium exposure of female mice impairs the meiotic maturation of oocytes and subsequent embryonic development[J]. Toxicol Sci, 2018, 164(1): 289-299. DOI:10.1093/toxsci/kfy089 |
| [29] |
BAVISTER B D, SQUIRRELL J M. Mitochondrial distribution and function in oocytes and early embryos[J]. Hum Reprod, 2000, 15(Suppl 2): 189-198. DOI:10.1093/humrep/15.suppl_2.189 |
| [30] |
SMITH T B, DUN M D, SMITH N D, et al. The presence of a truncated base excision repair pathway in human spermatozoa that is mediated by OGG1[J]. J Cell Sci, 2013, 126(Pt 6): 1488-1497. |
| [31] |
WOSSIDLO M, ARAND J, SEBASTIANO V, et al. Dynamic link of DNA demethylation, DNA strand breaks and repair in mouse zygotes[J]. EMBO J, 2010, 29(11): 1877-1888. DOI:10.1038/emboj.2010.80 |
| [32] |
LORD T, AITKEN R J. Fertilization stimulates 8-hydroxy-2'-deoxyguanosine repair and antioxidant activity to prevent mutagenesis in the embryo[J]. Dev Biol, 2015, 406(1): 1-13. DOI:10.1016/j.ydbio.2015.07.024 |
| [33] |
FLACH G, JOHNSON M H, BRAUDE P R, et al. The transition from maternal to embryonic control in the 2-cell mouse embryo[J]. EMBO J, 1982, 1(6): 681-686. DOI:10.1002/j.1460-2075.1982.tb01230.x |
| [34] |
SEAH M K Y, MESSERSCHMIDT D M. From germline to soma: epigenetic dynamics in the mouse preimplantation embryo[J]. Curr Top Dev Biol, 2018, 128: 203-235. |
| [35] |
MESSERSCHMIDT D M, KNOWLES B B, SOLTER D. DNA methylation dynamics during epigenetic reprogramming in the germline and preimplantation embryos[J]. Genes Dev, 2014, 28(8): 812-828. DOI:10.1101/gad.234294.113 |
| [36] |
HOUSE N C M, KOCH M R, FREUDENREICH C H. Chromatin modifications and DNA repair: beyond double-strand breaks[J]. Front Genet, 2014, 5: 296. |
| [37] |
LADSTÄTTER S, TACHIBANA-KONWALSKI K. A surveillance mechanism ensures repair of DNA lesions during zygotic reprogramming[J]. Cell, 2016, 167(7): 1774-1787. DOI:10.1016/j.cell.2016.11.009 |
| [38] |
MAYER W, NIVELEAU A, WALTER J, et al. Demethylation of the zygotic paternal genome[J]. Nature, 2000, 403(6769): 501-502. |
| [39] |
OSWALD J, ENGEMANN S, LANE N, et al. Active demethylation of the paternal genome in the mouse zygote[J]. Curr Biol, 2000, 10(8): 475-478. DOI:10.1016/S0960-9822(00)00448-6 |
(编辑 白永平)



