2. 江苏省农业科学院, 南京 210014
2. Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
日照变化对禽(鸟)类繁殖活动的调控发挥关键作用[1-2]。大量的研究表明,不论是在非季节性繁殖禽类还是季节性繁殖禽类上,不同的光照程序均对禽(鸟)类的繁殖机能产生显著影响。在非季节性繁殖禽类上,长光照能明显提升鸭生殖激素水平,使产蛋处于最佳水平[3-4];缩短光照则会减少鸭生殖激素水平,减少鸭产蛋量及不同等级的卵泡数量[5]。在季节性繁殖禽类上,光照对不同繁殖类型的禽类会呈现出不同的调控效果。在长日照繁殖型的中国北方鹅和鹌鹑上,长光照处理可以增加鹅产蛋量,同时还可以减少鹅采食和饮水等行为[6],而缩短光照则会减少鹌鹑产蛋量及卵泡数量[7]。在短日照繁殖型的中国南方鹅上,延长接受的光照时长,能促进兴国灰鹅下丘脑内繁殖抑制相关基因的表达,下调繁殖促进基因的表达,促进鹅进入停产期[8];延长光照能够抑制马冈鹅生殖激素的分泌,抑制鹅的繁殖活动[9]。
动物的繁殖活动由下丘脑-垂体-性腺(hypothalamic-pituitary-gonadal, HPG)轴调控[10],光照对鸟(禽)类繁殖活动的影响主要通过一些光感受体及相关通路来影响生殖轴,实现对禽类繁殖活动的调控。在介导光照调控禽类生殖活动的通路中,OPN5-TSH-DIO2/DIO3通路和VIP-PRL通路可能发挥重要作用。位于外隔区的下丘脑深部光受体(deep-brain photoreceptors, DBPs)对禽(鸟)类的繁殖机能起重要作用[11-12],目前发现的DBPs主要包括:黑视蛋白(melanopsin, OPN4)、神经视蛋白(neuropnsin, OPN5)、脊椎动物古视蛋白(vertebrate ancient opsin, VAOPN)等[13-14],它们通过感知光信号的变化,参与鸟类繁殖性能的调控[15]。OPN5是一种丝氨酸蛋白酶,分布于动物的眼、脑、睾丸等部位,与动物繁殖、节律、记忆获得等功能密切相关[13],被认为是鸟类的主要深脑光感受器之一。有研究表明,OPN5能与视黄醛的反式构象结合并诱导视蛋白的产生,从而激活信号通路以启动光传递[16-17]。DBPs接收光信号后,刺激促甲状腺细胞分泌促甲状腺激素(thyroid stimulating hormone, TSH),通过激活第三脑室的Ⅱ型脱碘酶(deiodinase type 2, DIO2),使第三脑室的四碘甲状腺原氨酸(T4)转换为三碘甲状腺原氨酸(T3),从而影响GnRH和GnIH的合成与分泌,调控HPG轴上激素的分泌[18]。
VIP是一种由28个氨基酸组成的促胰液素家族的多肽[19],PRL是主要由垂体前叶合成分泌的蛋白质激素[20],在禽类的就巢发生和维持中发挥关键作用[21]。VIP对PRL起到促进释放的作用,下丘脑多巴胺等能促进VIP的合成和释放[22-23]。有研究表明,由血管活性肠肽(vasoactive intestinal peptide, VIP)和PRL组成的VIP-PRL通路在光照调控鸟(禽)类的繁殖活动中也发挥着不可或缺的作用。Sharp[24]推导了一种禽类神经内分泌光周期的生殖反应模型,长日照可以上调VIP基因表达,促进PRL的分泌;在北京油鸡上的研究发现,短光照处理组与长光照处理组相比,PRL分泌量升高,产蛋量增加,表明稍高浓度的PRL反而促进鸡的繁殖性能[25]。在马冈鹅上的研究也发现,延长光照会上调VIP和PRL基因表达,但抑制鹅的繁殖机能[9]。
虽然大量的生产实践和研究表明,长光照能明显促进鸭的繁殖活动,尤其是产蛋性能,但关于长光照通过怎样的通路或机制去提升鸭生殖轴效率的机理仍不清楚,同时过短的光照处理对鸭繁殖机能的抑制效果及其中的相关机理也鲜有报道。本研究利用短光照对正常繁殖光照处理的山麻鸭进行处理,通过研究其繁殖机能的变化以及OPN5-TSH-DIO2/DIO3通路和VIP-PRL通路中主要因子的表达,以期一定程度揭示两通路在光照调控鸭生殖轴及繁殖活动中的机制,为光照调控禽类繁殖的生产及理论研究提供客观依据。
1 材料与方法 1.1 试验动物与试验设计试验选取80只220日龄性成熟的公山麻鸭,由仲恺农业工程学院动物试验养殖场提供,并在该场开展试验,所有试验均由仲恺农业工程学院动物伦理委员会批准。试验为期45 d,前15 d采取长光照处理(18 L ∶6 D),从d16天开始每天缩短光照2 h,到每天光照时间为8 h(8 L ∶16 D)后持续至试验结束。试验期,公鸭采用网上平养,自由采食、饮水,并配有舍内洗浴池,平均面积大于0.3 m2 ·只-1。在d15、d21、d30、d45上午7点进行样品采集(n=7),称量公鸭体重,翅下静脉采血,并于采集血液后3 h内以3 500 r ·min-1离心分离血清,血清样品分装后置于-20 ℃保存;采血后处死公鸭,检查其睾丸发育情况,并采集下丘脑、垂体及左侧睾丸组织于-80 ℃冷冻保存,采集右侧睾丸组织固定于4%多聚甲醛溶液。
1.2 主要试剂与仪器1.2.1 主要试剂 TRIzol Reagent购于中国上海玉博生物科技有限公司;PowerUpTM SYBRTM Green Master Mix购于中国上海赛默飞世尔科技有限公司;PrimeScriptrTMRT reagent Kit with gDNA Eraser购于中国北京宝日医生物技术有限公司;Chicken Luteinizing hormone(LH)ELISA Kit购于中国南京川博生物技术有限公司;T(testosterone)ELISA Kit购于中国武汉伊莱瑞特生物科技股份有限公司。
1.2.2 主要仪器 Quant Studio 7、梯度PCR仪、全波长酶标仪Multiskan GO购于中国上海赛默飞世尔科技有限公司;5200化学发光成像仪购于中国上海天能生物科技有限公司;自动脱水机、生物组织包埋机、石蜡切片机购于中国浙江益迪医疗设备有限公司;显微镜购于中国上海尼康仪器有限公司。
1.3 试验方法1.3.1 睾丸组织切片制作与HE染色 取睾丸组织于4%多聚甲醛溶液固定24 h以上,在自动脱水机内使用梯度浓度的酒精进行脱水处理,脱水后于包埋机内包埋,然后用石蜡切片机切割4 μm厚的切片,苏木精-伊红(hematoxylin-eosin staining, H&E)染色。对切片标本进行组织学分析,在显微镜下观察生精小管和生精细胞的变化。
1.3.2 血清生殖激素检测 血清激素检测严格按照试剂盒说明书进行,检测血清中LH及睾酮的激素水平。睾酮、LH的检测灵敏度分别为0.17 ng ·mL-1和0.5 mIU ·mL-1。试验内和试验间的变异系数均小于15%,标准曲线的r值均大于0.99。PRL激素检测试剂盒由江苏省农业科学院提供,参考Chen等[26]开发的家禽血浆PRL浓度检测方法,检测血清中PRL的激素水平。
1.3.3 基因表达水平检测 TRIzol法提取下丘脑、垂体及睾丸组织的总RNA,使用TaKaRa反转录试剂盒将RNA反转录为cDNA,然后通过qRT-PCR定量检测下丘脑中OPN5、OPN4、VAOPN、DIO2、DIO3、VIP、GnIH、GnRH,垂体中TSH-β、GnIHR、GnRHR、FSH、LH、PRL,睾丸中FSHR、LHR、PRLR的基因表达水平。根据NCBI上参考序列,利用Primer 5. 0设计目的基因和内参基因ACTB的引物(表 1),送由中国上海生工股份有限公司合成,以cDNA为模板,配制10 μL反应体系:Master Mix 5 μL,上、下游引物各0.1 μL,ddH2O 4.5 μL,cDNA模板0.3 μL。反应条件设定:50 ℃预变性2 min;95 ℃ 10 min,95 ℃ 15 s,Tm℃ 1 min,40个循环。每个样品设3个重复,用ACTB作为内参基因进行校正。
|
|
表 1 实时荧光定量PCR引物信息 Table 1 Real-time fluorescence quantitative PCR primers information |
1.3.4 蛋白表达水平检测 取下丘脑组织提取总蛋白,提取蛋白时各时间段均为3个样品混为一个样品进行提取,每个时间段两个蛋白样品;使用BCA试剂盒检测蛋白浓度,蛋白变性后,蛋白上样于10%的SDS-PAGE凝胶,运行程序为恒定电压,80 V 10 min,100 V 60 min,结束后进行转膜,将目的蛋白转至PVDF膜上,程序为恒定电流200 mA 40 min;镊子夹起膜边放入PBST内稍做清洗,然后转入5%的脱脂牛奶中室温封闭3 h;取出后PBST清洗5次,每次3 min;接着放入一抗内,4 ℃孵育过夜(12~16 h)取出后PBST清洗5次,每次3 min;二抗室温下孵育1 h,取出后PBST清洗5次,每次3 min,接着使用ECL试剂盒显色并将膜置于化学发光仪内曝光、拍照。
1.4 数据统计分析所有数据分析均采用SPSS 19.0进行单因素方差分析,P < 0.05视为具有显著性差异。睾丸切片使用CaseViewer 2.4.0截取4.0×和20.0×睾丸切片截屏,使用image-pro Plus 6.0分析软件测量每个切片20.0×截屏中6个圆形生精小管生精上皮厚度(μm)以及生精细胞数。qRT-PCR结果采用相对定量法(ΔΔCt法) 处理,基因相对表达量用2-ΔΔCt表示。蛋白表达结果采用Image J 1.48v软件对Western blot蛋白条带进行灰度值分析。
2 结果 2.1 睾丸组织发育检测检测公鸭睾丸发育,发现公鸭性腺指数(gonadosomatic index,GSI)随着短光照处理而逐渐下降,且在d30显著下降(P < 0.05)。观察睾丸组织发现,短光照处理前的d15,曲细精管界面清晰,排列紧密,管壁厚,其上生殖细胞分布密集,且管腔中央可见到大量精子。在d16缩短光照后,随着处理时间的延长,曲细精管虽仍排列紧密,但管壁逐渐变薄,管壁上生殖细胞的分布密度逐渐降低,空腔化愈发严重,管腔内精子数量快速减少。结果说明,短光照处理明显抑制了公鸭睾丸机能,尤其是光照处理30和45 d后影响显著(P < 0.05,图 1)。
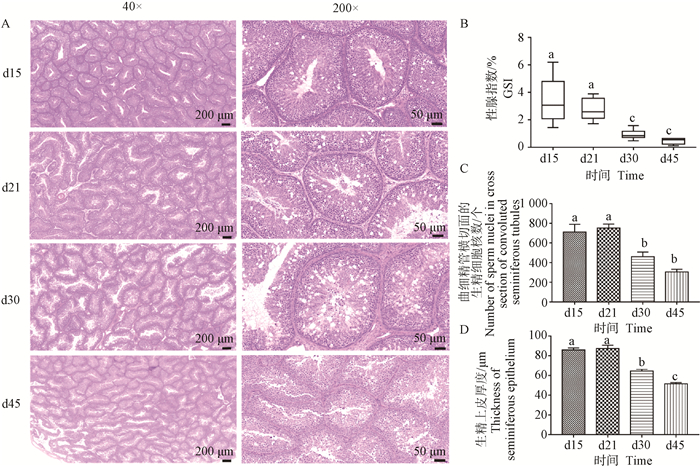
|
A.睾丸组织学结构;B.公鸭性腺指数;C.曲细精管横切面生精细胞核数;D.曲细精管横切面生精上皮厚度。图中不同字母表示差异显著(P < 0.05),相同字母表示差异不显著(P>0.05),下同 A. Histological structure of testis; B. GSI of male ducks; C. The number of sperm nuclei in the cross section of convoluted seminiferous tubules; D. The thickness of seminiferous epithelium on the cross section of convoluted seminiferous tubules. Different letters in the graph indicate significant differences (P < 0.05), and the same letter indicate on significant differences (P>0.05), the same as below 图 1 睾丸GSI与组织学发育 Fig. 1 Testicular GSI and histological development |
检测公鸭血清中的生殖激素水平,发现缩短光照会明显抑制睾酮、LH和PRL的分泌。与长光照条件相比,光照缩短后,血液睾酮和LH浓度均在d21显著下降(P < 0.05),并维持低水平至试验结束;血液PRL水平的变化趋势与前两者相似,在d30出现显著下降(P < 0.05),并一直维持低水平(图 2)。
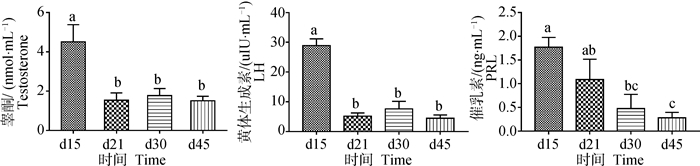
|
图 2 公鸭血清生殖激素水平 Fig. 2 Serum reproductive hormone levels of male ducks |
检测公鸭生殖轴主要因子的基因表达水平发现(图 3),短光照会抑制生殖轴促生殖因子的表达,而促进生殖抑制因子的表达。与长光照条件对比,短光照对下丘脑GnRH、垂体FSH、LH和睾丸FSHR和LHR的基因表达形成一定程度的抑制作用,但未达显著水平(P>0.05);对下丘脑GnIH和垂体GnIHR的基因表达具有促进作用,但未达显著水平(P>0.05);短光照对垂体GnRHR的基因表达在d15无明显影响,而在d45则显著促进其表达(P < 0.05),其中的原因有待探究。
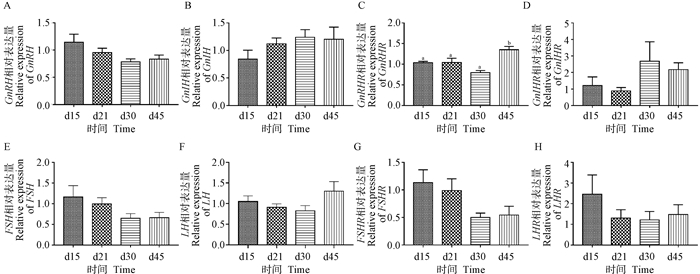
|
A、B.下丘脑GnRH、GnIH表达水平;C-F.垂体GnRHR、GnIHR、FSH、LH表达水平;G、H.睾丸FSHR、LHR表达水平 A, B. The expression gene level of GnRH, GnIH in hypothalamus; C-F. The expression gene level of GnRHR, GnIHR, FSH, LH in pituitary; G, H. The expression gene level of FSHR, LHR in testis 图 3 HPG轴主要生殖激素基因表达水平 Fig. 3 Expression levels of major reproductive hormone genes in the HPG-axis |
检测OPN5-TSH-DIO2/DIO3通路相关因子的表达,发现短光照处理会抑制该通路主要促进因子的表达,而促进抑制因子的表达(图 4),即抑制该通路的效率。与长光照条件相比,短光照显著抑制了OPN5的表达,OPN5的基因和蛋白表达水平在d21、d30、d45均显著低于d15(P < 0.05);也显著抑制了TSH-β、DIO2的表达,使d21、d30、d45的TSH-β、DIO2的基因表达均显著低于d15(P < 0.05),DIO2的蛋白表达水平则未出现显著变化(P> 0.05);明显促进DIO3的表达,d30、d45的DIO3蛋白表达水平显著高于d15(P < 0.05),但基因表达水平差异不显著。短光照对OPN4的基因表达无明显规律性,对VAOPN的基因表达则无明显影响。
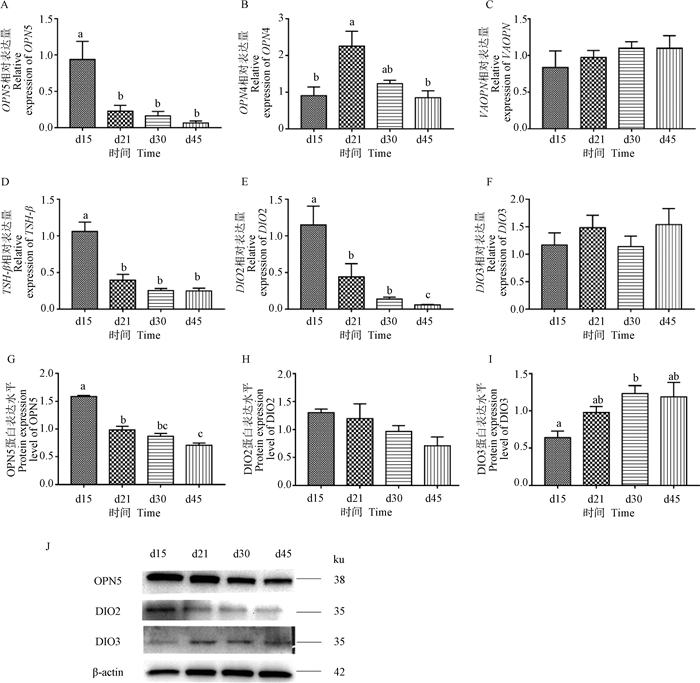
|
A~F.下丘脑OPN5、OPN4、VAOPN、TSH-β、DIO2、DIO3基因表达水平;G~J. OPN5、DIO2、DIO3的蛋白表达水平 A-F. The expression gene level of OPN5, OPN4, VAOPN, TSH-β, DIO2, DIO3 in hypothalamus; G-J.The expression protein level of OPN5, DIO2 and DIO3 图 4 OPN5-TSH-DIO2/DIO3通路相关因子的表达水平 |
检测公鸭生殖轴VIP、PRL和PRLR的基因表达水平发现(图 5),短光照对VIP-PRL通路的基因表达形成抑制。与长光照条件下相比,下丘脑VIP的基因表达在d21、d30、d45均显著低于d15(P < 0.05);垂体PRL的基因表达变化与下丘脑VIP的相一致,在d21、d30、d45的水平均显著低于d15(P < 0.05);垂体PRLR的基因表达水平上升,d45的水平明显高于d15(P < 0.05);睾丸中PRLR的基因表达的变化趋势则与下丘脑VIP和垂体PRL的相一致,d30和d45的水平显著低于d15(P < 0.05)。
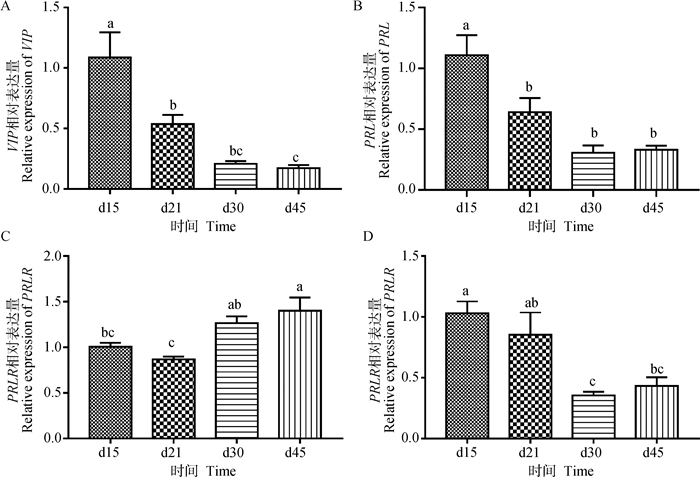
|
A.下丘脑VIP基因表达水平;B-C.垂体PRL、PRLR基因表达水平;D.睾丸PRLR基因表达水平 A. The expression gene level of VIP in hypothalamus; B-C. The expression gene level of PRL, PRLR in pituitary; D. The expression gene level of PRLR in testicular 图 5 VIP-PRL通路基因表达水平 Fig. 5 Expression of genes level in VIP-PRL pathway |
众所周知,动物的繁殖活动主要受下丘脑-垂体-性腺轴的调控,光照对禽(鸟)类繁殖机能的调控也同样通过调控生殖轴激素的生成和分泌来实现。大量的研究表明,延长光照时间能促进鸡睾酮的合成与分泌,促进睾丸发育和精子生成[27-28];在高纬度北极地区的斯瓦尔巴松鸡上,血液中PRL、LH激素的水平会随着日照时间的延长升高[29]。在季节性繁殖禽类上,日照的延长会促进扬州鹅体内睾酮等激素的分泌[30];随着光照时间的缩短,马冈鹅血液中PRL水平下降,LH和睾酮水平上升[31];但适当地延长光照时间,对马冈鹅睾丸机能具有一定促进作用[32]。在生产实践中,正常繁殖期山麻鸭普遍采用18 h光照处理,使鸭处于最佳繁殖状态。在本试验中,对正常繁殖期的山麻鸭进行8 h的短光照处理,直接导致公鸭睾丸机能退化,睾丸指数下降,所得结果与国内外相关的研究报道一致。具体表现在,随着短光照处理,公鸭睾丸曲细精管管壁变薄,管壁中生精细胞密度下降,空腔化严重,管腔中央精子数量减少。血液主要生殖激素水平的变化与睾丸组织学变化相一致,睾酮和LH浓度显著下降。在生殖轴上游,短光照处理导致鸭下丘脑中GnRH表达下降,下丘脑GnIH和垂体GnIHR表达上升,这与下丘脑GnRH、GnIH在HPG轴对生殖发挥重要作用的相关研究报道相一致[18, 33]。在性腺层面,FSHR和LHR的基因表达受到短光照的抑制,这与相关研究报道一致[7]。
光照是通过何种通路或机制来调控禽类生殖轴实现对禽类繁殖活动的调控?目前相关的研究比较多,其中OPN5-TSH-DIO2/DIO3通路和VIP-PRL通路可能发挥了重要作用。研究表明,OPN5作为鸟类的DBPs之一,通过感知光信号的变化参与鸟类繁殖性状的调控[34]。有研究报道,OPN5介导长光照对鹌鹑睾丸的刺激,诱发TSH合成并提高鹌鹑繁殖性能[12],长光照下下丘脑内侧基底核(mediobasal hypothalamus,MBH)内的DIO2相对表达量比短光照条件下更高[35];光照延长(8~16 h)也能提高红头雀OPN5的表达量[36],在匈牙利白鹅上会同时促进OPN5、TSH、DIO2基因表达[37]。这些结果说明,OPN5-TSH-DIO2/ DIO3通路介导了光照对禽类繁殖活动的调控。在本试验中,短光照处理下调了下丘脑OPN5的基因和蛋白表达,进而导致TSH-β基因表达和DIO2基因和蛋白表达水平显著下降,而DIO3基因和蛋白表达水平上升。有研究表明,OPN5神经元可以诱导TSH的分泌,TSH可以刺激诱导MBH内第三脑室腹侧壁的室管膜细胞生成DIO2,使四碘甲状腺原氨酸(T4)转换为三碘甲状腺原氨酸(T3),进而影响生殖轴上游GnRH和GnIH的合成与分泌,DIO3的作用则与DIO2相反,主要是将T4和T3转化为非活性代谢物T2和rT3[38]。因此,本研究的结果进一步验证了OPN5-TSH-DIO2/DIO3通路参与光照对禽类繁殖活动的调控,与国内外相关的研究报道相一致[39]。
VIP-PRL通路在光照对禽类繁殖调控中也发挥着重要作用。有研究显示,VIP作为PRL的释放因子,能促进催乳素分泌细胞产生cAMP[40],也参与了中枢5-羟色胺刺激PRL的分泌[41];注射VIP能促进鸽子血浆中PRL水平明显的升高,且呈剂量依赖关系[23]。高水平的PRL可以通过抑制下丘脑GnRH和促进GnIH的分泌,抑制垂体促性腺激素的分泌[42-43]。在山麻鸭和金定蛋鸭上,延长光照能促进VIP和PRL的生成和分泌,进而提高蛋鸭产蛋性能[5, 44];而在季节性繁殖禽类中,延长光照导致马冈鹅VIP和PRL的基因表达和血液PRL激素水平上升,使鹅繁殖性能受到抑制,产蛋量下降[9]。在本研究中,短光照导致下丘脑VIP、垂体PRL、睾丸PRLR的基因表达及血液PRL浓度显著降低,这与国内外相关研究报道一致,但与短日照繁殖型季节性繁殖禽类-马冈鹅的相关报道不一致。因此,PRL对禽类繁殖活性的促进可能存在一个适度水平,过高或过低水平的PRL对禽类繁殖活性都会产生抑制作用,但高低水平在不同禽类上有所不同,这在国内外的许多报道中也得到印证。一般而言,高水平PRL会抑制禽类繁殖。大量的研究表明,血液中高浓度的PRL会导致鸡卵泡闭锁[45];被动免疫抗PRL抗体可以通过中和内源性PRL,促进火鸡产蛋并抑制就巢[46];对白来航鸡主动免疫PRL后,也能降低血清中PRL水平,升高孕酮、雌二醇和LH的激素水平,并提高产蛋[47]。但是,有研究发现,低水平PRL能抑制火鸡繁殖活性[48],对生长中的公鸡免疫PRL会抑制睾丸发育,延迟性成熟时间[49]。至于其中的调控机制尚不明确,需进一步研究。本研究结果进一步证实,VIP-PRL通路介导了光照对禽类繁殖活动的调控,短光照对山麻鸭睾丸机能的抑制作用可能与短光照导致的低水平PRL相关。
综上,本研究结果证实,在光照对山麻鸭繁殖性能的调控中,OPN5-TSH-DIO2/DIO3和VIP-PRL通路发挥了重要介导作用,但其中两通路之间的调控关系如何,目前仍不清楚,需要进一步的研究工作来揭示。
4 结论本研究表明,在短光照抑制公山麻鸭睾丸机能的过程中,OPN5-TSH-DIO2/DIO3和VIP-PRL通路发挥了重要调控作用。短光照通过影响两通路中相关基因和蛋白的表达降低了通路效率,下调了生殖轴活性,从而抑制公鸭睾丸机能。研究结果证明,OPN5-TSH-DIO2/DIO3和VIP-PRL通路介导了光照对鸭繁殖活动的调控作用,其中两通路的相互调控关系仍需进一步研究。
| [1] |
SHINOMIYA A, SHIMMURA T, NISHIWAKI-OHKAWA T, et al. Regulation of seasonal reproduction by hypothalamic activation of thyroid hormone[J]. Front Endocrinol, 2014, 5: 12. |
| [2] |
NAKAYAMA T, YOSHIMURA T. Seasonal rhythms: the role of thyrotropin and thyroid hormones[J]. Thyroid, 2018, 28(1): 4-10. DOI:10.1089/thy.2017.0186 |
| [3] |
刘宏祥, 朱春红, 宋卫涛, 等. 光照时长对鸭产蛋性能的影响[J]. 中国家禽, 2020, 42(3): 114-116. LIU H X, ZHU C H, SONG W T, et al. Effects of illumination durations on laying performance of duck[J]. China Poultry, 2020, 42(3): 114-116. DOI:10.16372/j.issn.1004-6364.2020.03.023 (in Chinese) |
| [4] |
江丹莉, 潘建秋, 杨博, 等. 不同光照时间对蛋鸭产蛋及生殖激素的影响[J]. 仲恺农业工程学院学报, 2018, 31(2): 37-41. JIANG D L, PAN J Q, YANG B, et al. Effects of different lighting time on the egg production and reproductive hormone of duck[J]. Journal of Zhongkai University of Agriculture and Engineering, 2018, 31(2): 37-41. DOI:10.3969/j.issn.1674-5663.2018.02.008 (in Chinese) |
| [5] |
LIUFU S, PAN J Q, SUN J F, et al. OPN5 regulating mechanism of follicle development through the TSH-DIO2/DIO3 pathway in mountain ducks under different photoperiods[J]. Front Physiol, 2022, 13: 813881. DOI:10.3389/fphys.2022.813881 |
| [6] |
陈思颖, 陈维虎, 于静, 等. 光照对浙东白鹅产蛋及就巢相关行为的影响[J]. 中国畜牧杂志, 2021, 57(6): 243-247. CHEN S Y, CHEN W H, YU J, et al. Effects of light on laying and nest-related behaviors of East Zhejiang white geese[J]. Chinese Journal of Animal Science, 2021, 57(6): 243-247. DOI:10.19556/j.0258-7033.20200726-01 (in Chinese) |
| [7] |
ZHOU X L, JIANG D L, ZHANG Z S, et al. Expression of GnIH and its effects on follicle development and steroidogenesis in quail ovaries under different photoperiods[J]. Poult Sci, 2022, 101(12): 102227. DOI:10.1016/j.psj.2022.102227 |
| [8] |
黄江南, 刘林秀, 武艳平, 等. 光照时间对兴国灰鹅产蛋和PRL、FSHβ、LH mRNA表达的影响[J]. 江西农业大学学报, 2015, 37(2): 308-313. HUANG J N, LIU L X, WU Y P, et al. Effects of light exposure on egg production and mRNA expression of PRL, FSHβ, LH of Xingguo gray geese[J]. Acta Agriculturae Universitatis Jiangxiensis, 2015, 37(2): 308-313. (in Chinese) |
| [9] |
PAN J Q, LIUFU S, SUN J F, et al. Long-day photoperiods affect expression of OPN5 and the TSH-DIO2/DIO3 pathway in Magang goose ganders[J]. Poult Sci, 2022, 101(10): 102024. DOI:10.1016/j.psj.2022.102024 |
| [10] |
ROSE E M, HAAKENSON C M, BALL G F. Sex differences in seasonal brain plasticity and the neuroendocrine regulation of vocal behavior in songbirds[J]. Horm Behav, 2022, 142: 105160. DOI:10.1016/j.yhbeh.2022.105160 |
| [11] |
NAKAO N, ONO H, YAMAMURA T, et al. Thyrotrophin in the pars tuberalis triggers photoperiodic response[J]. Nature, 2008, 452(7185): 317-322. DOI:10.1038/nature06738 |
| [12] |
NAKANE Y, IKEGAMI K, ONO H, et al. A mammalian neural tissue opsin (Opsin 5) is a deep brain photoreceptor in birds[J]. Proc Natl Acad Sci U S A, 2010, 107(34): 15264-15268. DOI:10.1073/pnas.1006393107 |
| [13] |
KANG S W, KUENZEL W J. Deep-brain photoreceptors (DBPs) involved in the photoperiodic gonadal response in an avian species, Gallus gallus[J]. Gen Comp Endocrinol, 2015, 211: 106-113. DOI:10.1016/j.ygcen.2014.11.020 |
| [14] |
BEAUDRY F E G, IWANICKI T W, MARILUZ B R Z, et al. The non-visual opsins: eighteen in the ancestor of vertebrates, astonishing increase in ray-finned fish, and loss in amniotes[J]. J Exp Zool Part B Mol Dev Evol, 2017, 328(7): 685-696. DOI:10.1002/jez.b.22773 |
| [15] |
HALFORD S, PIRES S S, TURTON M, et al. VA Opsin-based photoreceptors in the hypothalamus of Birds[J]. Curr Biol, 2009, 19(16): 1396-1402. DOI:10.1016/j.cub.2009.06.066 |
| [16] |
张磊, 康波, 姜冬梅, 等. 神经视蛋白的结构及其生物学功能研究进展[J]. 西北农林科技大学学报: 自然科学版, 2015, 43(8): 46-50. ZHANG L, KANG B, JIANG D M, et al. Progress in structure and biological functions of neuropsin[J]. Journal of Northwest A&F University: Natural Science Edition, 2015, 43(8): 46-50. (in Chinese) |
| [17] |
YAMASHITA T. Unexpected molecular diversity of vertebrate nonvisual opsin Opn5[J]. Biophys Rev, 2020, 12(2): 333-338. DOI:10.1007/s12551-020-00654-z |
| [18] |
BENOIT J. The role of the eye and of the hypothalamus in the photostimulation of gonads in the duck[J]. Ann N Y Acad Sci, 1964, 117(1): 204-215. |
| [19] |
田继康, 靳岚. 血管活性肠肽的研究进展[J]. 药物生物技术, 2013, 20(6): 560-563. TIAN J K, JIN L. Research progress in vasoactive intestinal peptide[J]. Pharmaceutical Biotechnology, 2013, 20(6): 560-563. DOI:10.19526/j.cnki.1005-8915.2013.06.023 (in Chinese) |
| [20] |
张耀, 郭定宗. 催乳素结构与功能研究进展[J]. 动物医学进展, 2007, 28(5): 49-52. ZHANG Y, GUO D Z. Progress on structure and function of prolactin[J]. Progress in Veterinary Medicine, 2007, 28(5): 49-52. DOI:10.3969/j.issn.1007-5038.2007.05.015 (in Chinese) |
| [21] |
LI X, JI W, SUN G, et al. Cloning and expression analysis of PRL and PRLR genes in black Muscovy duck[J]. Br Poult Sci, 2020, 61(1): 92-96. DOI:10.1080/00071668.2019.1680800 |
| [22] |
GUMUŁKA M, HRABIA A, AVITAL-COHEN N, et al. The effect of parachlorophenylalanine treatment on the activity of gonadal and lactotrophic axes in native Polish crested chickens stimulated to broodiness[J]. Poult Sci, 2020, 99(5): 2708-2717. DOI:10.1016/j.psj.2019.12.015 |
| [23] |
LEA R W, VOWLES D M. Vasoactive intestinal polypeptide stimulates prolactin release in vivo in the ring dove (Streptopelia risoria)[J]. Experientia, 1986, 42(4): 420-422. DOI:10.1007/BF02118639 |
| [24] |
SHARP P J. Strategies in avian breeding cycles[J]. Anim Prod Sci, 1996, 42(1-4): 505-513. |
| [25] |
GENG A L, ZHANG J, ZHANG Y, et al. Effects of lighting regimes on performance, pineal melanopsin expression and melatonin content in native laying hens aged from 19 to 34 weeks[J]. Poult Sci, 2022, 101(1): 101567. DOI:10.1016/j.psj.2021.101567 |
| [26] |
CHEN R, GUO R H, ZHU H X, et al. Development of a sandwich ELISA for determining plasma prolactin concentration in domestic birds[J]. Domest Anim Endocrinol, 2019, 67: 21-27. DOI:10.1016/j.domaniend.2018.11.001 |
| [27] |
苑志宇, 董杨云逸, 李锰, 等. 不同光照周期对鸡睾酮合成的影响[J]. 中国畜牧杂志, 2019, 55(3): 99-102. YUAN Z Y, DONG Y Y Y, LI M, et al. Effects of different photoperiod on testosterone synthesis of roosters[J]. Chinese Journal of Animal Science, 2019, 55(3): 99-102. (in Chinese) |
| [28] |
KUENZEL W J, KANG S W, ZHOU Z J. Exploring avian deep-brain photoreceptors and their role in activating the neuroendocrine regulation of gonadal development[J]. Poult Sci, 2015, 94(4): 786-798. DOI:10.3382/ps.2014-4370 |
| [29] |
SHARP P J, BLACHE D. A neuroendocrine model for prolactin as the key mediator of seasonal breeding in birds under long-and short-day photoperiods[J]. Can J Physiol Pharmacol, 2003, 81(4): 350-358. DOI:10.1139/y03-025 |
| [30] |
ZHU H X, HU M D, GUO B B, et al. Effect and molecular regulatory mechanism of monochromatic light colors on the egg-laying performance of Yangzhou geese[J]. Anim Reprod Sci, 2019, 204: 131-139. DOI:10.1016/j.anireprosci.2019.03.015 |
| [31] |
黄运茂, 施振旦, 李孝伟, 等. 光照对马岗鹅季节性繁殖活动和内分泌的调控[J]. 畜牧兽医学报, 2008, 39(1): 29-36. HUANG Y M, SHI Z D, LI X W, et al. Regulation of photoperiod on seasonal reproductive activities and endocrine in Magang Geese[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(1): 29-36. (in Chinese) |
| [32] |
唐珊珊, 卢光熹, 陈元音, 等. 控制光照对非繁殖期种公鹅睾丸形态和组织学结构变化的研究[J]. 华南农业大学学报, 1989, 10(1): 59-64. TANG S S, LU G X, CHEN Y Y, et al. The effect of controlled light on the morphology and histological structure of the testes of stud Gandrs[J]. Journal of South China Agricultural University, 1989, 10(1): 59-64. (in Chinese) |
| [33] |
SINGH P, ANJUM S, SRIVASTAVA R K, et al. Central and peripheral neuropeptide RFRP-3:a bridge linking reproduction, nutrition, and stress response[J]. Front Neuroendocrinol, 2022, 65: 100979. DOI:10.1016/j.yfrne.2022.100979 |
| [34] |
CALLIGARO H, DKHISSI-BENYAHYA O, PANDA S. Ocular and extraocular roles of neuropsin in vertebrates[J]. Trends Neurosci, 2022, 45(3): 200-211. DOI:10.1016/j.tins.2021.11.008 |
| [35] |
YOSHIMURA T, YASUO S, WATANABE M, et al. Light-induced hormone conversion of T4 to T3 regulates photoperiodic response of gonads in birds[J]. Nature, 2003, 426(6963): 178-181. DOI:10.1038/nature02117 |
| [36] |
MAJUMDAR G, RANI S, KUMAR V. Hypothalamic gene switches control transitions between seasonal life history states in a night-migratory photoperiodic songbird[J]. Mol Cell Endocrinol, 2015, 399: 110-121. DOI:10.1016/j.mce.2014.09.020 |
| [37] |
ZHU H X, LIU X Q, HU M D, et al. Endocrine and molecular regulation mechanisms of the reproductive system of Hungarian White geese investigated under two artificial photoperiodic programs[J]. Theriogenology, 2019, 123: 167-176. DOI:10.1016/j.theriogenology.2018.10.001 |
| [38] |
NAKANE Y, YOSHIMURA T. Universality and diversity in the signal transduction pathway that regulates seasonal reproduction in vertebrates[J]. Front Neurosci, 2014, 8: 115. |
| [39] |
NAKANE Y, YOSHIMURA T. Deep brain photoreceptors and a seasonal signal transduction cascade in birds[J]. Cell Tissue Res, 2010, 342(3): 341-344. |
| [40] |
GOURDJI D, BATAILLE D, VAUCLIN N, et al. Vasoactive intestinal peptide (VIP) stimulates prolactin (PRL) release and cAMP production in a rat pituitary cell line (GH3/B6).Additive effects of VIP and TRH on PRL release[J]. FEBS Lett, 1979, 104(1): 165-168. |
| [41] |
OHTA H, KATO Y, SHIMATSU A, et al. Inhibition by antiserum to Vasoactive Intestinal Polypeptide (VIP) of prolactin secretion induced by serotonin in the rat[J]. Eur J Pharmacol, 1985, 109(3): 409-412. |
| [42] |
CICCONE N A, DUNN I C, BOSWELL T, et al. Gonadotrophin inhibitory hormone depresses gonadotrophin α and follicle-stimulating hormone β subunit expression in the pituitary of the domestic chicken[J]. J Neuroendocrinol, 2004, 16(12): 999-1006. |
| [43] |
ROZENBOIM I, TABIBZADEH C, SILSBY J L, et al. Effect of ovine prolactin administration on hypothalamic vasoactive intestinal peptide (VIP), gonadotropin releasing hormone Ⅰ and Ⅱ content, and anterior pituitary VIP receptors in laying turkey hens[J]. Biol Reprod, 1993, 48(6): 1246-1250. |
| [44] |
CUI Y M, WANG J, ZHANG H J, et al. Effects of photoperiod on performance, ovarian morphology, reproductive hormone level, and hormone receptor mRNA expression in laying ducks[J]. Poult Sci, 2021, 100(4): 100979. |
| [45] |
TABIBZADEH C, ROZENBOIM I, SILSBY J L, et al. Modulation of ovarian cytochrome P450 17 α-hydroxylase and cytochrome aromatase messenger ribonucleic acid by prolactin in the domestic turkey[J]. Biol Reprod, 1995, 52(3): 600-608. |
| [46] |
CRISÓSTOMO S, GUÉMENÉ D, GARREAU-MILLS M, et al. Prevention of incubation behavior expression in Turkey hens by active immunization against prolactin[J]. Theriogenology, 1998, 50(4): 675-690. |
| [47] |
REDDY I J, DAVID C G, RAJU S S. Effect of suppression of plasma prolactin on luteinizing hormone concentration, intersequence pause days and egg production in domestic hen[J]. Domest Anim Endocrinol, 2007, 33(2): 167-175. |
| [48] |
GUÉMENÉ D, WILLIAMS J B. Relationships between broodiness expression laying persistency and concentrations of hormones during the first productive period in turkey hens (Meleagris gallopavo)[J]. Reprod Nutr Dev, 1994, 34(4): 371-381. |
| [49] |
ZHU H X, LIU X Q, CAI L P, et al. Cellular and molecular mechanisms of low dose prolactin potentiation of testicular development in cockerels[J]. Domest Anim Endocrinol, 2019, 69: 51-61. |
(编辑 郭云雁)



