2. 西南民族大学畜牧兽医学院, 成都 610041
2. College of Animal Science and Veterinary Medicine, Southwest Minzu University, Chengdu 610041, China
随着人们消费水平的提高,消费者不仅追求肉类的品质,而且追求肉类的绿色健康,而山羊肉同时包含了这两个特点[1],因此山羊肉逐渐受到消费者的青睐。肌内脂肪含量是判断动物肉质好坏的指标之一[2-4],也是决定山羊肉风味的重要因素[5-10],具有丰富肌内脂肪的肉类产品逐渐进入到高端的消费市场中。研究表明,前体脂肪细胞分化与肌内脂肪的形成密切相关。前体脂肪细胞是一种类成纤维细胞,在分化过程中吸收脂质,最终成为成熟的脂肪细胞[11-12]。此过程包含许多基因之间的表达,例如C/EBPα、C/EBPβ、LPL等[13-16]。因此,明确山羊肌内脂肪分化的分子机制对改善羊肉品质和风味有重要意义。
在动物体内,脂肪组织中的甘油三酯储存在脂滴中。脂滴是一种大小相差极其悬殊的细胞器:新生的脂滴直径小于100 nm,小于绝大多数细胞器,而在成熟白色脂肪细胞中可达100 μm以上[17]。脂肪细胞的脂质代谢主要由甘油三酯的合成和分解代谢组成,其中脂肪分解酶在分解代谢中发挥重要作用,在其作用下将甘油三酯分解为甘油和游离的脂肪酸,并运送到血液中进行氧化供能[18]。所以甘油三酯的含量变化是判断脂肪细胞分化过程以及脂滴形成的一个关键指标。
载脂蛋白主要功能是通过血液和淋巴运输脂质,其不仅是脂蛋白的组成成分,而且还是细胞表面受体的配体和酶的辅助因子。可调节脂蛋白酶活性,激活卵磷脂胆固醇酰基转移酶,通过影响胆固醇的代谢而影响血脂代谢[19]。有研究报道,脂蛋白A-IV(apolipoprotein A-IV,APOA4)可影响肝脏甘油三酯的分泌,且肝脏中甘油三酯含量和APOA4 mRNA相关[20]。另外体内外试验研究表明,血浆中APOA4有助于胆固醇逆转运过程,进而影响血浆TC含量[21-22]。脂蛋白脂肪酶在脂肪的合成和分解中发挥了重要作用[23],并且脂蛋白脂肪酶水解会催化甘油三酯降解为脂肪酸,以供组织利用[24],而脂蛋白脂肪酶又受APOA4的调节[25],基于此,推测APOA4间接参与了这一系列过程。
本试验首先克隆获得山羊APOA4基因序列,其次明确山羊APOA4基因的组织及时序表达模式,并利用过表达手段阐明山羊APOA4基因对肌内脂肪细胞分化的影响,研究结果为明确该基因的功能及分子标记辅助育种提供基础资料。
1 材料与方法 1.1 试验材料1.1.1 试验样品的采集 本试验所用动物为1周岁生理状态良好,舍饲的简州大耳羊公羊(n=5),屠宰后取所需的组织置于液氮中保存备用。屠宰后采集其心、肝、脾、肺、肾、皮下脂肪、背(背最长肌)、肾周脂肪8个组织,DEPC水去除RNA酶,置于无酶冻存管中液氮贮存。
1.1.2 主要材料 反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)、TurboFect Transfection Reagent购自Thermo公司;感受态细胞(TreliefTM 5α Chemically Competent Cell)购自成都擎科生物技术有限公司;胶回收试剂盒购自天根生化科技有限公司;氨苄青霉素钠(Ampicillin)购自Biosharp公司;Hind Ⅲ、Xho Ⅰ、Primer STAR Max DNA Polymerase和TRIzol均购自TaKaRa公司;双抗、胎牛血清及DEME/F12培养基购自Gibco公司;DEPC、油酸购自Sigma公司。
1.2 试验方法1.2.1 RNA的提取及反转录 按RNAiso Plus法提取山羊各组织总RNA,使用Revert Aid MM试剂盒将RNA反转录成cDNA,冷冻保存备用。
1.2.2 山羊APOA4基因克隆 根据山羊APOA4的预测序列(Gene ID:1062905363)利用Primer Primer 5.0设计克隆性引物(表 1)。以山羊肝组织为模板,PCR反应体系为:Primer STAR Max DNA Polymerase酶12.5 μL、ddH2O 9.5 μL、上、下游引物各1 μL、cDNA 1 μL。胶回收完成后以10 μL体系在金属浴中进行连接:目的基因100 ng、007VS 2 μL、ddH2O补齐10 μL。将连接体转化进感受态细胞中,用涂布器均匀涂在固体培养基,37 ℃培养箱培养12 h左右,挑菌后进行菌液PCR检测并送公司测序。
|
|
表 1 引物信息 Table 1 Primers information |
1.2.3 山羊APOA4基因的生物信息学分析 基因序列生物信息学分析内容及软件网址见表 2。
|
|
表 2 生物信息学分析内容及工具 Table 2 Bioinformatics analysis content and corresponding analysis tools |
1.2.4 山羊APOA4基因时序表达谱的构建 提取诱导分化0~144 h的山羊肌内细胞RNA,利用实时荧光定量qPCR检测APOA4在各个时段的表达情况,所用引物见表 1。
1.2.5 山羊APOA4过表达载体构建 根据山羊APOA4基因CDS区序列和pEGFP-N1载体,选择酶切位点Hind Ⅲ和Xho I,设计亚克隆引物(表 1)。用Hind Ⅲ和Xho Ⅰ对载体和亚克隆获得的山羊APOA4基因进行双酶切,用T4酶连接纯化后的产物,随即转化至DH5α感受态细胞,接种、挑菌及测序方法同“1.2.2”,待菌液浑浊进行菌液PCR检测并测序。
1.2.6 山羊肌内脂肪细胞培养及转染 本次试验沿用实验室细胞复苏方法,37 ℃水浴复苏细胞,接种至细胞培养皿且加入6 mL 10%FBS培养基,待细胞密度在80%左右时进行传代,显微镜观察细胞传至第3代长至80%进行转染,组别设置为2组:山羊APOA4过表达组(pEGFP-N1-APOA4)和pEGFP-N1阴性对照组。转染过程为:将pEGFP-N1-APOA4和pEGFP-N1质粒1 μg与转染试剂4 μL及200 mL的无血清培养基混匀,室温孵育15 min,然后滴加到细胞中置于培养箱培养18 h后加油酸诱导液,加入诱导液2 d后收集细胞备用。
1.2.7 油红O染色、Bodipy染色及DAPI染色 用于染色的细胞接种于24孔板。中性甲醛(10%)固定细胞30 min,用PBS缓冲液清洗2遍。每孔加入150 μL油红O、Bodipy和DAPI染料,染色30 min后用PBS清洗3遍,随即用显微镜观察并拍照。拍照结束后每孔加入1 mL异丙醇溶解油红O,并于酶标仪中测定490 nm处吸光值(OD490 nm)。
1.2.8 qPCR检测过表达效率及脂肪细胞分化标志基因的表达 以“1.2.6”中得到的cDNA为模板,检测山羊APOA4过表达效率以及脂肪细胞分化标志基因的表达差异,qPCR引物信息见表 1。
1.2.9 数据统计与分析 采用2-△△Ct法对数据进行处理,用SPSS软件中的One-way ANOVA对数据进行显著性分析,P < 0.05表示差异显著,P < 0.01表示差异极显著,使用Graph Pad Prism 5.0绘图。
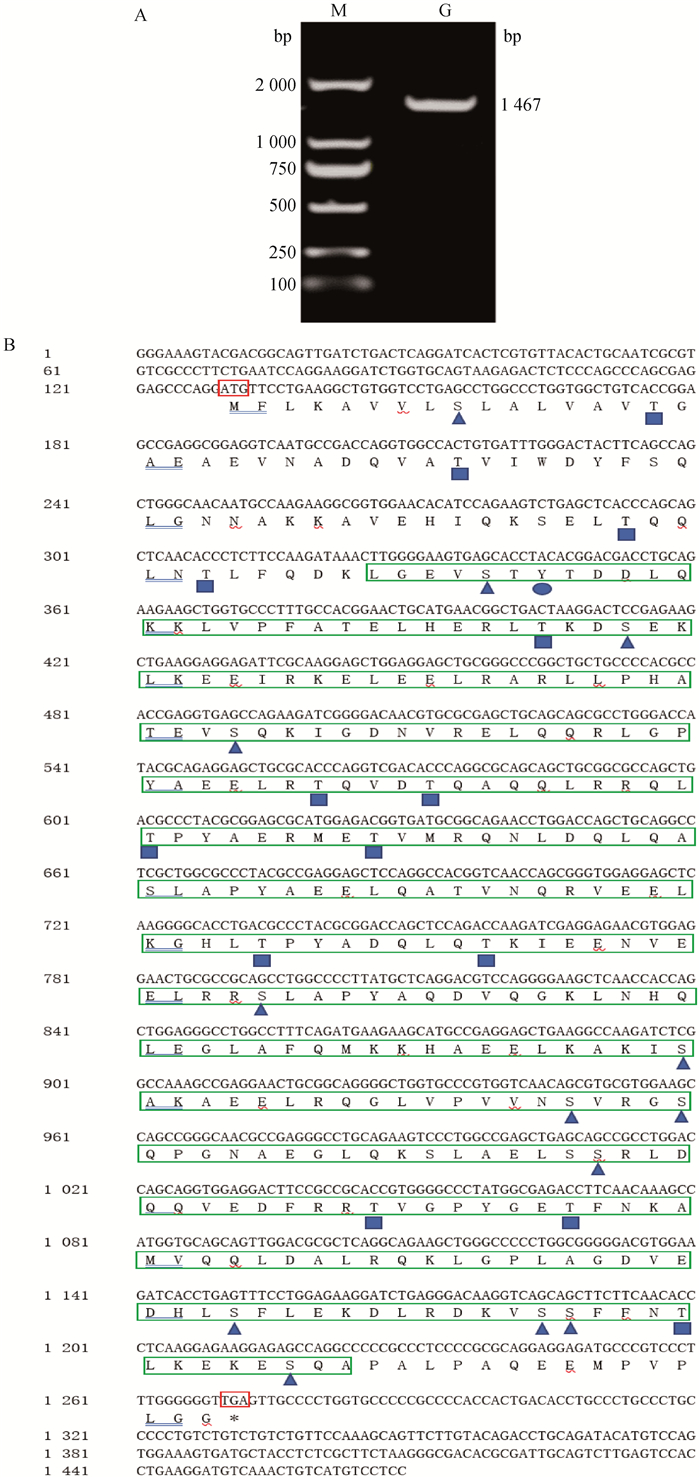
2 结果 2.1 山羊APOA4基因克隆克隆得到与预期相符的产物片段,经分析发现得到山羊APOA4序列为1 467 bp,CDS区为1 143 bp,共编码380个氨基酸(图 1A),生物信息学分析结果如图 1B、2B所示。
|
A. 山羊APOA4基因扩增:M. DNA相对分子质量标准;G.APOA4。B.理化性质分析结果:图中绿色方框部分表示功能结构域;▲■●分别标记丝氨酸、苏氨酸、酪氨酸磷酸化位点(共28个);红色方框代表起始和终止密码子。(APOA4登录号:APOA4ON792313) A. Amplification of APOA4 gene: M.DL2000 DNA Marker; G.APOA4 gene. B. Physical and chemical analysis results: the green box in the figure represents the functional domain; ▲■● respectively labeled serine, threonine, tyrosine phosphorylation sites (a total of 28); The red boxes represent start and stop codons. (APOA4 login number: APOA4ON792313) 图 1 山羊APOA4基因分析 Fig. 1 The analysis of APOA4 gene in goat |

|
A. 山羊APOA4定位;B. APOA4二级结构预测;C. APOA4三级结构预测;D. 部分APOA4序列(XM_005689482.3)与克隆APOA4序列比较(绿色字母为突变位点,红色为相应氨基酸变化);E. 山羊APOA4互作蛋白预测 A. Subcellular localization of goat APOA4; B. Secondary structure prediction of APOA4; C. Tertiary structure prediction of APOA4; D. Comparison of partial APOA4 sequence(XM_005689482.3)with cloned APOA4 sequence(green letters are mutation sites, and red letters are the corresponding amino acid change); E. APOA4 interaction protein prediction 图 2 山羊APOA4结构分析 Fig. 2 Structural analysis of goat APOA4 |
功能结构域预测显示,山羊APOA4有2个载脂蛋白A1/A4/E结构域,分别位于66~235和210~ 365位氨基酸(图 1B)。山羊APOA4蛋白理化结果见表 3,山羊APOA4蛋白正负电荷氨基酸残基总数比为5 ∶4,PI为5.30,不稳定指数为51.97,亲水性总平均值为0.921(表 3),故推测山羊APOA4蛋白为带负电且属于酸性不稳定疏水蛋白。
|
|
表 3 山羊APOA4理化性质 Table 3 Physical and chemical properties of APOA4 protein |
亚细胞定位结果如图 2A所示,APOA4在细胞内分布从高到低依次为细胞外、内质网、液泡、细胞质。
通过在线软件对APOA4编码的蛋白质进行二级结构预测,结果显示其中包括α螺旋(Hh)、延伸链(Ee)、无规卷曲(Cc),组成这些结构的氨基酸数及占比分别为349(91.84%)、3(0.79%)、28(7.37%)(图 2B)。蛋白质三维空间结构与二级结构相符(图 2C)。
克隆的山羊APOA4基因序列与预测序列比对可见该基因第463位碱基产生突变,由G碱基突变为A碱基,但编码氨基酸仍为亮氨酸,属于同义突变(图 2D)。
使用STRING对APOA4进行蛋白互作分析并构建蛋白互作网,APOA4可能与TTR、ENSCHIP00000009034、APOA2、APOC2、APOC4、APOB、APOM、LPL、PON1和APOC3等蛋白存在互作关系(图 2E)。
2.3 山羊APOA4基因组织和时序表达分析山羊APOA4组织表达具有广泛性,在肝脏组织中的表达最高,极显著高于其他的组织(P < 0.01),肾周脂肪组织中表达量最低(图 3A)。成脂诱导分化后山羊APOA4基因整体表达水平呈上升趋势(图 3B),且在48 h时达到最高值,显著高于0 h (P < 0.05,图 3B-3C)。

|
A. 山羊APOA4基因组织表达谱;B. 山羊APOA4基因时序表达谱;C. 未诱导分化和诱导分化两天APOA4的表达量。不同大写字母为差异极显著(P < 0.01),不同小写字母为差异显著(P < 0.05);*.P < 0.05。下同 A. Tissue expression profile of goat APOA4 gene; B. Temporal expression profile of goat APOA4 gene; C. Expression of APOA4 at 2 days after uninduced and induced differentiation. There was significant difference between different capital letters (P < 0.01) and different lowercase letters (P < 0.05); *.P < 0.05. The same as below 图 3 山羊APOA4在不同组织和肌内前体脂肪细胞的表达量 Fig. 3 The expression levels of goat APOA4 in different tissues and intramuscular preadipocytes |
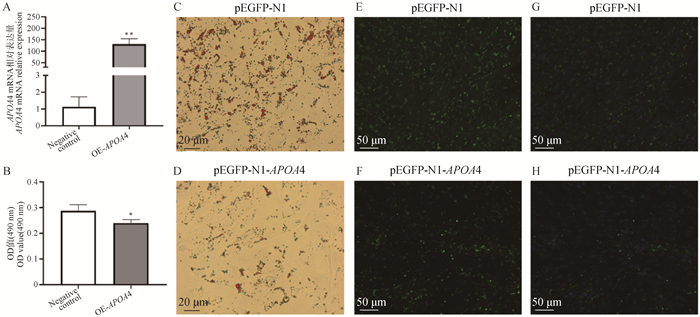
本研究成功构建了山羊APOA4过表达载体,上调表达量为131.26倍(P < 0.01,图 4A),形态学观察可见,过表达山羊APOA4后肌内脂肪细胞脂滴含量明显减少(图 4C-F)。定量检测OD值(量化油红O结果)表明OE-APOA4组的OD值显著降低(P < 0.05,图 4B)。过表达APOA4后同一视野下过表达组和对照组Bodipy染色和DAPI染色图(图 4G、H)。
|
A. 山羊APOA4基因过表达效率;B. OD值量化油红O染色结果;C、D、E、F、G、H.形态学观察(油红O染色:400×,Bodipy染色:200×,DAPI染色:200×)。C、E、G.对照组;D、F、H.过表达组 A. Overexpression efficiency of goat APOA4 gene; B. OD value quantifies the Oil Red O staining results; C.D.E.F.G.H. Morphological observation (Oil Red O staining: 400×; Bodipy staining: 200×; DAPI staining: 200×). C.E.G. The control group; D.F.H. The overexpression group 图 4 山羊APOA4过表达效率及肌内脂肪细胞形态学观察 Fig. 4 Overexpression efficiency and morphological observation of APOA4 in goats |
过表达山羊APOA4基因后脂肪分化标志基因C/EBPα、PPARγ表达极显著下调(P < 0.01),SREBP1、C/EBPβ表达水平显著下调(P < 0.05,图 5A)。脂代谢标志基因LPL、AP2表达水平显著下调(P < 0.05,图 5B)。

|
A. 过表达APOA4对脂肪细胞分化标志基因表达的影响;B. 过表达APOA4对脂质代谢基因表达的影响 A. Effect of overexpression of APOA4 on expression of differentiation marker genes; B. Effect of overexpression of APOA4 on expression of lipid metabolism genes 图 5 脂肪细胞分化标志基因表达水平 Fig. 5 Expression levels of adipocyte differentiation marker genes |
APOA4作为一种血浆脂蛋白,参与脂质代谢途径[19]等。首先APOA4可影响肝脏甘油三酯分泌[20]。其次脂滴的核心是由甘油三酯(ATG)和胆固醇酯等中性脂质形成的高度疏水的脂核[17]。脂蛋白脂肪酶参与了脂肪的合成与分解[23],并且脂蛋白脂肪酶水解会催化甘油三酯降解为脂肪酸,以供组织利用[24],而脂蛋白脂肪酶又受APOA4的调节[25]。本研究首先克隆获得包括CDS区的山羊APOA4基因序列1 143 bp,共编码380个AA。氨基酸序列分析结果显示,APOA4有28个磷酸化位点和4个N-糖基化位点,这些位点有助于细胞转录[26]。同时分析发现,山羊APOA4编码的蛋白在20~21位氨基酸处很可能存在信号肽区域,与刘洪瑜[27]对秦川牛APOA4基因的分析结果一致。蛋白相互作用预测结果显示,APOA4可能与TTR、ENSCHIP00000009034、APOA2、APOC2、APOC4、APOB、APOM、LPL、PON1和APOC3等蛋白存在互作关系。细胞定位结果显示,APOA4在细胞内分布从高到低依次为细胞外(66.6%)、内质网(11.1%)、液泡(11.1%)、细胞质(11.1%)。而同属APO家族成员,并且可能与APOA4有蛋白互作关系的APOC3基因在江乡猪[28]中的亚细胞定位结果为胞外基质占55.6%、内质网占22.2%、液泡占11.1%、细胞质占11.1%,与本试验预测结果基本一致。
本研究发现,APOA4基因在山羊多个组织中广泛表达,在肝脏中的表达最高,肾周组织中表达最低。冉黎等[29]研究发现,与APOA4可能存在互作关系的APOC3基因在山羊肝脏中表达相对较高,APOA4与APOC3为同家族成员且通过预测可能为互作蛋白,且组织表达规律基本一致。另有研究发现,APOA4在新生猪的小肠中表达较高[30]。基于猪和山羊APOA4组织表达特性差异,推测APOA4基因组织表达具有物种特异性。明确基因表达模式是阐明基因功能的基础,试验同时发现诱导分化后APOA4整体表达水平高于诱导分化前,且在分化48 h时达到最高值。冉黎等[29]研究发现,与APOA4可能存在有蛋白互作关系的APOC3基因在山羊肌内细胞中同样在诱导分化48 h表达量最高,极显著高于分化前。对于时序表达谱中60~ 144 h基因APOA4表达量显著降低这一结果:第一,推测可能是自噬导致了基因在各时间段的表达量不同,研究显示,人脂肪间充质干细胞在成脂过程中发生了自噬,免疫荧光检测LC3-Ⅱ的点状聚集在未分化时(0 d)较弱,于分化早期(1 ~ 3 d)增加明显,之后渐减弱至分化前水平。Western-blot检测LC3Ⅱ/Ⅰ于分化早期逐渐增高,之后开始下降[31]。另外自噬在脂肪细胞分化的过程中,能够降解KLF2和KLF3这两种脂肪细胞分化负调控因子。自噬对KLF2和KLF3的降解过程主要发生在脂肪细胞分化起始2~4 d[32]。并且前脂肪细胞分化为成熟脂肪细胞这一过程中,一些细胞器如线粒体、过氧化物酶体通过自噬被降解并最终被脂滴取代[33]。所以推测,在山羊肌内前体脂肪细胞分化的前期,自噬水平的增强导致细胞分化的速率增强进而促使APOA4的表达量升高,而随着诱导分化的时间变长,自噬水平降低导致脂肪细胞的分化水平变低,所以推测,APOA4在60~144 h的表达量相较于48 h变低。第二,推测可能是脂肪细胞的去分化造成的影响,细胞去分化是指在特定条件下终末分化的细胞失去原有的结构与功能,退回到分化程度较低的状态[34]。目前研究发现,成熟脂肪细胞作为一种终末分化的细胞,在体外培养过程或体内受到缺血、缺氧等刺激时可发生去分化,转变为成纤维细胞样的DFAT细胞,所以推测可能是由于去分化作用导致后期APOA4的表达量降低[35-36]。综上两个结果,细胞自噬和脂肪细胞去分化都可能是导致各时间段基因表达水平不同的原因。
本研究通过构建pEGFP-N1-APOA4过表达载体,过表达APOA4后肌内脂肪细胞脂滴积聚减少,脂肪细胞分化标志基因C/EBPβ、PPARγ、SREBP1、C/EBPα表达水平下调。其中,C/EBPβ是脂肪细胞分化的正调控因子,3T3-L1前体脂肪细胞或NIH-3T3细胞中,在没有激素诱导分化的情况下,过表达C/EBPβ促进生脂分化[37]。PPARγ作为配体激活的转录因子,在脂肪细胞分化中起着枢纽作用[38]。PPARγ激活后启动脂肪细胞分化及脂肪生成基因表达,导致甘油三酯合成与持续积累,调控脂肪细胞从发育到代谢的各个生物学过程[39-40]。研究发现,SREBP1为脂肪生成的正调节因子[41]。C/EBPα被认为也是脂肪生成的主要调节因子[42]。综上所述,脂肪分化调控因子C/EBPα、PPARγ、SREBP1、C/EBPβ在过表达APOA4后表达量下调,该结果与形态学结果相一致。过表达APOA4后,脂代谢基因LPL、AP2的表达水平显著下调。LPL的表达水平与脂质沉积息息相关[43],可以通过水解甘油三酯从而为机体提供游离脂肪酸[44],同时,LPL mRNA表达水平与肌内脂肪含量呈正相关[45]。AP2参与脂肪酸的转运过程[46]。结合以上分析及试验结果,表明过表达APOA4抑制山羊肌内脂肪细胞的脂质积聚。实验室后续将主要探究山羊基因APOA4对不同部位脂肪细胞分化影响。
4 结论本研究克隆得到包括CDS区为1 143 bp的山羊APOA4序列1 467 bp,共编码380个AA,其所编码蛋白是带负电且属于酸性不稳定疏水蛋白。山羊APOA4组织表达具有广泛性,在肝脏中的表达最高。通过下调脂肪分化标志基因C/EBPα、PPARγ、SREBP1、C/EBPβ和脂代谢标志基因LPL、AP2的表达水平进而抑制脂滴的聚集,提示APOA4是山羊肌内脂肪细胞分化的负向调节因子。
| [1] |
MIGDAL W, KAWĘCKA A, SIKORA J, et al. Meat quality of the native Carpathian goat breed in comparison with the Saanen breed[J]. Animals, 2021, 11(8): 2220. DOI:10.3390/ani11082220 |
| [2] |
苏艳芳, 杨曼, 牛乃琪, 等. 北京黑猪FABP3和SCD基因多态性与肉品质性状关联分析[J]. 畜牧兽医学报, 2023, 54(3): 966-975. SU Y F, YANG M, NIU N Q, et al. Association analysis of FABP3 and SCD gene polymorphisms with meat quality traits in Beijing black pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(3): 966-975. (in Chinese) |
| [3] |
XU K, JI M, HUANG X, et al. Differential regulatory roles of MicroRNAs in porcine intramuscular and subcutaneous adipocytes[J]. J Agric Food Chem, 2020, 68(13): 3954-3962. DOI:10.1021/acs.jafc.9b08191 |
| [4] |
ZHOU J W, ZHANG Y, WU J J, et al. Proteomic and lipidomic analyses reveal saturated fatty acids, phosphatidylinositol, phosphatidylserine, and associated proteins contributing to intramuscular fat deposition[J]. J Proteomics, 2021, 241: 104235. DOI:10.1016/j.jprot.2021.104235 |
| [5] |
FRANK D, BALL A, HUGHES J, et al. Sensory and flavor chemistry characteristics of Australian beef: influence of intramuscular fat, feed, and breed[J]. J Agric Food Chem, 2016, 64(21): 4299-4311. DOI:10.1021/acs.jafc.6b00160 |
| [6] |
FRANK D, WATKINS P, BALL A, et al. Impact of brassica and lucerne finishing feeds and intramuscular fat on lamb eating quality and flavor.A cross-cultural study using Chinese and Non-Chinese Australian consumers[J]. J Agric Food Chem, 2016, 64(36): 6856-6868. DOI:10.1021/acs.jafc.6b02018 |
| [7] |
GUI L S, RAZA S H A, SUN Y G, et al. Detection of polymorphisms in the promoter of bovine SIRT1 gene and their effects on intramuscular fat content in Chinese indigenous cattle[J]. Gene, 2019, 700: 47-51. DOI:10.1016/j.gene.2019.03.022 |
| [8] |
LI X, FU X, YANG G, et al. Review: enhancing intramuscular fat development via targeting fibro-adipogenic progenitor cells in meat animals[J]. Animal, 2020, 14(2): 312-321. DOI:10.1017/S175173111900209X |
| [9] |
LUO N, SHU J T, YUAN X Y, et al. Differential regulation of intramuscular fat and abdominal fat deposition in chickens[J]. BMC Genomics, 2022, 23(1): 308. DOI:10.1186/s12864-022-08538-0 |
| [10] |
郭俊涛, 谢遇春, 苏馨, 等. 大足黑山羊不同部位肌肉脂肪酸比较研究[J]. 肉类研究, 2020, 34(9): 6-11. GUO J T, XIE Y C, SU X, et al. Comparative study on muscle fatty acids in different carcass parts of Dazu black goats[J]. Meat Research, 2020, 34(9): 6-11. (in Chinese) |
| [11] |
刘珂含, 王永, 李艳艳, 等. SRSF10对山羊肌内前体脂肪细胞分化的影响[J]. 畜牧兽医学报, 2022, 53(6): 1768-1778. LIU K H, WANG Y, LI Y Y, et al. Effects of SRSF10 on the differentiation of intramuscular preadipocytes in goats[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(6): 1768-1778. (in Chinese) |
| [12] |
罗肖, 李惠侠, 杨公社. Wnt信号通路与前体脂肪细胞[J]. 中国生物化学与分子生物学报, 2007, 23(10): 791-796. LUO X, LI H X, YANG G S. Wnt signaling pathway and preadipocytes[J]. Chinese Journal of Biochemistry and Molecular Biology, 2007, 23(10): 791-796. DOI:10.3969/j.issn.1007-7626.2007.10.001 (in Chinese) |
| [13] |
蒋旭鹏, 潘晓琳, 潘泽民. 转录因子C/EBPβ功能研究进展[J]. 中国公共卫生, 2011, 27(12): 1628-1629. JIANG X P, PAN X L, PAN Z M. Transcription factor C/EBPβ progress in functional research[J]. Chinese Journal of Public Health, 2011, 27(12): 1628-1629. DOI:10.11847/zgggws2011-27-12-60 (in Chinese) |
| [14] |
帖媛媛. 转录因子C/EBPβ在糖尿病性心肌病中的作用及机制研究[D]. 济南: 山东大学, 2018. TIE Y Y. The role and mechanism of C/EBPβ in diabetic cardiomyopathy[D]. Ji'nan: Shandong University, 2018. (in Chinese) |
| [15] |
张浩, 王永, 李艳艳, 等. 山羊RPL26基因生物信息学分析及对肌内脂肪细胞分化的影响[J]. 畜牧兽医学报, 2022, 53(4): 1064-1076. ZHANG H, WANG Y, LI Y Y, et al. Bioinformatics analysis of goat RPL26 gene and its effect on intramuscular adipocyte differentiation[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(4): 1064-1076. (in Chinese) |
| [16] |
于祥国. ZHX2通过miR-24-3p抑制SREBP1c介导的脂质从头合成影响肝细胞肝癌进展[D]. 济南: 山东大学, 2020. YU X G. ZHX2 inhibits SREBP1c-mediated de novo lipogenesis in hepatocellular carcinoma via miR-24-3p[D]. Ji'nan: Shandong University, 2020. (in Chinese) |
| [17] |
赵向, 肖新华. 脂肪细胞中甘油三酯代谢的研究进展[J]. 国际内分泌代谢杂志, 2010, 30(3): 174-176, 188. ZHAO X, XIAO X H. Current progress of triacylglycerol metabolism in adipocyte[J]. International Journal of Endocrinology and Metabolism, 2010, 30(3): 174-176, 188. DOI:10.3760/cma.j.issn.1673-4157.2010.03.010 (in Chinese) |
| [18] |
叶友斌. 甘油三酯在高尿酸和血糖异常关联中的作用研究[D]. 福州: 福建医科大学, 2021. YE Y B. Study on the effect of triglycerides in the relationship between high uric acid levels and glucose abnormality[D]. Fuzhou: Fujian Medical University, 2021. (in Chinese) |
| [19] |
STEINBERG D, GOTTO A M JR. Preventing coronary artery disease by lowering cholesterol levels: fifty years from bench to bedside[J]. JAMA, 1999, 282(21): 2043-2050. DOI:10.1001/jama.282.21.2043 |
| [20] |
VERHAGUE M A, CHENG D M, WEINBERG R B, et al. Apolipoprotein A-IV expression in mouse liver enhances triglyceride secretion and reduces hepatic lipid content by promoting very low density lipoprotein particle expansion[J]. Arterioscler Thromb Vasc Biol, 2013, 33(11): 2501-2508. DOI:10.1161/ATVBAHA.113.301948 |
| [21] |
GOMARASCHI M, PUTT W E, POZZI S, et al. Structure and function of the APOA-IV T347S and Q360H common variants[J]. Biochem Biophys Res Commun, 2010, 393(1): 126-130. DOI:10.1016/j.bbrc.2010.01.099 |
| [22] |
STEIN O, STEIN Y, LEFEVRE M, et al. The role of apolipoprotein A-IV in reverse cholesterol transport studied with cultured cells and liposomes derived from an ether analog of phosphatidylcholine[J]. Biochim Biophys Acta, 1986, 878(1): 7-13. DOI:10.1016/0005-2760(86)90337-1 |
| [23] |
吕圆, 王姝之, 戴斌, 等. 脂蛋白脂肪酶在神经系统研究进展[J]. 中国临床药理学与治疗学, 2022, 27(9): 1041-1048. LV Y, WANG S Z, DAI B, et al. New advances in nervous system of lipoprotein lipase[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2022, 27(9): 1041-1048. (in Chinese) |
| [24] |
DOI H, KUGIYAMA K, OKA H, et al. Remnant lipoproteins induce proatherothrombogenic molecules in endothelial cells through a redox-sensitive mechanism[J]. Circulation, 2000, 102(6): 670-676. DOI:10.1161/01.CIR.102.6.670 |
| [25] |
TSO P, YAO L, ZHENG S, et al. Regulation of intestinal apolipoprotein A-IV synthesis[J]. J Gastroenterol Hepatol, 1998, 13(S3): S270-S274. DOI:10.1111/j.1440-1746.1998.tb01891.x |
| [26] |
JOSHI H J, NARIMATSU Y, SCHJOLDAGER K T, et al. SnapShot: O-Glycosylation pathways across Kingdoms[J]. Cell, 2018, 172(3): 632-632. DOI:10.1016/j.cell.2018.01.016 |
| [27] |
刘洪瑜. 牛脂肪代谢相关基因遗传分析及其与秦川牛经济性状关联分析[D]. 杨凌: 西北农林科技大学, 2009. LIU H Y. Genetic analysis of bovine genes related with lipid metaboloism and their association with economic traits in Qinchuan cattle[D]. Yangling: Northwest A&F University, 2009. (in Chinese) |
| [28] |
卢贤君, 赵佳福, 苟维胜, 等. 从江香猪APOC3基因的克隆及亚细胞定位研究[J]. 畜牧与兽医, 2017, 49(8): 1-5. LU X J, ZHAO J F, GOU W S, et al. Cloning and subcellular localization of APOC3 in Congjiang Xiang pigs[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(8): 1-5. (in Chinese) |
| [29] |
冉黎, 吕锦诗, 张浩, 等. 过表达山羊APOC3基因促进肌内脂肪细胞分化[J]. 华北农学报, 2022, 37(3): 223-230. RAN L, LÜ J S, ZHANG H, et al. Effect of overexpression of goat APOC3 gene on differentiation of intramuscular adipocytes[J]. Acta Agriculturae Boreali-Sinica, 2022, 37(3): 223-230. (in Chinese) |
| [30] |
BLACK D D, ROHWER P L, DAVIDSON N O. Intestinal apolipoprotein A-IV gene expression in the piglet[J]. J Lipid Res, 1990, 31(3): 497-505. DOI:10.1016/S0022-2275(20)43171-2 |
| [31] |
曾瑞霞. p62通过自噬调节油酸诱导人脂肪间充质干细胞成脂的作用[D]. 沈阳: 中国医科大学, 2018. ZENG R X. Effect of p62 on adipogenesis of human adipose derived stromal cells induced by oleic acid through autophagy[D]. Shenyang: China Medical University, 2018. (in Chinese) |
| [32] |
GUO L, HUANG J X, LIU Y, et al. Transactivation of Atg4b by C/EBPβ promotes autophagy to facilitate adipogenesis[J]. Mol Cell Biol, 2013, 33(16): 3180-3190. DOI:10.1128/MCB.00193-13 |
| [33] |
王天怡, 傅力. 自噬在运动调节脂肪细胞分化过程中的作用研究进展[J]. 中国运动医学杂志, 2015, 34(10): 1014-1017. WANG T Y, FU L. Research progress on the role of autophagy in the regulation of adipocyte differentiation by exercise[J]. Chinese Journal of Sports Medicine, 2015, 34(10): 1014-1017. DOI:10.16038/j.1000-6710.2015.10.015 (in Chinese) |
| [34] |
YAO Y C, WANG C M. Dedifferentiation: inspiration for devising engineering strategies for regenerative medicine[J]. NPJ Regen Med, 2020, 5: 14. DOI:10.1038/s41536-020-00099-8 |
| [35] |
COTE J A, GUÉNARD F, LESSARD J, et al. Temporal changes in gene expression profile during mature adipocyte dedifferentiation[J]. Int J Genomics, 2017, 2017: 5149362. |
| [36] |
LESSARD J, COTE J A, LAPOINTE M, et al. Generation of human adipose stem cells through dedifferentiation of mature adipocytes in ceiling cultures[J]. J Vis Exp, 2015(97): 52485. |
| [37] |
熊燕. C/EBPβ和FoxO1通过反馈环和蛋白互作调控猪前体脂肪细胞分化[D]. 杨凌: 西北农林科技大学, 2013. XIONG Y. C/EBPβ and FoxO1 Regulate porcine preadipocyte differentiation through feedback loop and protein interaction[D]. Yangling: Northwest A&F University, 2013. (in Chinese) |
| [38] |
STACHECKA J, NOWACKA J, KOLODZIEJSKI P A, et al. The importance of the nuclear positioning of the PPARG gene for its expression during porcine in vitro adipogenesis[J]. Chromosome Res, 2019, 27(3): 271-284. DOI:10.1007/s10577-019-09604-2 |
| [39] |
LEFTEROVA M I, HAAKONSSON A K, LAZAR M A, et al. PPARγ and the global map of adipogenesis and beyond[J]. Trends Endocrinol Metab, 2014, 25(6): 293-302. DOI:10.1016/j.tem.2014.04.001 |
| [40] |
LEE J E, GE K. Transcriptional and epigenetic regulation of PPARγ expression during adipogenesis[J]. Cell Biosci, 2014, 4: 29. DOI:10.1186/2045-3701-4-29 |
| [41] |
GEOGHEGAN G, SIMCOX J, SELDIN M M, et al. Targeted deletion of Tcf7l2 in adipocytes promotes adipocyte hypertrophy and impaired glucose metabolism[J]. Mol Metab, 2019, 24: 44-63. DOI:10.1016/j.molmet.2019.03.003 |
| [42] |
WHITE U A, STEPHENS J M. Transcriptional factors that promote formation of white adipose tissue[J]. Mol Cell Endocrinol, 2010, 318(1-2): 10-14. DOI:10.1016/j.mce.2009.08.023 |
| [43] |
孟金柱, 吴震洋, 安清明, 等. 黔北黑猪肌内脂肪沉积相关基因的筛选[J]. 杭州: 浙江大学学报(农业与生命科学版), 2021, 47(6): 797-804. MENG J Z, WU Z Y, AN Q M, et al. Screening of genes related to intramuscular fat deposition in Qianbei black pigs[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2021, 47(6): 797-804. (in Chinese) |
| [44] |
KERSTEN S. Physiological regulation of lipoprotein lipase[J]. Biochim Biophys Acta, 2014, 1841(7): 919-933. DOI:10.1016/j.bbalip.2014.03.013 |
| [45] |
盘道兴, 王振, 杨茂林, 等. 不同品种猪PPARγ和C/EBPα基因表达规律与肌内脂肪含量的相关[J]. 中国农业科学, 2017, 50(1): 171-182. PAN D X, WANG Z, YANG M L, et al. Association of the PPARγ and C/EBPα gene expression with intramuscular fat content in different varieties of pig[J]. Scientia Agricultura Sinica, 2017, 50(1): 171-182. (in Chinese) |
| [46] |
ZENG H L, SUN W H, REN X P, et al. AP2-microRNA-26a overexpression reduces visceral fat mass and blood lipids[J]. Mol Cell Endocrinol, 2021, 528: 111217. DOI:10.1016/j.mce.2021.111217 |
(编辑 郭云雁)



