2. 佛山市高明区新广农牧有限公司, 广东 528500
2. Foshan Gaoming Xinguang Agriculture and Animal Husbandry Co. Ltd., Guangdong 528500, China
鸡肉是世界第一大、我国第二大肉类产品,其中白羽肉鸡贡献了全球鸡肉总量的70%、我国鸡肉总量的60%[1]。白羽肉鸡具有产肉率和饲料转化效率高的显著优势,是畜禽中最为高效环保的品种之一。然而,随着产肉性能的极限选择,木质化肉(wooden breast, WB)[2]、白条纹肉(white striping, WS)[3]等新型劣质肉(称为异质肉)发生率逐年增高,达到30%以上[4-5]。劣质肉感官特性差、肉品质和营养价值降低[6-8],通常被淘汰或是降级处理,给产业造成了巨大的经济损失,成为制约品种性能提升的瓶颈,新型劣质肉表型精准检测是改良技术研发的基础。
已有木质肉和白条纹的研究表明,在表型特征方面,正常胸肌肉色均匀触感柔软,木质肉明显硬化触感坚硬[2],白条纹有平行于肌纤维的白色脂肪条纹沉积[3],木质肉与白条纹共同发生时,会同时出现白色条纹与胸肌硬化的情况[9]。目前,对木质肉与白条纹肉的等级评分主要依靠表观评分法。木质肉依据胸肌硬化的区域、范围和坚硬程度进行四档评分(正常:整块胸肌柔软且具有弹性;轻度:胸肌顶端较坚硬,其余部位有弹性;中度:胸肌顶端到中部坚硬,尾部有弹性;重度:整个胸肌坚硬、呈僵直状、有脊状突起)[8, 10],白条纹根据沉积的白色条纹的数目以及宽度进行四档评分(正常:无明显白条纹;轻度:有少量宽度小于1 mm的白条纹;中度:有较多宽度大于1 mm的白条纹;重度:有覆盖整块胸肌顶端的宽度大于2 mm的白条纹)[11]。研究指出,与硬度相关的压缩力指标在木质肉组个体胸肌组织中显著高于正常个体[12]。已有肌纤维组织学形态研究表明,正常胸肌肌纤维排列致密,木质肉和白条纹的肌纤维组织学形态大体一致,表现为组织内肌纤维周围存在结缔组织增生、炎性细胞和脂肪浸润,圆形肌纤维增多、肌纤维变性坏死溶解,伴随着肌纤维再生[13]。木质肉与白条纹也存在一定的区别,如木质肉圆形肌纤维数量和肌纤维空泡增多[14]、结缔组织和胶原纤维沉积[15],白条纹肉出现脂肪沉积和纤维化[16-17]。但是,关于异质肉的组织学形态的量化评价及比较研究未见报道。
已有的转录组也获得了大量的与木质肉或白条纹肉相关的基因和通路,木质肉主要富集到脂质代谢、组氨酸代谢、鞘磷脂代谢、线粒体稳态、氧化磷酸化、肌动蛋白细胞骨架、凋亡、紧密连接和黏着(FA)信号传导等通路,筛选到CTSB、ACTN1、CCL19等与阻碍脂肪代谢、组织黏连、炎症相关等途径相关的基因[18-21]。白条纹肉主要涉及组氨酸代谢、鞘磷脂代谢、免疫系统激活、血管生成、缺氧、细胞死亡和横纹肌收缩等分子途径,筛选到CD80、SYK、CAMK2A等与细胞增殖、凋亡和钙信号传导等途径相关的基因[22-23]。然而,因为异质肉类型多、发生程度差异大,所以前期依据粗略表观打分分组进行检测,筛选到的差异表达基因和通路涉及范围较广。因此,进一步的候选基因和分子调控通路研究均有必要结合精准的表型量化评估。
综上,本研究利用HE组织学染色切片,对胸肌组织学表型指标进行系统的数据统计和分析,并在此基础上,进行分组和组间差异表达基因和富集通路分析,为异质肉的精准评估方法建立和分子调控机制解析奠定基础。
1 材料与方法 1.1 试验动物与样本采集试验动物来自佛山高明区新广农牧有限公司150只白羽肉鸡终端父系,试验期间所有鸡自由采食饮水,从28日龄起单笼饲养至42日龄。屠宰后,所有鸡均选取右侧胸大肌进行异质肉表观评分,除去左侧胸大肌顶端的筋膜与表皮,取平行于肌纤维胸肌组织样(1 cm×1 cm×2 cm)于液氮中速冻并储存于-80 ℃冰箱,取平行于肌纤维胸肌组织样(2 cm×1 cm×0.2 cm)于4%多聚甲醛固定液(Solarbio)中固定48 h。基因表达荧光定量试验动物来自河北玖兴农牧发展有限公司养殖的42日龄120只科宝商品肉鸡,进行右侧胸肌异质肉表观评分,取平行于肌纤维胸肌组织样于液氮中速冻并储存于-80 ℃冰箱。科宝商品肉鸡表观评分包括有27个正常个体、67个轻度木质肉、21个中度木质肉个体、11个重度木质肉个体。
1.2 组织切片制作与数据采集150个白羽肉鸡终端父系屠宰个体胸肌表观评分包括有59个正常个体、23个轻度白条纹个体、43个中度木质肉个体和25个轻度木质肉白条纹共同发生个体。依据表观打分共挑选每组10个以上个体,包括正常组、轻度白条纹组、中度木质肉组、轻度白条纹木质肉共同发生4个组,分别选取12、12、18、19共61个胸肌样本进行组织HE染色。取固定48 h的胸肌组织,通过脱水、透明、浸蜡和包埋一系列处理后,于切片机切成5~8 μm厚薄片,进一步粘片和脱蜡后于苏木精水溶液中染色5 min。随后进行脱水和透明处理,最终用中性树胶固定后置于正置荧光显微镜下进行图片采集。
1.3 切片的显微镜观察及数据采集为了评估肌肉病理学指标,图像中共采集肌纤维面积、肌纤维直径、肌纤维密度、肌束膜、肌内膜5个指标为代表性组织病理学指标。利用正置荧光显微镜对制作的肌肉石蜡切片进行观察拍照,每个样本的切片选取3个50 ×视野良好区域,每个视野包含2~5条肌束膜用于肌束膜厚度的统计。通过Image pro plus6.0软件(Media Cybernetics, Silver Spring, USA) 对采集好的图像进行分析。
肌纤维面积和直径的采集统计:每个视野中选取50根完整清晰的连续肌纤维进行测量,采集3张照片至少150根肌纤维的面积和直径数据,计算测定数据的平均值分别代表个体的肌纤维面积和直径。
肌纤维密度的采集统计:在每个视野中选取2个肌纤维分布均匀且无肌束膜的区域进行面积测定,并对区域内的肌纤维数量进行计数,共采集5个肌纤维密度数据。肌纤维密度计算如下:肌纤维密度(N ·mm-2)=肌纤维个数/肌纤维面积,求平均值代表个体的肌纤维密度。
肌纤维肌内膜和肌束膜的采集统计:选取肌束内均匀分布的肌纤维,选定若干肌纤维作为中心,测量这些肌纤维与相邻肌纤维之间的距离为肌内膜厚度。共采集3张图片共100个肌内膜厚度数据,计算平均值代表个体的肌内膜厚度。在每个视野中选取两个相邻的肌束,测量肌束间的的距离作为肌束膜厚度。共测定3个视野中50处肌束膜厚度数据,计算平均值代表个体的肌束膜厚度。
1.4 胸肌组织RNA提取与文库构建结合异质肉表观评分以及病理切片测定,选择白羽肉鸡终端父系8个个体(正常组n=4, 中度木质肉组n=4)取胸肌样本,使用TRIzol(Invitrogen,美国)试剂提取总RNA。将A260 nm/A280 nm比值在1.8~2.0之间且RNA完整性大于7.5为标准进行质检。
总RNA样品检测合格后,Oligo(dT)的磁珠进行富集纯化得到mRNA,并加入Fragmentation Buffer使其片断成为短片段。以片断后的mRNA为模板,用六碱基随机引物合成一链cDNA,并加入缓冲液、dNTPs、RNaseH和DNA Polymerase I合成双链cDNA。洗脱纯化后的双链cDNA再进行末端修复、加碱基A并连接测序接头,经琼脂糖凝胶电泳回收目的大小片段并进行PCR扩增。文库构建完成后使用Agilent 2100检测文库大小、有效浓度和质量,对合格的cDNA文库进行测序。
1.5 转录组测序与数据处理基于Illumina测序平台采用PE150测序方式对文库进行测序,原始序列(raw reads)通过去低质量序列、去接头污染等过程完成数据处理得到高质量的序列(clean reads),与鸡参考基因组(Gallus_gallus.ensembl.GRCg6a)进行序列比对。
1.6 主成分分析使用HTSeq软件统计比对到每个基因上的Reads个数,进而估计每个基因的表达水平(FPKM值),用R语言绘制主成分分析(principal component analysis,PCA)平面图。
1.7 差异表达基因分析和KEGG与GO富集分析用DESeq2软件对原始测序数据进行分析,基于差异倍数(Fold Change) >1.5且P-value < 0.05为标准筛选差异表达基因(differentially expressed genes, DEGs)。对符合标准的基因通过DAVID(Visualization and Integrated Discovery)(https://david.ncifcrf.gov/home.jsp)进行注释分析(包括分子功能、生物学过程和细胞组分),通过KOBAS(KEGG Orthology Based Annotation System)(http://kobas.cbi.pku.edu.cn/kobas3)进行通路富集分析。以P < 0.05为标准筛选富集通路。
1.8 RT-qPCR基因表达检测基于木质肉表观评分和胸肌肌纤维组织学形态统计结果挑选白羽肉鸡终端父系18个样本(正常组n=9,中度木质肉组n=9),基于木质肉表观评分挑选科宝肉鸡32个样本(正常组n=8,轻度木质肉组n=8,中度木质肉组n=8,重度木质肉组n=8)。参照“1.4”的方法提取样本总RNA后,以β-actin为内参基因,FastKing一步法除基因组cDNA第一链合成预混试剂(天根)反转录成的cDNA为模板,以华大基因合成的引物使用荧光定量PCR试剂盒(ABI,美国)进行实时荧光定量PCR(qPCR),基因的相对表达量采用2-ΔΔCT法计算。胸苷激酶1(TK1)、ATP酶肌质/内质网Ca2+转运2(ATP2A2)、胰岛素样生长因子1受体(IGF1R)、一氧化氮合酶2(NOS2)、整合素β2亚单位(ITGB2)、整合素亚基α11(ITGA11)和纤调蛋白聚糖(FMOD)的基因引物序列见表 1。
|
|
表 1 基因引物序列 Table 1 Gene primer sequences |
白羽肉鸡终端父系胸肌组织HE染色形态特征如图 1所示,异质肉发生的3个组中皆出现肌纤维分散、出现圆形肌纤维、结缔组织增生的情况。其中可见中度木质肉组中圆形肌纤维数量、肌纤维空泡多于正常组和轻度白条纹组。
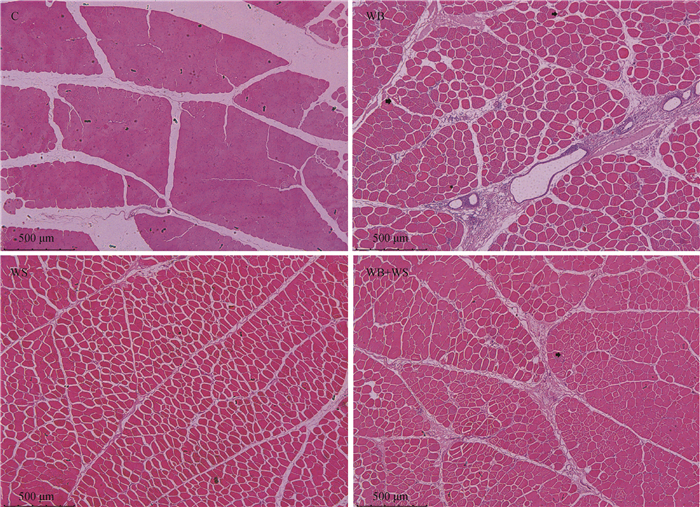
|
正常组(C)、中度木质肉组(WB)、轻度白条纹组(WS)和轻度木质肉白条纹共同发生组(WB+WS)胸肌HE染色病理切片。箭头所指为肌纤维空泡 Pathological sections of pectoral muscle HE-stained made by Control group (C), moderate wooden breast group (WB), mild white spring group (WS) and mild WB accompanied by WS group (WB+WS). The arrow points to myofiber vacuoles 图 1 胸肌HE染色的病理切片(50×) Fig. 1 Pathological sections of pectoral muscle HE-stained(50×) |
胸肌肌纤维形态量化统计分析的结果如图 2A所示,中度木质肉组肌纤维面积、直径与其它3组相比分别增高约45%和20%;中度木质肉组和正常组肌纤维密度差异不显著,但与其它2组相比降低约20%。中度木质肉组肌纤维面积平均为151.88 μm,肌纤维直径为11.46 μm,肌纤维密度为6 175.38 N ·mm-2。正常组肌纤维面积平均为106.43 μm,肌纤维直径为9.48 μm,肌纤维密度为6 807.69 N ·mm-2。轻度白条纹组肌纤维面积平均为105.29 μm,肌纤维直径为9.43 μm,肌纤维密度为8 639.52 N ·mm-2。轻度木质肉白条纹共同发生组肌纤维面积平均为96.88 μm,肌纤维直径为9.23 μm,肌纤维密度为8 708.44 N ·mm-2。

|
*. 0.01≤P < 0.05;**. 0.001≤P < 0.01;***. 0.000 1≤P < 0.001; ****. P < 0.000 1。下同 *. 0.01≤P < 0.05;**. 0.001≤P < 0.01;***. 0.000 1≤P < 0.001; ****. P < 0.000 1. The same as below 图 2 胸肌肌纤维形态指标统计分析结果 Fig. 2 Statistical analysis results of pectoral muscle fiber morphological indicators |
胸肌肌内膜厚度量化统计分析的结果如图 2B所示,中度木质肉组与其它3组相比增高约75%。具体为中度木质肉组平均肌内膜厚度为1.97 μm,正常组平均肌内膜厚度为1.11 μm,轻度白条纹组平均肌内膜厚度为1.05 μm,轻度木质肉白条纹共同发生组平均肌内膜厚度为1.21 μm。
2.2 不同分组胸肌差异表达基因分析根据异质肉表观评分以及组织病理切片肌纤维组织学形态数据统计结果,分别挑选白羽肉鸡终端父系木质肉组和正常组共8个胸肌组织进行转录组测序,结果表明木质肉组有1 201个显著上调DEGs,无显著下调DEGs。基于基因表达量对于8个个体进行PCA分析,正常组和木质肉组个体可独立分群(图 3)。

|
图 3 转录组测序个体主成分分析结果 Fig. 3 The principal component analysis results of transcriptome-sequenced individuals |
对于上调DEGs进行KEGG代谢通路分析,这些基因显著富集到13条通路(图 4)。其中主要富集到与结缔组织增生相关的、黏附斑信号通路和基质受体相互作用等通路,与细胞增殖、分化、凋亡等一系列细胞生理活动相关的MAPK信号通路和TGF-β信号通路,与细胞迁移、囊泡运输等过程密切相关的肌动蛋白细胞骨架的调节通路。
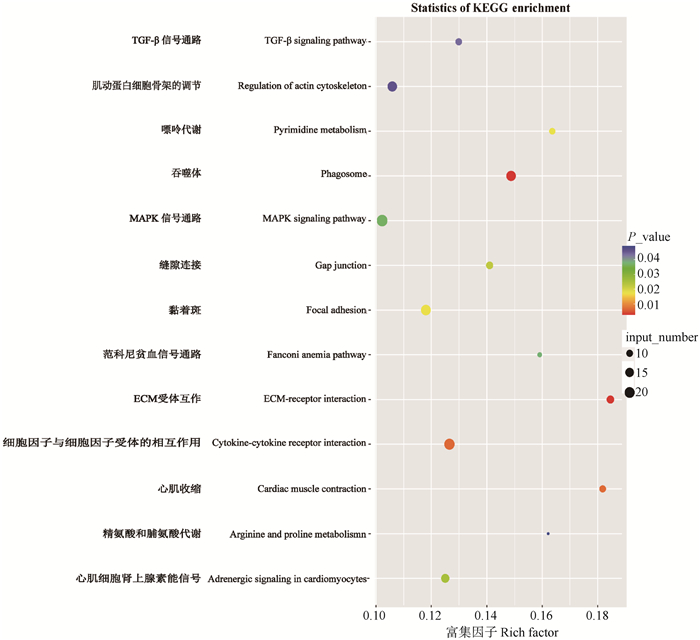
|
图 4 KEGG通路富集分析结果 Fig. 4 KEGG pathway enrichment analysis results |
对于上调DEGs进行GO注释分析,共91条显著条目,部分条目见图 5。其中生物过程(biological process)大类中显著注释到46条显著条目,主要注释与结缔组织增生相关的条目是胶原纤维组织;与细胞和细胞基质以及细胞与细胞之间粘附相关的条目是细胞粘附和细胞基质粘附等;与细胞发育分化相关的条目是细胞分化、细胞增殖的正调节、促进成肌细胞分化和积极调节骨骼肌纤维发育;与炎性细胞浸润相关的条目是炎症反应。分子功能(molecular function)和细胞成分(cellular component)大类中显著注释到45条显著条目,主要注释与细胞外基质、黏附斑、纤连蛋白结合和整合素结合等细胞和细胞基质以及细胞与细胞之间粘附相关的条目;分别与细胞的形态的维持和细胞运动相关的皮质肌动蛋白细胞骨架、肌动蛋白长丝结合和肌动蛋白结合等条目。
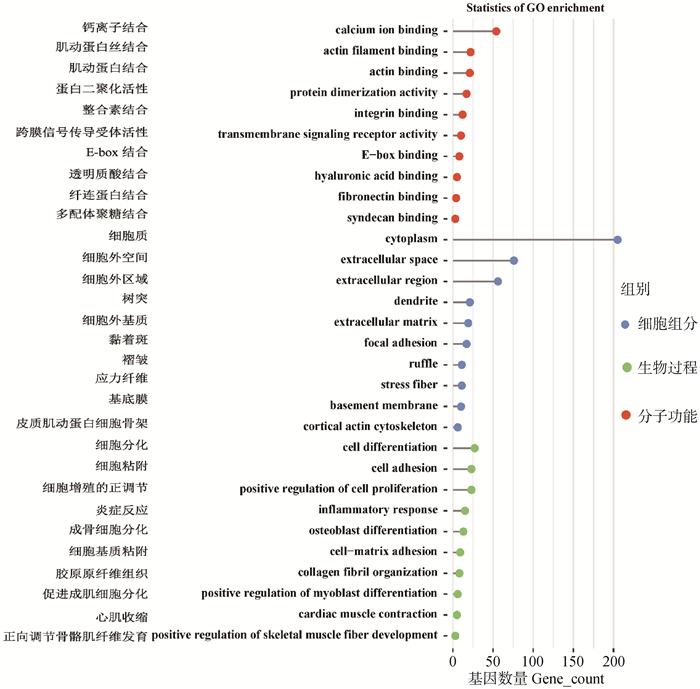
|
图 5 DEGs的GO注释分析结果 Fig. 5 GO annotation analysis results of DEGs |
以白羽肉鸡终端父系9个正常组和9个中度木质肉组样本为素材,从富集通路中筛选与结缔组织增生和细胞增殖、凋亡等过程相关的7个基因,通过RT-qPCR检测基因的相对表达量,结果如图 6所示。基因TK1、ATP2A2、IGF1R、NOS2、ITGB2、ITGA11和FMOD在木质肉个体中相对表达量显著高于正常个体。7个基因在科宝商品肉鸡8个正常组、8个轻度木质肉、8个中度木质肉和8个重度木质肉组样本中检测基因的相对表达量,结果如图 7所示。基因IGF1R和FMOD在木质肉个体中相对表达量显著高于正常个体,基因ITGB2在重度木质肉个体中表达量显著高于正常个体,基因ITGA11在中度和重度木质肉个体中表达量显著高于正常个体。基因的表达趋势与转录组测序数据一致,并进一步筛选出了与木质化胸肌相关的重要候选基因。

|
图 6 差异表达基因在白羽肉鸡终端父系进行RT-qPCR验证 Fig. 6 RT-qPCR verification of DEGs in the paternal line of the fast growing white feather broiler terminal |

|
图 7 差异表达基因在科宝肉鸡进行RT-qPCR验证 Fig. 7 RT-qPCR verification of DEGs in Cobb |
目前,在已有的异质肉胸肌肌纤维组织学形态研究中,主要通过胸肌组织的苏木精-伊红染色切片和马松染色切片对于正常个体及不同肌病分组个体肌纤维的形态变化、炎性细胞浸润以及肌纤维间结缔组织与胶原纤维沉积[24-28]等病理特征进行描述,但异质肉组织学形态的量化评价及比较研究尚未见报道。本研究进行表型特征评分后,采集木质肉组、正常组、白条纹组以及木质肉白条纹共同发生组共4个组,分别对胸肌组织肌纤维的面积、直径、密度、肌束膜和肌内膜5个指标进行量化测定及统计分析。数据分析结果表明,木质肉组肌纤维面积、直径和肌内膜厚度显著高于其它3组(P < 0.05)。木质肉组肌纤维面积、直径与其它3组相比分别增高约45%和20%,木质肉组和正常组肌纤维密度与其它2组相比降低约20%,木质肉组肌内膜厚度与其它3组相比增高约75%。综上,本研究对胸肌木质化等异质肉的肌纤维和肌肉结缔组织特征改变给出了量化评价。
研究进一步对组织学特征差异最显著的正常组和木质肉组个体进行了组织转录组分析,筛选到1 201个上调的DEGs,且无显著下调的DEGs。对DEGs进行KEGG通路富集和GO功能注释分析,注释到的通路与条目中,与木质肉肌内膜厚度相关的是间隙连接、黏附斑信号通路、基质受体相互作用、细胞粘附、细胞基质粘附、纤连蛋白结合和整合素结合等通路。间隙连接是一种细胞连接,其中相邻的细胞通过蛋白质通道连接, 当细胞开始死于疾病或损伤时,它会通过其间隙连接处发出信号,这些信号可能导致附近的细胞死亡[29]。黏附斑信号通路利用整合素介导ECM和细胞之间的黏附作用,在细胞迁移和形态变化中发生作用,局灶性粘附和相关结构还通过细胞膜传递粘附触发的信号,调节细胞增殖、分化和死亡[30]。黏附斑信号传导中断,伴随着ECM缺陷和血管生成不足,导致ECM分子(例如胶原蛋白和核心蛋白)的异常沉积,最终导致纤维化细胞与其细胞外基质(ECM)之间的机械相互作用可以影响和控制细胞的行为和功能[31]。木质肉通过增强肉鸡胸大肌肌肉中ECM沉积和胶原蛋白交联来诱导严重的纤维化[32]。通过形成局部黏附的结构促进整合素介导细胞和细胞外基质的黏附[33],细胞粘附参与调节细胞分化、细胞周期、细胞迁移和细胞存活的刺激信号[34]。间隙连接、黏附斑、细胞粘附和基质受体相互作用信号等通路可能通过介导细胞外及细胞间异常信号进入胞内,导致肌细胞出现异常代谢、细胞增生和死亡情况增加,影响肌纤维间的粘附粘连,从而导致木质肉胸肌组织中细胞坏死及肌内膜厚度增加。
分别在白羽肉鸡终端父系和科宝肉鸡个体胸肌组织对富集分析显著差异通路中的基因进行RT-qPCR测定,IGF1R、ITGB2、ITGA11和FMOD在正常个体中相对表达量显著低于木质肉个体,与转录组测序数据结果一致。IGF1R参与细胞的存活和生长分化[35],且研究认为IGF1R在鸡早期骨骼肌中调控肌纤维的形成与发育[36],与肌纤维病理切片中观察到的少量肌纤维再生情况相符。ITGB2参与肿瘤细胞之间以及肿瘤细胞和肿瘤微环境之间的细胞粘附、基质重塑和信号转导[37],诱导肿瘤浸润、血管生成和肿瘤特异性免疫反应,识别纤维蛋白原α链中的序列,参与白细胞粘附和迁移[38],与木质肉中炎性细胞浸润相关。FMOD主要参与调节胶原纤维化,在调节人成纤维细胞分化为多能细胞,炎症机制,细胞凋亡和转移等关键生物学过程中起着非常重要的作用[39]。ITGA11编码整合素亚基α11,它与β1亚基二聚,形成细胞表面胶原受体,参与细胞迁移和胶原重组过程[40]。ITGA11和FMOD可能通过促进木质肉组胸肌组织肌束间隙和肌内膜间胶原蛋白和纤维蛋白沉积,从而导致肌纤维排列分散、肌内膜增厚,所以可作为木质化胸肌重要候选基因用于后期深入研究。
4 结论木质肉组肌纤维面积、直径和肌内膜厚度与其它3组相比分别增高约45%、20%和75%;木质肉组相比正常组筛选出显著上调表达差异基因1 201个,主要富集在与结缔组织增生相关的通路,包括间隙连接、黏着斑信号通路、基质受体相互作用等,其中ITGA11、FMOD、IGF1R、ITGB2等基因在木质肉和正常组间差异表达趋势与转录组测序结果一致,ITGA11和FMOD可作为木质化胸肌候选基因用于后期深入功能验证,辅助木质肉遗传选择分子标记开发和分子调控机制深入研究。
| [1] |
TALLENTIRE C W, LEINONEN I, KYRIAZAKIS I. Artificial selection for improved energy efficiency is reaching its limits in broiler chickens[J]. Sci Rep, 2018, 8(1): 1168. DOI:10.1038/s41598-018-19231-2 |
| [2] |
SIHVO H K, IMMONEN K, PUOLANNE E. Myodegeneration with fibrosis and regeneration in the pectoralis major muscle of broilers[J]. Vet Pathol, 2014, 51(3): 619-623. DOI:10.1177/0300985813497488 |
| [3] |
KUTTAPPAN V A. Characterization and consumer acceptance of white striping in broiler breast fillets[D]. University of Arkansas, 2012.
|
| [4] |
孔富丽, 刘冉冉, 赵桂苹, 等. 肉鸡木质肉和白条纹肉研究进展[J]. 畜牧兽医学报, 2020, 51(10): 2329-2340. KONG F L, LIU R R, ZHAO G P, et al. Research progress on wooden breast and white striping myopathies in broilers[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(10): 2329-2340. DOI:10.11843/j.issn.0366-6964.2020.10.001 (in Chinese) |
| [5] |
LÓPEZ T A, GARCÍA P A, TICA L, et al. Classification, quality characteristics, sensory perception and texture prediction of wooden breast myopathy in broilers from Argentina[J]. J Food Sci Technol, 2023, 60(1): 233-242. DOI:10.1007/s13197-022-05608-9 |
| [6] |
BALDI G, SOGLIA F, PETRACCI M. Spaghetti meat abnormality in broilers: current understanding and future research directions[J]. Front Physiol, 2021, 12: 684497. DOI:10.3389/fphys.2021.684497 |
| [7] |
KUTER E, AHSAN U, SEVIM Ö, et al. Carcase characteristics, meat quality, nutrient composition, serum biochemistry and oxidant/antioxidant status in white striping-affected broiler chickens fed diets based on maize-soybean meal[J]. Br Poult Sci, 2022, 63(6): 788-794. DOI:10.1080/00071668.2022.2102890 |
| [8] |
CHE S, WANG C Y, IVERSON M, et al. Characteristics of broiler chicken breast myopathies (spaghetti meat, woody breast, white striping) in Ontario, Canada[J]. Poult Sci, 2022, 101(4): 101747. DOI:10.1016/j.psj.2022.101747 |
| [9] |
BORDIGNON F, XICCATO G, CABROL M B, et al. Factors affecting breast myopathies in broiler chickens and quality of defective meat: a meta-analysis[J]. Front Physiol, 2022, 13: 933235. DOI:10.3389/fphys.2022.933235 |
| [10] |
TIJARE V V, YANG F L, KUTTAPPAN V A, et al. Meat quality of broiler breast fillets with white striping and woody breast muscle myopathies[J]. Poult Sci, 2016, 95(9): 2167-2173. DOI:10.3382/ps/pew129 |
| [11] |
KUTTAPPAN V A, LEE Y S, ERF G F, et al. Consumer acceptance of visual appearance of broiler breast meat with varying degrees of white striping[J]. Poult Sci, 2012, 91(5): 1240-1247. DOI:10.3382/ps.2011-01947 |
| [12] |
LIU R R, KONG F L, XING S Y, et al. Dominant changes in the breast muscle lipid profiles of broiler chickens with wooden breast syndrome revealed by lipidomics analyses[J]. J Anim Sci Biotechnol, 2022, 13(1): 93. DOI:10.1186/s40104-022-00743-x |
| [13] |
KUTTAPPAN V A, HARGIS B M, OWENS C M. White striping and woody breast myopathies in the modern poultry industry: a review[J]. Poult Sci, 2016, 95(11): 2724-2733. DOI:10.3382/ps/pew216 |
| [14] |
HOSOTANI M, KAWASAKI T, HASEGAWA Y, et al. Physiological and pathological mitochondrial clearance is related to pectoralis major muscle pathogenesis in broilers with wooden breast syndrome[J]. Front Physiol, 2020, 11: 579. DOI:10.3389/fphys.2020.00579 |
| [15] |
VELLEMAN S G, CLARK D L. Histopathologic and myogenic gene expression changes associated with wooden breast in broiler breast muscles[J]. Avian Dis, 2015, 59(3): 410-418. DOI:10.1637/11097-042015-Reg.1 |
| [16] |
MAZZONI M, PETRACCI M, MELUZZI A, et al. Relationship between pectoralis major muscle histology and quality traits of chicken meat[J]. Poult Sci, 2015, 94(1): 123-130. DOI:10.3382/ps/peu043 |
| [17] |
KUTTAPPAN V A, SHIVAPRASAD H L, SHAW D P, et al. Pathological changes associated with white striping in broiler breast muscles[J]. Poult Sci, 2013, 92(2): 331-338. DOI:10.3382/ps.2012-02646 |
| [18] |
MALILA Y, UENGWETWANIT T, THANATSANG K V, et al. Insights into transcriptome profiles associated with wooden breast myopathy in broilers slaughtered at the age of 6 or 7 weeks[J]. Front Physiol, 2021, 12: 691194. DOI:10.3389/fphys.2021.691194 |
| [19] |
HUGHES T K, WADSWORTH Ⅱ M H, GIERAHN T M, et al. Second-strand synthesis-based massively parallel scRNA-Seq reveals cellular states and molecular features of human inflammatory skin pathologies[J]. Immunity, 2020, 53(4): 878-894. e7. DOI:10.1016/j.immuni.2020.09.015 |
| [20] |
LAKE J A, YAN Y R, DEKKERS J C M, et al. Identification of circulating metabolites associated with wooden breast and white striping[J]. PLoS One, 2022, 17(9): e0274208. DOI:10.1371/journal.pone.0274208 |
| [21] |
HASEGAWA Y, HOSOTANI M, SAITO M, et al. Mitochondrial characteristics of chicken breast muscle affected by wooden breast[J]. Comp Biochem Physiol A Mol Integr Physiol, 2022, 273: 111296. DOI:10.1016/j.cbpa.2022.111296 |
| [22] |
MARCHESI J A P, IBELLI A M G, PEIXOTO J O, et al. Whole transcriptome analysis of the pectoralis major muscle reveals molecular mechanisms involved with white striping in broiler chickens[J]. Poult Sci, 2019, 98(2): 590-601. DOI:10.3382/ps/pey429 |
| [23] |
MARCIANO C M M, IBELLI A M G, MARCHESI J A P, et al. Differential expression of myogenic and calcium signaling-related genes in broilers affected with white striping[J]. Front Physiol, 2021, 12: 712464. DOI:10.3389/fphys.2021.712464 |
| [24] |
PRISCO F, DE BIASE D, PIEGARI G, et al. Pathologic characterization of white striping myopathy in broiler chickens[J]. Poult Sci, 2021, 100(7): 101150. DOI:10.1016/j.psj.2021.101150 |
| [25] |
MAHARJAN P, HILTON K, WEIL J, et al. Characterizing woody breast myopathy in a meat broiler line by heat production, microbiota, and plasma metabolites[J]. Front Vet Sci, 2020, 6: 497. DOI:10.3389/fvets.2019.00497 |
| [26] |
PRAUD C, JIMENEZ J, PAMPOUILLE E, et al. Molecular phenotyping of white striping and wooden breast myopathies in chicken[J]. Front Physiol, 2020, 11: 633. DOI:10.3389/fphys.2020.00633 |
| [27] |
SOGLIA F, MAZZONI M, PETRACCI M. Spotlight on avian pathology: current growth-related breast meat abnormalities in broilers[J]. Avian Pathol, 2019, 48(1): 1-3. DOI:10.1080/03079457.2018.1508821 |
| [28] |
KANG K L, ZHOU N X, PENG W S, et al. Multi-omics analysis of the microbiome and metabolome reveals the relationship between the gut microbiota and wooden breast myopathy in broilers[J]. Front Vet Sci, 2022, 9: 922516. DOI:10.3389/fvets.2022.922516 |
| [29] |
NIELSEN M S, AXELSEN L N, SORGEN P L, et al. Gap junctions[J]. Compr Physiol, 2012, 2(3): 1981-2035. |
| [30] |
ZAMIR E, GEIGER B. Focal adhesions and related integrin contacts[M]//LENNARZ W J, LANE M D. Reference Module in Biomedical Sciences/Encyclopedia of Biological Chemistry. 2nd ed. Amsterdam: Elsevier, 2013: 318-323.
|
| [31] |
KOIVISTO L, HEINO J, HÄKKINEN L, et al. Integrins in wound healing[J]. Adv Wound Care, 2014, 3(12): 762-783. DOI:10.1089/wound.2013.0436 |
| [32] |
XING T, ZHAO Z R, ZHAO X, et al. Enhanced transforming growth factor-beta signaling and fibrosis in the pectoralis major muscle of broiler chickens affected by wooden breast myopathy[J]. Poult Sci, 2021, 100(3): 100804. DOI:10.1016/j.psj.2020.10.058 |
| [33] |
BACHMANN M, KUKKURAINEN S, HYTÖNEN V P, et al. Cell adhesion by integrins[J]. Physiol Rev, 2019, 99(4): 1655-1699. DOI:10.1152/physrev.00036.2018 |
| [34] |
HUANG S, INGBER D E. The structural and mechanical complexity of cell-growth control[J]. Nat Cell Biol, 1999, 1(5): E131-E138. DOI:10.1038/13043 |
| [35] |
SELL C, DUMENIL G, DEVEAUD C, et al. Effect of a null mutation of the insulin-like growth factor I receptor gene on growth and transformation of mouse embryo fibroblasts[J]. Mol Cell Biol, 1994, 14(6): 3604-3612. |
| [36] |
盛中伟, 姬改革, 刘一帆, 等. 鸡生长发育早期骨骼肌IGF1R mRNA表达规律研究[J]. 浙江农业学报, 2020, 32(7): 1160-1165. SHENG Z W, JI G G, LIU Y F, et al. Study on mRNA expression pattern of IGF-1R gene in chicken skeletal muscles during early development[J]. Acta Agriculturae Zhejiangensis, 2020, 32(7): 1160-1165. DOI:10.3969/j.issn.1004-1524.2020.07.04 (in Chinese) |
| [37] |
BEDNARCZYK M, STEGE H, GRABBE S, et al. β2 integrins-multi-functional leukocyte receptors in health and disease[J]. Int J Mol Sci, 2020, 21(4): 1402. DOI:10.3390/ijms21041402 |
| [38] |
COOPER J, GIANCOTTI F G. Integrin signaling in cancer: mechanotransduction, stemness, epithelial plasticity, and therapeutic resistance[J]. Cancer Cell, 2019, 35(3): 347-367. |
| [39] |
POURHANIFEH M H, MOHAMMADI R, NORUZI S, et al. The role of fibromodulin in cancer pathogenesis: implications for diagnosis and therapy[J]. Cancer Cell Int, 2019, 19: 157. DOI:10.1186/s12935-019-0870-6 |
| [40] |
TIGER C F, FOUGEROUSSE F, GRUNDSTRÖM G, et al. α11β1 integrin is a receptor for interstitial collagens involved in cell migration and collagen reorganization on mesenchymal nonmuscle cells[J]. Dev Biol, 2001, 237(1): 116-129. DOI:10.1006/dbio.2001.0363 |
(编辑 郭云雁)



