2. 中国农业大学动物医学院, 北京 100193
2. College of Veterinary Medicine, China Agricultural University, Beijing 100193, China
氟苯尼考(florfenicol, FF)又名氟甲砜霉素,属于酰胺醇类广谱抗生素[1],是化学合成的动物专用广谱抗菌药,广泛应用于规模化养殖各类动物细菌性疾病的防治[2]。氟苯尼考在生物药剂学分类系统(BCS)中属于Ⅱ类药物,即低溶解性/高渗透性药物[3],吸收的限速步骤是低溶解度。Zhang(张伟)等[4]和刘梦喜等[5]通过制剂手段提高了氟苯尼考的溶解度,但其口服生物利用度并未得到大幅度提高,因此推测,氟苯尼考溶解度并不是影响氟苯尼考吸收的关键因素;刘梦喜等[5]制备的氟苯尼考磷脂复合物在增加氟苯尼考水溶性的同时降低了其脂水分配系数,却使不同肠段对氟苯尼考的吸收都得到了显著增加。Afifi和El-Sooud[6]、Shen等[7]研究了FF在肉鸡的药代动力学及组织分布特性,其结果显示,经单次口服及肌肉注射给予FF后其吸收半衰期均在30 min左右,但口服吸收速度较肌肉注射更快,拥有更短的达峰时间,FF口服后吸收较好。Park等[8]研究了氟苯尼考在犬和兔体内的生物利用度和药动学,结果显示,氟苯尼考能够通过肠道迅速吸收。氟苯尼考经口给药后在诸如大西洋鲑鱼、斑点叉尾鮰等水产养殖过程中也表现出肠道的迅速吸收[9],转运体是否参与了FF的口服吸收值得研究。
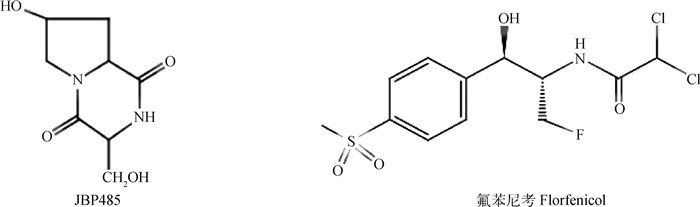
目前,药物转运体的研究取得了很大进步,通过转运体参与的主动转运在药物吸收过程中起关键作用,在肠道内发现的药物转运体中,寡肽转运体最受关注,研究也最为深入[10]。其中,小肠表达最多的寡肽转运体1(PepT1)有低亲和力、高容量转运的特点[11],可广泛识别具有寡肽及类似结构的分子,其转运底物主要为蛋白质水解产物中的二肽和三肽[12],含有分子内酰胺键的环状二肽JBP485(图 1)已被证实可作为PepT1底物进行转运和吸收[13]。具有典型寡肽结构的小分子药物可在肠上皮与PepT1靶向结合[14-16],提高药物在肠上皮的转运速率。另外,一些完全不具有寡肽结构的药物通过与氨基酸酯化实现靶向PepT1,也可以有效解决药物口服吸收差及生物利用度不高的缺陷[17-18],因此通过对药物分子改性或者功能化载体修饰均可以实现向PepT-1的靶向作用,提高药物的口服吸收[19-20]。
氟苯尼考结构存在分子内酰胺键(图 1),且N端为芳香环侧链修饰,具有PepT1转运的结构基础[13]。氟苯尼考口服吸收过程中除被动扩散外是否与PepT1转运蛋白之间存在关系值得探讨。本文运用大鼠在体肠循环灌流模型[21],通过高效液相色谱(HPLC)测定FF的浓度,并对FF在肠道的吸收方式和PepT1对其吸收的影响进行了初步研究,达到了预期研究目的。
|
图 1 JBP485与氟苯尼考结构式 Fig. 1 Structural of JBP485 and florfenicol |
Agilent 1100高效液相色谱(安捷伦科技有限公司);ST16R大容量高速台式冷冻离心机(赛默飞世尔科技有限公司);氟苯尼考标准品(HN20190215A,99.5 %),甘氨酰肌氨酸(GlySar)标准品(HN20190210B,99.5 %)与酚红均购于成都艾娜华化学制剂有限公司;Krebs-Ringer粉剂(主要成分为NaCl、KCl、NaH2PO4、MgCl2、CaCl2、葡萄糖,1包·L-1,上海源叶生物科技有限公司);色谱纯乙腈(成都科龙化学试剂厂)。
1.2 动物健康6~7周龄SPF级雄性SD大鼠,体重180~220 g,四川农业大学动物伦理委员会,动物伦理审批号:SICAU-2018203003。试验动物饲养于恒定温度(22 ℃±2 ℃),相对湿度60%±10%,12 h光照-黑暗交替的SPF级环境中,常规饲料喂养(每100 g体重每天5~8 g)并自由饮水,严格遵循《试验动物饲养管理和使用指南》。
1.3 FF测定方法的建立1.3.1 FF测定的色谱条件 色谱柱为岛津Inertsil ODS-3(4.6 mm×250 mm,5 μm),流动相:水-乙腈(67∶33),流速为1.0 mL·min-1,检测波长为266 nm,柱温35 ℃,进样量为20 μL。
1.3.2 方法专属性试验 分别取空白酚红K-R试液,空白酚红K-R试液加FF标准品样品及转运后样品进样分析,比较其色谱行为。
1.3.3 氟苯尼考标准曲线的建立 精密量取适量FF母液(1 mg·mL-1),分别以空白肠循环灌流液稀释配制成200、100、50、5、2 μg·mL-1的FF溶液,以流动相作为空白对照溶液,进样测定各浓度的峰面积。以FF浓度C为横坐标对峰面积S进行线性回归,所得回归方程即为标准曲线。
1.3.4 检测限、定量限、精密度的测定 取适量FF母液以蒸馏水稀释制成低浓度的FF标准品溶液,上清液用蒸馏水逐步稀释, 经0.22 μm聚四氟乙烯针式过滤器过滤后分别进样,记录色谱图,以基线噪音3倍和10倍时的样品浓度为最低检测限和定量限。
精密量取适量FF母液,配制浓度分别为27.50、45.00、90.00 μg·mL-1的低、中、高3个浓度,依前法测定,计算日内和日间精密度。
1.3.5 回收率的测定 方法回收率(Fm):配制浓度分别为27.50、45.00、90.00 μg·mL-1的低、中、高3个浓度(C已知)的FF含药肠灌流液样品,根据标准曲线计算浓度(C测),计算Fm。
| $ F_{\mathrm{m}}=\frac{C_{\text {测 }}}{C_{\text {已知 }}} \times 100 \% $ |
提取回收率(Fe):配制浓度分别为27.50、45.00、90.00 μg·mL-1的低、中、高3个浓度(C)的FF含药肠灌流液样品,另取相同低、中、高浓度的FF标准品溶液(C标),根据标准曲线计算浓度,计算Fe。
| $ F_{\mathrm{e}}=\frac{C}{C_{\text {标 }}} \times 100 \% $ |
1.3.6 FF在空白灌流液中的稳定性考察 构建在体循环系统,使用生理盐水洗去肠腔内的食物残渣,将硅胶管连接循环蠕动泵。使用37 ℃预热的酚红K-R缓冲液以2 mL·min-1流速单向冲洗10 min收集流出液上清作为肠灌流液。取空白肠灌流液配制40 μg·mL-1的FF,置于37 ℃水浴24 h,每6 h采样1 mL,用于FF含量测定以评价其稳定性。
1.4 大鼠在体肠灌流试验1.4.1 含酚红和FF的K-R试液试药的配制 将Krebs-Ringer粉剂与1.3 g碳酸氢钠溶解在1 L蒸馏水中,配制成K-R缓冲液,并添加酚红制备成20 mg·L-1(Cp0)的(pH=7.4)酚红K-R缓冲液。取适量FF标准品加入酚红K-R缓冲液分别配制成浓度(C0)为50 (低)、75(中)及100 μg·mL-1(高)的FF试液。
1.4.2 含酚红、FF和GlySar的K-R试液的配制 取适量FF标准品和适量GlySar标准品加入一定体积的酚红K-R缓冲液分别配制成含GlySar为50(低)、75(中)及100 μg·mL-1(高)的FF(100 μg·mL-1)试液。
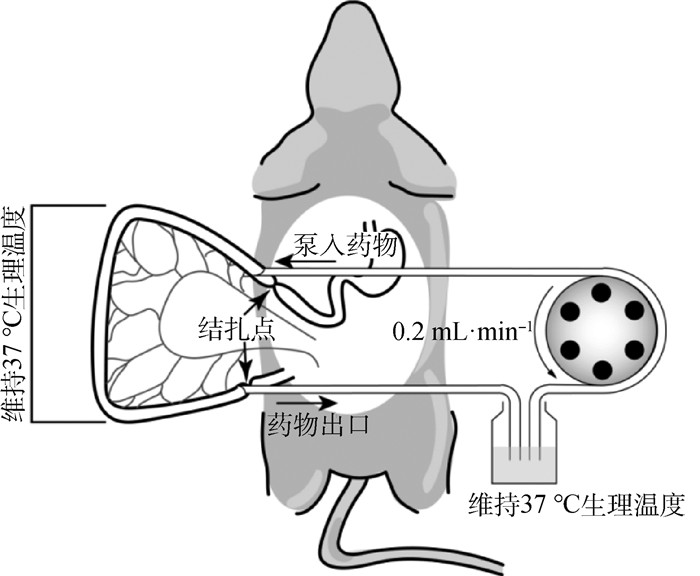
1.4.3 不同浓度FF大鼠在体肠循环灌流 SD大鼠试验前禁食不禁水12 h,经20%乌拉坦溶液(根据体重按1 g·kg-1给药)麻醉,立即沿腹中线剖开,迅速在幽门末端1 cm开口,盲肠前端5 cm处开口,分别插入硅胶管构建在体循环系统,使用生理盐水洗去肠腔内的食物残渣,将硅胶管连接循环蠕动泵(图 2)。使用37 ℃预热的酚红K-R缓冲液以2 mL·min-1流速单向冲洗10 min后,排空循环回路中液体,将进出口硅胶管共同放入装有不同浓度FF试液的锥形瓶中,以0.2 mL·min-1流速循环灌流2 h,每15 min取样[22-26]。
|
图 2 大鼠在体循环肠灌流示意图 Fig. 2 The sketch of circulation pass perfusion model in rat experiment |
肠灌流样品以体积比1∶1加入乙腈沉淀可能存在的蛋白,并旋涡振荡混匀3 min,以5 000 r·min-1,4 ℃离心15 min后,取上清液以蒸馏水适当稀释,经0.22 μm聚四氟乙烯针式过滤器过滤,将滤液20 μL注入高效液相色谱仪,按照“1.3.3”方法测定FF浓度,同时样品经蒸馏水适当稀释,使用酶标仪在560 nm处测定酚红吸光度(A),依据回归方程A=0.023C+0.0546(R2=0.999 9)计算酚红浓度。
1.4.4 PepT1对氟苯尼考肠吸收的影响 试验方法同“1.4.3”,区别在于将进出口硅胶管共同放入装有含不同浓度GlySar的FF试液,样品处理方式同“1.4.3”。
1.4.5 有效渗透系数(Peff)和吸收速率常数(Ka)的计算 依据下式分别计算药物有效渗透系数(Peff)和吸收速率常数(Ka)[27-28]。根据t时刻所测得的苯酚红浓度(Ctp,μg·mL-1),按照Eq.1校正剩余试液的体积。通过剩余试液体积(Vt,mL)与t时刻所对应的FF浓度(Ctf,μg·mL-1),采用Eq.2计算t时刻循环液中剩余药物的量(Xt,μg)。
| $ V_{\mathrm{t}}=\frac{\left(V_{\mathrm{t}-1}-2\right) \times C_{t-1}^{\mathrm{p}}+2 \times C_0^{\mathrm{p}}}{C_{\mathrm{t}}^{\mathrm{p}}} $ | (Eq.1) |
| $ X_t=V_t C_t+2.0 \times \sum\limits_{i=1}^{t-1} C_i $ | (Eq.2) |
将循环灌流中的循环液的剩余药量(Xt)取对数,与采样时间(t)线性回归,所得直线斜率就是Ka。按照Eq.3及Eq.4分别计算不同浓度FF组及不同浓度GlySar/FF组的吸收速率常数Ka(μg·h-1·cm-2) 和有效渗透系数Peff(cm·h-1)。
| $ \ln X_t=x {-} K_a t $ | (Eq.3) |
| $ P_{\text {eff }}=\frac{Q \times \ln \left(C_{\text {in }} / C_{\text {out (corrected })}\right)}{2 \pi r L} $ | (Eq.4) |
| $ C_{\text {out (corrected )}}=\frac{C_{\text {out }} \times P R_{\text {in }}}{P R_{\text {out }}} $ | (Eq.5) |
其中,Cout(corrected)是远端经过使用酚红的浓度进行校正后循环液中药物的浓度(μg·mL-1,按照Eq.5计算),Cout是实际通过试验手段测得样品的浓度(μg·mL-1),Cin是循环液中药物的浓度(μg·mL-1),PRin是入口处酚红的浓度(μg·mL-1),PRout是出口处酚红的浓度(μg·mL-1),Q是在试验过程中通过恒流泵所控制的循环液的流速(mL·h-1),r是循环灌流中的所选取肠段的内径(cm),L是循环灌流中选取肠段的长度(cm)[29-33]。
使用SPSS 20.0对各组间试验数据进行单因素方差分析,分析不同浓度FF及不同浓度GlySar对FF跨肠上皮细胞的影响。
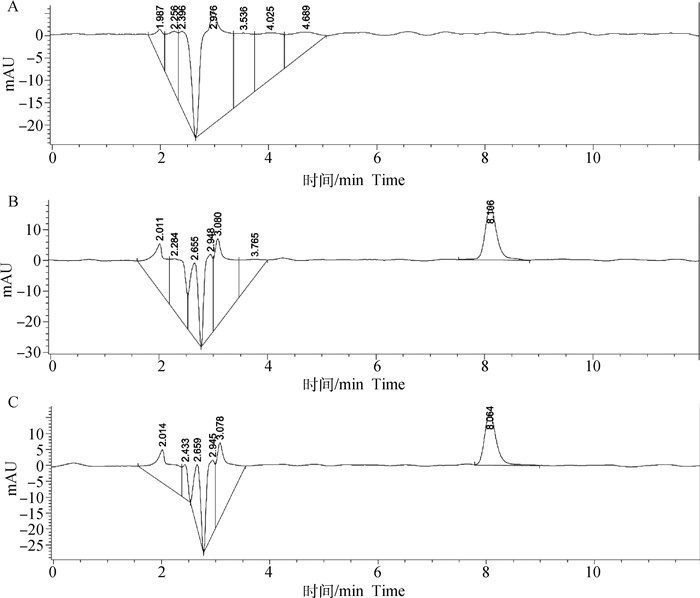
2 结果 2.1 FF含量测定方法的建立2.1.1 专属性试验 结果如图 3,FF的出峰时间为8.10 min左右,出峰时间附近无内源性物质干扰且基线平稳,专属性较高。
|
A. 空白酚红K-R试液; B. 空白酚红K-R试液加FF标准品样品; C. 转运后样品 A. Blank Phenolsulfonphthalein/K-R buffer; B. FF in Blank Phenolsulfonphthalein/K-R buffer; C. Sample after transportation 图 3 FF含量测定专属性试验 Fig. 3 Specific experiment of the determination of FF |
2.1.2 线性关系考察 在266 nm处测得不同浓度FF肠灌流样品的峰面积S与浓度C进行回归分析后, 得回归方程为S=19.49C-28.55(R2=0.999 4)。表明FF溶液在1.562 5~100 μg·mL-1线性关系良好。
2.1.3 检测限、定量限、精密度的测定 检测限为0.37 μg·mL-1,定量限为0.57 μg·mL-1。精密度测定结果见表 1,结果表明,日内和日间两种精密度的RSD均 < 3 %,此方法用于测定FF在标准曲线浓度范围内的精密度良好,满足测定要求。
|
|
表 1 日内精密度与日间精密度(n=3) Table 1 Results of intra-day and inter-day precision (n=3) |
2.1.4 回收率的测定 由表 2可知,按样品处理方法处理样品后,方法回收率较高,各样品FF的提取回收率均>75 %,RSD < 5 %,符合测定要求。
|
|
表 2 回收率结果(n=3) Table 2 Results of the recovery rate (n=3) |
2.1.5 FF在肠灌流液中稳定性考察 在所测定的24 h之内FF含量未发生显著性变化,且本试验中大鼠在体循环肠灌流仅进行2 h,在试验时间内FF稳定性良好(图 4)。

|
图 4 24 h内灌流液中FF稳定性考察(x±s,n=3) Fig. 4 Investigation of FF stability in internal perfusion fluid in 24 h(x±s, n=3) |
表 3结果显示,通过对不同浓度组间进行对比,肠道吸收表现出一定的浓度依赖性,且FF跨肠道吸收的Ka与Peff在试验所用浓度范围内随浓度增加而增加。Peff是衡量单位时间内单位浓度下单位接触面积的吸收率,当不同浓度组间Peff无显著性差异时,才能表明转运中仅存在被动扩散。因此在本试验所用浓度范围内FF的肠道吸收过程中存在除被动扩散外的其他吸收途径。
|
|
表 3 不同浓度FF大鼠在体肠循环灌流结果(x±s,n=6) Table 3 The results of intestinal circulation perfusion in different concentration of FF(x±s, n=6) |
选择以PepT1典型底物GlySar作为竞争性抑制剂与FF共灌注以研究二者对转运位点的竞争性关系。共灌注结果如表 4,显示高浓度(100 μg·mL-1)GlySar显著降低了FF肠道吸收的Peff,因此作为竞争性抑制剂的GlySar有效地抢占了作为转运蛋白的PepT1的底物结合位点,使得FF与PepT1接触的频率降低,转运减少。因而PepT1作为主动转运蛋白参与了FF的跨肠道吸收过程。
|
|
表 4 不同浓度GlySar与FF (100 μg·mL-1)大鼠在体肠循环灌流结果(x±s,n=6) Table 4 The results of intestinal circulation perfusion in different concentration of GlySar with FF (100 μg·mL-1) (x±s, n=6) |
酚红不被肠道吸收,在肠吸收试验中用于测定肠对水分的吸收,以计算肠循环液中药物浓度的变化。氟苯尼考在酚红的最大吸收峰558 nm处无吸收,对酚红的紫外测定无干扰,采用HPLC法测定氟苯尼考在肠道人工灌流液(K-R液)的含量,快速准确,专属性好。
口服药物吸收是一个受药物理化性质和生物制药特性及其与胃肠道相互关系影响的过程。其中,理化因素包括pKa、溶解度、稳定性、扩散率、亲脂性、极性和非极性表面积、氢键的存在、颗粒大小和晶体形式,而生理因素包括胃肠道pH、胃肠道血流量、胃排空、小肠转运时间、结肠转运时间、和吸收机制[34]。一种药物只有在与特定的受体结合时才能发挥其药理作用,因此它必须以溶解的形式存在,然后才能穿过肠道屏障。氟苯尼考在生物药剂学分类系统(BCS)中属于Ⅱ类药物,即低溶解性/高渗透性药物,此类药物吸收的限速步骤是低溶解度。本课题组前期试验中通过制剂手段将氟苯尼考的溶解度提高了3倍,但是其口服生物利用度并未因此得到大幅度的提高。
本试验通过大鼠在体肠循环灌流研究了不同浓度FF及在不同浓度GlySar参与灌注的情况下,FF在肠道的吸收特性。低浓度与中高浓度组间的Ka值均具有显著性差异(P<0.05);有效渗透系数低中高3个组别间均具有显著性差异(P<0.05),当药物仅为简单的单纯扩散时,不同组别间的Ka值与Peff值应无显著性差异,因此,FF的转运并不完全是被动扩散。
自20世纪90年代起,诸多研究利用表达PepT1转运蛋白的细胞系模型,分别考察多种β内酰胺类抗生素与PepT1典型底物GlySar共同细胞摄取及跨细胞单层转运特性,证实了PepT1参与了β-内酰胺类抗生素的肠道吸收过程[14-15]。这些药物化学结构上具有分子内酰胺键,部分还含有游离羧基,呈现出典型的拟肽结构。氟苯尼考结构(如图 1)也含有分子内酰胺键,具有PepT1转运的结构基础。
GlySar为PepT1的典型底物,常通过添加GlySar来判断药物是否是通过PepT1进行主动转运[35]。添加高浓度(100 μg·mL-1)甘氨酰肌氨酸(GlySar)后,Peff(×102 cm·h-1)值为97.2±5.30,与未添加组(110.64±5.70)相比具有显著性差异(P<0.05)。说明其转运受到PepT1蛋白典型底物GlySar的抑制[36],存在转运竞争关系,且存在的竞争抑制关系无法通过PepT1的补偿性表达机制弥补。作为竞争性抑制剂的GlySar有效地抢占了作为转运蛋白的PepT1的底物结合位点,使得FF与PepT1接触的频率降低,转运减,即PepT1作为主动转运蛋白参与了FF的跨肠道吸收过程。
4 结论本研究表明不同浓度间FF的Ka值及Peff值存在显著性差异,并不完全符合简单扩散机制,在添加PepT1的典型底物Gly-Sar后,FF的转运量显著下降,说明Gly-Sar能抑制FF的转运,即PepT1可能作为主动转运蛋白参与了氟苯尼考的跨肠道吸收过程。
| [1] |
杨洁, 李慧素, 彭丽, 等. 两种氟苯尼考注射液在鸡体内比较药动学研究[J]. 中国兽药杂志, 2022, 56(6): 15-20. YANG J, LI H S, PENG L, et al. Comparative pharmacokinetic of two florfenicol injections in chicken[J]. Chinese Journal of Veterinary Drug, 2022, 56(6): 15-20. (in Chinese) |
| [2] |
何英霞, 覃智斌, 梁世仁, 等. 氟苯尼考的毒副作用及其在猪临床上的应用[J]. 现代畜牧科技, 2021(7): 10-11, 13. HE Y X, QIN Z B, LIANG S R, et al. Toxicity and side effects of florfenicol and its clinical application in pigs[J]. Modern Animal Husbandry Science and Technology, 2021(7): 10-11, 13. (in Chinese) |
| [3] |
LI B, HU Y, GUO Y J, et al. Coamorphous system of florfenicol-oxymatrine for improving the solubility and dissolution rate of florfenicol: preparation, characterization and molecular dynamics simulation[J]. J Pharm Sci, 2021, 110(6): 2544-2554. DOI:10.1016/j.xphs.2021.02.005 |
| [4] |
ZHANG W, LIU C P, CHEN S Q, et al. Poloxamer modified florfenicol instant microparticles for improved oral bioavailability[J]. Colloids Surf B: Biointerfaces, 2020, 193: 111078. DOI:10.1016/j.colsurfb.2020.111078 |
| [5] |
刘梦喜, 符华林, 费文波, 等. 氟苯尼考磷脂复合物的制备及表征[J]. 中国抗生素杂志, 2015, 40(2): 103-107. LIU M X, FU H L, FEI W B, et al. Preparation and characterization of florfenicol phospholipid complex[J]. Chinese Journal of Antibiotics, 2015, 40(2): 103-107. DOI:10.3969/j.issn.1001-8689.2015.02.006 (in Chinese) |
| [6] |
AFIFI N A, EL-SOOUD K A. Tissue concentrations and pharmacokinetics of florfenicol in broiler chickens[J]. Br Poult Sci, 1997, 38(4): 425-428. DOI:10.1080/00071669708418013 |
| [7] |
SHEN J, HU D, WU X, et al. Bioavailability and pharmacokinetics of florfenicol in broiler chickens[J]. J Vet Pharmacol Ther, 2003, 26(5): 337-341. DOI:10.1046/j.1365-2885.2003.00495.x |
| [8] |
PARK B K, LIM J H, KIM M S, et al. Pharmacokinetics of florfenicol and its metabolite, florfenicol amine, in dogs[J]. Res Vet Sci, 2008, 84(1): 85-89. DOI:10.1016/j.rvsc.2007.04.001 |
| [9] |
FENG Y Y, ZHAI Q Q, WANG J J, et al. Comparison of florfenicol pharmacokinetics in Exopalaemon carinicauda at different temperatures and administration routes[J]. J Vet Pharmacol Ther, 2019, 42(2): 230-238. DOI:10.1111/jvp.12734 |
| [10] |
BORST P, ELFERINK R O. Mammalian ABC transporters in health and disease[J]. Annu Rev Biochem, 2002, 71: 537-592. DOI:10.1146/annurev.biochem.71.102301.093055 |
| [11] |
HAN X P, SUN J, WANG Y J, et al. PepT1, ASBT-linked prodrug strategy to improve oral bioavailability and tissue targeting distribution[J]. Curr Drug Metab, 2015, 16(1): 71-83. DOI:10.2174/1389200216666150401110754 |
| [12] |
ADIBI S A. Regulation of expression of the intestinal oligopeptide transporter (Pept-1) in health and disease[J]. Gastrointest Liver Physiol, 2003, 285(5): G779-G788. DOI:10.1152/ajpgi.00056.2003 |
| [13] |
LIU Z H, WANG C Y, LIU Q, et al. Uptake, transport and regulation of JBP485 by PEPT1 in vitro and in vivo[J]. Peptides, 2011, 32(4): 747-754. DOI:10.1016/j.peptides.2011.01.019 |
| [14] |
POSADA M M, SMITH D E. Relevance of PepT1 in the intestinal permeability and oral absorption of cefadroxil[J]. Pharm Res, 2013, 30(4): 1017-1025. DOI:10.1007/s11095-012-0937-8 |
| [15] |
POSADA M M, SMITH D E. In vivo absorption and disposition of cefadroxil after escalating oral doses in wild-type and PepT1 knockout mice[J]. Pharm Res, 2013, 30(11): 2931-2939. DOI:10.1007/s11095-013-1168-3 |
| [16] |
SHU C, SHEN H, HOPFER U, et al. Mechanism of intestinal absorption and renal reabsorption of an orally active ace inhibitor: uptake and transport of fosinopril in cell cultures[J]. Drug Metab Dispos, 2001, 29(10): 1307-1315. |
| [17] |
TAO W H, ZHAO D Y, SUN M C, et al. Intestinal absorption and activation of decitabine amino acid ester prodrugs mediated by peptide transporter PEPT1 and enterocyte enzymes[J]. Int J Pharm, 2018, 541(1-2): 64-71. DOI:10.1016/j.ijpharm.2018.02.033 |
| [18] |
SUN Y B, GAN W, LEI M D, et al. PEPT1-mediated prodrug strategy for oral delivery of peramivir[J]. Asian J Pharm Sci, 2018, 13(6): 555-565. DOI:10.1016/j.ajps.2018.05.008 |
| [19] |
GOURDON B, CHEMIN C, MOREAU A, et al. Functionalized PLA-PEG nanoparticles targeting intestinal transporter PepT1 for oral delivery of acyclovir[J]. Int J Pharm, 2017, 529(1-2): 357-370. DOI:10.1016/j.ijpharm.2017.07.024 |
| [20] |
DU Y Q, TIAN C T, WANG M L, et al. Dipeptide-modified nanoparticles to facilitate oral docetaxel delivery: new insights into PepT1-mediated targeting strategy[J]. Drug Deliv, 2018, 25(1): 1403-1413. DOI:10.1080/10717544.2018.1480675 |
| [21] |
HE R, WANG S H, LIU Q, et al. Liquiritin enhancing intestinal absorption of paeoniflorin in in situ single-pass intestinal perfusion and in vitro Caco-2 cell monolayer absorption models[J]. Pharm Mag, 2021, 17(75): 615-622. |
| [22] |
TIAN C H, ASGHAR S, WU Y F, et al. Improving intestinal absorption and oral bioavailability of curcumin via taurocholic acid-modified nanostructured lipid carriers[J]. Int J Nanomedicine, 2017, 12: 7897-7911. DOI:10.2147/IJN.S145988 |
| [23] |
陈俊, 黄家宇, 温昌琳, 等. 基于在体肠循环灌流模型分析腺苷蛋氨酸的肠吸收特性[J]. 中国新药杂志, 2019, 28(18): 2279-2284. CHEN J, HUANG J Y, WEN C L, et al. Analysis of intestinal absorption characteristics of S-adenosyl-L-methionine by in situ intestinal circulating perfusion model[J]. Chinese Journal of New Drugs, 2019, 28(18): 2279-2284. DOI:10.3969/j.issn.1003-3734.2019.18.019 (in Chinese) |
| [24] |
YANG H, HAO Q, CHENG J X, et al. Exploring the compatibility mechanism of ShengDiHuang decoction based on the in situ single-pass intestinal perfusion model[J]. Biopharm Drug Dispos, 2020, 41(1-2): 44-53. DOI:10.1002/bdd.2211 |
| [25] |
王虎斌, 黄卫胤, 温玉发, 等. 大鼠在体单向肠灌流模型研究拉米夫定的肠道渗透性[J]. 南京工业大学学报: 自然科学版, 2021, 43(4): 540-546. WANG H B, HUANG W Y, WEN Y F, et al. Intestinal permeability of lamivudine using in-situ single pass intestinal perfusion in rats[J]. Journal of Nanjing Technology University: Natural Science Edition, 2021, 43(4): 540-546. DOI:10.3969/j.issn.1671-7627.2021.04.020 (in Chinese) |
| [26] |
屈清慧, 周莉, 张继业. 单向肠灌流法研究芍药苷和刺芒柄花苷的肠吸收特性[J]. 药物分析杂志, 2021, 41(1): 64-71. QU Q H, ZHOU L, ZHANG J Y. Study on intestinal absorption characteristics of paeoniflorin and ononin by in situ single-pass intestinal perfusion[J]. Chinese Journal of Pharmaceutical Analysis, 2021, 41(1): 64-71. (in Chinese) |
| [27] |
刘婉霞, 陈瑞, 班玉娟, 等. 基于在体单向肠灌流法探究刺囊酸的大鼠肠吸收特性[J]. 中国新药杂志, 2022, 31(10): 998-1002. LIU W X, CHEN R, BAN Y J, et al. Investigation of intestinal absorption of echinocystic acid by single pass intestinal perfusion model in rats[J]. Chinese Journal of New Drugs, 2022, 31(10): 998-1002. DOI:10.3969/j.issn.1003-3734.2022.10.012 (in Chinese) |
| [28] |
潘承慧, 齐东月, 赵大云. 在体单向肠灌流模型检验大豆皂苷苷元的肠吸收特性[J]. 食品工业科技, 2021, 42(10): 336-342. PAN C H, QI D Y, ZHAO D Y. Determination of soyasapogenols absorption characteristics in rat gut using in situ single-pass intestinal perfusion model[J]. Science and Technology of Food Industry, 2021, 42(10): 336-342. (in Chinese) |
| [29] |
王丽峰, 国大亮, 黄富强, 等. 大鼠在体单向肠灌流法对核黄素肠吸收的研究[J]. 药学研究, 2016, 35(3): 136-138, 153. WANG L F, GUO D L, HUANG F Q, et al. Intestine absorption study on riboflavin with rat single pass intestinal perfusion technique[J]. Journal of Pharmaceutical Research, 2016, 35(3): 136-138, 153. (in Chinese) |
| [30] |
于绍华, 朱立俏, 李传厚, 等. 在体单向肠灌流模型研究萝卜苷的肠吸收特性[J]. 中华中医药杂志, 2021, 36(6): 3273-3276. YU S H, ZHU L Q, LI C H, et al. Intestinal absorption of glucoraphenin by rat single pass intestinal perfusion in situ[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(6): 3273-3276. (in Chinese) |
| [31] |
胡律江, 赵晓娟, 郭慧玲, 等. 基于大鼠在体单向肠灌流模型研究四制香附主成分肠吸收机制[J]. 中华中医药杂志, 2021, 36(3): 1392-1396. HU L J, ZHAO X J, GUO H L, et al. Intestinal absorption mechanism of Cyperi Rhizoma with Jianchangbang by single pass intestinal perfusion model in rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(3): 1392-1396. (in Chinese) |
| [32] |
ITALIYA K S, SINGH A K, CHITKARA D, et al. Nanoparticulate tablet dosage form of lisofylline-linoleic acid conjugate for type 1 diabetes: in situ single-pass intestinal perfusion (SPIP) studies and pharmacokinetics in rat[J]. AAPS PharmSciTech, 2021, 22(3): 114. DOI:10.1208/s12249-021-01980-5 |
| [33] |
罗立宇, 吴宏伟, 赵海誉, 等. 基于在体单向肠灌流模型的红车轴草异黄酮类成分渗透性研究[J]. 中国中医药信息杂志, 2020, 27(11): 89-95. LUO L Y, WU H W, ZHAO H Y, et al. Study on intestinal permeability of isoflavones in Trifolium pretense L. based on in situ single pass intestinal perfusion model[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2020, 27(11): 89-95. (in Chinese) |
| [34] |
FAGERBERG J H, BERGSTRÖM C A S. Intestinal solubility and absorption of poorly water soluble compounds: predictions, challenges and solutions[J]. Ther Deliv, 2015, 6(8): 935-959. |
| [35] |
BAJRAKTARI-SYLEJMANI G, VON LINDE T, BURHENNE J, et al. Evaluation of PepT1 (SLC15A1) substrate characteristics of therapeutic cyclic peptides[J]. Pharmaceutics, 2022, 14(8): 1610. |
| [36] |
STAUFFER M, JECKELMANN J M, ILGV H, et al. Peptide transporter structure reveals binding and action mechanism of a potent PEPT1 and PEPT2 inhibitor[J]. Commun Chem, 2022, 5(1): 23. |
(编辑 白永平)



