2. 西北农林科技大学生命科学学院, 杨凌 712100
2. College of Life Sciences, Northwest A&F University, Yangling 712100, China
中性粒细胞来源于粒细胞-单核细胞祖细胞,是哺乳动物外周血中含量最丰富的白细胞。中性粒细胞作为动物机体固有免疫系统和获得性免疫系统抵御入侵病原体的第一道防线,通过吞噬、脱颗粒和产生活性氧起到宿主防御作用。特别是在机体发生感染时,中性粒细胞可向炎症部位趋化游走,与细菌相遇后被激活,将细菌吞噬形成吞噬体,活性氧在吞噬体膜上形成,细胞脱颗粒,颗粒与吞噬体融合,释放抗菌肽和酶,在吞噬体内高浓度的活性氧和抗菌肽负责清除细菌。对抗体积较小的病原微生物如细菌时,中性粒细胞优先发挥吞噬作用,而在对抗积较大的病原微生物如真菌菌丝时则似乎倾向于形成中性粒细胞胞外诱捕网[1]。大多数研究表明,中性粒细胞胞外诱捕网在细菌、真菌、寄生虫和病毒感染中都能发挥一定的抵御作用,防止病原体的进一步传播和生存。但是,越来越多的证据表明,有些病原体可进化出生存策略,甚至一些研究发现,NETs起到了促进疾病发生发展的负面作用。本文就中性粒细胞胞外诱捕网在病原感染方面的研究进展进行综述。
1 NETs的发现和基本组成成分1996年,Takei等[2]用十四烷酸佛波醇酯(phorbol myristate acetate, PMA)刺激人中性粒细胞后,发现细胞出现与凋亡和坏死完全不同的快速死亡现象,表现为中粒细胞的分叶核退缩、扩散,继而核膜破裂,核内成分释放到细胞质,细胞膜破裂,导致中性粒细胞最终死亡。2004年,Brinkmann等[3]研究发现,活化的中性粒细胞胞外形成的物理性屏障可杀灭其中的细菌,并首次将之定义为中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs)。2007年,Fuchs等[4-5]认为NETs的形成是一种新的不同于细胞坏死和细胞凋亡的细胞死亡程序所控制的,可将中性粒细胞产生和释放NETs的过程定义为NETosis。进一步研究发现,NETs的形成并不一定会导致中性粒细胞死亡,2018年细胞死亡命名委员会(Nomenclature Committee on Cell Death,NCCD)建议用NETs或NET形成来描述这种现象[6]。除中性粒细胞能够产生这种胞外结构之外,肥大细胞[7]、嗜酸性粒细胞[8]和巨噬细胞[9]等也可以产生,因此对类似中性粒细胞胞外诱捕网这样的胞外结构更广泛的定义是胞外诱捕网(extracellular traps,ETs)[10]。
对NETs的组成成分分析表明,其中主要包括细胞DNA、组蛋白和颗粒蛋白等。DNA是NETs的骨干部分,其他蛋白成分附着于DNA骨干结构上。DNA主要是核源DNA,线粒体DNA也可能是NETs的成分[11]。组蛋白主要有H1、H2A、H2B、H3和H4等5种。颗粒蛋白主要包括中性粒细胞弹性酶(neutrophil elastase,NE)、髓过氧化物酶(myeloperoxidase,MPO)、组织蛋白酶G、乳铁蛋白和明胶酶等。通过高分辨率扫描电子显微镜观察发现,NETs呈现无膜包被的纤维网状结构,由直径为15~17 nm的DNA纤维和直径约为25 nm的球形蛋白质结构域组成,该结构非常脆弱,难以提取和纯化[3]。大多数文章描述NETs的形状为纤维网状结构,也有文章表述为云雾状结构[12]。目前在针对NETs的组成成分进行研究的过程中,主要针对蛋白(如MPO和NE等),使用了诸多方法如免疫荧光、免疫组织化学、免疫印迹、活细胞成像、活体显微镜、DNA插入染色技术等[13]。
2 诱导NETs形成的因素诱导NETs产生的因素较多,根据现有的诱导剂自身是否具有生命特征,大体上可分为生物性和非生物性诱导因素。生物性诱导因素主要包括细菌、支原体、螺旋体、真菌、病毒、寄生虫等的感染,细菌和真菌感染与NETs的形成研究报道较多,其他如支原体、螺旋体、寄生虫和病毒的研究报道则较少。非生物性诱导因素如PMA、脂多糖(lipopolysaccharide,LPS)和白介素-8(interleukin,IL-8)等,这些因素可能参与到中性粒细胞产生NETs的生物学事件中,例如可能与染色质的解聚存在关系。Strandin等[14]认为,普马拉汉坦病毒直接诱导NETs形成的证据不足,但是体外试验证明,中性粒细胞是由被汉坦病毒感染的内皮细胞激活的。因此,这些诱导因素可能是直接或间接诱导NETs形成的,目前常见的诱导因素如表 1所示。
|
|
表 1 可诱导NETs形成的因素汇总 Table 1 Summary of the factors that can induce the formation of NETs |
NETs的形成是一个复杂的动态过程,依赖于多种信号分子和信号通路,目前对于其形成机制的描述众说纷纭。在NETs形成过程中,中性粒细胞的形态发生了一系列的变化。Fuchs等[4]以20 nmol·L-1的PMA刺激人中性粒细胞60 min后,发现细胞核小叶开始消失,染色质开始解致密,此时核膜仍保持完整,但内外核膜间隙扩张;在120 min时,核膜形成明显囊泡;180 min时,核膜分解成许多小泡,染色质解致密,大部分颗粒消失。Tabrizi等[41]认为,NETs形成的生物学步骤主要包括核膜破裂、染色质逐步解凝、中性粒细胞弹性酶转移、组蛋白加工,最终形成NETs。根据中性粒细胞在NETs形成过程中是否会发生死亡,可将NETs形成分为自杀型NETs形成和活性型NETs形成。但目前对于NETs形成机制还没有形成系统的理论或学说,自杀型NETs的形成机制是最早被描述的。
研究表明,活性氧(reactive oxygen species,ROS)的产生有利于NETs的形成。一些活性氧如单线态氧(1O2)、HOCl、H2O2等可以诱导中性粒细胞产生NETs[42-43]。PMA等可促进烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NOX)在吞噬体膜或细胞质上的组装和激活,诱导ROS的产生[4]。研究表明,Raf-MEK-ERK通路位于NOX的上游,调控ROS的产生[44]。但也存在不依赖于NOX的线粒体ROS,可由线粒体DNA诱导产生[45-46]。ROS损伤分泌颗粒和溶酶体的膜,导致NE从嗜蓝颗粒中释放。NE首先转移至细胞核,切割部分特定的组蛋白,促进染色质解聚。随后,MPO也从嗜蓝颗粒从释放,与NE协同驱动促进染色质解凝[47]。PMA与蛋白激酶C(protein kinase C, PKC)结合[2],诱导胞内钙离子释放,进而激活肽精氨酸脱亚胺酶4(peptidylarginine deiminase,PAD4)。PAD4又称为PADI4或PADV,首次在人白血病细胞HL-60中被发现,在外周血中性粒细胞中高表达[48-49]。PAD4可使组蛋白H2A、H3和H4的精氨酸残基脱亚氨基形成瓜氨酸残基,正电荷减少,与DNA的静电结合力减弱,染色质从而解凝[50]。可见,NETs形成过程中的核心过程是染色质解凝,需要ROS、NE、MPO以及PAD4等的参与;之后细胞核膜破裂,解聚的染色质被释放至胞质,并与胞质中的其他物质如MPO和NE等颗粒蛋白一起通过Gasdermin D(GSDMD)孔或由GSDMD驱动的膜撕裂排放到胞外空间,并导致了中性粒细胞的死亡[51]。NETs的形成机制如图 1所示。
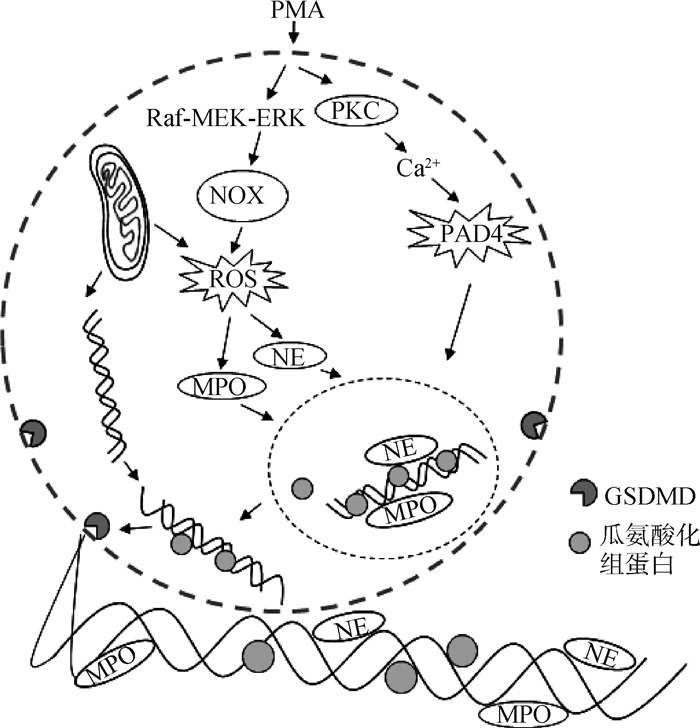
|
图 1 NETs的形成机制示意图 Fig. 1 The schematic diagram of the formation mechanism of NETs |
大多数观点认为,ROS、PAD4在NETs的形成过程中是不可或缺的,在NETs形成中使用它们的抑制剂时可以抑制NETs的形成。NOX抑制剂如二苯基碘铵(diphenyl iodonium,DPI)和罗布宁在以利什曼原虫或PMA作为刺激物刺激中性粒细胞时可使NETs的产生减少[52]。慢性肉芽肿病患者由于缺乏NOX-2,其中性粒细胞无法产生ROS,在PMA应答时不会形成NETs[53]。但也有研究认为ROS并不是不可或缺的,Rochael等[52]将利什曼原虫前鞭毛体与人中性粒细胞共孵育10 min后产生NETs,认为NETs形成的早期/快速机制依赖于NE活性,不依赖于ROS的释放。其他的刺激物如活化的血小板、白色念珠菌、肿瘤坏死因子-α及免疫复合物等亦可产生上述类似的ROS非依赖诱导NETs形成的作用[54]。PAD4选择性可逆抑制剂GSK484预处理中性粒细胞,再以PMA刺激,发现能消除组蛋白H3的瓜氨酸化,抑制NETs形成[43, 55]。
4 NETs在病原感染中的作用NETs可捕获、抑制或杀灭细菌、真菌、寄生虫和病毒等多种病原体,诱导机体产生抗感染免疫,形成宿主防御。但是病原体可能会通过形成NETs抑制因子和NETs降解因子等,阻断或抑制NETs形成所依赖的某些细胞信号通路等,逃脱NETs的作用。此外,NETs在病原感染中可能会被利用以进一步增强感染,或者介导组织损伤,加重疾病的严重程度。
4.1 NETs在细菌感染中的作用细菌感染时中性粒细胞会形成NETs来捕获细菌、支原体和螺旋体,NETs的多个组分如DNA、NE和组蛋白等可通过破坏细菌细胞膜完整性或降解毒力因子等方式杀死部分细菌。胞外DNA具有快速杀菌活性,螯合表面结合的阳离子,可破坏细菌细胞膜完整性和溶解细菌[18]。NE可降解革兰阴性菌的毒力因子,可杀死金黄色葡萄球菌和弗氏杆菌。纯化的组蛋白H2A能够杀死弗氏志贺菌、鼠伤寒沙门菌和金黄色葡萄球菌[3]。
然而细菌会进化形成逃避策略,目前已知部分细菌如马链球菌、肺炎支原体和牛支原体等可通过分泌胞外核酸酶降解NETs的DNA骨干等,以逃脱NETs的杀菌作用。马链球菌分泌的胞外核酸酶ENuc和5 Nuc通过降解NETs的DNA骨干并产生脱氧腺苷,损害巨噬细胞的吞噬活性而避免被清除[56]。肺炎支原体分泌的核酸酶Mpn491可降解NETs,造成肺炎支原体的持续感染[21]。牛支原体的核酸酶抑制了NETs的形成,添加的乙二胺四乙酸能螯合核酸酶活性所依赖的钙离子,从而显著提升NETs存在下对牛支原体的杀伤力[22]。除牛支原体外,一些细菌的胞外核酸酶活性可能与多种金属离子有关,李琦等[57]发现,有些金属离子对猪霍乱沙门菌胞外核酸酶活性有促进作用。或许,通过减少金属离子抑制胞外核酸酶活性,从而提升NETs的杀伤力不失为一种良策。
部分证据显示,细菌可能通过杀死或抑制吞噬细胞,或降解NETs作为生长因子来增强细菌感染。Bhattacharya等[58]认为,耐甲氧西林金黄色葡萄球菌生物膜通过释放杀白细胞素和γ-溶血素AB诱导NETs的形成,但是这两种毒力因子导致与NETs相关的中性粒细胞死亡,阻止中性粒细胞清除生物膜细菌,NETs的杀菌活性失效,这提示NETs可能会无意中增强细菌的持续感染,使慢性感染的预后复杂化。此外,细菌会劫持宿主成分如DNA等来形成生物膜,因此NETs可能参与细菌生物膜的形成[59]。同样地,de Buhr等[60]认为胸膜肺炎放线菌不仅利用宿主核酸酶DNase 1或其他共感染细菌如猪链球菌的核酸酶降解NETs来逃避NETs的抗菌作用,还利用降解的NETs作为它自身生长所需因子即烟酰胺腺嘌呤二核苷酸的来源。
4.2 NETs在真菌感染中的作用NETs对真菌感染也具有抑制作用,通过分泌颗粒蛋白,如钙卫蛋白等螯合真菌生长所需的金属离子,或者以其网状物理屏障帮助捕获和固定真菌以限制其扩散传播从而抑制或杀死真菌。Urban等[25]通过试验证明,白色念珠菌可诱导NETs的产生,NETs分泌的颗粒蛋白介导部分真菌在细胞外杀伤。NETs的组分钙卫蛋白通过螯合真菌生长所需的锌离子,在低浓度下可逆抑制曲霉菌的生长,在高浓度下导致不可逆的曲霉菌生长受抑制,从而减少曲霉菌病感染[26]。巴西副囊球菌与人中性粒细胞的模式识别受体dectin-1受体结合诱导NETs的产生,NETs负责捕获酵母细胞,促进其固定以防止感染传播,并有助于细胞外杀伤[27]。
同样地,真菌也能进化形成逃逸机制,一些真菌可通过抑制或阻断某些细胞信号通路使NETs生成减少或不能生成。新生隐球菌的荚膜成分葡萄糖醛酸多糖通过抑制活性氧的产生导致人中性粒细胞产生NETs减少,帮助真菌的扩散传播和加重疾病[28]。白色念珠菌生物膜的细胞外基质中存在调节NETs抗性的甘露聚糖基因,与抑制中性粒细胞产生ROS相关,损害了NETs的释放,从而允许真菌存活和传播[61]。同样地,光滑念珠菌生物膜的形成涉及富含多糖的细胞外基质的产生,这些基质中特有的多糖与NETs的受损有关,可导致NETs释放延迟,从而抵抗吞噬细胞的攻击[62]。
NETs的存在可能会增加某些真菌性疾病的易感性,或者被利用以增加真菌的感染能力。许向华等[63]利用烟曲霉对患有2型糖尿病小鼠和无糖尿病小鼠进行气道感染,在患病小鼠上发现,其真菌负荷、炎症水平以及肺部的组蛋白3的水平显著高于对照组,这提示由于NOX异常导致的NETs释放增多可能会增加糖尿病小鼠易感侵袭性曲霉菌病。还有研究认为,NETs的蛋白质成分如NE和MPO等几种蛋白质混合物黏附在白色念珠菌细胞表面,并与真菌细胞壁蛋白如凝集素样序列蛋白家族Als3的黏附素、烯醇化酶、糖异构酶和磷酸甘油酸突变酶相互作用,大大增加了病原体对人类上皮细胞的破坏能力,影响NETs的诱捕效果,增加真菌在宿主上的进一步定植[64]。
4.3 NETs在寄生虫感染中的作用在寄生虫感染中NETs可发挥其物理屏障作用,以其纤维网状结构诱捕寄生虫,通过与其他免疫细胞协同杀死寄生虫,或者通过分泌其组分如组蛋白和颗粒酶等使寄生虫的存活率或入侵率降低。粪圆线虫幼虫可以触发中性粒细胞和巨噬细胞释放ETs,被ETs诱捕,但不能被ETs杀死,可能是中性粒细胞与其他免疫细胞如巨噬细胞协同作用导致这种大型且高度运动的线虫死亡[32]。Rochael等[52]用富含NETs的上清液处理利什曼原虫前鞭毛体,发现寄生虫的存活率降低40%左右,Guimarães-Costa等[29]在电子显微镜下观察到利什曼原虫被NETs诱捕,在中性粒细胞-利什曼原虫前鞭毛体上清液中添加抗组蛋白抗体后,利什曼原虫杀灭作用被抑制,纯化组蛋白可杀死部分利什曼原虫前鞭毛体,表明寄生虫杀灭可能依赖NETs成分组蛋白。驴中性粒细胞和刚地弓形虫速殖子在体外共孵育,NETs可物理捕获速殖子,其分泌的NE可能通过杀微生物激肽和外壁蛋白水解起到抗寄生虫作用,使弓形虫速殖子入侵宿主细胞的入侵率降低[12]。
在寄生虫感染中,部分寄生虫也能产生逃避策略,可利用其自身所具有的毒力因子等对抗NETs的抗寄生虫作用。Gabriel等[65]的研究表明,杜氏利什曼原虫前鞭毛体可以刺激人中性粒细胞触发NETs的产生,NETs会诱捕寄生虫,可能有助于将寄生虫限制在感染部位,促进单核吞噬细胞的吞噬。但是杜氏利什曼原虫可能利用其前鞭毛体的主要表面毒力因子脂磷多糖(lipophosphoglycan, LPG)和糖蛋白GP63拮抗NETs的杀伤作用。LPG通过一种不同寻常的糖基磷脂酰肌醇锚定在前鞭毛体膜上,可以保护杜氏利什曼原虫前鞭毛体免受NETs的杀伤作用。GP63可能也是通过这种作用保护杜氏利什曼原虫前鞭毛体。
NETs对介导组织损伤、产生病理变化和促进寄生虫感染具有一部分“功劳”。Sercundes等[66]在由伯氏疟原虫引起的急性肺损伤和急性呼吸窘迫综合征的小鼠上发现,其肺部有大量中性粒细胞浸润,且与未发生肺部并发症小鼠相比,产生了过多的MPO、ROS和中性粒细胞吸引趋化因子。在使用一些NETs抑制剂或降解剂如AMD3100、Pulmozyme、Sivelestat后,降低了急性肺损伤和急性呼吸窘迫综合征的发展,显著增加了小鼠的生存率。Knackstedt等[67]的数据直接表明,在由疟原虫感染引起的疟疾中,由血红素刺激诱导产生NETs,但DNase 1降解NETs产生离散的片段,这些NETs片段在血管炎症传播和促进寄生虫黏附细胞中发挥重要的作用。
4.4 NETs在病毒感染中的作用NETs可发挥抗病毒作用,抗病毒免疫机制可能包括对病毒颗粒的固定、NETs相关蛋白对病毒的抑制或诱导浆细胞样树突状细胞产生Ⅰ型干扰素等。部分研究已经指出,病毒可产生对抗NETs的诱捕和杀伤的免疫逃避作用,抵消NETs的宿主防御功能。也有部分研究证明NETs没有抗病毒作用,反而对疾病的发生发展具有促进作用。此外,一些研究认为NETs在适量浓度下可以发挥抗病毒作用,但是过度的NETs反应可能会促进炎症因子形成,放大炎症级联反应或促进栓塞形成等,不利于疾病的治愈。然而,目前关于NETs在病毒感染中的作用研究报道不是很多,基本上集中在人类病毒感染方面。
在病毒感染中,NETs能以其物理屏障捕获和固定病毒粒子,通过分泌颗粒成分、诱导其他免疫细胞产生抗病毒因子或与NETs相关蛋白互作发挥抗病毒作用。人类免疫缺陷病毒(human immunodeficiency virus,HIV)刺激人中性粒细胞产生NETs,导致病毒颗粒被捕获和消除。可能的机制是中性粒细胞通过Toll样受体TLR7和TLR8检测并识别HIV-1,诱导ROS产生,触发NETs形成,表达MPO和α-防御素导致HIV-1被清除[33]。此外还有证据表明,女性生殖器中性粒细胞不同于血液中性粒细胞,具有不同的表型和功能,Barr等[68]发现粒细胞可刺激HIV病毒样颗粒快速产生NETs,捕获和灭活HIV,防止HIV易感细胞的后续感染。由于病毒暴露后,生殖器中性粒细胞产生NETs仅需几分钟,不太可能产生组织损伤,且HIV刺激后的前3 h时内生殖器树突状细胞不产生IL-10,NETs形成没有被抵消。因此,NETs可能是一种性接触后防止黏膜感染HIV的有效机制。
同样地,病毒也会产生免疫逃避机制来抵御NETs的抗病毒作用。虽然NETs在一定程度上可以消除HIV-1,但是HIV-1可通过诱导树突状细胞产生c型凝集素CD209依赖的IL-10抑制TLR7和TLR8信号通路来抵消NETs的抗病毒反应,帮助病毒实现免疫逃避[33]。不过在艾滋病患者体内实现NETs消除HIV是存在困难的,因为随着病程的进展,患者体内的中性粒细胞数量逐渐减少,免疫屏障和免疫功能也遭到破坏,NETs形成受阻或不足都无法发挥完全的抗病毒作用。
有些研究表明,NETs的生成非但没有抗病毒作用,反而会加重疾病的严重程度,它可作为一种炎症介质,介导组织损伤,对患病机体的健康有害。Veras等[39]认为,在新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-COV-2)感染中,4种分子机制即血管紧张素转换酶2、丝氨酸蛋白酶、PAD4以及病毒复制,参与到诱导NETs的生成。在患者的血浆、气管抽吸物和肺部组织均能检测到高水平的NETs,SARS-CoV-2激活的中性粒细胞释放的NETs在体外促进肺上皮细胞死亡。NETs是炎症性疾病组织损伤的重要介质,可能参与介导新冠肺炎的病理生理过程,因此,作者提出抑制NETs的释放可能是一种治疗新型冠状肺炎疾病的潜在手段。Akk等[69]明确表示,小鼠副流感病毒Ⅰ型仙台病毒(Sendai virus, Sev)感染急性期释放的NETs诱发了气道炎症,导致炎症细胞因子进一步招募和激活免疫细胞,促进最终的慢性哮喘表型。一种由中性粒细胞衍生的与NE、组织蛋白酶G和蛋白酶3等表达相关的半胱氨酸蛋白酶二肽基肽酶Ⅰ(dipeptidyl peptidase I, DPPI)缺失可显著降低Sev诱导的NET形成,抑制了急性肺部炎症反应和随后的哮喘表型。此外,同时给予DNase 1或抑制PAD4,可抑制Sev感染的早期炎症反应[69]。因此,缺失DPPI、给予DNase 1或抑制PAD4可能对Sev感染导致的炎症反应的减少有一定帮助。
也有一些研究认为,NETs在适量条件下是具有抗病毒作用的,过度的NETs生成可能会加重疾病严重程度。呼吸道合胞病毒(respiratory syncytial virus, RSV)颗粒及其融合蛋白可通过TLR4的激活、NOX衍生的ROS、ERK、p38MAPK磷酸化等途径刺激人中性粒细胞产生NETs[37]。NETs具有抗人呼吸道合胞病毒(human respiratory syncytial virus, hRSV)活性,可捕获病毒颗粒[70],体外试验证明,低浓度的NETs抗hRSV活性较为良好,可减少Hep-2细胞损伤和合胞体的合成,降低病毒感染的传播率。可能的抗病毒机制是hRSV的包膜F蛋白与NETs相关蛋白即杀菌渗透增强蛋白的互作,抑制细胞-细胞融合和合胞体的形成,影响病毒的黏附和内化等早期步骤,促进病毒中和作用[71]。但同时,Funchal等[37]不仅在患有严重的RSV引起的下呼吸道疾病的人类婴儿和小牛支气管肺泡灌洗液和肺组织切片中观察到NETs的存在,而且对感染了RSV的小牛组织进行病理学检查显示,在阻塞气道的致密堵塞物中存在广泛的网状结构。该网状物中存在大量的DNA,黏液黏度高。这表明过多的NETs会导致气道阻塞,NETs在RSV感染期间积极参与气道阻塞,而局部dornase α治疗可通过降解DNA主干显著减少NETs引起的气道阻塞[72]。
5 展望自NETs被发现和描述以来,对其组成成分的分析和检测方法一直在不断探索和完善中。NETs大致由DNA、组蛋白和各种颗粒酶组成。其中,DNA是NETs必不可少的主干部分,对DNA进行降解将会导致NETs的完整性遭到破坏。大多数细菌也正是利用这一点,分泌核酸酶降解DNA,以此逃脱NETs的抗菌效应。Yousefi等[11]发现组成NETs的DNA是线粒体DNA,且形成的NETs不需要中性粒细胞死亡。这或许是NETs可根据中性粒细胞死亡与否区分为活性型NETs和自杀型NETs的证据。由于NETs发生在胞外空间,但是其他活动如细胞外囊泡的分泌或者细胞坏死等可能也会导致DNA释放在胞外空间,那么如果针对DNA进行检测,可能难以区分。这或许是目前大多数的检测方法以颗粒酶作为NETs的检测指标之一的原因。由此可见,针对NETs的检测方法亟待进一步发展。
关于NETs形成的分子机制,目前存在众多说法,尚未形成系统的论述。在自杀型NETs的形成机制中,ROS的产生对NETs的形成来说是十分重要的。除了Raf-MEK-ERK通路是调控ROS的上游细胞信号通路,还存在其他的细胞信号通路如TLR信号通路等,这是有待深入研究NETs形成机制的其中一个方面。
NETs在病原感染中具有双重效应,一方面具有抵御多种病原体的作用,另一方面也会介导多种疾病,促进其发生发展。现有的研究表明,NETs在病原体感染中能发挥抗病原体效应,但是其作用有限,并不能完全杀死病原体。对有些病原体而言,NETs只是起到诱捕作用。在疾病的发生发展中,NETs可能会起到负面作用,可作为炎症介质,可能会放大炎症级联反应,介导组织损伤,阻碍疾病的康复。针对NETs对病原体的杀灭或毒性作用,病原体本身可通过启动一些逃避机制如表达降解NETs因子来降解NETs的核心组分或抑制某些激活途径等来抵御NETs的作用,促进在机体中的感染传播。因此,在开发NETs相关的药物方面具有巨大的市场潜力,针对性地发掘治疗药物如NETs抑制剂或NETs碎片促进剂等,通过抑制NETs的形成可能对疾病的治愈有一定帮助。
NETs在病原体感染中并不能产生完全的抵御效应,这意味着中性粒细胞在病原体感染中不可能单打独斗,可能与其他的细胞存在一定的联系,或许在抗病原体反应中发挥协同作用。除了NETs以外,目前已经发现其他的细胞如肥大细胞、嗜酸性粒细胞和巨噬细胞等也会被诱导产生ETs。这些能形成ETs的细胞是固有免疫细胞,这表明形成的ETs与先天免疫系统可能存在密不可分的联系。那么,这些细胞产生的ETs与NETs存在哪些差异呢?这也值得研究者深入地挖掘和研究。
| [1] |
BRANZK N, LUBOJEMSKA A, HARDISON S E, et al. Neutrophils sense microbe size and selectively release neutrophil extracellular traps in response to large pathogens[J]. Nat Immunol, 2014, 15(11): 1017-1025. DOI:10.1038/ni.2987 |
| [2] |
TAKEI H, ARAKI A, WATANABE H, et al. Rapid killing of human neutrophils by the potent activator phorbol 12-myristate 13-acetate (PMA) accompanied by changes different from typical apoptosis or necrosis[J]. J Leukoc Biol, 1996, 59(2): 229-240. DOI:10.1002/jlb.59.2.229 |
| [3] |
BRINKMANN V, REICHARD U, GOOSMANN C, et al. Neutrophil extracellular traps kill bacteria[J]. Science, 2004, 303(5663): 1532-1535. DOI:10.1126/science.1092385 |
| [4] |
FUCHS T A, ABED U, GOOSMANN C, et al. Novel cell death program leads to neutrophil extracellular traps[J]. J Cell Biol, 2007, 176(2): 231-241. DOI:10.1083/jcb.200606027 |
| [5] |
STEINBERG B E, GRINSTEIN S. Unconventional roles of the NADPH oxidase: signaling, ion homeostasis, and cell death[J]. Sci STKE, 2007, 2007(379): pe11. |
| [6] |
GALLUZZI L, VITALE I, AARONSON S A, et al. Molecular mechanisms of cell death: recommendations of the nomenclature committee on cell death 2018[J]. Cell Death Differ, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 |
| [7] |
TRAN H, JHA R, NGUYEN J, et al. Hemin-induced mast cell-extracellular traps impart resistance to therapy in a sickle microenvironment[J]. Blood, 2015, 126(23): 3385. DOI:10.1182/blood.V126.23.3385.3385 |
| [8] |
UEKI S, MELO R C N, GHIRAN I, et al. Eosinophil extracellular DNA trap cell death mediates lytic release of free secretion-competent eosinophil granules in humans[J]. Blood, 2013, 121(11): 2074-2083. DOI:10.1182/blood-2012-05-432088 |
| [9] |
SONG C, LI H T, LI Y, et al. NETs promote ALI/ARDS inflammation by regulating alveolar macrophage polarization[J]. Exp Cell Res, 2019, 382(2): 111486. DOI:10.1016/j.yexcr.2019.06.031 |
| [10] |
PINEGIN B, VOROBJEVA N, PINEGIN V. Neutrophil extracellular traps and their role in the development of chronic inflammation and autoimmunity[J]. Autoimmun Rev, 2015, 14(7): 633-640. DOI:10.1016/j.autrev.2015.03.002 |
| [11] |
YOUSEFI S, MIHALACHE C, KOZLOWSKI E, et al. Viable neutrophils release mitochondrial DNA to form neutrophil extracellular traps[J]. Cell Death Differ, 2009, 16(11): 1438-1444. DOI:10.1038/cdd.2009.96 |
| [12] |
YILDIZ K, GOKPINAR S, SURSAL N, et al. Extracellular trap formation by Donkey polymorphonuclear neutrophils against Toxoplasma gondii[J]. J Equine Vet Sci, 2019, 73: 1-9. DOI:10.1016/j.jevs.2018.11.002 |
| [13] |
SHAO B Z, YAO Y, LI J P, et al. The role of neutrophil extracellular Traps in cancer[J]. Front Oncol, 2021, 11: 714357. DOI:10.3389/fonc.2021.714357 |
| [14] |
STRANDIN T, MÄKELÄ S, MUSTONEN J, et al. Neutrophil activation in acute hemorrhagic fever with renal syndrome is mediated by hantavirus-infected microvascular endothelial cells[J]. Front Immunol, 2019, 9: 2098. |
| [15] |
GRINBERG N, ELAZAR S, ROSENSHINE I, et al. β-hydroxybutyrate abrogates formation of bovine neutrophil extracellular traps and bactericidal activity against mammary pathogenic Escherichia coli[J]. Infect Immun, 2008, 76(6): 2802-2807. DOI:10.1128/IAI.00051-08 |
| [16] |
RAMOS-KICHIK V, MONDRAGÓN-FLORES R, MONDRAGÓN-CASTELÁN M, et al. Neutrophil extracellular traps are induced by Mycobacterium tuberculosis[J]. Tuberculosis (Edinb), 2009, 89(1): 29-37. DOI:10.1016/j.tube.2008.09.009 |
| [17] |
SEPER A, HOSSEINZADEH A, GORKIEWICZ G, et al. Vibrio cholerae evades neutrophil extracellular traps by the activity of two extracellular nucleases[J]. PLoS Pathog, 2013, 9(9): e1003614. DOI:10.1371/journal.ppat.1003614 |
| [18] |
HALVERSON T W R, WILTON M, POON K K H, et al. DNA is an antimicrobial component of neutrophil extracellular traps[J]. PLoS Pathog, 2015, 11(1): e1004593. DOI:10.1371/journal.ppat.1004593 |
| [19] |
MOORTHY A N, NARASARAJU T, RAI P, et al. In vivo and in vitro studies on the roles of neutrophil extracellular traps during secondary pneumococcal pneumonia after primary pulmonary influenza infection[J]. Front Immunol, 2013, 4: 56. |
| [20] |
BUCHANAN J T, SIMPSON A J, AZIZ R K, et al. DNase expression allows the pathogen group A Streptococcus to escape killing in neutrophil extracellular traps[J]. Curr Biol, 2006, 16(4): 396-400. DOI:10.1016/j.cub.2005.12.039 |
| [21] |
YAMAMOTO T, KIDA Y, SAKAMOTO Y, et al. Mpn491, a secreted nuclease of Mycoplasma pneumoniae, plays a critical role in evading killing by neutrophil extracellular traps[J]. Cell Microbiol, 2017, 19(3): e12666. DOI:10.1111/cmi.12666 |
| [22] |
GONDAIRA S, HIGUCHI H, NISHI K, et al. Mycoplasma bovis escapes bovine neutrophil extracellular traps[J]. Vet Microbiol, 2017, 199: 68-73. DOI:10.1016/j.vetmic.2016.12.022 |
| [23] |
CACCIOTTO C, CUBEDDU T, ADDIS M F, et al. Mycoplasma lipoproteins are major determinants of neutrophil extracellular trap formation[J]. Cell Microbiol, 2016, 18(12): 1751-1762. DOI:10.1111/cmi.12613 |
| [24] |
MENTEN-DEDOYART C, FACCINETTO C, GOLOVCHENKO M, et al. Neutrophil extracellular traps entrap and kill Borrelia burgdorferi sensu stricto spirochetes and are not affected by Ixodes ricinus tick saliva[J]. J Immunol, 2012, 189(11): 5393-5401. DOI:10.4049/jimmunol.1103771 |
| [25] |
URBAN C F, REICHARD U, BRINKMANN V, et al. Neutrophil extracellular traps capture and kill Candida albicans yeast and hyphal forms[J]. Cell Microbiol, 2006, 8(4): 668-676. DOI:10.1111/j.1462-5822.2005.00659.x |
| [26] |
BIANCHI M, NIEMIEC M J, SILER U, et al. Restoration of anti-Aspergillus defense by neutrophil extracellular traps in human chronic granulomatous disease after gene therapy is calprotectin-dependent[J]. J Allergy Clin Immunol, 2011, 127(5): 1243-1252. DOI:10.1016/j.jaci.2011.01.021 |
| [27] |
BACHIEGA T F, DIAS-MELICIO L A, Fernandes R K, et al. Participation of dectin-1 receptor on NETs release against Paracoccidioides brasiliensis: role on extracellular killing[J]. Immunobiology, 2016, 221(2): 228-235. DOI:10.1016/j.imbio.2015.09.003 |
| [28] |
ROCHA J D B, NASCIMENTO M T C, DECOTE-RICARDO D, et al. Capsular polysaccharides from Cryptococcus neoformans modulate production of neutrophil extracellular traps (NETs) by human neutrophils[J]. Sci Rep, 2015, 5: 8008. DOI:10.1038/srep08008 |
| [29] |
GUIMARÃES-COSTA A B, NASCIMENTO M T C, FROMENT G S, et al. Leishmania amazonensis promastigotes induce and are killed by neutrophil extracellular traps[J]. Proc Natl Acad Sci U S A, 2009, 106(16): 6748-6753. DOI:10.1073/pnas.0900226106 |
| [30] |
CHUAH C, JONES M K, BURKE M L, et al. Spatial and temporal transcriptomics of Schistosoma japonicum-induced hepatic granuloma formation reveals novel roles for neutrophils[J]. J Leukoc Biol, 2013, 94(2): 353-365. DOI:10.1189/jlb.1212653 |
| [31] |
GARZA J J, GREINER S P, BOWDRIDGE S A. Ovine vital neutrophil extracellular traps bind and impair Haemonchus contortus L3 in a breed-dependent manner[J]. Parasite Immunol, 2018, 40(9): e12572. |
| [32] |
BONNE-ANNÉE S, KEREPESI L A, HESS J A, et al. Extracellular traps are associated with human and mouse neutrophil and macrophage mediated killing of larval Strongyloides stercoralis[J]. Microbes Infect, 2014, 16(6): 502-511. DOI:10.1016/j.micinf.2014.02.012 |
| [33] |
SAITOH T, KOMANO J, SAITOH Y, et al. Neutrophil extracellular traps mediate a host defense response to human immunodeficiency virus-1[J]. Cell Host Microbe, 2012, 12(1): 109-116. DOI:10.1016/j.chom.2012.05.015 |
| [34] |
WARDINI A B, GUIMARÃES-COSTA A B, Nascimento M T C, et al. Characterization of neutrophil extracellular traps in cats naturally infected with feline leukemia virus[J]. J Gen Virol, 2010, 91(1): 259-264. DOI:10.1099/vir.0.014613-0 |
| [35] |
HU S N, LIU X W, GAO Y, et al. Hepatitis B virus inhibits neutrophil extracellular trap release by modulating reactive oxygen species production and autophagy[J]. J Immunol, 2019, 202(3): 805-815. DOI:10.4049/jimmunol.1800871 |
| [36] |
TOUSSAINT M, JACKSON D J, SWIEBODA D, et al. Host DNA released by NETosis promotes rhinovirus-induced type-2 allergic asthma exacerbation[J]. Nat Med, 2017, 23(6): 681-691. DOI:10.1038/nm.4332 |
| [37] |
FUNCHAL G A, JAEGER N, CZEPIELEWSKI R S, et al. Respiratory syncytial virus fusion protein promotes TLR-4-dependent neutrophil extracellular trap formation by human neutrophils[J]. PLoS One, 2015, 10(4): e0124082. DOI:10.1371/journal.pone.0124082 |
| [38] |
OPASAWATCHAI A, AMORNSUPAWAT P, JIRAVEJCHAKUL N, et al. Neutrophil activation and early features of net formation are associated with dengue virus infection in human[J]. Front Immunol, 2019, 9: 3007. DOI:10.3389/fimmu.2018.03007 |
| [39] |
VERAS F P, PONTELLI M C, SILVA C M, et al. SARS-CoV-2-triggered neutrophil extracellular traps mediate COVID-19 pathology[J]. J Exp Med, 2020, 217(12): e20201129. DOI:10.1084/jem.20201129 |
| [40] |
CLARK S R, MA A C, TAVENER S A, et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood[J]. Nat Med, 2007, 13(4): 463-469. DOI:10.1038/nm1565 |
| [41] |
TABRIZI Z A, KHOSROJERDI A, ASLANI S, et al. Multi-facets of neutrophil extracellular trap in infectious diseases: moving beyond immunity[J]. Microb Pathog, 2021, 158: 105066. DOI:10.1016/j.micpath.2021.105066 |
| [42] |
NISHINAKA Y, ARAI T, ADACHI S, et al. Singlet oxygen is essential for neutrophil extracellular trap formation[J]. Biochem Biophys Res Commun, 2011, 413(1): 75-79. DOI:10.1016/j.bbrc.2011.08.052 |
| [43] |
TATSIY O, MCDONALD P P. Physiological stimuli induce PAD4-Dependent, ROS-Independent NETosis, with early and late events controlled by discrete signaling pathways[J]. Front Immunol, 2018, 9: 2036. DOI:10.3389/fimmu.2018.02036 |
| [44] |
HAKKIM A, FUCHS T A, MARTINEZ N E, et al. Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation[J]. Nat Chem Biol, 2011, 7(2): 75-77. DOI:10.1038/nchembio.496 |
| [45] |
PIETERSE E, ROTHER N, YANGINLAR C, et al. Cleaved N-terminal histone tails distinguish between NADPH oxidase (NOX)-dependent and NOX-independent pathways of neutrophil extracellular trap formation[J]. Ann Rheum Dis, 2018, 77(12): 1790-1798. DOI:10.1136/annrheumdis-2018-213223 |
| [46] |
LIU L, MAO Y, XU B C, et al. Induction of neutrophil extracellular traps during tissue injury: Involvement of STING and Toll-like receptor 9 pathways[J]. Cell Prolif, 2019, 52(3): e12579. DOI:10.1111/cpr.12579 |
| [47] |
PAPAYANNOPOULOS V, METZLER K D, HAKKIM A, et al. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps[J]. J Cell Biol, 2010, 191(3): 677-691. DOI:10.1083/jcb.201006052 |
| [48] |
NAKASHIMA K, HAGIWARA T, ISHIGAMI A, et al. Molecular characterization of peptidylarginine deiminase in HL-60 cells induced by retinoic acid and 1α, 25-dihydroxyvitamin D3[J]. J Biol Chem, 1999, 274(39): 27786-27792. DOI:10.1074/jbc.274.39.27786 |
| [49] |
HAGIWARA T, NAKASHIMA K, HIRANO H, et al. Deimination of arginine residues in nucleophosmin/B23 and histones in HL-60 granulocytes[J]. Biochem Biophys Res Commun, 2002, 290(3): 979-983. DOI:10.1006/bbrc.2001.6303 |
| [50] |
WANG Y M, LI M, STADLER S, et al. Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation[J]. J Cell Biol, 2009, 184(2): 205-213. DOI:10.1083/jcb.200806072 |
| [51] |
BURGENER S S, SCHRODER K. Neutrophil extracellular traps in host defense[J]. Cold Spring Harb Perspect Biol, 2020, 12(7): a037028. DOI:10.1101/cshperspect.a037028 |
| [52] |
ROCHAEL N C, GUIMARÃES-COSTA A B, NASCIMENTO M T C, et al. Classical ROS-dependent and early/rapid ROS-independent release of Neutrophil Extracellular Traps triggered by Leishmania parasites[J]. Sci Rep, 2015, 5: 18302. DOI:10.1038/srep18302 |
| [53] |
BIANCHI M, HAKKIM A, BRINKMANN V, et al. Restoration of NET formation by gene therapy in CGD controls aspergillosis[J]. Blood, 2009, 114(13): 2619-2622. DOI:10.1182/blood-2009-05-221606 |
| [54] |
KRAAIJ T, TENGSTRÖM F C, KAMERLING S W A, et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes[J]. Autoimmun Rev, 2016, 15(6): 577-584. DOI:10.1016/j.autrev.2016.02.018 |
| [55] |
LEWIS H D, LIDDLE J, COOTE J E, et al. Inhibition of PAD4 activity is sufficient to disrupt mouse and human NET formation[J]. Nat Chem Biol, 2015, 11(3): 189-191. DOI:10.1038/nchembio.1735 |
| [56] |
MA F, GUO X, FAN H J. Extracellular nucleases of Streptococcus equi subsp. zooepidemicus degrade neutrophil extracellular traps and impair macrophage activity of the host[J]. Appl Environ Microbiol, 2017, 83(2): e02468-16. |
| [57] |
李琦, 牛俊辉, 王晓利, 等. 猪霍乱沙门菌胞外产物的核酸酶活性及其对巨噬细胞胞外诱捕网形成的影响[J]. 畜牧兽医学报, 2021, 52(3): 733-741. LI Q, NIU J H, WANG X L, et al. The nuclease activity of extracellular products from Salmonella choleraesuis and its effect on the formation of macrophages extracellular traps[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(3): 733-741. (in Chinese) |
| [58] |
BHATTACHARYA M, BERENDS E T M, CHAN R, et al. Staphylococcus aureus biofilms release leukocidins to elicit extracellular trap formation and evade neutrophil-mediated killing[J]. Proc Natl Acad Sci U S A, 2018, 115(28): 7416-7421. DOI:10.1073/pnas.1721949115 |
| [59] |
MIRZAEI R, RANJBAR R. Hijacking host components for bacterial biofilm formation: An advanced mechanism[J]. Int Immunopharmacol, 2022, 103: 108471. DOI:10.1016/j.intimp.2021.108471 |
| [60] |
DE BUHR N, BONILLA M C, PFEIFFER J, et al. Degraded neutrophil extracellular traps promote the growth of Actinobacillus pleuropneumoniae[J]. Cell Death Dis, 2019, 10(9): 657. DOI:10.1038/s41419-019-1895-4 |
| [61] |
JOHNSON C J, CABEZAS-OLCOZ J, KERNIEN J F, et al. The extracellular matrix of Candida albicans biofilms impairs formation of neutrophil extracellular traps[J]. PLoS Pathog, 2016, 12(9): e1005884. DOI:10.1371/journal.ppat.1005884 |
| [62] |
JOHNSON C J, KERNIEN J F, HOYER A R, et al. Mechanisms involved in the triggering of neutrophil extracellular traps (NETs) by Candida glabrata during planktonic and biofilm growth[J]. Sci Rep, 2017, 7(1): 13065. DOI:10.1038/s41598-017-13588-6 |
| [63] |
许向华, 夏初, 黄怡. 中性粒细胞胞外诱捕网增加糖尿病小鼠对侵袭性曲霉病的易感性[J]. 临床内科杂志, 2021, 38(6): 407-411. XU X H, XIA C, HUANG Y. Neutrophil extracellular traps increase the susceptibility of diabetic mice to invasive aspergillosis[J]. Journal of Clinical Internal Medicine, 2021, 38(6): 407-411. DOI:10.3969/j.issn.1001-9057.2021.06.014 (in Chinese) |
| [64] |
KARKOWSKA-KULETA J, SMOLARZ M, SEWERYN-OZOG K, et al. Proteinous components of neutrophil extracellular traps are arrested by the cell wall proteins of Candida albicans during fungal infection, and can be used in the host invasion[J]. Cells, 2021, 10(10): 2736. DOI:10.3390/cells10102736 |
| [65] |
GABRIEL C, MCMASTER W R, GIRARD D, et al. Leishmania donovani promastigotes evade the antimicrobial activity of neutrophil extracellular traps[J]. J Immunol, 2010, 185(7): 4319-4327. DOI:10.4049/jimmunol.1000893 |
| [66] |
SERCUNDES M K, ORTOLAN L S, DEBONE D, et al. Targeting neutrophils to prevent malaria-associated acute lung injury/acute respiratory distress syndrome in mice[J]. PLoS Pathog, 2016, 12(12): e1006054. DOI:10.1371/journal.ppat.1006054 |
| [67] |
KNACKSTEDT S L, GEORGIADOU A, APEL F, et al. Neutrophil extracellular traps drive inflammatory pathogenesis in malaria[J]. Sci Immunol, 2019, 4(40): eaaw0336. DOI:10.1126/sciimmunol.aaw0336 |
| [68] |
BARR F D, OCHSENBAUER C, WIRA C R, et al. Neutrophil extracellular traps prevent HIV infection in the female genital tract[J]. Mucosal Immunol, 2018, 11(5): 1420-1428. DOI:10.1038/s41385-018-0045-0 |
| [69] |
AKK A, SPRINGER L E, PHAM C T N. Neutrophil extracellular traps enhance early inflammatory response in sendai virus-induced asthma phenotype[J]. Front Immunol, 2016, 7: 325. |
| [70] |
CORTJENS B, DE BOER O J, DE JONG R, et al. Neutrophil extracellular traps cause airway obstruction during respiratory syncytial virus disease[J]. J Pathol, 2016, 238(3): 401-411. DOI:10.1002/path.4660 |
| [71] |
SOUZA P S S, BARBOSA L V, DINIZ L F A, et al. Neutrophil extracellular traps possess anti-human respiratory syncytial virus activity: Possible interaction with the viral F protein[J]. Virus Res, 2018, 251: 68-77. DOI:10.1016/j.virusres.2018.04.001 |
| [72] |
CORTJENS B, DE JONG R, BONSING J G, et al. Local dornase alfa treatment reduces NETs-induced airway obstruction during severe RSV infection[J]. Thorax, 2018, 73(6): 578-580. DOI:10.1136/thoraxjnl-2017-210289 |
(编辑 范子娟)



