软骨细胞是关节软骨中唯一的细胞,在正常关节中代谢活性较低,软骨细胞在维持关节软骨的正常生理结构和功能中发挥关键作用[1]。兽医临床上,许多动物疾病都与软骨退变有关,包括骨关节炎、骨关节病和骨软骨病等。软骨疾病能够导致关节肿胀、疼痛、活动受限甚至残疾,影响动物生活质量并造成严重的经济损失。临床上常用的非甾体抗炎药能够缓解疼痛等症状,但不能修复软骨和逆转疾病,并且这些药物长期使用的胃肠毒性较大[2]。因此,研发功效显著、副作用小并具有保护软骨作用的药物非常必要[3]。
天然产物因其安全和多样的生物活性而备受关注[4]。银杏叶提取物(Ginkgo biloba L. extract)药理活性广泛,具有改善血流变状态、抗炎和清除自由基等作用[5],而白果内酯是银杏叶提取物中唯一的倍半萜化合物[6]。有报道称,白果内酯通过JNK和NF-κB信号通路下调miRNA-125a从而抑制IL-17诱导的ATDC5细胞炎症损伤[7],推测白果内酯对软骨细胞具有保护作用。此外,白果内酯也通过AMPK/SIRT1/mTOR通路抑制IL-1β诱导的ATDC5软骨细胞和大鼠骨关节炎模型中诱导型一氧化氮合酶(iNOS)和环氧合酶2(COX-2)炎症介质的表达,从而发挥抗炎作用[8]。但白果内酯对IL-1β诱导软骨细胞的自噬、增殖和凋亡作用尚需深入研究。
细胞凋亡是由基因控制的细胞自主有序的死亡,异常细胞凋亡会促进疾病的发生发展,细胞凋亡与骨关节炎组织标本中软骨破坏和基质耗竭的严重程度呈正相关[9]。自噬是一种细胞稳态和生存机制,依赖自噬体和溶酶体去除蛋白质聚集体和功能失调的细胞器[10]。软骨细胞自噬与凋亡有复杂的互作机制,自噬减少通常伴随着细胞凋亡和软骨退化的增加[11]。基于此,本试验以ATDC5软骨细胞自噬和凋亡为切入点,探究白果内酯对ATDC5软骨细胞的保护作用机制,为白果内酯在兽医临床上的应用及相关靶点药物的研究提供理论依据。
1 材料与方法 1.1 试验材料来源ATDC5小鼠成软骨细胞系由东北农业大学兽医外科教研室提供;自噬双标腺病毒(mRFP-GFP-LC3)由东北农业大学兽医病理解剖教研室赠予;白果内酯(纯度≥98%,CAS:33570-04-6)购自成都曼思特生物科技有限公司。
1.2 主要试剂10%胎牛血清(BI,以色列);1%胰岛素-转铁蛋白-亚硒酸钠培养基补充剂(ITS)(Sigma,美国);DMEM/F12培养基(Gibco,美国);胰蛋白酶-EDTA(Thermo Fisher,美国);PBS(索莱宝,中国);细胞凋亡检测鸡尾酒套装(Abbkin,中国);ECL化学发光试剂盒(Vazyme,中国);总RNA提取试剂盒购自天根生化科技有限公司;HiScript III 1 st Strand cDNA Synthesis Kit (+gDNA wiper)试剂盒和AceQ Universal SYBR qPCR Master Mix试剂盒购自南京诺唯赞生物科技股份有限公司;1%青霉素-链霉素、BeyoClickTM EdU-555细胞增殖检测试剂盒、RIPA裂解液、BCA蛋白分析试剂盒、5%牛血清白蛋白(BSA)和SDS-PAGE凝胶超快速配制试剂盒均购自上海碧云天生物技术有限公司;本研究涉及的所有抗体均购自武汉爱博泰克生物科技有限公司(ABclonal,中国)。
1.3 主要仪器荧光显微镜(Leica,德国);流式细胞仪(BD,美国);超高分辨显微镜(GE,美国);电泳仪(百晶生物,中国);自动凝胶图像分析系统(Tannon,中国);恒温培养箱(Thermo,美国);罗氏480定量PCR仪(Roche,美国);微量核酸蛋白浓度测定仪(Thermo,美国)。
1.4 细胞培养及分组将细胞置于37 ℃和5% CO2的培养箱中进行培养,并配制含10%胎牛血清、1%青霉素-链霉素和1% ITS的DMEM/F12培养基。在细胞达到80%融合时,用胰蛋白酶-EDTA消化细胞传代。添加ITS诱导ATDC5细胞分化为软骨细胞,使ATDC5细胞表达成软骨表型标记基因[12],参考前人研究[13],将ATDC5细胞诱导14 d后用于后续的试验研究。试验分为对照组、IL-1β组(10 ng·mL-1)、IL-1β和白果内酯共培养组,其中共培养组又分为白果内酯高、中和低(15、30和60 μmol·L-1)3个不同剂量组,白果内酯剂量的选择参考之前的研究[8]。
1.5 Western blot检测目的蛋白使用含蛋白酶抑制剂的RIPA裂解缓冲液提取各组细胞的总蛋白。用BCA蛋白分析试剂盒测定蛋白浓度。通过SDS-PAGE分离蛋白样品,然后转移到PVDF膜上。用5%牛血清白蛋白(BSA)常温下封闭1 h后,置于4 ℃与一抗孵育过夜,一抗使用稀释比如下:GAPDH(1∶2 000)、LC3(1∶2 000)、Beclin1(1∶2 000)、Bcl2(1∶2 000)、BAX(1∶2 000) 和Cleaved Caspase-3(1∶2 000)。然后,将膜与二抗(1∶3 000)孵育1 h,滴加ECL缓冲液,用自动凝胶图像分析系统显示蛋白条带,Image J软件分析灰度值。
1.6 qRT-PCR检测软骨细胞相关基因表达使用总RNA提取试剂盒提取各组软骨细胞的总RNA,然后利用微量核酸蛋白浓度测定仪测定总RNA浓度。严格按照HiScript III 1 st Strand cDNA Synthesis Kit (+gDNA wiper)试剂盒的说明进行逆转录,AceQ Universal SYBR qPCR Master Mix试剂盒通过罗氏480定量PCR仪进行qRT-PCR反应,采用2-ΔΔCt方法计算基因相对表达量。引物序列见表 1。
|
|
表 1 qRT-PCR检测中使用的引物序列 Table 1 The primer sequences used in qRT-PCR assay |
将自噬双标腺病毒mRFP-GFP-LC3转染ATDC5软骨细胞,自噬溶酶体呈现为红色荧光点,自噬体则呈现为黄色荧光点。通过不同颜色斑点的计数可以检测自噬流的强弱。用腺病毒mRFP-GFP-LC3转染培养ATDC5软骨细胞24~36 h,转染后再用10 ng·mL-1 IL-1β和/或60 μmol·L-1白果内酯培养24 h。用4%多聚甲醛固定细胞20 min后,使用超高分辨显微镜获得细胞图像。
1.8 EdU检测软骨细胞增殖能力严格根据制造商的说明书进行EdU染色。用10 ng·mL-1IL-1β和/或60 μmol·L-1白果内酯共同处理的细胞,并与10 μmol·L-1 EdU工作溶液在37 ℃下孵育2 h。孵育后,将细胞用PBS洗涤2次,并用4%多聚甲醛固定15 min。将细胞用0.5% Triton X-100通透15 min,PBS洗涤2次。将细胞与Hoechst 33342溶液在室温避光孵育10 min后,用荧光显微镜捕获图像。
1.9 Annexin-V/PI方法检测细胞凋亡细胞用10 ng·mL-1 IL-1β和/或60 μmol·L-1白果内酯培养24 h后,消化收集至离心管。4 ℃,300×g离心5 min,预冷PBS洗涤2次。用1×Annexin V Binding Buffer重悬细胞,加入Annexin V-Ab Flour TM 488和PI,轻柔混匀,室温避光孵育15 min。孵育后加入1×Annexin V Binding Buffer,轻柔混匀后置于冰上。通过流式细胞仪上检测细胞凋亡情况,结果用FlowJo软件进行分析。
1.10 统计与分析本试验数据使用SPSS软件(Windows版本19.0,USA)进行分析。试验数据(n≥3)均采用“平均值±标准偏差(SD)”表示。组间采用单因素方差分析(ANOVA),然后进行Turkey检验,P < 0.05认为差异具有统计学意义,柱状图作图软件为GraphPad Prism 8。
2 结果 2.1 白果内酯激活IL-1β诱导的ATDC5软骨细胞自噬Western blot和qRT-PCR方法检测细胞自噬相关蛋白和mRNA的表达(图 1),结果显示,与对照组相比,IL-1β组软骨细胞中LC3-Ⅱ和Beclin1的蛋白显著降低(P<0.05),LC3和Beclin1的mRNA表达显著降低(P<0.01)。与IL-1β组相比,不同浓度白果内酯处理后LC3-Ⅱ和Beclin1的蛋白表达显著增加(P<0.05),LC3和Beclin1的mRNA表达显著增加(P<0.01),并且呈剂量依赖性增加,其中60 μmol·L-1白果内酯处理后软骨细胞中LC3-Ⅱ和Beclin1的蛋白表达量最高。因此使用高剂量60 μmol·L-1白果内酯进行后续研究。
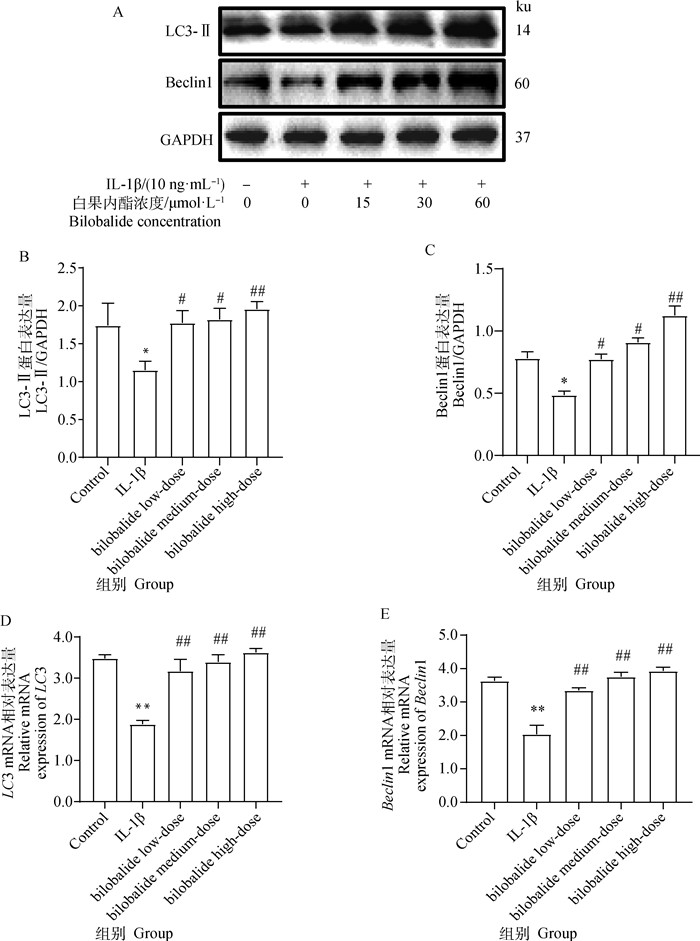
|
A. Western blot检测各蛋白表达水平;B. LC3-Ⅱ蛋白表达分析;C. Beclin1蛋白表达分析;D. LC3 mRNA表达;E. Beclin1 mRNA表达。与对照组相比,*P<0.05,**P<0.01。与IL-1β组相比,#P<0.05,##P<0.01。下同 A. Western blot detects the expression level of each protein; B. LC3-Ⅱ protein expression analysis; C. Beclin1 protein expression analysis; D. LC3 mRNA expression; E. Beclin1 mRNA expression. Compared with the control group, * P < 0.05, ** P < 0.01. Compared with IL-1β group, #P < 0.05, ##P < 0.01. The same as below 图 1 白果内酯激活IL-1β诱导的ATDC5软骨细胞自噬 Fig. 1 Bilobalide activates autophagy of IL-1β-induced ATDC5 chondrocytes |
mRFP-GFP-LC3结果显示(图 2),与对照组相比,IL-1β组图像中黄色荧光显著增多,且黄色荧光多于红色荧光,即自噬小体显著增多,自噬溶酶体较少,表明自噬下游受阻导致自噬减弱。与IL-1β组相比,60 μmol·L-1白果内酯组图像中黄色荧光减少,红色荧光相对增多。

|
图 2 白果内酯对ATDC5软骨细胞自噬流的影响 Fig. 2 The effect of bilobalide on autophagic flux in ATDC5 chondrocytes |
采用EdU染色检测细胞增殖情况(图 3A),对EdU染色阳性细胞数进行统计分析(图 3B)。结果发现,经10 ng·mL-1 IL-1β处理后,EdU阳性细胞总数极显著低于对照组(P<0.01),细胞增殖被抑制。与IL-1β组相比,白果内酯和IL-1β共同处理细胞后,EdU阳性细胞率显著升高(P<0.01),说明白果内酯对ATDC5软骨细胞增殖具有促进作用。

|
A. EdU染色(200×);B. 阳性细胞数 A. EdU staining (200×); B. Count of positive cells 图 3 白果内酯对IL-1β诱导的ATDC5软骨细胞增殖的影响 Fig. 3 Effects of bilobalide on proliferation of IL-1β-induced ATDC5 chondrocytes |
为了进一步明确白果内酯对ATDC5软骨细胞凋亡的影响,本研究采用Annexin V/PI方法检测细胞凋亡情况。如图 4所示,与对照组比较,IL-1β刺激后软骨细胞凋亡率显著增加(P<0.01)。与IL-1β组比较,60 μmol·L-1白果内酯和IL-1β共同处理细胞后凋亡率显著降低(P<0.01)。
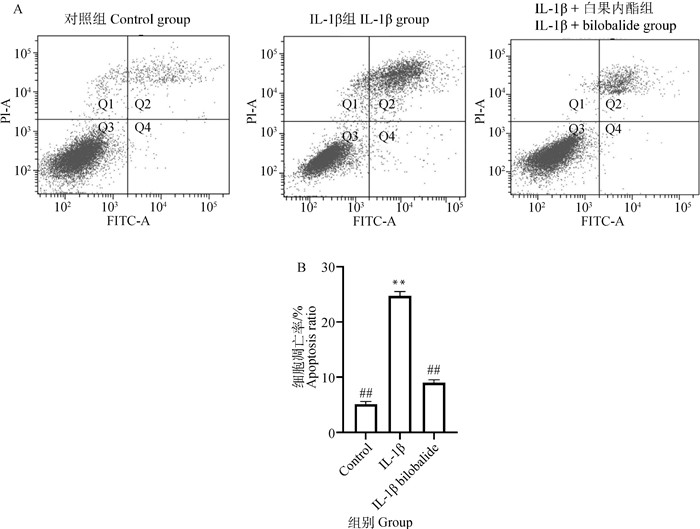
|
A. 流式细胞术检测细胞凋亡图像;B.凋亡率分析 A. Flow cytometry to detect cell apoptosis images; B. Apoptosis rate analysis 图 4 白果内酯对IL-1β诱导的ATDC5软骨细胞凋亡率的影响 Fig. 4 The effect of bilobalide on apoptosis rate of IL-1β-induced ATDC5 chondrocytes |
如图 5所示,Western blot和qRT-PCR方法结果显示,与对照组相比,IL-1β组显著增加BAX和Cleaved Caspase-3蛋白表达(P<0.05),增加BAX和Caspase-3 mRNA表达(P<0.01),而抑制Bcl2 mRNA(P<0.01)和蛋白表达(P<0.05)。细胞经过60 μmol·L-1白果内酯干预后,与IL-1β组相比,显著抑制BAX和Cleaved Caspase-3蛋白表达(P<0.05),抑制BAX和Cleaved Caspase-3 mRNA表达(P<0.01),而增加Bcl2蛋白表达(P<0.05)和Bcl2 mRNA表达(P < 0.01)。综上所述,白果内酯抑制IL-1β诱导的ATDC5软骨细胞凋亡。
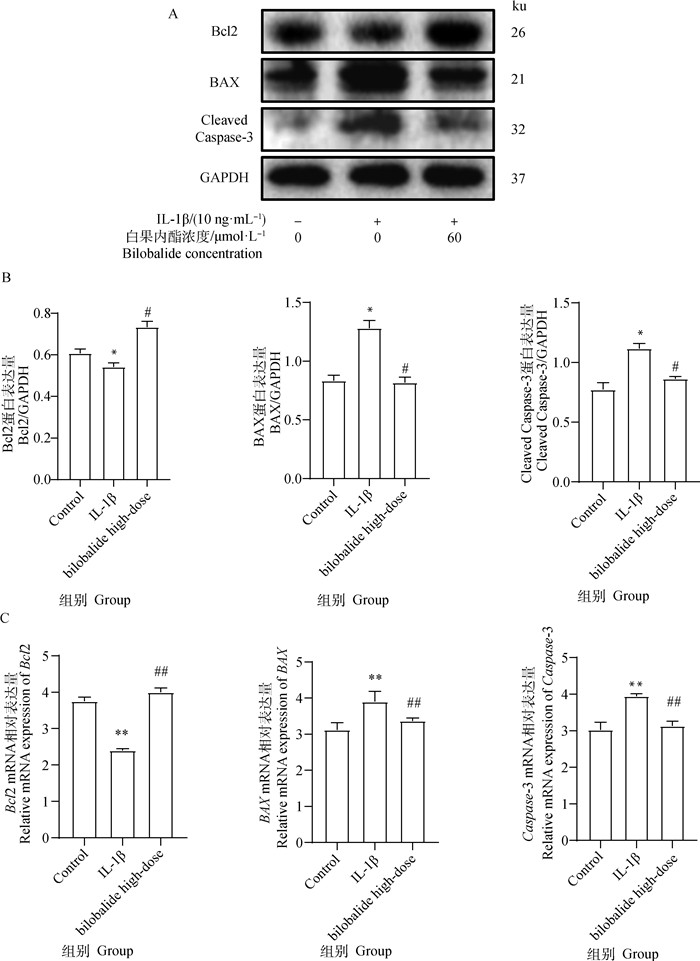
|
A. Western blot检测目的蛋白表达水平;B. Bcl2、BAX和Cleaved Caspase-3蛋白表达灰度分析结果;C. Bcl2、BAX和Caspase-3 mRNA表达 A. Western blot detection of target protein expression level; B. Grayscale analysis of Bcl2, BAX and Cleaved Caspase-3 protein expression; C. Bcl2, BAX and Caspase-3 mRNA expression 图 5 白果内酯对IL-1β诱导的ATDC5软骨细胞凋亡相关蛋白表达的影响 Fig. 5 The effect of bilobalide on the expression of apoptosis-related proteins in ATDC5 chondrocytes induced by IL-1β |
天然产物具有来源自然、双向调节、毒副作用低等优势,越来越多的天然产物被发现具有广泛的抗炎、抗氧化或缓解骨关节炎的活性,已成为保护软骨药物研发的重要方向[14]。齐墩果酸通过调节miR-148-3p/FGF2信号通路,减轻IL-1β诱导的软骨细胞功能障碍[15]。槲皮素可抑制IL-1β诱导细胞凋亡,并通过TSC2-RHEB-mTOR通路调节骨关节炎软骨细胞自噬发挥软骨保护作用[16]。白果内酯对IL-1β诱导的软骨细胞具有保护作用[7],但是其具体机制不明确。另外,炎症细胞因子IL-1β在软骨疾病的病理中发挥关键作用[17],其中10 ng·mL-1 IL-1β被广泛用于体外诱导软骨细胞炎症模型[18]。前期研究发现,15~60 μmol·L-1白果内酯诱导ATDC5软骨细胞24 h无毒性作用,并且60 μmol·L-1白果内酯是抑制IL-1β诱导的ACTD5软骨细胞中iNOS/COX-2/MMP13蛋白表达的最具优势剂量[8],因此,本研究选择15、30和60 μmol·L-1剂量组进行试验,发现10 ng·mL-1 IL-1β诱导的ATDC5软骨细胞与白果内酯共培养后,LC3-Ⅱ和Beclin1的蛋白表达升高,说明自噬被激活,EdU检测细胞新合成的DNA增加,细胞增殖速度加快,而BAX和Caspase-3的表达被抑制,Bcl2蛋白表达增多,软骨细胞凋亡率降低。这些结果表明,白果内酯能够促进自噬,促进ATDC5软骨细胞增殖而抑制凋亡。
以关节软骨退变为特征的骨关节炎的早期阶段,自噬可能作为一种避免细胞死亡的适应性反应被激活,而在骨关节炎晚期,这种作为细胞死亡的替代途径,可能与细胞凋亡一起被激活[19]。细胞将自噬物吞噬到自噬小体,直到最后自噬溶酶体形成并降解自噬物的这个过程被称为自噬流[20]。自噬流是一个动态过程,转染mRFP-GFP-LC3融合蛋白细胞内荧光变化是评价自噬流的良好选择。LC3II的产生是自噬成熟的常见标志,而Beclin1是III类磷脂酰肌醇3-激酶复合物的关键成分,Beclin1能够介导其他自噬蛋白定位于吞噬泡(phagophore),从而调控自噬体的形成与成熟[21]。研究表明,许多天然产物通过靶向调控自噬在维持软骨稳态[22]。本研究中,白果内酯干预IL-1β诱导的软骨细胞后LC3II和Beclin1蛋白和mRNA表达呈剂量依赖性增加。说明白果内酯能够促进IL-1β诱导ATDC5软骨细胞的自噬。此外,软骨细胞转染mRFP-GFP-LC3病毒后,白果内酯与IL-1β共同处理组中黄色荧光减少,红色荧光相对增多,表明自噬小体与溶酶体融合现象增多,形成自噬溶酶体的进程更顺畅,自噬流活化。
软骨细胞过度凋亡是导致关节软骨损伤和退变的重要因素,并伴有炎症因子的溢出,进而加重损伤的严重程度[23]。通过对细胞应激的应答,自噬起到了保护细胞凋亡的作用[24]。Bcl-2和BAX分别是抑制细胞凋亡和促进细胞凋亡基因,并且同属于Bcl-2基因家族。BAX能够与Bcl-2形成多聚体,而调节线粒体膜的通透性,最终调控细胞凋亡或存活[25]。Caspase-3正常以酶原的形式存在于胞浆中,但在凋亡的早期阶段Caspase-3能够被激活,进而裂解相应的胞浆胞核底物,最终诱导细胞凋亡[26]。研究表明,当归多糖能够促进软骨细胞增殖,并通过ERK1/2通路诱导自噬减弱硝普钠诱导的软骨细胞凋亡[27]。CDDO-Im通过Nrf2通路增强TNF-α诱导的软骨细胞中的细胞自噬而改善小鼠骨关节炎并抑制软骨细胞凋亡[28]。本研究显示,IL-1β组细胞凋亡率和BAX和Caspase-3表达增加,Bcl2水平显著降低,说明IL-1β能够促进ATDC5软骨细胞凋亡。白果内酯干预后,BAX和Caspase-3水平被抑制,Bcl2蛋白表达显著增加,软骨细胞凋亡率显著降低。综上,白果内酯能够增强自噬,活化自噬流以调节软骨内平衡,抑制软骨细胞凋亡从而保护软骨。
本研究发现,白果内酯对IL-1β诱导的ATDC5软骨细胞具有明显的保护作用,通过促进软骨细胞自噬通量,细胞增殖增加而显著抑制软骨细胞凋亡。但也有报道称,食用过量的银杏叶提取物偶尔会引起机体不良反应,包括头晕、皮肤过敏[29]。因此,在研究其临床应用的可能性前,需要对白果内酯对软骨保护作用进行广泛的分子机制、药理学和毒理学研究。尽管如此,本研究可以为白果内酯对关节软骨的保护机制提供新的见解。
4 结论综上所述,白果内酯能够促进IL-1β诱导ATDC5软骨细胞的自噬并且抑制细胞凋亡,进而抑制IL-1β诱导的炎症反应并促进ATDC5软骨细胞的增殖。
| [1] |
HU X S, ZHANG W Y, LI X, et al. Strategies to modulate the redifferentiation of chondrocytes[J]. Front Bioeng Biotechnol, 2021, 9: 764193. DOI:10.3389/fbioe.2021.764193 |
| [2] |
HUNTER D J, BIERMA-ZEINSTRA S. Osteoarthritis[J]. Lancet, 2019, 393(10182): 1745-1759. DOI:10.1016/S0140-6736(19)30417-9 |
| [3] |
PÉREZ-LOZANO M L, CESARO A, MAZOR M, et al. Emerging natural-product-based treatments for the management of osteoarthritis[J]. Antioxidants (Basel), 2021, 10(2): 265. DOI:10.3390/antiox10020265 |
| [4] |
SUKHIKH S, NOSKOVA S, IVANOVA S, et al. Chondroprotection and molecular mechanism of action of phytonutraceuticals on osteoarthritis[J]. Molecules, 2021, 26(8): 2391. DOI:10.3390/molecules26082391 |
| [5] |
SIERPINA V S, WOLLSCHLAEGER B, BLUMENTHAL M. Ginkgo biloba[J]. Am Fam Physician, 2003, 68(5): 923-926. |
| [6] |
LU J, XIE L, LIU K, et al. Bilobalide: A review of its pharmacology, pharmacokinetics, toxicity, and safety[J]. Phytother Res, 2021, 35(11): 6114-6130. DOI:10.1002/ptr.7220 |
| [7] |
MAO D M, LI H, ZHANG L, et al. Bilobalide alleviates IL-17-induced inflammatory injury in ATDC5 cells by downregulation of microRNA-125a[J]. J Biochem Mol Toxicol, 2019, 33(12): e22405. |
| [8] |
MA T W, LV L Y, YU Y, et al. Bilobalide exerts anti-inflammatory effects on chondrocytes through the AMPK/SIRT1/mTOR pathway to attenuate ACLT-induced post-traumatic osteoarthritis in rats[J]. Front Pharmacol, 2022, 13: 783506. DOI:10.3389/fphar.2022.783506 |
| [9] |
ELMORE S. Apoptosis: A review of programmed cell death[J]. Toxicol Pathol, 2007, 35(4): 495-516. DOI:10.1080/01926230701320337 |
| [10] |
DUAN R, XIE H, LIU Z Z. The role of autophagy in osteoarthritis[J]. Front Cell Dev Biol, 2020, 8: 608388. DOI:10.3389/fcell.2020.608388 |
| [11] |
CARAMÉS B, OLMER M, KIOSSES W B, et al. The relationship of autophagy defects to cartilage damage during joint aging in a mouse model[J]. Arthritis Rheumatol, 2015, 67(6): 1568-1576. DOI:10.1002/art.39073 |
| [12] |
SHUKUNAMI C, SHIGENO C, ATSUMI T, et al. Chondrogenic differentiation of clonal mouse embryonic cell line ATDC5 in vitro: Differentiation-dependent gene expression of parathyroid hormone (PTH)/PTH-related peptide receptor[J]. J Cell Biol, 1996, 133(2): 457-468. DOI:10.1083/jcb.133.2.457 |
| [13] |
HUITEMA L F A, VAN WEEREN P R, BARNEVELD A, et al. Iron ions derived from the nitric oxide donor sodium nitroprusside inhibit mineralization[J]. Eur J Pharmacol, 2006, 542(1-3): 48-53. DOI:10.1016/j.ejphar.2006.06.006 |
| [14] |
TIAN Z, ZHANG X N, SUN M L. Phytochemicals mediate autophagy against osteoarthritis by maintaining cartilage homeostasis[J]. Front Pharmacol, 2021, 12: 795058. DOI:10.3389/fphar.2021.795058 |
| [15] |
LI Y L, NIE J L, JIANG P. Oleanolic acid mitigates interleukin-1β-induced chondrocyte dysfunction by regulating miR-148-3p-modulated FGF2 expression[J]. J Gene Med, 2020, 22(5): e3169. |
| [16] |
LV S J, WANG X J, JIN S J, et al. Quercetin mediates TSC2-RHEB-mTOR pathway to regulate chondrocytes autophagy in knee osteoarthritis[J]. Gene, 2022, 820: 146209. DOI:10.1016/j.gene.2022.146209 |
| [17] |
HU Z C, GONG L F, LI X B, et al. Inhibition of PI3K/Akt/NF-κB signaling with leonurine for ameliorating the progression of osteoarthritis: in vitro and in vivo studies[J]. J Cell Physiol, 2019, 234(5): 6940-6950. DOI:10.1002/jcp.27437 |
| [18] |
JENEI-LANZL Z, MEURER A, ZAUCKE F. Interleukin-1β signaling in osteoarthritis - chondrocytes in focus[J]. Cell Signal, 2019, 53: 212-223. DOI:10.1016/j.cellsig.2018.10.005 |
| [19] |
ALMONTE-BECERRIL M, NAVARRO-GARCIA F, GONZALEZ-ROBLES A, et al. Cell death of chondrocytes is a combination between apoptosis and autophagy during the pathogenesis of Osteoarthritis within an experimental model[J]. Apoptosis, 2010, 15(5): 631-638. DOI:10.1007/s10495-010-0458-z |
| [20] |
LIAO M F, LU K T, HSU J L, et al. The role of autophagy and apoptosis in neuropathic pain formation[J]. Int J Mol Sci, 2022, 23(5): 2685. DOI:10.3390/ijms23052685 |
| [21] |
KANG R, ZEH H J, LOTZE M T, et al. The Beclin 1 network regulates autophagy and apoptosis[J]. Cell Death Differ, 2011, 18(4): 571-580. DOI:10.1038/cdd.2010.191 |
| [22] |
KAO WC, CHEN JC, LIU PC, et al. The Role of Autophagy in Osteoarthritic Cartilage[J]. Biomolecules, 2022, 12(10): 1357. DOI:10.3390/biom12101357 |
| [23] |
HWANG H S, KIM H A. Chondrocyte apoptosis in the pathogenesis of osteoarthritis[J]. Int J Mol Sci, 2015, 16(11): 26035-26054. DOI:10.3390/ijms161125943 |
| [24] |
王金明, 高宇凤, 成小芳, 等. GSTO1基因沉默对氟致成骨细胞自噬与凋亡的影响[J]. 畜牧兽医学报, 2019, 50(1): 183-192. WANG J M, GAO Y F, CHENG X F, et al. Effects of GSTO1 gene silencing on autophagy and apoptosis of fluoride-induced osteoblasts[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(1): 183-192. (in Chinese) |
| [25] |
EDLICH F. BCL-2 proteins and apoptosis: Recent insights and unknowns[J]. Biochem Biophys Res Commun, 2018 27;500(1): 26-34.
|
| [26] |
ASADI M, TAGHIZADEH S, KAVIANI E, et al. Caspase-3: Structure, function, and biotechnological aspects[J]. Biotechnol Appl Biochem, 2022, 69(4). |
| [27] |
XU C, NI S, ZHUANG C, et al. Polysaccharide from Angelica sinensis attenuates SNP-induced apoptosis in osteoarthritis chondrocytes by inducing autophagy via the ERK1/2 pathway[J]. Arthritis Res Ther, 2021, 23(1): 47. DOI:10.1186/s13075-020-02409-3 |
| [28] |
DONG J, ZHANG K J, LI G C, et al. CDDO-Im ameliorates osteoarthritis and inhibits chondrocyte apoptosis in mice via enhancing Nrf2-dependent autophagy[J]. Acta Pharmacol Sin, 2022, 43(7): 1793-1802. DOI:10.1038/s41401-021-00782-6 |
| [29] |
MAHADEVAN S, PARK Y. Multifaceted therapeutic benefits of Ginkgo biloba L.: chemistry, efficacy, safety, and uses[J]. J Food Sci, 2008, 73(1): R14-R19. |
(编辑 范子娟)



