2. 山东莒县畜牧兽医管理服务中心, 莒县 276500
2. Shandong Juxian Animal Husbandry and Veterinary Management Service Center, Juxian 276500, China
生命早期,肠道菌群的建立是一个循序渐进的过程,而母体的营养健康状况、分娩方式和饮食的变化等[1-3]能显著影响其仔代肠道菌群的发育及成熟。此外,从母乳转换到固体食物(或实施断奶)[4]及抗生素的使用[5-7],能导致肠道微生物的组成发生显著变化,特别是在畜牧养殖行业中,仔猪、犊牛、羔羊等在早期断奶时容易出现腹泻、免疫力下降、摄食减少、生长缓慢等一系列应激反应,严重影响养殖业的经济效益[8-9];研究表明,仔畜断奶应激导致的腹泻与肠道屏障结构破坏及功能受损有关[9]。胃肠道作为体内最大的免疫器官,其屏障功能的正常运行在维持机体免疫平衡中发挥重要作用。其中,肠上皮细胞中的紧密连接蛋白是构成肠道物理屏障的主要成分,包括紧密连接蛋白Claudin、Occludin、ZO-1(Zonula occludens 1)等[10]。已有研究表明,肠道微生物可以影响肠道屏障功能[11],如乳酸杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)以及Bacteroides thetaiotaomicron、Akkermansia muciniphila等新一代益生菌,这些菌属可以通过分泌细胞外蛋白有效减弱病原体的黏附,或增加JAM-1(Junctional adhesion molecule 1)、Occludin、Claudin-1和ZO-1在内的紧密连接蛋白的表达来保护肠道屏障,维持肠上皮稳态,促进肠道健康[12-14]。
参苓白术散出自宋代《太平惠民和剂局方》,具有健脾益气、渗湿止泻之功。临床上,参苓白术散既可以单独使用以治疗溃疡性结肠炎,又可以与中药复方如附子理中丸[15]、桃花汤[16]、理中汤[17]等联合使用治疗克罗恩病等肠道疾病。本研究主要目的是探讨哺乳期母鼠使用抗生素对仔代肠道菌群、断奶应激的影响,同时观察应用参苓白术散能否通过改善仔鼠肠道健康而减轻早期断奶应激,以期为畜牧养殖业中调节母畜肠道稳态,提高仔畜肠道健康提供理论依据。
1 材料与方法 1.1 材料1.1.1 试验材料与试剂 参苓白术散中药饮片购自北京同仁堂有限公司;盐酸万古霉素、氨苄青霉素、硫酸卡那霉素、甲硝唑、硫酸新霉素购自北京索莱宝科技有限公司;ZO-1、Occludin抗体购自赛默飞世尔科技有限公司。
1.1.2 试验动物 妊娠SD大鼠,SPF级,购自南方医科大学试验动物中心。
1.1.3 仪器设备 MK3型酶标仪,赛默飞(上海)仪器有限公司;EPS600电泳仪,上海天能科技有限公司。
1.2 试验方法1.2.1 分组 9只妊娠17~18 d雌性SD大鼠,随机均分成3组,分组及处理见图 1,抗生素的使用剂量参考文献[18]方法。

|
图 1 试验过程流程图 Fig. 1 Flow diagram of the experimental procedure |
1.2.2 样品采集 分娩后第7、14和21天记录每组仔鼠体重,第14和21天采集粪便于-80 ℃保存;仔鼠安乐死后记录心、肝、脾、肺、肾重量;分离结肠于-80 ℃保存,同时另取0.5 cm近盲肠端结肠固定于4%甲醛溶液中,用于HE染色。
1.2.3 微生物群落多样性组成谱研究 采用DNeasy PowerSoilKit对仔鼠粪便样本进行DNA抽提,并通过1.2%的琼脂糖凝胶电泳检测DNA的质量;采用F: ACTCCTACGGGAGGCAGCA、R: CGGACTACHVGGGTWTCTAAT序列对16S rRNA V3-V4区域进行扩增,并通过Illumina测序平台对群落微生物DNA片段进行双端测序,使用DADA2插件对扩增序列进行去引物、质量过滤、去噪、拼接和去嵌合体等优化,经DADA2方法处理后的序列称为ASVs(amplicon sequence variants);基于细菌16S rRNA Greengenes数据库(gg_13)进行物种注释,基于默认参数使用QIIME2中的Naive bayes分类器对ASVs进行物种分类学分析。
1.2.4 蛋白免疫印迹检测结肠组织中ZO-1和Occludin的表达量 将结肠组织加入适量裂解液低温匀浆后,12 000×g离心5 min,取上清;BCA法测定蛋白浓度,按蛋白总量10 μg每孔等体积上样;电泳时间为70 v,30 min;100 v,2 h;转膜:150 mA,90 min;TBST清洗PVDF膜3次,每次5 min,用5%牛血清蛋白于摇床上室温封闭1.5 h;封闭结束后TBST洗涤3次,每次5 min;4 ℃过夜孵育一抗ZO-1(1∶1 000)、Occludin(1∶1 000);TBST清洗3次,每次5 min,室温孵育二抗(1∶10 000)1 h;TBST清洗3次,每次5 min,加入发光液显影,扫描拍照。
1.2.5 数据分析 试验数据采用SPSS 22.0软件统计分析,结果以“平均数±标准差(X±SD)”表示,仅有两组数据比较时通过独立样本T检验进行分析,有多组数据比较时采用单因素ANOVA分析各组间差异性,通过最小显著差数法(LSD)进行各组间的多重比较,以P < 0.05作为显著性判断的标准。并使用Graphpad Prism 5软件作图。
2 结果 2.1 参苓白术散对仔鼠体重的影响对不同天数不同组别的仔鼠进行称重,结果如表 2所示,在第7、14和21天,与CON组相比,ABX组的仔鼠体重显著降低(P < 0.05)。第21天时,与ABX组相比,SLBZS组仔鼠的体重显著增加(P < 0.05)。
|
|
表 2 各组仔鼠的体重情况(X±SD, n=6) Table 2 Weight of offspring rats in different groups (X±SD, n=6) |
如表 3所示,在第21天时,与CON组仔鼠比,ABX组及SLBZS组仔鼠的肝脏指数显著降低(P < 0.05),ABX组仔鼠的脾脏指数显著降低(P < 0.05);与ABX组仔鼠比,SLBZS组仔鼠的脾脏指数显著升高(P < 0.05)。
|
|
表 3 第21天各组仔鼠的脏器指数(X±SD,n=6) Table 3 The organ index of offspring in day 21(X±SD, n=6) |
根据16S rRNA基因测序结果分析,使用韦恩图展示各组ASVs数目,在第14天时,CON组和ABX组之间共有的ASVs数目为143个,而CON组中独有的ASVs数目为3 921个,ABX组中独有的ASVs数目为656个(图 2a);在第21天时,三组共有的ASVs数目为84个,CON组与ABX组之间共有的ASVs数目为38个,CON组与SLBZS组之间共有的ASVs数目为122个,ABX组与SLBZS组之间共有的ASVs数目为1 004个(图 2b)。样品的稀疏曲线(Rarefaction Curve)趋于平缓(图 2c),说明测序数据量渐进合理,满足测序要求,物种的丰富度较高,物种分布均匀。在第14天时,与CON组相比,ABX组的微生物群落在纲、目、科、属、种五种分类水平上的单元数均显著降低(P < 0.05,表 4)。在第21天时,与CON组相比,ABX组与SLBZS组的微生物群落在门、纲、目、科、属五种分类水平中的单元数均显著降低(P < 0.05),而SLBZS组的微生物群落在种分类水平中的单元数有所增加(表 5)。
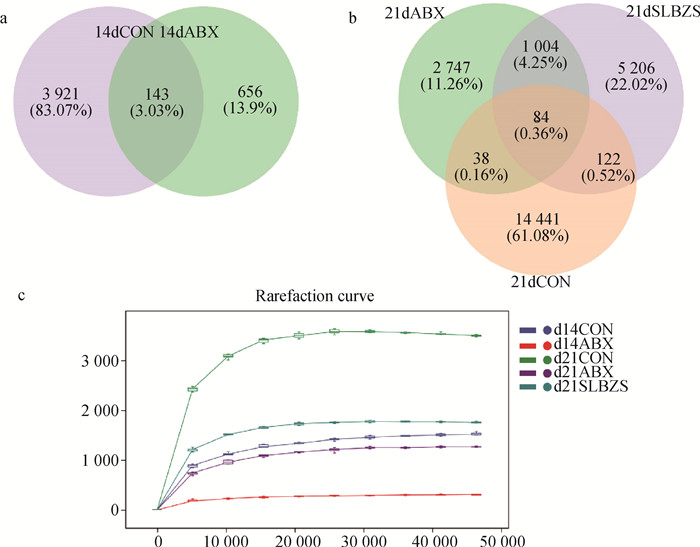
|
a、b. 第14和第21天ASVs韦恩图;c. 第14和第21天稀疏曲线 a, b. ASVs Venn diagram on day 14 and day 21; c. Rarefaction curve on day 14 and day 21 图 2 第14和第21天各组物种组成ASVs韦恩图和稀疏曲线 Fig. 2 ASVs Venn diagram and rarefaction curve of each group on day 14 and day 21 |
|
|
表 4 第14天各水平微生物分类单元数统计表(X±SD,n=6) Table 4 Microbial taxon number counts on the 14th day(X±SD, n=6) |
|
|
表 5 第21天各水平微生物分类单元数统计表(X±SD,n=6) Table 5 Microbial taxon number counts on the 21th day(X±SD, n=6) |
选取Chao1、Observed species、Shannon、Simpson等指数评估微生物群落的α多样性。结果显示,在第14天时,ABX组微生物群落的Chao1、Observed species、Shannon、Simpson指数显著低于CON组(P < 0.05,图 3a)。第21天时,ABX组微生物群落的Chao1、Observed species指数显著低于CON组(P < 0.05),Shannon、Simpson指数差异不显著(图 3b)。此外,与ABX组比,SLBZS组Chao1、Observed species指数显著升高(P < 0.05),Shannon、Simpson指数差异不显著(图 3c)。通过主坐标分析(Principal coordinate analysis,PCoA)对多维的微生物数据进行β多样性分析,结果显示,在第14天时,距离矩阵的比例为51.2%时能将CON组与ABX组样本分开(图 3d);在第21天时,距离矩阵的比例为30.5%时能将CON组与其余两组分开,距离矩阵的比例为16.5%时能将ABX组和SLBZS组分开。以上结果说明CON组、ABX组与SLBZS组样品中的微生物的多样性存在差异(图 3e)。
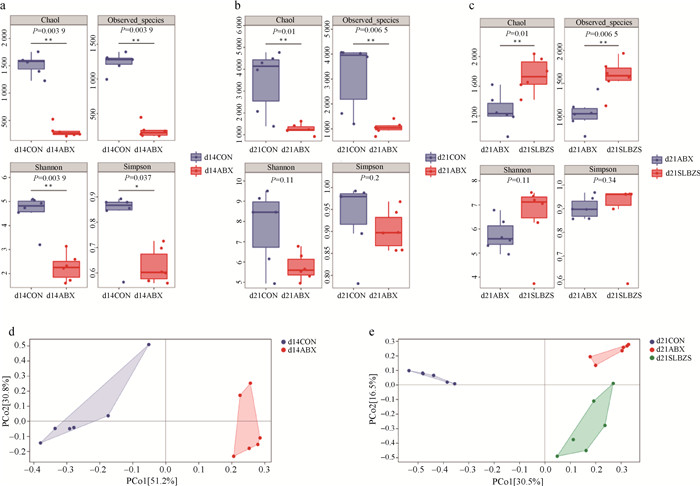
|
a、b、c: 第14和21天Alpha多样性指数的分组箱线图;d、e: 第14和21天PCoA分析二维排序图;* 表示P < 0.05,** 表示P < 0.01 a, b, c. Grouped boxplots of Alpha diversity index on days 14 and 21. d, e. Two dimensional ranking diagram of PCoA analysis on days 14 and 21;* means P < 0.05, ** means P < 0.01 图 3 第14和第21天各组仔鼠肠道微生物的Alpha多样性和Beta多样性分析 Fig. 3 Alpha diversity and Beta diversity analysis of intestinal microbiota in each group of offsprings on days 14 and 21 |
第14天时,在门水平上,ABX组仔鼠粪便样本中Firmicutes和Bacteroidetes的相对丰度低于CON组,而Proteobacteria的相对丰度高于CON组(图 4a);在属水平上,ABX组中Lactobacillus、Shigella的相对丰度高于CON组,而Bacteroides、Blautia等菌属的相对丰度低于CON组(图 4b)。第21天时,在门水平上,ABX组仔鼠粪便样本中Firmicutes和Bacteroidetes的相对丰度低于CON组,而Proteobacteria的相对丰度高于CON组(图 4c);与ABX组仔鼠比,SLBZS组仔鼠粪便样本中Firmicutes的相对丰度明显升高,Proteobacteria的相对丰度明显降低(图 4c);此外,在SLBZS组仔鼠粪便样本中Verrucomicrobia的相对丰度明显高于CON组与ABX组(图 4c)。在属水平上,ABX组仔鼠粪便样本中Shigella、 Sutterella、Enterococcus等菌属的相对丰度高于CON组,而Lactobacillus、Prevotella、Blautia等菌属的相对丰度低于CON组(图 4d );与ABX组仔鼠比,SLBZS组仔鼠粪便样本中Shigella、Sutterella、 Enterococcus等菌属的相对丰度降低,Lactobacillus、Clostridiaceae_Clostridium、Blautia等菌属的相对丰度升高,且在SLBZS组中观察到Akkermansia的相对丰度明显升高(图 4d )。
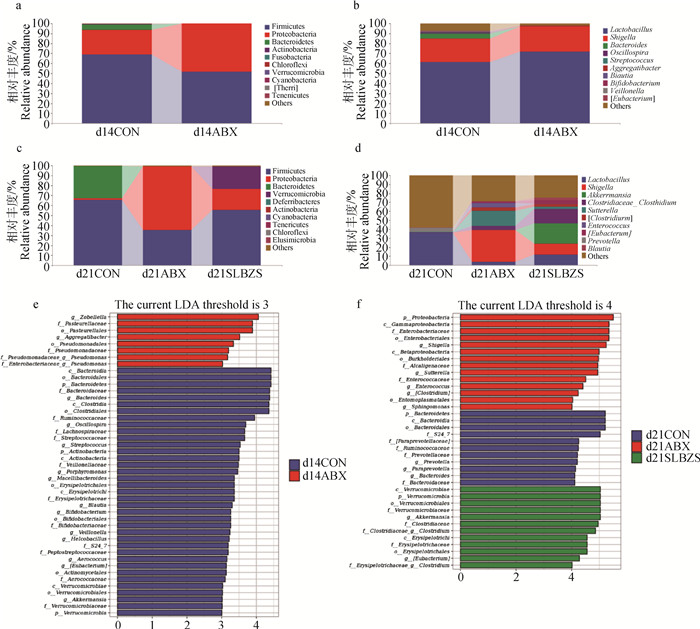
|
a.第14天各组门水平相对丰度柱状图;b. 第14天各组属水平相对丰度柱状图;c. 第21天各组门水平相对丰度柱状图;d. 第21天各组属水平相对丰度柱状图;e. 第14天LDA score柱状图;f. 第21天LDA score柱状图 a. Histogram of relative abundance at phylum level in each group on day 14; b. Histogram of relative abundance at genus level in each group on day 14; c. Histogram of relative abundance at phylum level in each group on day 21; d. Histogram of relative abundance at genus level in each group on day 21; e. Histogram of LDA score in each group on day 14; f. Histogram of LDA score in each group on day 21 图 4 第14和第21天不同组间物种在门、属水平上相对丰度柱状图和LEfSe值柱状图 Fig. 4 Histogram of relative abundance and LEfSe score of species at different levels in different groups on day 14 and day 21 |
采用LEfSe(LDA Effect Size)分析方法对不同组样本间在所有分类水平上进行差异性比较分析,并以LDA score柱状图展示每个组内显著富集的物种。结果显示,第14天时,在CON组与ABX组间(LDA阈值为3时)共有45个差异项,其中在ABX组中富集的有g_Aggregatibacter、f_Enterobacteriaceae_g_Pseudomonas等8个;在CON组中富集的有p_Bacteroidetes、g_Bacteroides、g_Blautia, g_Bifdobacterium、g_Akkermansia等37个(图 4e)。第21天时,在CON组、ABX组及SLBZS组中(LDA阈值为4时)共有37个差异项,其中在ABX组中富集的有p_Proteobacteria、c_Gammaproteobacteria、c_Betaproteobacteria、g_Enterococcus、g_Shigella、g_Sutterella等14个;在CON组中富集的有p_Bacteroidetes、g_Prevotella、g_Paraprevotella、g_Bacteroides等11个;在SLBZS组中富集的有p_Verrucomicrobia、g_Eubacterium、 g_Akkermansia、g_Clostridium等14个(图 4f)。
2.6 参苓白术散对仔鼠结肠中Occludin和ZO-1蛋白表达的影响第14天ABX组仔鼠结肠中Occludin蛋白表达量显著低于CON组(P < 0.05,图 5a),ZO-1蛋白表达情况无显著差异(P>0.05,图 5c)。第21天ABX组中的仔鼠结肠中ZO-1、Occludin的表达量显著低于CON组(P < 0.05),SLBZS组中的仔鼠结肠中ZO-1、Occludin的表达量显著高于ABX组(P < 0.05,图 5b、5d)。

|
a.第14天仔鼠结肠紧密连接蛋白Occludin表达量;b.第21天Occludin蛋白表达量;c.第14天ZO-1蛋白表达量;d.第21天ZO-1蛋白表达量。左边为蛋白表达灰度图,右边为灰度分析柱状图。柱上不同字母表示差异显著(P < 0.05),相同字母表示差异不显著(P>0.05) a. Tight junction proteins Occludin expression level in colon of offspring rats on day 14. b. Occludin protein expression level on day 21. c. ZO-1 protein expression level on day 14. d.ZO-1 protein expression level on day 21.On the left is the protein expression gray map, and on the right is the gray analysis histogram. Bars labelled with different letters are significantly different among groups(P < 0.05), while the same letter means no significant difference(P>0.05) 图 5 第14和第21天仔鼠结肠Occludin和ZO-1蛋白免疫印迹结果 Fig. 5 Western blot results of ZO-1 and Occludin in colon of offspring rats on day 14and day 21 |
结肠组织切片结果显示,CON组仔鼠结肠组织结构完整、清晰,且排列整齐、连续性好,无炎性细胞浸润;ABX组仔鼠结肠组织有明显的炎性细胞增生浸润(图中红色圈所指);给仔鼠灌胃参苓白术散后炎性细胞浸润程度减轻(图 6)。
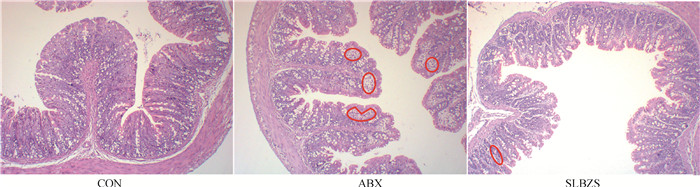
|
图中红色圈中提示出现炎性细胞浸润 The red circles in these figures indicate inflammatory cell infiltration 图 6 第21天仔鼠结肠病理切片(100×) Fig. 6 Colon histologic section of offspring rats on day 21(100×) |
在生命早期,幼崽出现肠道感染的几率较高,而其中一个重要的原因是幼崽肠道菌群发育的不成熟,不能有效地防止病原体在肠道中的定植。此外,仔代肠道菌群的早期建立在很大程度上受到母体菌群的影响,研究发现,哺乳期给母鼠连续使用万古霉素能显著降低母乳菌群的α多样性,同时其后代仔鼠肠道菌群的α多样性也显著下降,并伴随着脾中B细胞数量显著下降[19],这可能降低新生仔鼠对病毒的抵抗力[20]。与此相似,在本试验结果中,对哺乳期的母鼠使用抗生素,显著降低其仔代肠道微生物的α多样性及各分类水平上的物种单元数,增加Shigella、Sutterella、Enterococcus等有害菌属的相对丰度,并下调仔鼠结肠紧密连接蛋白的表达,这可能导致结肠上皮中有害菌的易位从而增加其仔代患肠道炎症的风险。有研究表明,参苓白术散可以恢复脾虚模型小鼠的黏膜层厚度及增加肠腺数目[21],上调CD(Crohn’s disease)模型大鼠结肠紧密连接蛋白中Claudin-1蛋白的表达[22],还可以调节肠道菌群,增加有益菌如双歧杆菌的丰度并降低病原菌如肠球菌的丰度,提高宿主肠道黏膜对致病菌定植的抵抗能力[23]。与他人研究结果相似,本研究也发现给仔鼠灌胃参苓白术散水煎液后,仔鼠肠道微生物中乳杆菌属(Lactobacillus)和嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)等有益菌属的相对丰度升高,肠道屏障功能得到改善。
3.1 参苓白术散对仔鼠体重及脏器指数的影响在肠道菌群正常的发育过程中,厚壁菌门和拟杆菌门始终作为优势菌群,厚壁菌门与拟杆菌门的比例失衡能引起仔鼠糖代谢与脂代谢的失调,从而影响仔鼠的正常发育与体重的变化[24-26],本研究中,ABX组仔鼠体重的显著降低可能与其厚壁菌门和拟杆菌门的相对丰度显著降低有关,而对仔鼠灌胃参苓白术散后其体重得以恢复则可能与其厚壁菌门的相对丰度升高有关。有报道发现,营养不良儿童肠道微生物中变形菌门显著富集,而拟杆菌门相对丰度则显著降低[27],本试验中,仔鼠在接受参苓白术散治疗后厚壁菌门的相对丰度升高,与此相对应,SLBZS组仔鼠的体重恢复至正常水平,此外,参苓白术散灌胃后还降低了变形菌门的的相对丰度,但没有恢复拟杆菌门的相对丰度,分析原因可能是在断奶前后,由于变形菌门丰度的增多改变了仔鼠的肠道环境,如pH和氧气浓度等,而肠道免疫系统尚未完善,无法调节肠道的稳态,导致拟杆菌门中的微生物无法在肠道定植[28]。脾是一个由结缔组织和淋巴组织组成的复杂的外周淋巴器官,是多种免疫细胞产生、定殖和产生免疫应答的场所[29]。作为动物体内重要的免疫器官,脾脏指数的高低可以衡量动物机体免疫能力的强弱[30]。本研究中,ABX组仔鼠脾脏指数显著低于CON组仔鼠,说明母鼠使用抗生素可能会降低其仔代的免疫力,而使用参苓白术散治疗后,脾脏指数恢复至CON组水平,说明参苓白术散有助于促进脾的发育并可能提高仔鼠机体的免疫力。
3.2 参苓白术散对仔鼠肠道微生物物种组成差异的影响抗生素的使用能够破坏肠道微生物群的正常定植,改变宿主肠道菌群的结构组成及生物多样性,甚至可以在出生前损害仔代的肠道微生物群[31-32];而本课题组前期研究发现,参苓白术散可治疗抗生素相关性腹泻,并对抗生素诱导的肠道微生物结构变化有一定的恢复作用[33]。在本研究LEfSe分析结果中,可观察到ABX组仔鼠粪便中出现有害菌属明显富集,如巴斯德氏菌科(f_Pasteurellaceae)、假单胞菌属(g_Pseudomonas)、放线杆菌属(g_Aggregatibacter)、γ变形菌纲(c_Gammaproteobacteria)、志贺氏菌属(g_Shigella)、萨特氏菌属(g_Sutterella)和肠球菌属(g_Enterococcus)等,其中志贺氏菌属、萨特氏菌属、肠球菌属等为已知的有害菌属,均可引起肠道炎[34],甚至可以破坏结肠上皮细胞之间的紧密连接进而导致肠上皮完整性的缺失,加重炎症感染程度[35-36];Pasteurellaceae和Gammaproteobacteria则与细菌耐药性升高相关,且Gammaproteobacteria相对丰度的升高还被认为是肠道菌群结构被破坏的表现[37-38],这表明母鼠在哺乳期使用抗生素,会导致其仔鼠肠道菌群结构被破坏,增加有害菌属的定植,并可能破坏结肠上皮的完整性,从而诱发肠道炎症。但在接受参苓白术散灌胃后,仔鼠粪便中Shigella、Sutterella、Enterococcus等肠道致病菌的相对丰度明显降低,而乳杆菌属(Lactobacillus)、布劳特氏菌属(Blautia)、阿克曼氏菌属(Akkermansia)、真杆菌属(Eubacterium)等有益菌属的相对丰度升高,有研究表明,嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)不仅可以通过调节肠道内黏液厚度和维持肠道屏障的完整性发挥益生作用[39],其还可通过调节结肠炎小鼠肠道中的免疫细胞及免疫因子发挥抗炎功能[40];Lactobacillus和Blautia则有助于增加粪便中丁酸的浓度,而丁酸盐能修复高脂饮食导致的肠黏膜损伤,并增加肠组织中ZO-1的表达,改善肠道健康[41];而Eubacterium则被证明参与肠道中多种重要物质的代谢和转化,如短链脂肪酸、胆固醇和胆汁酸等[42]。所以参苓白术散可能通过抑制有害菌属的增殖,并通过增加产短链脂肪酸菌属的数量,进而调节肠道紧密连接蛋白的表达,降低仔鼠患炎症肠病的风险,达到改善仔鼠肠道健康的效果。
3.3 参苓白术散对仔鼠结肠紧密连接蛋白Occludin和ZO-1的影响在健康动物肠腔表面,肠道共生菌与肠上皮细胞分泌物(如紧密连接蛋白,黏蛋白等)互作,形成一层生物保护屏障,有助于维持宿主肠道健康。然而,肠上皮紧密连接功能的破坏,可增加肠道的通透性并促进肠道菌群易位,从而引起肠道炎症如IBD等[43],而肠道菌群也能影响结肠屏障的结构和功能,如Akkermansia muciniphila、Lactobacillus、Blautia、Bifidobacterium和Bacteroides等可以增加肠道中紧密连接蛋白的表达[44-46]。此外,Lactobacillus和Blautia在肠道中还可以通过发酵膳食纤维产生大量的短链脂肪酸,目前短链脂肪酸已被证明可以通过激活G蛋白偶联受体,抑制组蛋白去乙酰化酶活性,并下调促炎因子基因的表达,其中丁酸盐还可以通过改变肠道中Claudin-2的水平来缓解TNF-α/IFN-γ等细胞因子诱导的屏障功能障碍[47-48]。在本试验中,仔鼠在使用参苓白术散之后,结肠中ZO-1和Occludin的表达量显著上升,这可能是由于灌胃参苓白术散升高了Akkermansia muciniphila、Lactobacillus、Blautia和Eubacterium等菌群的丰度,这些微生物通过代谢使肠道内短链脂肪酸的含量升高,从而上调紧密连接蛋白的表达量,改善仔鼠肠道屏障结构的完整性。
4 结论本试验结果表明,在母鼠哺乳期使用抗生素能导致仔鼠肠道稳态的失调,肠道菌群丰富度及多样性显著下降进而抑制仔鼠肠道菌群的定植与成熟,影响仔鼠的肠道屏障功能,而给予仔鼠参苓白术散可改善肠道菌群紊乱,促进仔鼠肠道菌群的定植与成熟,增强仔鼠肠道上皮屏障功能。这表明,参苓白术散具有改善肠道健康、缓解幼仔早期断奶应激的作用。
| [1] |
DOMINGUEZ-BELLO M G, COSTELLO E K, CONTRERAS M, et al. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns[J]. Proc Natl Acad Sci U S A, 2010, 107(26): 11971-11975. DOI:10.1073/pnas.1002601107 |
| [2] |
NURIEL-OHAYON M, NEUMAN H, KOREN O. Microbial changes during pregnancy, birth, and infancy[J]. Front Microbiol, 2016, 7: 1031. |
| [3] |
NURIEL-OHAYON M, NEUMAN H, ZIV O, et al. Progesterone increases Bifidobacterium relative abundance during late pregnancy[J]. Cell Rep, 2019, 27(3): 730-736. DOI:10.1016/j.celrep.2019.03.075 |
| [4] |
KOENIG J E, SPOR A, SCALFONE N, et al. Succession of microbial consortia in the developing infant gut microbiome[J]. Proc Natl Acad Sci U S A, 2011, 108(S1): 4578-4585. |
| [5] |
KORPELA K, SALONEN A, VIRTA L J, et al. Intestinal microbiome is related to lifetime antibiotic use in Finnish pre-school children[J]. Nat Commun, 2016, 7: 10410. DOI:10.1038/ncomms10410 |
| [6] |
TANAKA S, KOBAYASHI T, SONGJINDA P, et al. Influence of antibiotic exposure in the early postnatal period on the development of intestinal microbiota[J]. FEMS Immunol Med Microbiol, 2009, 56(1): 80-87. DOI:10.1111/j.1574-695X.2009.00553.x |
| [7] |
ANTONOPOULOS D A, HUSE S M, MORRISON H G, et al. Reproducible community dynamics of the gastrointestinal microbiota following antibiotic perturbation[J]. Infect Immun, 2009, 77(6): 2367-2375. DOI:10.1128/IAI.01520-08 |
| [8] |
杨茜雅, 谢磊, 赵永攀, 等. 犊牛断奶应激的原因、影响和评估[J]. 中国乳业, 2021(10): 31-34. YANG X Y, XIE L, ZHAO Y P, et al. Causes, effects and evaluation of weaning stress in calves[J]. China Dairy, 2021(10): 31-34. DOI:10.12377/1671-4393.21.10.07 (in Chinese) |
| [9] |
万凡, 钟儒清, 刘明, 等. 断奶仔猪应激期肠道健康及营养调控的研究进展[J]. 中国畜牧杂志, 2021, 57(3): 25-30. WAN F, ZHONG R Q, LIU M, et al. Research progress on intestinal health and nutritional regulation of weaned piglets during stress[J]. Chinese Journal of Animal Science, 2021, 57(3): 25-30. DOI:10.19556/j.0258-7033.20200507-01 (in Chinese) |
| [10] |
SUZUKI T. Regulation of the intestinal barrier by nutrients: the role of tight junctions[J]. Anim Sci J, 2020, 91(1): e13357. |
| [11] |
SOMMER F, ANDERSON J M, BHARTI R, et al. The resilience of the intestinal microbiota influences health and disease[J]. Nat Rev Microbiol, 2017, 15(10): 630-638. DOI:10.1038/nrmicro.2017.58 |
| [12] |
SÁNCHEZ B, URDACI M C. Extracellular proteins from Lactobacillus plantarum BMCM12 prevent adhesion of enteropathogens to mucin[J]. Curr Microbiol, 2012, 64(6): 592-596. DOI:10.1007/s00284-012-0115-6 |
| [13] |
YIN M M, YAN X B, WENG W H, et al. Micro integral membrane protein (MIMP), a newly discovered anti-inflammatory protein of Lactobacillus plantarum, enhances the gut barrier and modulates microbiota and inflammatory cytokines[J]. Cell Physiol Biochem, 2018, 45(2): 474-490. DOI:10.1159/000487027 |
| [14] |
EVERARD A, BELZER C, GEURTS L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J]. Proc Natl Acad Sci U S A, 2013, 110(22): 9066-9071. DOI:10.1073/pnas.1219451110 |
| [15] |
张萌, 张向东, 夏永欣, 等. 参苓白术散合附子理中丸联合西药治疗克罗恩病临床研究[J]. 新中医, 2019, 51(12): 73-76. ZHANG M, ZHANG X D, XIA Y X, et al. Clinical study on Shenling Baizhu powder combined with Fuzi Lizhong pills and western medicine in the treatment of Crohn's disease[J]. Journal of New Chinese Medicine, 2019, 51(12): 73-76. (in Chinese) |
| [16] |
姜宝山. 桃花汤合参苓白术散加减治疗溃疡性结肠炎的疗效观察[J]. 中国医药指南, 2019, 17(33): 223. JIANG B S. Therapeutic effect of Taohua decoction combined with Shenling Baizhu powder on ulcerative colitis[J]. Guide of China Medicine, 2019, 17(33): 223. (in Chinese) |
| [17] |
崔爱珍. 参苓白术散联合理中汤对慢性功能性腹泻患者的临床效果[J]. 世界最新医学信息文摘, 2019, 19(91): 182-183. CUI A Z. Clinical effect of Shenling Baizhu powder combined with Li Zhong Decoction on patients with chronic functional diarrhea[J]. World Latest Medicine Information, 2019, 19(91): 182-183. DOI:10.19613/j.cnki.1671-3141.2019.91.126 (in Chinese) |
| [18] |
AL NABHANI Z, DULAUROY S, MARQUES R, et al. A weaning reaction to microbiota is required for resistance to immunopathologies in the adult[J]. Immunity, 2019, 50(5): 1276-1288. DOI:10.1016/j.immuni.2019.02.014 |
| [19] |
NYANGAHU D D, LENNARD K S, BROWN B P, et al. Disruption of maternal gut microbiota during gestation alters offspring microbiota and immunity[J]. Microbiome, 2018, 6(1): 124. DOI:10.1186/s40168-018-0511-7 |
| [20] |
GONZALEZ-PEREZ G, HICKS A L, TEKIELI T M, et al. Maternal antibiotic treatment impacts development of the neonatal intestinal microbiome and antiviral immunity[J]. J Immunol, 2016, 196(9): 3768-3779. DOI:10.4049/jimmunol.1502322 |
| [21] |
雷英, 贺志有, 刘丽莎, 等. 参苓白术散对脾虚证小鼠血清淀粉酶、D-木糖、胃泌素及小肠组织学变化的研究[J]. 中药药理与临床, 2012, 28(2): 6-9. LEI Y, HE Z Y, LIU L S, et al. Shenlingbaizhu powde of spleen deficiency inserum amylase, D-xylose, gastrin and intestinal histological changes in experimental study[J]. Pharmacology and Clinics of Chinese Materia Medica, 2012, 28(2): 6-9. DOI:10.13412/j.cnki.zyyl.2012.02.008 (in Chinese) |
| [22] |
张志谦, 赵斌, 肖秋平, 等. 基于miR-21、miR-150和miR-200b研究参苓白术散对克罗恩病大鼠肠黏膜屏障的干预机制[J]. 中医临床研究, 2021, 13(25): 8-13. ZHANG Z Q, ZHAO B, XIAO Q P, et al. The intervention mechanism of Shenling Baizhu San on miR-21, miR-150 and miR-200b in intestinal mucosal barrier of rats with Crohn's disease[J]. Clinical Journal of Chinese Medicine, 2021, 13(25): 8-13. DOI:10.3969/j.issn.1674-7860.2021.25.002 (in Chinese) |
| [23] |
张超, 吕伟杰, 雷丰瑞, 等. 参苓白术散对哺乳仔猪生长性能及肠道菌群的影响[J]. 中国兽医学报, 2017, 37(6): 1155-1160. ZHANG C, LYU W J, LEI F R, et al. Effect of Shenling Baizhu san on growth performance and structural changes of gut microbiota in nursing piglets[J]. Chinese Journal of Veterinary Science, 2017, 37(6): 1155-1160. DOI:10.16303/j.cnki.1005-4545.2017.06.32 (in Chinese) |
| [24] |
WANG K, LIAO M F, ZHOU N, et al. Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J]. Cell Rep, 2019, 26(1): 222-235.e5. DOI:10.1016/j.celrep.2018.12.028 |
| [25] |
WANG L, ZENG B H, LIU Z W, et al. Green tea polyphenols modulate colonic microbiota diversity and lipid metabolism in high-fat diet treated HFA mice[J]. J Food Sci, 2018, 83(3): 864-873. DOI:10.1111/1750-3841.14058 |
| [26] |
CHANG C J, LIN C S, LU C C, et al. Correction: Corrigendum: Ganoderma lucidum reduces obesity in mice by modulating the composition of the gut microbiota[J]. Nat Commun, 2017, 8: 16130. DOI:10.1038/ncomms16130 |
| [27] |
PHAM T P T, ALOU M T, BACHAR D, et al. Gut microbiota alteration is characterized by a proteobacteria and fusobacteria bloom in kwashiorkor and a bacteroidetes paucity in marasmus[J]. Sci Rep, 2019, 9(1): 9084. DOI:10.1038/s41598-019-45611-3 |
| [28] |
SHIN N R, WHON T W, BAE J W. Proteobacteria: Microbial signature of dysbiosis in gut microbiota[J]. Trends Biotechnol, 2015, 33(9): 496-503. DOI:10.1016/j.tibtech.2015.06.011 |
| [29] |
汪富文, 罗小雨, 王朝飞, 等. 动物脾脏发育研究进展[J]. 家畜生态学报, 2021, 42(12): 9-13. WANG F W, LUO X Y, WANG Z F, et al. Research progress on the development of animal spleen[J]. Journal of Domestic Animal Ecology, 2021, 42(12): 9-13. DOI:10.3969/j.issn.1673-1182.2021.12.002 (in Chinese) |
| [30] |
田艳, 刘青青, 田海霞, 等. 益生菌缓解环磷酰胺所致小鼠免疫功能低下[J]. 中国免疫学杂志, 2020, 36(15): 1805-1808. TIAN Y, LIU Q Q, TIAN H X, et al. Probiotics alleviate immunosuppression induced by cyclophosphamide in mice[J]. Chinese Journal of Immunology, 2020, 36(15): 1805-1808. DOI:10.3969/j.issn.1000-484X.2020.15.003 (in Chinese) |
| [31] |
IANIRO G, TILG H, GASBARRINI A. Antibiotics as deep modulators of gut microbiota: Between good and evil[J]. Gut, 2016, 65(11): 1906-1915. DOI:10.1136/gutjnl-2016-312297 |
| [32] |
AZAD M B, KONYA T, PERSAUD R R, et al. Impact of maternal intrapartum antibiotics, method of birth and breastfeeding on gut microbiota during the first year of life: A prospective cohort study[J]. BJOG, 2016, 123(6): 983-993. DOI:10.1111/1471-0528.13601 |
| [33] |
LV W J, LIU C, YE C X, et al. Structural modulation of gut microbiota during alleviation of antibiotic-associated diarrhea with herbal formula[J]. Int J Biol Macromol, 2017, 105(Pt 3): 1622-1629. |
| [34] |
WANG S, MARTINS R, SULLIVAN M C, et al. Diet-induced remission in chronic enteropathy is associated with altered microbial community structure and synthesis of secondary bile acids[J]. Microbiome, 2019, 7(1): 126. DOI:10.1186/s40168-019-0740-4 |
| [35] |
FERRARI M L, MALARDÉ V, GRASSART A, et al. Shigella promotes major alteration of gut epithelial physiology and tissue invasion by shutting off host intracellular transport[J]. Proc Natl Acad Sci U S A, 2019, 116(27): 13582-13591. DOI:10.1073/pnas.1902922116 |
| [36] |
ABT M C, MCKENNEY P T, PAMER E G. Clostridium difficile colitis: Pathogenesis and host defence[J]. Nat Rev Microbiol, 2016, 14(10): 609-620. DOI:10.1038/nrmicro.2016.108 |
| [37] |
MICHAEL G B, BOSSÉ J T, SCHWARZ S. Antimicrobial resistance in Pasteurellaceae of veterinary origin[J]. Microbiol Spectr, 2018, 6(3): 10. |
| [38] |
HU Y F, YANG X, QIN J J, et al. Metagenome-wide analysis of antibiotic resistance genes in a large cohort of human gut microbiota[J]. Nat Commun, 2013, 4: 2151. |
| [39] |
ZHOU K Q. Strategies to promote abundance of Akkermansia muciniphila, an emerging probiotics in the gut, evidence from dietary intervention studies[J]. J Funct Foods, 2017, 33: 194-201. |
| [40] |
WANG L J, TANG L, FENG Y M, et al. A purified membrane protein from Akkermansia muciniphila or the pasteurised bacterium blunts colitis associated tumourigenesis by modulation of CD8+ T cells in mice[J]. Gut, 2020, 69(11): 1988-1997. |
| [41] |
ZHOU D, PAN Q, XIN F Z, et al. Sodium butyrate attenuates high-fat diet-induced steatohepatitis in mice by improving gut microbiota and gastrointestinal barrier[J]. World J Gastroenterol, 2017, 23(1): 60-75. |
| [42] |
MUKHERJEE A, LORDAN C, ROSS R P, et al. Gut microbes from the phylogenetically diverse genus Eubacterium and their various contributions to gut health[J]. Gut Microbes, 2020, 12(1): 1802866. |
| [43] |
LIN Y L, LI B J, YANG X G, et al. Non-hematopoietic STAT6 induces epithelial tight junction dysfunction and promotes intestinal inflammation and tumorigenesis[J]. Mucosal Immunol, 2019, 12(6): 1304-1315. |
| [44] |
HAYES C L, DONG J, GALIPEAU H J, et al. Commensal microbiota induces colonic barrier structure and functions that contribute to homeostasis[J]. Sci Rep, 2018, 8(1): 14184. |
| [45] |
SAITOH Y, SUZUKI H, TANI K, et al. Structural insight into tight junction disassembly by Clostridium perfringens enterotoxin[J]. Science, 2015, 347(6223): 775-778. |
| [46] |
CHELAKKOT C, CHOI Y, KIM D K, et al. Akkermansia muciniphila-derived extracellular vesicles influence gut permeability through the regulation of tight junctions[J]. Exp Mol Med, 2018, 50(2): e450. |
| [47] |
LIU L X, LI Q Q, YANG Y J, et al. Biological function of short-chain fatty acids and its regulation on intestinal health of poultry[J]. Front Vet Sci, 2021, 8: 736739. |
| [48] |
HUANG X Y, OSHIMA T, TOMITA T, et al. Butyrate alleviates cytokine-induced barrier dysfunction by modifying claudin-2 levels[J]. Biology (Basel), 2021, 10(3): 205. |
(编辑 范子娟)



