2. 青岛农业大学动物医学学院, 青岛 266109;
3. 内蒙古自治区扎兰屯市高台子党群服务中心, 扎兰屯 162650;
4. 大庆市杜尔伯特蒙古族自治县畜牧技术服务中心, 大庆 166200;
5. 黑龙江省农业科学院大豆研究所, 哈尔滨 150086
2. College of Veterinary Medicine, Qingdao Agricultural University, Qingdao 266109, China;
3. Party Service Center in Gaotaizi, Zhalantun City, Inner Mongolia Autonomous Region, Zhalantun 162650, China;
4. Daqing Dulbert Mongol Autonomous County Animal Husbandry Technology Service Center, Daqing 166200, China;
5. Soybean Research Institute, Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China
应激会导致身体和心理疾病[1]。近年来,压力引起人们的广泛关注,因为它引起的疾病对公共卫生构成了极大的威胁[2]。目前,报道最多关注的是,急性应激可以影响人与动物学习和工作记忆能力[3-4]。但是,急性应激也会引起自身免疫性疾病[5]、脑部损伤[6]、心血管疾病[7]、急性心肌梗死[8]、胃溃疡[9]和肝损伤[10]。肾是应激反应下最脆弱的器官之一,肾损伤可导致肾功能不全、高钾血症、水中毒、致命性心律失常、脑水肿,这往往危及生命[11-12]。因此,亟需研究急性应激引起的肾损伤的潜在机制和有效治疗目标。目前,急性应激性肾损伤的潜在分子机制尚不清楚。先前的研究表明,急性束缚应激对肝和海马的损伤与氧化应激有关[13-14]。应激过程中,会有大量去甲肾上腺素(norepinephrine,NE)、皮质酮(corticosterone,CORT)、血管紧张素等激素产生。它们可以破坏蛋白质,产生自由基,促进氧化应激。NADPH氧化酶为膜结合蛋白,可以产生活性氧。作为细胞凋亡的诱导剂,氧化应激可引起肾损害[15]。
右美托咪定(dexmedetomidine,DEX)是医学和兽医学临床中常用的药物,除具有镇静、止疼作用外,还具有抑制交感兴奋、调节免疫、抗感染等多重作用。先前的研究表明,应用DEX治疗后,仅NE的浓度被显著地降低了,提示DEX可能会抑制NE的释放,从而防止大鼠急性应激致肾损伤[16-17]。在本课题组的一些预试验中的结果表明,DEX可降低肾组织NADPH氧化酶4(NADPH oxidase 4,NOX4)的蛋白表达水平和氧化应激反应,但DEX抗氧化应激的药理作用靶点仍有待探索。
在上述研究的基础上,本课题组设计采用了“强迫游泳15 min、束缚应激3 h”的大鼠急性应激模型。通过进行旷场试验验证模型,肾功能检查、肾组织病理学观察、肾组织氧化应激指标检测和NOX4/AKT信号通路中关键蛋白(NOX4、AKT、Nrf2、HO-1和NQO1)的检测,探讨DEX对急性应激致大鼠肾损伤的保护作用及机制,期望能为兽医和医学临床治疗急性应激致肾损伤提供新的研究思路和干预手段,为DEX抗应激的临床应用提供必要的资料。
1 材料与方法 1.1 试验材料1.1.1 实验动物 体重为180~200 g的Wistar雄性大鼠24只,购自哈尔滨医科大学第二附属医院。在试验开始7 d前将这些大鼠进行分笼饲养,随机分配3只一笼,并将大鼠置于安静、清洁、温度22 ℃±1 ℃、湿度为45%~55%,且有自然光照射的房间内。大鼠进行适应性饲养7 d,期间可自由采食饮水。本试验涉及动物均获得黑龙江省农业科学院畜牧兽医分院实验动物伦理委员会(SRM-11)的批准。
1.1.2 试剂 右美托咪定(美国辉瑞公司,12071234)、异氟烷(河北九派制药有限公司,1011),谷胱甘肽GSH(南京建成生物工程研究所,A006-1-1),丙二醛MDA(南京建城生物工程研究所,A003-2-2),超氧化物歧化酶SOD(南京建城生物工程研究所,A001-3-2),甲醛(天津富宇精细化工有限公司),Acr-Bis(北京雷根生物技术有限公司,PE0103),抗体:NOX4、AKT、Nrf2、HO-1、NQO1、GAPDH(北京博奥森生物技术有限公司)。
1.1.3 主要仪器 GRGD-R1大鼠固定器(杭州中科生命科技股份有限公司),BX-FM光学显微镜观察(Olympus Corp,东京,日本),组织制备仪(Bio-Xplorer International Limited),TanonESP300通用型电泳仪(上海天能科技有限公司),蛋白转膜仪(美国BayGene公司,BG-Power 600),全自动凝胶成像仪(上海天能科技有限公司, Tanon5200),水浴锅(江苏金城国胜实验仪器厂),酶标仪(美国BioTek公司,Bio-Rad 680)。
1.2 试验方法1.2.1 实验动物分组与处理 24只Wistar大鼠,随机均分为空白对照组(C组)、DEX对照组(C+D组)、急性应激组(AS组)、DEX干预组(AS+D组)。
C组:本组大鼠均不做任何处理。
C+D组:即DEX对照组,对该组大鼠进行腹腔注射DEX(30 μg·kg-1)处理。
AS组:首先强迫大鼠游泳15 min(水温18~20 ℃),若出现溺水状态则立即捞出;然后将其固定在固定器上,四肢和头部均外露,持续3 h。
AS+D组:大鼠造模前腹腔注射DEX(30 μg·kg-1),30 min后将其置于水中(18~20 ℃)强迫游泳15 min(出现溺水状态立即捞出),然后将大鼠固定在固定器上,四肢和头部均外露,持续3 h。
1.2.2 旷场试验 建立急性应激模型后,进行旷场试验,验证模型是否建立成功。应用Super Maze软件记录3 min内大鼠的表现,包括中央格静止时间、总路程、跨格次数、站立次数(两前肢同时离地的频率)[18-19]。所有大鼠均测试一次,每次结束后需要清扫场箱。
1.2.3 大鼠血液及肾组织的收集 试验结束后,进行心取血,完整取下肾,一侧冷冻保存,另一侧用4%甲醛固定。
1.2.4 大鼠肾功能的检查 采集血液后,用4 ℃离心机在3 000 r·min-1离心10 min,收集血清。用生化分析仪检测血清中肌酐(creatinine,CREA)和尿素氮(blood urea nitrogen,BUN)的含量。
1.2.5 大鼠肾组织病理学观察 常规制备肾组织石蜡切片(4~5 μm),并进行HE染色。在光学显微镜下观察所有切片,由不清楚本试验分组的人员进行评估。评估标准参考文献[16-17]。
1.2.6 大鼠肾组织氧化应激指标的检测 氧化检测应激指标SOD、MDA、GSH均使用南京建成试剂盒,使用方法均按照使用说明。
1.2.7 氧化应激相关蛋白表达的检测 裂解大鼠肾组织细胞,提取蛋白,使用BSA计算蛋白含量和上样量。制胶、上样,进行电泳。转膜后进行一抗和二抗的孵育,时间分别为12和2 h,蛋白稀释比例:NOX4(1∶500),AKT(1∶500),Nrf2(1∶1 000),HO-1 (1∶1 500),NQO1(1∶1 000),GAPDH(1∶2 000)。采用TImager 600全自动化学发光分析系统进行目的蛋白化学发光的检测,获取并保存结果。应用ImageJ软件分析蛋白灰度值。
1.2.8 统计学分析 数据结果应用SPSS 18.0分析,以“平均值±标准误(x±sx)”表示,多组间数据比较采用单因素ANOVA检验,两组间数据采用独立样本T检验。本试验中所有的柱状图均采用GraphPad Prism 7制作;积分光密度应用Image-Pro Plus软件定量分析;蛋白条带灰度值应用ImageJ软件分析。各试验组与C组结果相比较的差异以*表示,与AS组的结果差异以#表示,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 大鼠急性应激模型的验证通过旷场试验验证急性应激模型。旷场试验结果表明(图 1),AS组大鼠在中央格的静止时间极显著(P < 0.01)高于C组,而其总路程、站立次数均极显著(P < 0.01)低于C组。根据旷场轨迹图也可直观看出AS组大鼠的活动量显著少于C组,这说明大鼠对新环境的好奇度明显降低,对周边的事物失去兴趣,不愿去探索新环境,而是缩在一处,表现抑郁样行为。以上结果表明,大鼠急性应激模型建立成功。

|
C. 对照组;C+D. DEX对照组;AS.急性应激组;AS+D. DEX治疗组;*和**代表与C组比较,#和##代表与AS组比较,都具有统计学意义(*, #.P < 0.05;**,##.P < 0.01),下图同 C. Control group; C+D. DEX control group; AS. Acute stress group; AS+D. DEX treatment group; * and ** represent the comparison with the C group, # and ## represent the comparison with the AS group, all of which are statistically significant (*, #.P < 0.05;**, ##.P < 0.01). The same as below 图 1 旷场试验结果(n=6)及参数统计(a~d) Fig. 1 Open field test results (n=6) and parameter statistics (a-d) |
血清CREA和BUN检测结果表明(图 2),AS组和AS+D组大鼠血清中BUN的浓度极显著高于C组(P < 0.01),而AS+D组大鼠的BUN浓度与AS组相比降低到正常水平(P < 0.01)。AS组大鼠的血清CREA浓度极显著高于C组和AS+D组(P < 0.01)。结果见图 2。

|
图 2 大鼠肾功能指标BUN与CREA的含量(n=6) Fig. 2 Contents of BUN and CREA in Rat Renal Function Index (n=6) |
肾组织病理学观察结果显示(图 3),C组大鼠肾小球、肾小管及肾间质均未见异常。AS组大鼠肾组织观察到空泡变性、局灶性肾出血及局灶性肾小管坏死等。然而,AS+D组大鼠肾组织未观察到出血,仅有极少数空泡变性。
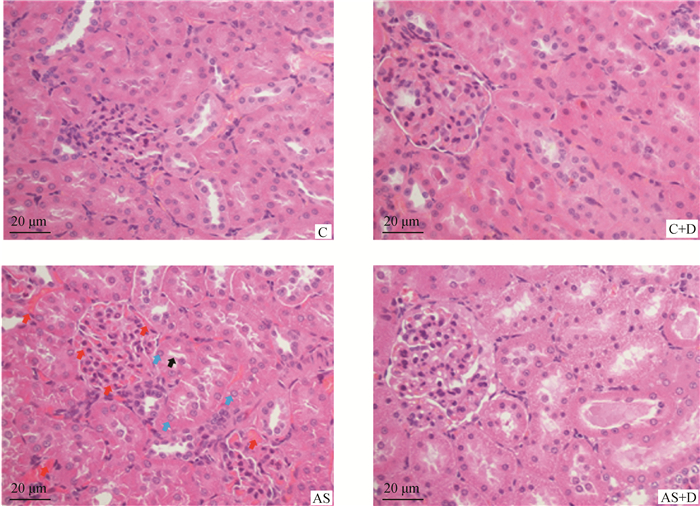
|
AS组引起实质性组织损伤,可以在AS组中观察到严重出血/充血(红色箭头指示),局灶性肾小管坏死(黑色箭头指示),空泡变性(蓝色箭头指示) The AS group caused parenchymal tissue damage, and severe hemorrhage/congestion (indicated by red arrows), focal tubular necrosis (indicated by black arrows), vacuolar degeneration (indicated by blue arrows) 图 3 大鼠肾组织HE染色结果 Fig. 3 HE staining results of rat kidney tissue |
肾损伤评分结果见图 4。

|
图 4 大鼠肾损伤评分(n=6) Fig. 4 Renal score results of rat (n=6) |
MDA检测结果表明(图 5),AS组大鼠肾组织中MDA含量极显著高于C组(P < 0.01)。AS+D组与AS组相比,大鼠肾组织中MDA含量明显降低,差异显著(P < 0.05)。AS+D组与C组相比差异不显著。结果表明,DEX预处理后能够显著降低MDA的含量。

|
图 5 大鼠肾组织中MDA的含量(n=6) Fig. 5 The content of MDA in rat kidney tissue (n=6) |
SOD和GSH检测结果表明(图 6),AS组大鼠肾组织的SOD活性和GSH含量均显著低于C组(P < 0.05)。然而,AS+D组大鼠肾组织的SOD活性和GSH含量显著地高于AS组(P < 0.01)。AS+D组与C组相比差异不显著。这些结果表明DEX能增加SOD的活性和GSH的含量。

|
图 6 大鼠肾组织中SOD活性与GSH浓度(n=6) Fig. 6 SOD activity and GSH concentration in rat kidney tissue (n=6) |
Nox4介导氧化应激途径相关蛋白表达检测结果显示(图 7),AS组大鼠肾组织中NOX4和AKT蛋白表达明显高于C组。AS+D组大鼠肾组织中NOX4和AKT蛋白表达明显低于AS组。AS组Nrf2、HO-1和NQO1蛋白表达明显低于C组。AS+D组HO-1和NQO1蛋白表达明显高于AS组。

|
图 7 NOX4介导氧化应激途径相关蛋白的表达(n=6) Fig. 7 NOX4 mediates the expression of oxidative stress pathway-related proteins (n=6) |
各蛋白条带灰度值分析结果表明(图 7),AS组大鼠肾组织中NOX4和AKT蛋白表达量极显著(P < 0.01)或显著高于C组(P < 0.05),Nrf2、HO-1和NQO1蛋白表达量极显著(P < 0.01)或显著(P < 0.05)低于C组。AS+D组大鼠肾组织中NOX4和AKT蛋白表达量极显著低于AS组(P < 0.01)。以上结果表明急性应激诱导大鼠肾组织氧化应激是通过激活NOX4/AKT途径。
3 讨论生物体在急性应激状态下,过量的NE可能会自我氧化,产生过剩的氧自由基,从而破坏机体氧化和抗氧化平衡,产生大量的ROS,引起氧化应激[20]。氧化应激不仅会引起肾实质细胞和间质细胞发生空泡样变性、凋亡、坏死等一系列形态学的改变,还会造成肾小球滤过功能和肾小管重吸收功能的降低[21]。BUN和CREA的血清水平是评估肾功能的常用指标[22]。急性应激组大鼠的血清BUN的含量为其他组2倍左右,超出正常范围。在DEX预处理后大鼠血清中BUN与CREA的含量显著降低,恢复到正常范围内。
肾组织病理学检查是用于评估肾损伤最直观的指标[23]。在本研究中,急性应激后大鼠肾组织出现局灶性肾出血、局灶性肾小管坏死和肾小管上皮细胞空泡变性。用DEX预处理后,大鼠肾组织切片中仅发现少量肾小管坏死,未观察到空泡变性和出血等肾组织病理学损伤。肾组织损伤统计结果表明,DEX可抑制出血现象,改善肾小管坏死和空泡变性。由此可以看出,急性应激后大鼠肾组织病理学损伤严重,DEX可改善急性应激诱导的大鼠肾损伤。肾小管坏死和空泡变性可能与初期血流动力学导致的肾缺血有关,也可能与氧化应激有关[24]。
应激的神经内分泌调节系统主要包括交感肾上腺髓质系统(sympathetic adrenal medullary system,SAM)和下丘脑-垂体-肾上腺皮质系统(hypothalamic-pituitary-adrenal cortex system,HPA)。SAM系统通过外周效应分泌(catecholamine,CA),即NE和肾上腺素(epinephrine,E),因此SAM轴是最早参与应激反应的系统之一[25]。有研究指出,DEX会抑制NE的释放[26]。因此DEX通过影响NE可能也会在一定程度上影响氧化应激的强度。但是NADPH氧化酶4(NOX4)主要是肾和血管中表达[27]。因此,在肾组织中的氧化应激的发生,可能更多地由NOX4来影响。
韩勇等[28]研究表明,NADPH氧化酶的激活可导致ROS生成增多。ROS大量积聚引发机体内源性氧化应激反应,并进一步促进炎性因子的释放,加剧炎症反应。这可以看出,氧化应激的损伤机制可能是急性应激诱导机体损伤的一个重要机制。因此,根据本研究结果,DEX可影响NOX4的表达,不仅可阻止氧化应激,还会对抑制炎症有一定作用。
4 结论DEX预处理可显著降低肾组织病理学损伤的严重性,DEX治疗急性应激可影响NOX4/Nrf2/HO-1/NQO1信号通路,并减轻氧化应激治疗肾损伤。
| [1] |
ROSENBERGER C, ELSENBRUCH S, SCHOLLE A, et al. Effects of psychological stress on the cerebral processing of visceral stimuli in healthy women[J]. Neurogastroenterol Motil, 2009, 21(7): 740-e45. DOI:10.1111/j.1365-2982.2009.01295.x |
| [2] |
MCEWEN B S, GIANAROS P J. Stress- and allostasis-induced brain plasticity[J]. Annu Rev Med, 2011, 62: 431-445. DOI:10.1146/annurev-med-052209-100430 |
| [3] |
SMEETS T, JELICIC M, MERCKELBACH H. The effect of acute stress on memory depends on word valence[J]. Int J Psychophysiol, 2006, 62(1): 30-37. DOI:10.1016/j.ijpsycho.2005.11.007 |
| [4] |
SCHOOFS D, PREUSS D, WOLF O T. Psychosocial stress induces working memory impairments in an n-back paradigm[J]. Psychoneuroendocrinology, 2008, 33(5): 643-653. DOI:10.1016/j.psyneuen.2008.02.004 |
| [5] |
STOJANOVICH L, MARISAVLJEVICH D. Stress as a trigger of autoimmune disease[J]. Autoimmun Rev, 2008, 7(3): 209-213. DOI:10.1016/j.autrev.2007.11.007 |
| [6] |
BROWN S M, HENNING S, WELLMAN C L. Mild, short-term stress alters dendritic morphology in rat medial prefrontal cortex[J]. Cereb Cortex, 2005, 15(11): 1714-1722. DOI:10.1093/cercor/bhi048 |
| [7] |
BLACK P H, GARBUTT L D. Stress, inflammation and cardiovascular disease[J]. J Psychosom Res, 2002, 52(1): 1-23. DOI:10.1016/S0022-3999(01)00302-6 |
| [8] |
ROSENGREN A, HAWKEN S, ÕUNPUU S, et al. Association of psychosocial risk factors with risk of acute myocardial infarction in 11 119 cases and 13 648 controls from 52 countries (the INTERHEART study): case-control study[J]. Lancet, 2004, 364(9438): 953-962. DOI:10.1016/S0140-6736(04)17019-0 |
| [9] |
MACDONALD J J, ROBERTS J C, WASHINGTON S. Stress ulcer prophylaxis: friend or foe?[J]. Br J Hosp Med (Lond), 2012, 73(4): 238-238. DOI:10.12968/hmed.2012.73.4.238 |
| [10] |
ZHU Q, GU L W, WANG Y M, et al. The role of alpha-1 and alpha-2 adrenoceptors in restraint stress-induced liver injury in mice[J]. PLoS One, 2014, 9(3): e92125. DOI:10.1371/journal.pone.0092125 |
| [11] |
WOHLAUER M V, SAUAIA A, MOORE E E, et al. Acute kidney injury and posttrauma multiple organ failure: the canary in the coal mine[J]. J Trauma Acute Care Surg, 2012, 72(2): 373-380. DOI:10.1097/TA.0b013e318244869b |
| [12] |
WANG Y B, YAN J L, XI L, et al. Protective effect of crocetin on hemorrhagic shock-induced acute renal failure in rats[J]. Shock, 2012, 38(1): 63-67. DOI:10.1097/SHK.0b013e3182596ec4 |
| [13] |
AMIN S N, EL-AIDI A A, ZICKRI M B, et al. Hepatoprotective effect of blocking N-methyl-D-aspartate receptors in male albino rats exposed to acute and repeated restraint stress[J]. Can J Physiol Pharmacol, 2017, 95(6): 721-731. DOI:10.1139/cjpp-2016-0556 |
| [14] |
LEE J S, KIM H G, LEE H W, et al. Pine needle extract prevents hippocampal memory impairment in acute restraint stress mouse model[J]. J Ethnopharmacol, 2017, 207: 226-236. DOI:10.1016/j.jep.2017.06.024 |
| [15] |
MA J Q, LIU C M, YANG W. Protective effect of rutin against carbon tetrachloride-induced oxidative stress, inflammation and apoptosis in mouse kidney associated with the ceramide, MAPKs, p53 and calpain activities[J]. Chem Biol Interact, 2018, 286: 26-33. DOI:10.1016/j.cbi.2018.03.003 |
| [16] |
陈永平. 右美托咪定通过调控NE/ROS/JNK对急性应激致大鼠肾损伤保护作用[D]. 哈尔滨: 东北农业大学, 2019. CHEN Y P. Protective effect of dexmedetomidine on acute stress-induced kidney injury in rats by regulating NE/ROS/JNK[D]. Harbin: Northeast Agricultural University, 2019. (in Chinese) |
| [17] |
杨昊天. 基于P2X7R/NF-κB/NLRP3通路探究右美托咪定对急性应激致大鼠肾损伤的保护作用机制[D]. 哈尔滨: 东北农业大学, 2021. YANG H T. Protective mechanism of dexmedetomidine on acute stress induced renal injury in rats via the regulation of P2X7R/NF-κB/NLRP3 pathway[D]. Harbin: Northeast Agricultural University, 2021. (in Chinese) |
| [18] |
CHEN Y P, YANG H T, YANG T Y, et al. Protective effects of low-dose alcohol against acute stress-induced renal injury in rats: involvement of CYP4A/20-HETE and LTB4/BLT1 pathways[J]. Oxid Med Cell Longev, 2021, 2021: 4475968. |
| [19] |
SHA J C, FENG X J, CHEN Y P, et al. Dexmedetomidine improves acute stress-induced liver injury in rats by regulating MKP-1, inhibiting NF-κB pathway and cell apoptosis[J]. J Cell Physiol, 2019, 234(8): 14068-14078. DOI:10.1002/jcp.28096 |
| [20] |
TOMA V A, FARCAS A D, PARVU M, et al. CA3 hippocampal field: cellular changes and its relation with blood nitro-oxidative stress reveal a balancing function of CA3 area in rats exposed to repetead restraint stress[J]. Brain Res Bull, 2017, 130: 10-17. DOI:10.1016/j.brainresbull.2016.12.012 |
| [21] |
RATLIFF B B, ABDULMAHDI W, PAWAR R, et al. Oxidant mechanisms in renal injury and disease[J]. Antioxid Redox Signal, 2016, 25(3): 119-146. DOI:10.1089/ars.2016.6665 |
| [22] |
LIN L, CUI F Y, ZHANG J J, et al. Antioxidative and renoprotective effects of residue polysaccharides from Flammulina velutipes[J]. Carbohydr Polym, 2016, 146: 388-395. DOI:10.1016/j.carbpol.2016.03.071 |
| [23] |
邹万忠. 肾活检病理学[M]. 2版. 北京: 北京大学医学出版社, 2009. ZOU W Z. Pathology of renal biopsy[M]. 2nd ed. Beijing: Peking University Medical Press, 2009. (in Chinese) |
| [24] |
宣吉晴, 李明星, 陈晓梅, 等. 兔肾缺血-再灌注损伤后叶间动脉血流动力学变化与肾小管上皮Bcl-2表达的相关性[J]. 中国医学影像学杂志, 2012, 20(3): 212-215, 219. XUAN J Q, LI M X, CHEN X M, et al. The correlation between hemodynamic change of the renal interlobar arteria and the expression of Bcl-2 Protein in tubular epithelial cells on rabbit renal ischemia reperfusion models[J]. Chinese Journal of Medical Imaging, 2012, 20(3): 212-215, 219. (in Chinese) |
| [25] |
OLFE J, DOMANSKA G, SCHUETT C, et al. Different stress-related phenotypes of BALB/c mice from in-house or vendor: alterations of the sympathetic and HPA axis responsiveness[J]. BMC Physiol, 2010, 10: 2. DOI:10.1186/1472-6793-10-2 |
| [26] |
CHEN Y P, FENG X J, HU X Y, et al. Dexmedetomidine ameliorates acute stress-induced kidney injury by attenuating oxidative stress and apoptosis through inhibition of the ROS/JNK signaling pathway[J]. Oxid Med Cell Longev, 2018, 2018: 4035310. |
| [27] |
TARAFDAR A, PULA G. The role of NADPH oxidases and oxidative stress in neurodegenerative disorders[J]. Int J Mol Sci, 2018, 19(12): 3824. DOI:10.3390/ijms19123824 |
| [28] |
韩勇, 郭立荣, 贺滟, 等. 20-HETE对大鼠心肌缺血再灌注损伤中NADPH氧化酶活性及ROS生成的影响[J]. 遵义医学院学报, 2016, 39(4): 366-371. HAN Y, GUO L R, HE Y, et al. Effect of 20-HETE on NADPH oxidase activity and ROS production of rats with myocardial ischemia reperfusion injury[J]. Journal of Zunyi Medical University, 2016, 39(4): 366-371. (in Chinese) |
(编辑 白永平)



