非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起的猪的一种烈性、高度致死性的重大传染病,目前暂无商品化的疫苗和防控药物可用[1-4],严重威胁全球养猪业[5]。
ASFV是Asfarviridae家族的唯一成员,属于核质巨DNA病毒(nucleocytoplasmiclarge DNA viruses,NCLDV)[6-7]。ASFV是目前唯一报道的DNA虫媒病毒[3]。ASFV粒子呈现出独特的多层结构,整体形态呈二十面体,直径约250 nm[8-9]。病毒基因组是双链DNA (dsDNA)分子,长度为170~190 kbp,编码超过150个开放阅读框(open reading frame,ORF),其中大约一半ORF缺乏任何已知或可预测的功能[6]。病毒粒子包含约70种不同的多肽[10],包括用于病毒结构的多种成分,以及一组参与病毒转录和mRNA修饰以及维持病毒基因组完整性的酶。ASFV主要在猪单核细胞和巨噬细胞中复制[11-14]。ASFV编码的D1133L基因在ASFV中高度保守[15],与牛痘病毒(vaccinia virus,VACV)的转录因子蛋白D6R相似[16],具有SF2解旋酶家族相似的基序,值得注意的是,D1133L在病毒感染晚期表达,属于晚期表达基因,D1133L定位于胞质[17],可能参与病毒转录过程[6, 11-12]。目前对D1133L在病毒复制过程中发挥的作用及其机制知之甚少。
ASFV编码的结构蛋白在病毒复制不同阶段发挥相关的功能,为了探究病毒蛋白在复制阶段发挥的功能,乳糖操纵子中编码的酶在阻遏物——乳糖操纵子阻遏蛋白(lac repressor Lac I,Lac I)负调控下,可特异性地与乳糖操纵基因(lac operator LacO,Lac O)结合并以高亲和力与其21 bp序列结合,阻遏酶表达。Lac I也可以与异乳糖或异丙基硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG)结合,从而降低阻遏物对操纵子的亲和力,通过这种方式,IPTG可以减少Lac操纵子转录的抑制,从而诱导表达。该系统可调节哺乳动物细胞中转染和整合基因的表达,在VACV中已使用该系统可以用来研究病毒形态,成为调控病毒蛋白与宿主互作的有力工具[18]。基于乳糖Lac操纵阻遏系统的ASFV诱导表达系统[19]。例如p72蛋白诱导重组的ASFV,利用该策略对ASFV其他蛋白在病毒复制中发挥的功能进行探究,比如pE120R[20]和pE199L[21]构建诱导表达pE120R和pE199L基因的ASFV重组病毒,探究这两种病毒蛋白在病毒入侵和出芽过程发挥作用。因此ASFV感染与致病功能与其编码的病毒蛋白息息相关,构建缺失病毒相关蛋白的ASFV重组病毒是研究病毒编码致病基因及其机制的重要手段。本研究团队发现缺失D1133L基因ASFV无法复制,利用大肠杆菌阻遏系统条件性敲除D1133L基因,探究了D1133L在ASFV病毒复制过程中发挥的功能,获得ASFV条件性敲除D1133L基因的重组病毒vD1133Li,比较了重组病毒和亲本毒株的复制能力,本研究结果为D1133L基因功能研究和机制的探究提供了基础,为条件性基因缺失ASFV弱毒疫苗的研发提供了新的思路。
1 材料与方法 1.1 材料1.1.1 细胞与病毒 MA-104细胞和MA-104/D1133L细胞系由兰州兽医研究所口蹄疫流行病实验室保存;ASFV CN/GS/2018分离株、由兰州兽医研究所非洲猪瘟区域实验室构建并保存。猪肺泡巨噬细胞(porcine alveolar macrophages, PAM) 和骨髓源巨噬细胞(bone marrow-derived macrophages,BMDM)的分离、鉴定和培养参照European Union Reference Laboratory for ASF, SOP/CISA/ASF中的操作程序。
1.1.2 试剂和抗体 ASFV p30单克隆抗体,兔抗ASFV p72多克隆抗体由中国农业科学院兰州兽医研究所提供;peGFP-N1载体、pUC118载体均购于兰州瑞博莱生物科技有限公司;无内毒素的质粒提取试剂盒,购于OMEGA公司;胎牛血清(FBS)和0.25%EDTA-Trypsin(Gibco)购自博鑫生物科技有限公司;青霉素-链霉素-庆大霉素混合溶液(三抗)和PBS缓冲液购自北京索莱宝公司;大肠杆菌Trans5a感受态、LA Taq DNA聚合酶、T4 DNA连接酶、Trizol试剂购自SYBR Permix Ex Taq II均购于宝生物工程大连有限公司;RPIM1640培养基(Gibco)和高糖DMEM(Gibco)培养基购自购自Thermo Fisher Scientific公司;鼠抗β-actin单克隆抗体购自英潍捷基(上海)贸易有限公司,HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L),Goat Anti-Mouse,蛋白预染marker购自proteintech公司。
1.2 不同转移载体的构建本研究中使用的表达盒参考相关报道由三部分组成[22],通过PCR扩增得到p72启动子序列,即从p72基因上游的-97 nt到ATG起始密码子之前序列,以peGFP-N1载体为模板,扩增得到绿色荧光蛋白(enhanced green fluorescent protein,eGFP)基因,合成以u104L为启动子的Lac I系统,最后合成以p72启动子的Lac O系统。将这几个部分部分连接,获得eGFP筛选表达盒基因片段,命名p72-eGFP-U104L-Lac I-p72-Lac O。为便于后续纯化病毒,在合成调控序列的同时,合成p72启动子启动表达的eGFP基因筛选标记元件。
1.3 重组载体的构建与鉴定利用pU118载体作为骨架载体,构建D1133L基因敲除同源重组转移载体。步骤如下:分别设计D1133L基因起始密码子的上下游序列1.0 kb作为同源重组臂,分别克隆入骨架载体中,两个同源臂中插入p72-eGFP-U104L-Lac I-p72-Lac O表达盒基因片段。得到用于条件性敲除D1133L基因的同源重组转移载体,经测序正确后,将该同源重组转移载体命名为ASFVΔi130;用去内毒素的质粒提取试剂盒提取质粒DNA,测定浓度,-20 ℃保存备用。
1.4 质粒转染和重组病毒筛选与鉴定1.4.1 重组质粒转染 将同源重组转移载体pUC-p72-eGFP-U104L-LacI-p72-LacO用4 μL JetPER-Macrophage DNA转染试剂转染至猪BMDM细胞中(细胞数约为106个·孔-1),6 h后,感染ASFVCN/GS2018,至感染48 h,荧光显微镜观察荧光细胞数,挑取所有单孔中的荧光细胞,在新的培养皿中小心吹散,沉降1 h,挑取所有单个荧光细胞,反复冻融后,接种预先铺好的96孔板BMDM细胞,每12 h观察一次,连续观察至72 h;在荧光显微镜下可见有零星绿色荧光,即视为可疑重组毒感染的细胞。挑取荧光细胞,在新的培养皿中小心吹散,沉降1 h,挑取单个荧光细胞,收集后反复冻融3次,接种预先铺好的96孔板PAMs,每12 h观察一次,连续观察至72 h。荧光细胞数量比例达100%的为全阳性孔,表明重组毒构建基本成功。
1.4.2 重组病毒鉴定 在1.5 mmol·L-1 IPTG的情况下,对阳性孔进行有限稀释扩大培养,挑取第11代重组病毒孔消化成单个细胞,吸取10个荧光细胞,分别接种于预先铺好的96孔板PAMs,生长72 h。挑取GFP荧光较多的细胞,用病毒基因组提取试剂盒提取ASFV野毒和基因缺失ASFV的基因组,用针对D1133L的引物进行PCR鉴定,确认是否缺失成功。通过加入IPTG,扩大培养,纯净性检验、目的基因通过Western blot测定,以确定纯化的ASFV vD1133Li在没有IPTG情况下,D1133L蛋白的表达被阻止。检测引物序列表见表 1。
|
|
表 1 重组病毒检测引物序列表 Table 1 Sequence list of primers for recombinant virus detection |
将PAM细胞接种于24孔细胞培养板,ASFV重组毒株vD1133Li和亲本毒株感染(MOI=0.1)PAMs,吸附2 h后,亲本毒株没有IPTG及重组毒株vD1133Li更换培养基IPTG(1.5 mmol·L-1)和没有IPTG的培养基中培养。在感染后指定时间将感染细胞与培养上清一起收集,反复冻融三次后,用qPCR测定病毒拷贝数。反应体系25 μL,用Qiagen公司的QIAamp DNA Mini试剂盒提取样本DNA,设计以ASFV p72基因为靶点的定量引物来分析病毒增殖的拷贝数,引物序列如下,上游引物序列f:5′-CAGGCAAAACAAGTGAAACA-3′,下游引物序列r:5′-GCAAACTGCTCATCCAATAT-3′;探针(probe):TGTTCTTCACGCGTAGCGAATGGGC,探针的5′端标记fam荧光报告基团,3′端标记荧光淬灭基团bhq1,扩增条件: 95 ℃预热30 s,95 ℃预热5 s,58 ℃预热30 s,40次循环。计算ASFV基因组的数量,并以每微升含有病毒基因组拷贝数表示。
1.6 荧光观察利用荧光显微镜观条件性缺失D1133L重组病毒(vD1133Li)感染PAM细胞的荧光值,将PAM细胞按1×105密度接种于六孔板中,感染48 h后,在荧光显微镜下观察并在绿色和白光通道并拍照记录,细胞放大倍数为20×。
1.7 实时定量PCR(RT-qPCR)采用Trizol裂解法提取细胞的总RNA,并反转录为cDNA,用于实时定量PCR,反转录体系20 μL:10 μL反转录酶,5 μL DEPC水,5 μL RNA。反应程序:37 ℃ 15 min,82 ℃ 5 s。RT-qPCR的反应体系(10 μL):5 μL SYBR Permix Ex TaqⅡ,0.5 μL上游引物,0.5 μL下游引物,3 μL DEPC水和1 μL cDNA。反应程序:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火和延伸34 s,共40个循环,同时进行熔解曲线分析,采用2-ΔΔCt方法,计算目的基因的相对表达量并进行分析。引物序列见表 2。
|
|
表 2 RT-qPCR引物序列 Table 2 RT-qPCR primer sequences |
MA-104/D1133L和MA-104细胞以每孔1×105细胞量接种于12孔板,感染ASFV(MOI=1.5),不同时间点收取蛋白,用PBS洗涤后加入100 μL 1×loading蛋白上样缓冲液裂解细胞,取20 μL蛋白上样量进行SDS-PAGE,电泳结束后用100 V恒压转膜1.5 h,用5%的脱脂奶粉室温封闭2.5 h,加入对应D1133L单克隆抗体和p72多克隆抗体,4 ℃过夜孵育,加入山羊抗鼠和山羊抗兔(1∶5 000) 室温孵育2 h,用ECL显色液全自动化学发光成像分析。
1.9 数据分析用GraphPad Prism软件进行统计学分析并作图,采用独立样本t检验进行显著性分析,*. P < 0.05说明数据间有显著差异,**.P < 0.01说明数据间有极显著差异。
2 结果 2.1 重组病毒ASFV vD1133Li的构建及鉴定为研究D1133L基因在病毒复制中的作用。首先构建了条件性缺失D1133L的重组病毒,构建策略如图 1A所示,同时针对该基因表达元件设计了内源性检测引物和外源性检测引物,病毒纯净性检测结果如图 1B所示,结果表明在无IPTG的条件下,利用内源性检测引物LP3056/3057检测基因组,i130#1和i130#2无法检测到D1133L相关条带;利用外源性检测引物LP2918/3057检测大肠杆菌阻遏元件,WT检测不到相关条带,说明成功构建条件性诱导D1133L缺失的重组病毒,该重组病毒命名为ASFV vD1133Li。

|
A.重组病毒vD1133Li基因组构建策略图;B.重组病毒vD1133Li基因组核酸检测图 A. Genome construction strategy genomic structure of recombinant virus vD1133Li; B. Nucleic acid map of recombinant virus vD1133Li genome 图 1 ASFV重组病毒vD1133Li构建及鉴定 Fig. 1 Construction and identification of ASFV recombinant virus vD1133Li |
为进一步明确重组病毒vD1133Li感染PAM细胞后病毒的复制差别。条件性缺失重组病毒vD1133Li感染PAM细胞,48 hpi后荧光显微镜观察,结果表明在IPTG(1.5 mmol·L-1)存在时荧光数量明显增多,当D1133L基因缺失后,ASFV复制能力明显减弱。
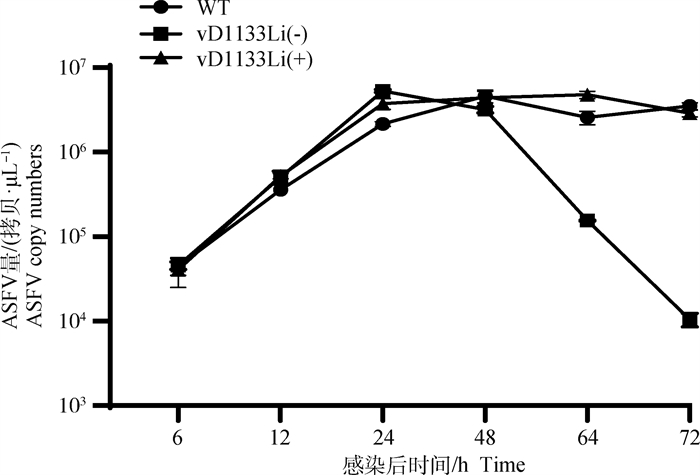
2.3 重组病毒ASFV vD1133Li的生长特性为明确探究D1133L缺失对ASFV复制的影响,在存在或不存在IPTG的情况下,分析了重组病毒vD1133Li的生长曲线,如图 3C所示,在添加IPTG(1.5 mmol·L-1)诱导表达D1133L蛋白,重组病毒vD1133Li(+)和亲本毒株的生长曲线相似,而在IPTG不存在,即D1133L不表达,重组病毒vD1133Li(-)在48 hpi后复制明显低于亲本毒株。以上结果表明D1133L基因对ASFV复制至关重要。

|
存在IPTG[(vD1133Li(+)]或不存在IPTG[vD1133Li(-)]的情况下,重组病毒vD1133Li感染PAMs,感染48 h后,荧光显微镜观察 With or without IPTG, the recombinant virus vD1133Li infected single layer of PAMs, and fluorescence was observed with fluorescence microscope on the 48 hpi 图 2 重组病毒vD1133Li感染PAM细胞(20×) Fig. 2 Fluorescent phenotype of recombinant virus vD1133Li(20×) |
|
存在IPTG[vD1133Li(+)]或不存在IPTG[vD1133Li(-)]的情况,用vD1133Li病毒感染PAMs。在指定的感染时间内,测定每个样品的病毒拷贝数,亲代GS/CN2018 (WT)感染作为对照 PAMs were infected with vD1133Li virus in the presence or absence of IPTG (vD1133Li(+)) or in the absence of IPTG (vD1133Li(-)). During the indicated infection time, the viral copy number of each sample was determined, and parental GS/CN2018 (WT) infection served as a control 图 3 重组病毒vD1133Li与亲本毒株的生长曲线 Fig. 3 Growth curve of recombinant virus vD1133Li and parent strain |
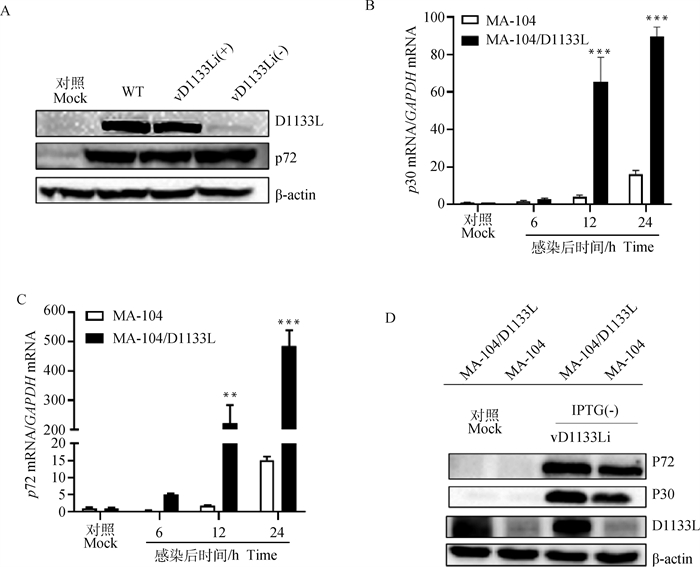
为检测D1133L蛋白的诱导表达,Western blot分析了感染亲本ASFV或重组vD1133Li的MA-104细胞在存在和不存在IPTG(1.5 mmol·L-1)情况下的细胞裂解液。如图 4A所示,D1133L在亲本病毒感染和在诱导剂IPTG存在下生长的重组病毒vD1133Li,表达水平相似。在没有IPTG诱导的情况下,重组vD1133Li几乎检测不到D1133L蛋白表达。作为对照组,p72的表达水平在所有感染条件下是一致的。为进一步证明D1133L对病毒复制的作用,将重组毒株vD1133Li在IPTG不存在(D1133L不表达)的情况下,感染稳定表达D1133L的MA-104细胞系MA-104/D1133L,在不同时间点收取样品,利用RT-qPCR、Western blot检测了ASFV p30、p72的转录水平(图 4B和4C)和蛋白水平(图 4D),结果表明在不存在IPTG的条件下,重组病毒在MA-104/D1133L细胞的复制能力显著高于野生型MA-104细胞。综上所述,重组vD1133Li的病毒复制能力与D1133L相关,进一步证明D1133L对病毒复制是必须基因。
|
A.D1133L蛋白的诱导表达,在IPTG存在或不存在的条件下,用亲本GN/CS2018株(WT)和重组毒株vD1133Li病毒(MOI= 1.5)感染MA-104细胞,在36 hpi时,用抗病毒蛋白D1133L和p72的抗体进行免疫印迹分析;B、C. vD1133Li病毒感染MA-104/D1133L细胞和MA-104细胞ASFV p30和p72转录水平表达;D. vD1133Li病毒感染MA-104/D1133L细胞ASFV p30、p72和D1133L蛋白水平表达 A. Induced expression of D1133L protein, in the presence or absence of IPTG, MA-104 cells were infected with parent GN/CS2018 strain (WT) and recombinant vD1133Li virus (MOI=1.5), at 36 hPI, Western blot analysis was performed with antibodies to D1133L and P72; B, C. Transcription of ASFV p30 and p72 in MA-104/D1133L cells and MA-104 cells infected by vD1133Li virus; D. Expression of ASFVp30, P72 and D1133L proteins in MA-104/D1133L cells infected by B-C vD1133Li virus 图 4 D1133L对ASFV复制至关重要 Fig. 4 ASFV protein D1133L is essential for virus replication |
ASFV编码的病毒蛋白较多,为验证基因功能,采用CRISPR/Cas9技术或者同源重组技术缺失单个和多个病毒毒力基因,在取得毒力减弱的同时,也可验证基因功能;而对于病毒存活的必需基因,用上述方法无法获得敲除毒株。研究采用CRISPR/Cas9技术构建缺失毒力基因的重组毒株在猪体内的评价研究为疫苗的研发提供有利的基础[23-24],本文利用大肠杆菌Lac阻遏操作系统实现目的基因的条件性敲除[21, 25],探究病毒编码的基因功能,为ASFV致病机制的研究和相关防控产品研发提供依据[26-27]。
本文利用乳糖阻遏操作系统实现目的基因的条件性敲除,构建了条件性敲除D1133L蛋白的ASFV重组毒株vD1133Li,在PAM细胞,观察了重组病毒vD1133Li的感染状态,测定了重组毒株vD1133Li在IPTG存在的条件下和亲本毒株CN/GS2018在PAM细胞中的生长特性。利用稳定表达D1133L的MA-104细胞系MA-104/D1133L感染vD1133Li,与野生型MA-104细胞相比,在没有IPTG的条件下,稳定表达D1133L的MA-104细胞中ASFV p30和p72的表达量显著高于野生型MA-104,证实D1133L蛋白对病毒复制是至关重要的。针对ASFV复制过程中利用病毒蛋白靶点来设计抗病毒药物引起大家关注,比如DNA结合蛋白pA104R在ASFV基因组包装中的作用及作为疫苗和药物开发的新靶点[28-29];ASFV编码的基因S273R具有sumo-1特异性蛋白酶和腺病毒蛋白酶的保守催化残基特征,针对ASFV pS273R蛋白酶的小分子化合物靶向抑制剂,通过用一种小分子抑制剂阻断pS273R蛋白酶的活性来潜在抑制ASFV复制[30]。因此本研究证实的D1133L基因功能,为针对D1133L设计与之结合的小分子化合物来抑制ASFV复制的抗病毒药物研发提供了新的研究策略。
4 结论本次研究首次成功构建了条件性诱导缺失D1133L的ASFV重组病毒vD1133Li,利用ASFV重组病毒vD1133Li感染PAM细胞和稳定表达D1133L的MA-104细胞,研究了重组病毒增殖特性,明确了D1133L对ASFV复制至关重要,此研究结果为探究D1133L作用的分子机制和基因缺失ASFV疫苗株的研发提供关键的生物学材料和新的研发思路。
| [1] |
PENRITH M L, BASTOS A D, ETTER E M C, et al. Epidemiology of African swine fever in Africa today: Sylvatic cycle versus socio-economic imperatives[J]. Transbound Emerg Dis, 2019, 66(2): 672-686. DOI:10.1111/tbed.13117 |
| [2] |
GAUDREAULT N N, RICHT J A. Subunit vaccine approaches for African swine fever virus[J]. Vaccines, 2019, 7(2): 56. DOI:10.3390/vaccines7020056 |
| [3] |
KARGER A, PÉREZ-NÚÑEZ D, URQUIZA J, et al. An update on African swine fever virology[J]. Viruses, 2019, 11(9): 864. DOI:10.3390/v11090864 |
| [4] |
DIXON L K, SUN H, ROBERTS H. African swine fever[J]. Antiviral Res, 2019, 165: 34-41. DOI:10.1016/j.antiviral.2019.02.018 |
| [5] |
DIXON L K, STAHL K, JORI F, et al. African swine fever epidemiology and control[J]. Annu Rev Anim Biosci, 2020, 8: 221-246. DOI:10.1146/annurev-animal-021419-083741 |
| [6] |
DIXON L K, CHAPMAN D A G, NETHERTON C L, et al. African swine fever virus replication and genomics[J]. Virus Res, 2013, 173(1): 3-14. DOI:10.1016/j.virusres.2012.10.020 |
| [7] |
KOONIN E V, YUTIN N. Evolution of the large nucleocytoplasmic DNA viruses of eukaryotes and convergent origins of viral gigantism[J]. Adv Virus Res, 2019, 103: 167-202. |
| [8] |
ANDRÉS G, CHARRO D, MATAMOROS T, et al. The cryo-EM structure of African swine fever virus unravels a unique architecture comprising two icosahedral protein capsids and two lipoprotein membranes[J]. J Biol Chem, 2020, 295(1): 1-12. DOI:10.1074/jbc.AC119.011196 |
| [9] |
WANG N, ZHAO D M, WANG J L, et al. Architecture of African swine fever virus and implications for viral assembly[J]. Science, 2019, 366(6465): 640-644. DOI:10.1126/science.aaz1439 |
| [10] |
ALEJO A, MATAMOROS T, GUERRA M, et al. A proteomic atlas of the African swine fever virus particle[J]. J Virol, 2018, 92(23): e01293-18. |
| [11] |
RODRÍGUEZ J M, SALAS M L. African swine fever virus transcription[J]. Virus Res, 2013, 173(1): 15-28. DOI:10.1016/j.virusres.2012.09.014 |
| [12] |
CACKETT G, SYKORA M, WERNER F. Transcriptome view of a killer: African swine fever virus[J]. Biochem Soc Trans, 2020, 48(4): 1569-1581. DOI:10.1042/BST20191108 |
| [13] |
SUAREZ C, ANDRES G, KOLOVOU A, et al. African swine fever virus assembles a single membrane derived from rupture of the endoplasmic reticulum[J]. Cell Microbiol, 2015, 17(11): 1683-1698. DOI:10.1111/cmi.12468 |
| [14] |
SALAS M L, ANDRÉS G. African swine fever virus morphogenesis[J]. Virus Res, 2013, 173(1): 29-41. DOI:10.1016/j.virusres.2012.09.016 |
| [15] |
张婷, 申超超, 杨博, 等. 非洲猪瘟病毒解旋酶结构与功能研究进展[J]. 中国兽医科学, 2021, 51(2): 135-143. ZHANG T, SHEN C C, YANG B, et al. Research advances on the structure and function of African swine fever virus helicases[J]. Chinese Veterinary Science, 2021, 51(2): 135-143. (in Chinese) |
| [16] |
YÁÑEZ R J, RODRÍGUEZ J M, BOURSNELL M, et al. Two putative African swine fever virus helicases similar to yeast 'DEAH' pre-mRNA processing proteins and vaccinia virus ATPases D11L and D6R[J]. Gene, 1993, 134(2): 161-174. DOI:10.1016/0378-1119(93)90090-P |
| [17] |
侯景, 申超超, 张大俊, 等. 非洲猪瘟病毒解旋酶D1133L基因序列分析、蛋白结构预测及亚细胞定位[J]. 畜牧兽医学报, 2021, 52(7): 1953-1962. HOU J, SHEN C C, ZHANG D J, et al. Gene sequence analysis, protein structure prediction and subcellular localization of African swine fever virus helicase D1133L[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(7): 1953-1962. (in Chinese) |
| [18] |
MENG X Z, EMBRY A, ROSE L, et al. Vaccinia virus A6 is essential for virion membrane biogenesis and localization of virion membrane proteins to sites of virion assembly[J]. J Virol, 2012, 86(10): 5603-5613. DOI:10.1128/JVI.00330-12 |
| [19] |
GARCÍA-ESCUDERO R, ANDRÉS G, ALMAZÁN F, et al. Inducible gene expression from African swine fever virus recombinants: analysis of the major capsid protein p72[J]. J Virol, 1998, 72(4): 3185-3195. DOI:10.1128/JVI.72.4.3185-3195.1998 |
| [20] |
ANDRÉS G, GARCÍA-ESCUDERO R, VIÑUELA E, et al. African swine fever virus structural protein pE120R is essential for virus transport from assembly sites to plasma membrane but not for infectivity[J]. J Virol, 2001, 75(15): 6758-6768. DOI:10.1128/JVI.75.15.6758-6768.2001 |
| [21] |
MATAMOROS T, ALEJO A, RODRÍGUEZ J M, et al. African swine fever virus protein pe199l mediates virus entry by enabling membrane fusion and core penetration[J]. mBio, 2020, 11(4): e00789-20. |
| [22] |
PORTUGAL R S, BAUER A, KEIL G M. Selection of differently temporally regulated African swine fever virus promoters with variable expression activities and their application for transient and recombinant virus mediated gene expression[J]. Virology, 2017, 508: 70-80. DOI:10.1016/j.virol.2017.05.007 |
| [23] |
RATHAKRISHNAN A, CONNELL S, PETROVAN V, et al. Differential effect of deleting members of African swine fever virus multigene families 360 and 505 from the genotype Ⅱ Georgia 2007/1 isolate on virus replication, virulence, and induction of protection[J]. J Virol, 2022, 96(6): e01899-21. |
| [24] |
RATHAKRISHNAN A, REIS A L, GOATLEY L C, et al. Deletion of the K145R and DP148R genes from the virulent ASFV Georgia 2007/1 isolate delays the onset, but does not reduce severity, of clinical signs in infected pigs[J]. Viruses, 2021, 13(8): 1473. DOI:10.3390/v13081473 |
| [25] |
RODRÍGUEZ I, NOGAL M L, REDREJO-RODRíGUEZ M, et al. The African swine fever virus virion membrane protein pE248R is required for virus infectivity and an early postentry event[J]. J Virol, 2009, 83(23): 12290-12300. DOI:10.1128/JVI.01333-09 |
| [26] |
TURLEWICZ-PODBIELSKA H, KURIGA A, NIEMYJSKI R, et al. African swine fever virus as a difficult opponent in the fight for a vaccine-current data[J]. Viruses, 2021, 13(7): 1212. DOI:10.3390/v13071212 |
| [27] |
TEKLUE T, SUN Y, ABID M, et al. Current status and evolving approaches to African swine fever vaccine development[J]. Transbound Emerg Dis, 2020, 67(2): 529-542. DOI:10.1111/tbed.13364 |
| [28] |
URBANO A C, FERREIRA F. Role of the DNA-binding protein pA104R in ASFV genome packaging and as a novel target for vaccine and drug development[J]. Vaccines, 2020, 8(4): 585. DOI:10.3390/vaccines8040585 |
| [29] |
LIU R L, SUN Y P, CHAI Y, et al. The structural basis of African swine fever virus pA104R binding to DNA and its inhibition by stilbene derivatives[J]. Proc Natl Acad Sci U S A, 2020, 117(20): 11000-11009. DOI:10.1073/pnas.1922523117 |
| [30] |
LIU B Z, CUI Y S, LU G, et al. Small molecule inhibitor E-64 exhibiting the activity against African swine fever virus pS273R[J]. Bioorg Med Chem, 2021, 35: 116055. DOI:10.1016/j.bmc.2021.116055 |
(编辑 孟培)



