2. 中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室OIE/国家口蹄疫参考实验室, 兰州 730046
2. OIE/National Foot and Mouth Disease Reference Laboratory, State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(foot-and-mouth disease virus,FMDV)感染引起的一种急性、热性、高度接触传染性疾病,主要感染猪、牛、羊等偶蹄动物[1]。FMD被世界动物卫生组织列为必须报告的传染病,我国规定为一类动物疫病,对动物贸易和国家经济构成持续的威胁。FMDV属于小RNA病毒科(Picornaviridae),口蹄疫病毒属(Aphthovirus),有7个血清型(O、A、C、SAT1、SAT2、SAT3和Asia1型),不同的血清型之间互不交叉保护[2]。由于FMDV易感动物种类繁多、病原变异大、免疫逃逸和免疫抑制等因素,因此很难控制和根除[3]。
FMDV在与宿主免疫系统进行长期斗争的过程中,已经进化出逃避宿主免疫应答的多种机制[4-8]。T细胞在机体抵御病毒入侵、免疫监视和抗肿瘤免疫等过程中发挥着至关重要的作用,其增殖能力和效应功能的降低均能引起宿主免疫抑制[9-11]。有研究表明,猪感染FMDV后1 d(1 dpi),其外周血T细胞对有丝分裂原刀豆蛋白A(concanavalin A, ConA)刺激的增殖显著下降,并且这种免疫抑制状态持续到10 dpi,为FMDV感染早期在体内的快速复制和传播提供了绝佳的机会和环境[12-13]。白细胞介素-10(interleukin-10, IL-10)是一种多细胞源、多功能的细胞因子,其几乎可以由所有免疫细胞产生[14]。IL-10增高是FMDV感染猪、牛和小鼠等易感动物后常见的特征之一,其与FMDV引起的免疫抑制密切相关[15-17]。研究表明,从FMDV感染猪的外周血中分离树突状细胞(dendritic cells, DCs),将其与未感染猪的T细胞进行体外混合培养发现,DCs可以产生大量的IL-10,体外抗体阻断IL-10可以恢复T细胞的增殖,提示IL-10在该过程中具有重要的作用[15]。然而,增高的IL-10在体内是否影响外周血T细胞的增殖尚不清楚。IFN-γ、TNF-α和IL-2作为免疫应答重要的细胞因子,其有助于清除进入细胞内的病毒。研究表明,T细胞表达IFN-γ、TNF-α和IL-2的水平在一定程度上反映T细胞的效应功能[18-20]。目前,FMDV对外周血T细胞效应功能的影响未见报道,并且IL-10是否影响FMDV感染小鼠外周血T细胞的效应功能也不清楚。作者实验室最近研究发现,FMDV能引起小鼠血清中IL-10显著增高,其通过调控淋巴细胞减少症进而造成免疫抑制[17]。因此,本研究的目的是探究IL-10对FMDV感染小鼠外周血T细胞增殖及其表达IFN-γ、TNF-α和IL-2的影响。
1 材料与方法 1.1 材料1.1.1 实验动物 C57/BL6小鼠(4~5周龄)购于中国农业科学院兰州兽医研究所实验动物中心。IL-10敲除(IL-10-/-)的C57/BL6小鼠购买于赛业生物科技有限公司(广州,中国)。
1.1.2 病毒 FMDV O血清型(O/BY/CHA/2010)毒株,来自中国农业科学院兰州兽医研究所国家口蹄疫参考实验室。
1.1.3 主要试剂及仪器 小鼠外周血淋巴细胞分离试剂盒(天津灏洋,KITLTS1092);PrimeScriptTM RT Master Mix (TaKaRa,RR036A);Premix Ex TaqTM(Probe qPCR)(TaKaRa,RR390A);TRIzoL(InvitrogenTM,10296028);CCK-8检测试剂盒(日本同仁,CK04);刀豆蛋白(ConA)(Sigma,11028-71-0);Cell Activation Cocktail (with Brefeldin A)(Biolegend, 423303);eBioscienceTM Foxp3/转录因子染色缓冲液套件(InvitrogenTM,00-5523-00);APC anti-mouse TNF-α (BD,MCA500APC);TNF-α isotype control(Biolegend,400411);APC anti-mouse IFN-γ (Biolegend,100307);IFN-γ isotype control(Biolegend,400411);PE/Cy7 anti-mouse IL-2 (Biolegend,505810);IL-2 isotype control(Biolegend,400617);Percp anti-mouse CD8 (Biolegend,100732);FITC anti-mouse CD4 (BD,MCA4635F);TruStain FcXTM PLUS anti-mouse CD16/32(Biolegend,156604)。CytoFLEX流式细胞分析仪(Beckman Coulter Inc., 上海, 中国);qPCR仪(Agilent Technologies, Stratagene M×3005P),超微量分光光度计(GE,NanoVue Plus);酶标仪(Thermo Scientific,Varioskan LUX);细胞计数仪(Countstar,IC1000)。
1.2 方法1.2.1 小鼠攻毒与对照试验 小鼠颈背部皮下感染FMDV(0.05 mL),每只小鼠5×105.5 TCID50,这是导致4~6周龄C57BL/6小鼠死亡的最低感染剂量[17]。皮下注射0.05 mL的磷酸盐缓冲液(phosphate buffered saline, PBS),作为对照组。所有FMDV感染性试验均在中国农业科学院兰州兽医研究所动物生物安全防护三级实验室(ABSL-3)进行。动物试验严格按照《中华人民共和国动物伦理程序和指南》的规定进行,并经过中国农业科学院兰州兽医研究所动物伦理委员会批准后开展本研究中的相关动物试验。
1.2.2 样本收集 随机分配5只和15只小鼠作为对照组和感染组,感染后每隔12 h观察并记录小鼠的临床症状和存活率。根据FMDV感染小鼠的存活曲线,随机分配9和72只小鼠分别作为对照组和感染组(n=9),在不同时间点[12、24、36、48和60 hpi(hours post infection)](采集对照小鼠和FMDV感染小鼠的全血,分离血清,检测血清中病毒RNA载量。随机分配9和60只小鼠分别作为对照组和感染组(n=9),在不同时间点(12、24、36和48 hpi)采集对照小鼠和FMDV感染小鼠的外周血,用于检测外周血T细胞的增殖。随机分配9和24只小鼠分别作为对照组和感染组(n=9),在48 hpi,采集每组小鼠的外周血,用于检测外周血T细胞表达的细胞因子。随机分配9、24和24只小鼠分别作为对照组、FMDV感染同型对照组和FMDV感染抗IL-10受体(IL-10R)组(n=9)。同样的,随机分配9、24和24只小鼠分别作为对照组和FMDV感染野生型组和FMDV感染IL-10-/-组(n=9)。在48 hpi,采集每组小鼠的外周血,用于检测外周血T细胞增殖及其表达的细胞因子。
1.2.3 体内阻断IL-10/IL-10R信号 根据先前的研究报道[17],在FMDV感染的第-1天和第0天,小鼠腹腔注射200 μg in vivo anti-mouse IL-10R(clone 1B1.3A)用于体内阻断IL-10/IL-10R的信号转导;同样地,注射相同剂量的in vivo rat IgG1 isotype control(clone HRPN)用于小鼠的同型对照。
1.2.4 RNA提取及cDNA的合成 取100 μL血清加入700 μL TRIzol,涡旋后室温静置5 min。加入200 μL氯仿,涡旋混匀后冰上静置5 min。4 ℃ 12 000 r·min-1离心15 min,取上清,加入等体积的异丙醇,冰上静置10 min。4 ℃ 12 000 r·min-1离心15 min;弃掉上清,加入1 mL 70%的DEPC无水乙醇。4 ℃ 12 000 r·min-1离心10 min,弃上清,自然晾干,定量RNA浓度。根据PrimeScriptTM RT Master Mix试剂盒的说明书反转录成cDNA,-20 ℃保存。
1.2.5 RT-qPCR检测FMDV 检测FMDV的方法采用先前的报道,该方法的靶基因是FMDV 3D基因[21]。引物序列如下:3D sense Primer: 5′-ACTGGGTTTTAYAAACCTGTGATG-3′,3D anti-sense Primer: 5′-TCAACTTCTCCTGKAT GGTCCCA-3′,Probe: 5′-ATCCTCTCCTTTGCACGC-3。上述引物均由生工生物工程(上海)股份有限公司合成。反应体系:Premix Ex TaqTM(Probe qPCR)12.5 μL,上、下游引物各0.5 μL,Probe引物1 μL模板2 μL,用Rnase free H2O补齐到25 μL。反应条件为:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30,共40个循环。
1.2.6 CCK-8检测T细胞的增殖 根据小鼠外周血淋巴细胞分离试剂盒的说明书,分别从对照小鼠和FMDV感染小鼠(12、24、36和48 hpi) 的外周血中分离小鼠的外周血单个核细胞(PBMC)。用含有10% FBS、1%双抗(青霉素和链霉素)和5 μg·mL-1 ConA(用于刺激T细胞增殖)的RPMI-1640培养基分别重悬对照小鼠的PBMC和FMDV感染小鼠的PBMC,通过细胞计数仪将PBMC的浓度均调整为1×105 cells·mL-1。向平底96孔微量细胞培养板中接种100 μL的细胞悬液,每孔约为1×104个细胞。37 ℃,5% CO2的细胞培养箱中培养72 h,孵育结束前4 h每孔加入10 μL CCK-8试剂(含有水溶性四唑盐——WST-8,线粒体中的脱氢酶可以还原WST-8为黄色甲臜,甲臜的量与活细胞数量呈相关性),轻轻混匀后继续培养至72 h。酶标仪检测波长为450 nm的OD值(A)。根据CCK-8检测试剂盒的说明书,计算细胞的增殖率(%)。即,增殖率=(AConA-A空白)/(A对照-A空白)。AConA表示具有细胞、CCK-8溶液和ConA的孔的OD值;A空白表示具有培养基和CCK-8溶液而没有细胞的孔的OD值;A对照表示具有细胞、CCK-8溶液而没有ConA的孔的OD值。
1.2.7 流式细胞术检测CD4+和CD8+T细胞表达IFN-γ、TNF-α和IL-2 分别从对照小鼠和FMDV感染小鼠(48 hpi)的外周血中分离小鼠的PBMC。向24孔细胞培养板接种细胞悬液,900 μL·孔-1,每孔约含有1×106个细胞;将含有Cell Activation Cocktail(with Brefeldin A)的100 μL RPMI-1640培养基加入到细胞培养板中,使刺激体系为1 mL。将培养板放入培养箱刺激6 h,刺激结束后收集细胞并以350 g离心5 min,弃上清液。PBS洗3次后,用100 μL染色缓冲液重悬细胞,加入2 μL anti-mouse CD16/32冰上静置10 min以封闭FC受体;之后加入FITC anti-mouse CD4和Percp anti-mouse CD8抗体进行细胞表面分子的标记,冰上避光孵育20 min,PBS洗3次。
将Foxp3/转录因子缓冲液套件中的10×破膜液配制成使用浓度。在最后一次洗涤后,保留约100 μL残余体积,并轻轻的重悬细胞。加入200 μL IC固定液室温下避光孵育40 min。350 g离心5 min,弃上清。加入200 μL破膜液,350 g离心5 min,弃上清。用100 μL 1×破膜液重悬细胞,加入2 μL anti-mouse CD16/32抗体避光冰上静置10 min以封闭FC受体。之后,分别加入2 μL的APC anti-mouse IFN-γ、APC anti-mouse TNF-α和PE/Cy7 anti-mouse IL-2抗体4 ℃避光孵育20 min。设置空白管、单染管和同型对照管(FMO)。PBS洗3次后,过滤,上机检测。
1.2.8 数据分析 使用GraphPad Prism 8软件(GraphPad)进行unpaired t检验分析组间差异的显著性。本文中,*、**、***和****表示有统计学差异显著,P值分别 < 0.05、0.01、0.001和0.000 1,而ns表示统计学上差异不显著,P值>0.05。数据按“x±s”表示。
2 结果 2.1 FMDV感染小鼠的生存曲线与血清中病毒RNA载量的测定FMDV感染4~5周龄的C57BL/6小鼠最初表现嗜睡、精神沉郁和厌食,这些症状在本研究中被判定为轻微的临床症状。随后小鼠出现呼吸窘迫、毛发皱褶和驼峰姿势,这些症状被判定为严重的临床症状。FMDV感染小鼠在36 hpi开始出现死亡,急性感染导致小鼠在72 hpi内全部死亡(图 1A)。观察发现,FMDV感染小鼠在表现出呼吸窘迫等严重临床症状后的4~6 h内死亡。FMDV感染小鼠在36、48、60和72 hpi的存活率分别为86.67% (13/15)、53.30%(8/15)、13.33%(2/15)和0(0/15)(图 1A)。以上结果证实,FMDV能致死C57BL/6小鼠。接下来,通过RT-qPCR分别测定FMDV感染小鼠在12、24、36、48和60 hpi血清中病毒RNA水平。结果显示,最早在36 hpi能在FMDV感染小鼠的血清中检测到病毒RNA序列,其血清病毒RNA载量约为(2.41±1.30)×107 copies·100 μL-1;在60 hpi,血清中病毒RNA载量最高约为4.31×108 copies·100 μL-1,且该小鼠表现出呼吸窘迫等严重的临床症状(图 1B)。小鼠出现临床症状的时间与血清中检测到FMDV RNA的时间一致,并且当血清中的病毒RNA载量较高时,其相应的临床症状更为严重。因此,FMDV感染小鼠的疾病进程与血清中病毒载量有关。

|
A. 对照小鼠(n=5)和FMDV感染小鼠(n=15)的生存曲线;B. 对照小鼠和FMDV感染小鼠在12、24、36、48和60 hpi的血清中FMDV RNA载量(n=9) A. The survival curve of mock-mice (n=5) and FMDV-infected mice (n=15); B. FMDV RNA loads in the sera of mock-mice and FMDV-infected mice at 12, 24, 36, 48, 60 hpi (n=9) 图 1 FMDV感染小鼠的存活曲线和血清中病毒的RNA载量 Fig. 1 The survival curve and viral RNA loads in the sera of FMDV-infected mice |
CCK-8检测对照小鼠和FMDV感染小鼠外周血T细胞增殖的情况。结果表明,与对照小鼠[细胞增殖率(2.99±0.17)%]相比,FMDV感染小鼠在12、24、36和48 hpi,外周血T细胞的增殖能力均显著下降,细胞增殖率分别为(2.37±0.15)%(P < 0.05)、(2.07±0.16)%(P < 0.01)、(2.41±0.13)%(P < 0.05)和(2.08±0.15)%(P < 0.01)(图 2)。由此可见,FMDV能抑制小鼠外周血T细胞增殖。

|
图 2 CCK-8检测对照小鼠和FMDV感染小鼠外周血T细胞的增殖 Fig. 2 The proliferation of T cells in peripheral blood of mock-mice and FMDV-infected mice was detected by CCK-8 |
利用流式细胞术检测对照小鼠和FMDV感染小鼠中CD4+T细胞表达TNF-α、IFN-γ和IL-2的能力。结果显示,与对照小鼠相比,FMDV感染小鼠外周血中CD4+T细胞表达TNF-α的水平显著降低[对照组vs感染组:(33.06±2.11)% vs(21.43± 2.02)%,P < 0.01](图 3)。与对照小鼠相比,FMDV感染小鼠的外周血CD4+ T细胞表达IFN-γ的水平有降低趋势,但差异不显著[对照组vs感染组:(36.16±2.82)% vs (32.72±3.85)%,P=0.482 3] (图 3)。与对照小鼠相比,FMDV感染小鼠的外周血CD4+ T细胞表达IL-2的水平显著降低[对照组vs感染组:(16.78±1.25)% vs(9.70±1.36)%,P < 0.01](图 3)。以上结果表明,FMDV能抑制小鼠外周血CD4+ T细胞表达TNF-α和IL-2。

|
图 3 流式细胞术检测对照小鼠和FMDV感染小鼠(48 hpi)的外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2 Fig. 3 The expressions of TNF-α, IFN-γ and IL-2 of CD4+ T cells in peripheral blood from mock-mice and FMDV-infected mice (48 hpi) was detected by flow cytometry |
同样地,流式细胞术检测CD8+ T细胞表达TNF-α、IFN-γ和IL-2的水平。结果表明,与对照小鼠相比,FMDV感染小鼠外周血CD8+ T细胞表达TNF-α的水平显著降低[对照组vs感染组:(23.29±1.79)% vs(16.63±1.32)%,P < 0.01](图 4)。与对照小鼠相比,FMDV感染小鼠(48 hpi) 外周血CD8+ T细胞表达IFN-γ的水平也显著降低[对照组vs感染组:(93.12±1.86)% vs(75.30±2.34)%,P < 0.000 1](图 4)。与对照小鼠相比,FMDV感染小鼠(48 hpi)的外周血CD8+ T细胞表达IL-2的水平显著降低[对照组vs感染组:(22.57±1.38)% vs(12.13±0.92)%,P < 0.000 1](图 4)。以上结果表明,FMDV感染抑制小鼠的外周血CD8+ T细胞表达TNF-α、IFN-γ和IL-2。

|
图 4 流式细胞术检测对照小鼠和FMDV感染小鼠(48 hpi)的外周血CD8+ T细胞表达TNF-α、IFN-γ和IL-2 Fig. 4 The expressions of TNF-α, IFN-γ and IL-2 of CD8+ T cells in peripheral blood from mock-mice and FMDV-infected mice (48 hpi) was detected by flow cytometry |
接下来,采用in vivo anti-mouse IL-10R抗体和IL-10-/-小鼠,进一步探究IL-10对FMDV感染小鼠外周血T细胞增殖的影响。结果表明,与FMDV感染同型对照组的小鼠相比[增殖率:(1.95 ± 0.19)%],FMDV感染抗IL-10R抗体处理小鼠的T细胞增殖显著增高[增殖率:(2.48 ± 0.15)%, P < 0.05](图 5A)。进一步分析发现,与FMDV感染野生型的小鼠相比[增殖率:(1.94 ± 0.18)%],FMDV感染IL-10-/-小鼠的T细胞增殖也显著增高[增殖率:(2.88 ± 0.21)%, P < 0.01](图 5B)。以上的结果表明,体内阻断IL-10/IL-10R信号或敲除IL-10有助于恢复FMDV感染小鼠外周血T细胞的增殖。

|
A. FMDV感染用In vivo rat IgG1同型对照处理的小鼠和用In vivo anti-mouse IL-10R抗体处理的小鼠的外周血T细胞的增殖(48 hpi);B. FMDV感染野生型小鼠和IL-10-/-小鼠的外周血T细胞的增殖(48 hpi) A. The proliferation of T cells in peripheral blood of mice treated with In vivo rat IgG1 isotype control and mice treated with In vivo anti-mouse IL-10R antibody following FMDV infection (48 hpi); B. The proliferation of T cells in peripheral blood of wild-type mice and IL-10-/- mice following FMDV infection (48 hpi) 图 5 FMDV感染体内阻断IL-10/IL-10R信号或敲除IL-10小鼠的外周血T细胞的增殖 Fig. 5 The proliferation of T cells in peripheral blood of mice treated with in vivo anti-mouse IL-10R and IL-10-/-mice after FMDV infection |
为了探究IL-10对FMDV感染小鼠外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2的影响。首先分析体内阻断IL-10/IL-10R信号是否影响FMDV感染小鼠外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2。结果表明,与FMDV感染同型对照组的小鼠相比,FMDV感染抗IL-10R抗体处理小鼠外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2的水平差异均不显著[TNF-α,Isotype vs IL-10R:(19.90±1.86)% vs (22.36±1.86)%,P=0.359 6;IFN-γ,Isotype vs IL-10R:(29.46±2.38)% vs (29.93±2.13)%,P=0.882 8;IL-2,Isotype vs IL-10R:(9.467±1.313)% vs(10.61±1.23)%,P=0.532 5](图 6A、C、E)。进一步分析发现,与FMDV感染野生型小鼠相比,FMDV感染IL-10-/-小鼠外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2的水平差异也均不显著[TNF-α,Wild type vs IL-10-/-:(19.93±1.44)% vs (22.38±2.01)%,P=0.337 4;IFN-γ,Wild type vs IL-10-/-:(30.13±2.49)% vs (30.32±2.41)%,P=0.957 2;IL-2,Wild type vs IL-10-/-:(10.46±1.16)% vs (10.58± 1.23)%,P=0.943 1](图 6B、D、F)。以上的结果表明,体内阻断IL-10/IL-10R信号或敲除IL-10对FMDV感染小鼠外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2无影响。
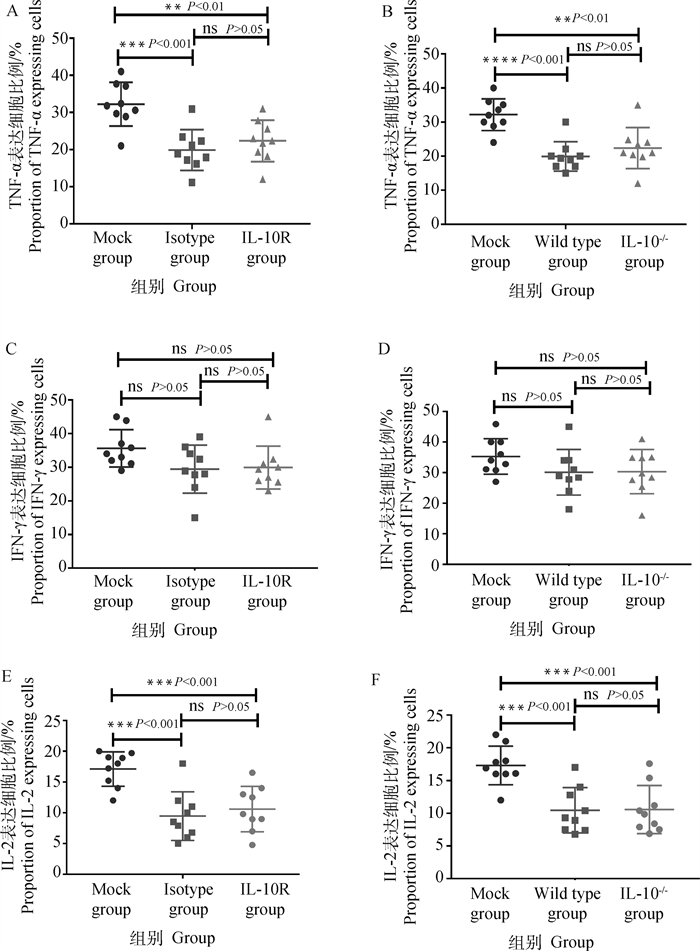
|
A、C、E. FMDV感染用in vivo rat IgG1同型对照处理的小鼠和用in vivo anti-mouse IL-10R抗体处理的小鼠的外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2(48 hpi);B、D、F. FMDV感染野生型小鼠和IL-10-/-小鼠的外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2(48 hpi) A, C, E. The expressions of TNF-α, IFN-γ and IL-2 of CD4+ T cells in peripheral blood of mice treated with in vivo rat IgG1 isotype control and mice treated with in vivo anti-mouse IL-10R antibody following FMDV infection (48 hpi); B, D, F. The expressions of TNF-α, IFN-γ and IL-2 of CD4+ T cells in peripheral blood of wild-type mice and IL-10-/- mice following FMDV infection (48 hpi) 图 6 FMDV感染体内阻断IL-10/IL-10R信号或敲除IL-10小鼠的外周血CD4+ T细胞表达TNF-α、IFN-γ和IL-2 Fig. 6 The expressions of TNF-α, IFN-γ and IL-2 of CD4+ T cells in peripheral blood of mice treated with in vivo anti-mouse IL-10R and IL-10-/-mice after FMDV infection |
同样地,首先分析体内阻断IL-10/IL-10R信号是否影响FMDV感染小鼠外周血CD8+ T细胞表达TNF-α、IFN-γ和IL-2。结果表明,与FMDV感染同型对照组的小鼠相比,FMDV感染抗IL-10R抗体处理小鼠的外周血CD8+T细胞表达TNF-α、IFN-γ和IL-2的水平差异均不显著[TNF-α,Isotype vs IL-10R:(14.36±1.51)% vs (15.12±1.53)%,P=0.725 5;IFN-γ,Isotype vs IL-10R:(82.49±1.96)% vs(82.52±1.85)%,P=0.990 3;IL-2,Isotype vs IL-10R:(12.14±1.20)% vs (15.30±1.22)%,P=0.084 0](图 7A、C、E)。进一步分析发现,与FMDV感染野生型小鼠相比,FMDV感染IL-10-/-小鼠外周血CD8+T细胞表达TNF-α、IFN-γ和IL-2的水平差异也不显著[TNF-α,Wild type vs IL-10-/-:(16.24±1.67)% vs (16.6±1.29)%,P=0.868 2;IFN-γ,Wild type vs IL-10-/-:(81.36±2.27)% vs (82.51±2.10)%,P=0.714 1;IL-2,Wild type vs IL-10-/-:(11.36±1.27)% vs (12.69±1.19)%,P=0.453 0](图 7B、D、F)。以上的结果表明,体内阻断IL-10/IL-10R信号或敲除IL-10对FMDV感染小鼠外周血CD8+ T细胞表达TNF-α、IFN-γ和IL-2无影响。

|
A、C、E. FMDV感染用in vivo rat IgG1同型对照处理的小鼠和用in vivo anti-mouse IL-10R抗体处理的小鼠的外周血CD8+ T细胞表达TNF-α、IFN-γ和IL-2(48 hpi);B、D、F. FMDV感染野生型小鼠和IL-10-/-小鼠的外周血CD8+ T细胞表达TNF-α、IFN-γ和IL-2(48 hpi)。 A, C, E. The expressions of TNF-α, IFN-γ and IL-2 of CD8+ T cells in peripheral blood of mice treated with in vivo rat IgG1 isotype control and mice treated with in vivo anti-mouse IL-10R antibody following FMDV infection (48 hpi); B, D, F. The expressions of TNF-α, IFN-γ and IL-2 of CD8+ T cells in peripheral blood of wild-type mice and IL-10-/- mice following FMDV infection (48 hpi) 图 7 FMDV感染体内阻断IL-10/IL-10R信号或敲除IL-10小鼠的外周血CD8+ T细胞表达TNF-α、IFN-γ和IL-2 Fig. 7 The expressions of TNF-α, IFN-γ and IL-2 of CD8+ T cells in peripheral blood of mice treated with in vivo anti-mouse IL-10R and IL-10-/-mice after FMDV infection |
T细胞在机体抵御病毒入侵、免疫监视和抗肿瘤免疫等过程中发挥着至关重要的作用[9-11]。其中,CD4+ T细胞活化后主要分化为Th1和Th2,分别参与机体的细胞免疫和体液免疫;CD8+T细胞是主要通过直接杀伤或诱导病毒感染的靶细胞凋亡发挥细胞免疫作用[10-11],CD4+和CD8+ T的数量和功能的改变直接影响机体免疫的状态[9-11]。作为重大动物疫病FMD的病原,FMDV感染能抑制猪的外周血T细胞增殖,其被认为是FMDV逃避宿主免疫应答造成免疫抑制的重要方式之一[12-13]。本研究证明,FMDV感染小鼠的外周血T细胞对ConA刺激的增殖显著降低,表明FMDV感染损伤小鼠的外周血T细胞的增殖能力。此外,FMDV感染对淋巴结或者脾脏中淋巴细胞增殖和相关细胞因子的表达的影响有待于进一步研究。有研究表明,FMDV感染猪会引起DCs表达的IL-10显著增高,体外抗体阻断IL-10能恢复T细胞增殖,提示IL-10在FMDV感染抑制T细胞增殖中具有重要的作用[15]。本研究结果证明,体内阻断IL-10/IL-10R信号或者敲除IL-10小鼠有助于恢复FMDV感染抑制外周血T细胞的增殖。最近的研究发现,阻断IL-6受体(IL-6R)可以通过恢复T细胞增殖等方式提高COVID-19患者外周血淋巴细胞的数量[22]。阻断IL-6R被作为重症COVID-19患者的治疗策略之一,如托利单抗、沙利单抗和西妥昔单抗等药物[23]。因此,阻断IL-10R可能为FMD新型防控产品的研发提供新的思路。
研究表明,T细胞表达IFN-γ、TNF-α和IL-2的能力在一定程度上反映T细胞的效应功能,其在抗病毒细胞免疫应答中发挥重要的作用[18-20]。IL-2通过与淋巴细胞表面IL-2R结合,促进T细胞增殖、分化及成熟,因而在机体细胞免疫中起到重要的调节作用[24]。IFN-γ在抗病毒感染诱导巨噬细胞活化和促进T细胞分化等方面起着不可或缺的作用。TNF-α主要由活化的巨噬细胞产生,在与靶细胞表面死亡受体结合后可以激活Caspase家族,诱导靶细胞凋亡,因而在抗病毒、抗肿瘤细胞免疫过程中发挥重要作用[25]。本研究首次揭示,FMDV感染抑制小鼠外周血CD4+和CD8+ T细胞表达IFN-γ、TNF-α和IL-2,其严重损害CD4+和CD8+ T细胞的效应功能,造成宿主的免疫抑制。
T细胞激活需要两种信号:第一信号由TCR识别APC表面的抗原肽-MHC复合物(p-MHC)所启动;第二信号由T细胞和APC间共信号分子的相互作用所启动[26]。共信号分子包括共刺激分子和共抑制分子,其在调节T细胞活化、亚群分化、效应功能和存活方面起着关键作用[27]。CD28与CD80/86的相互作用属于共刺激信号,是抗原刺激T细胞增殖和产生细胞因子必不可少的信号[26]。研究发现,IL-10可以通过抑制CD28刺激所诱导的酪氨酸磷酸化进而抑制T细胞的增殖[28]。另外,PD-1通过AKT、磷脂酰肌醇3-激酶(PI3K)、细胞外信号调节激酶(ERK)和磷脂酰肌醇磷脂酶C-γ(PLCγ)等信号通路抑制IFN-γ和IL-2的表达、抑制细胞增殖和促进细胞凋亡[29]。作者实验室最近的研究发现,FMDV感染能引起小鼠的外周血T细胞共抑制分子上调表达,包括CTLA-4、LAG-3、2B4和TIGIT,并且IL-10能调控这些共抑制分子的表达[17]。因此,IL-10是否通过共抑制分子调控T细胞增殖及其潜在的分子机制有待于进一步研究。体内阻断IL-10/IL-10R信号或者敲除IL-10不影响FMDV感染小鼠的外周血T细胞的表达效应分子,表明IL-10并不介导FMDV感染抑制外周血T细胞的表达IFN-γ、TNF-α和IL-2,推测存在其他潜在的因子调控这些免疫相关的细胞因子的表达。有必要进一步研究FMDV感染抑制T细胞增殖和抑制CD4+和CD8+ T细胞表达免疫相关细胞因子的分子机制。
4 结论本研究首次证明FMDV抑制小鼠外周血T细胞增殖及其表达效应功能相关的细胞因子IFN-γ、TNF-α和IL-2,体内阻断IL-10/IL-10R信号或者敲除IL-10不影响CD4+和CD8+T细胞表达IFN-γ、TNF-α和IL-2,但有助于恢复FMDV感染小鼠外周血T细胞的增殖。
| [1] |
JAMAL S M, BELSHAM G J. Foot-and-mouth disease: past, present and future[J]. Vet Res, 2013, 44(1): 116. DOI:10.1186/1297-9716-44-116 |
| [2] |
DOMINGO E, BARANOWSKI E, ESCARMIS C, et al. Foot-and-mouth disease virus[J]. Comp Immunol Microbiol Infect Dis, 2002, 25(5-6): 297-308. DOI:10.1016/S0147-9571(02)00027-9 |
| [3] |
GRUBMAN M J, BAXT B. Foot-and-mouth disease[J]. Clin Microbiol Rev, 2004, 17(2): 465-493. DOI:10.1128/CMR.17.2.465-493.2004 |
| [4] |
GRUBMAN M J, MORAES M P, DIAZ-SAN SEGUNDO F, et al. Evading the host immune response: how foot-and-mouth disease virus has become an effective pathogen[J]. FEMS Immunol Med Microbiol, 2008, 53(1): 8-17. DOI:10.1111/j.1574-695X.2008.00409.x |
| [5] |
李显, 张富东, 张中旺, 等. 口蹄疫病毒利用自身蛋白逃逸宿主天然免疫应答的研究进展[J]. 畜牧兽医学报, 2020, 51(11): 2622-2632. LI X, ZHANG F D, ZHANG Z W, et al. Recent advance on foot-and-mouth disease virus utilizes self-proteins to evade innate immunity response of host[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(11): 2622-2632. (in Chinese) |
| [6] |
KENUBIH A. Foot and mouth disease vaccine development and challenges in inducing long-lasting immunity: trends and current perspectives[J]. Vet Med (Auckl), 2021, 12: 205-215. |
| [7] |
YANG B, ZHANG X H, ZHANG D J, et al. Molecular mechanisms of immune escape for foot-and-mouth disease virus[J]. Pathogens, 2020, 9(9): 729. DOI:10.3390/pathogens9090729 |
| [8] |
RODRÍGUEZ-HABIBE I, CELIS-GIRALDO C, PATARROYO M E, et al. A comprehensive review of the immunological response against foot-and-mouth disease virus infection and its evasion mechanisms[J]. Vaccines (Basel), 2020, 8(4): 764. DOI:10.3390/vaccines8040764 |
| [9] |
ABUBAKAR M, MANZOOR S, AHMED A. Interplay of foot and mouth disease virus with cell-mediated and humoral immunity of host[J]. Rev Med Virol, 2018, 28(2): e1966. DOI:10.1002/rmv.1966 |
| [10] |
RAD F R, AJDARY S, OMRANIPOUR R, et al. Comparative analysis of CD4+ and CD8+ T cells in tumor tissues, lymph nodes and the peripheral blood from patients with breast cancer[J]. Iran Biomed J, 2015, 19(1): 35-44. |
| [11] |
XIAO M L, CHEN X Y, HE R, et al. Differentiation and function of follicular CD8 T cells during human immunodeficiency virus infection[J]. Front Immunol, 2018, 9: 1095. DOI:10.3389/fimmu.2018.01095 |
| [12] |
DIAZ-SAN SEGUNDO F, SALGUERO F J, DE AVILA A, et al. Selective lymphocyte depletion during the early stage of the immune response to foot-and-mouth disease virus infection in swine[J]. J Virol, 2006, 80(5): 2369-2379. DOI:10.1128/JVI.80.5.2369-2379.2006 |
| [13] |
BAUTISTA E M, FERMAN G S, GOLDE W T. Induction of lymphopenia and inhibition of T cell function during acute infection of swine with foot and mouth disease virus (FMDV)[J]. Vet Immunol Immunopathol, 2003, 92(1-2): 61-73. DOI:10.1016/S0165-2427(03)00004-7 |
| [14] |
ROJAS J M, AVIA M, MARTÍN V, et al. IL-10:a multifunctional cytokine in viral infections[J]. J Immunol Res, 2017, 2017: 6104054. |
| [15] |
DÍAZ-SAN SEGUNDO F, RODRÍGUEZ-CALVO T, DE AVILA A, et al. Immunosuppression during acute infection with foot-and-mouth disease virus in swine is mediated by IL-10[J]. PLoS One, 2009, 4(5): e5659. DOI:10.1371/journal.pone.0005659 |
| [16] |
ZHANG Z D, DOEL C, BASHIRUDDIN J B. Interleukin-10 production at the early stage of infection with foot-and-mouth disease virus related to the likelihood of persistent infection in cattle[J]. Vet Res, 2015, 46: 132. DOI:10.1186/s13567-015-0276-y |
| [17] |
GUO Z J, ZHAO Y, ZHANG Z D, et al. Interleukin-10-mediated lymphopenia caused by acute infection with foot-and-mouth disease virus in mice[J]. Viruses, 2021, 13(12): 2358. DOI:10.3390/v13122358 |
| [18] |
刘丹华, 郑世民, 刘晓静, 等. 禽网状内皮组织增生病病毒感染对SPF雏鸡血液和局部淋巴组织CD4+/CD8+细胞及相关细胞因子表达的影响[J]. 畜牧兽医学报, 2020, 51(6): 1447-1454. LIU D H, ZHENG S M, LIU X J, et al. Effects of avian reticuloendotheliosis virus infection on the CD4+/CD8+ ratio and the expression of related cytokines in SPF chicks[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(6): 1447-1454. (in Chinese) |
| [19] |
FAN Y, BAI H W, QIAN Y Y, et al. CD4+ T cell immune response to VP1 and VP3 in BK virus infected recipients of renal transplantation[J]. Surg Infect (Larchmt), 2019, 20(3): 236-243. DOI:10.1089/sur.2018.116 |
| [20] |
SHARAN R, SINGH D K, RENGARAJAN J, et al. Characterizing early T cell responses in nonhuman primate model of tuberculosis[J]. Front Immunol, 2021, 12: 706723. DOI:10.3389/fimmu.2021.706723 |
| [21] |
SUN P, ZHANG S M, QIN X D, et al. Foot-and-mouth disease virus capsid protein VP2 activates the cellular EIF2S1-ATF4 pathway and induces autophagy via HSPB1[J]. Autophagy, 2018, 14(2): 336-346. DOI:10.1080/15548627.2017.1405187 |
| [22] |
GIAMARELLOS-BOURBOULIS E J, NETEA M G, ROVINA N, et al. Complex immune dysregulation in COVID-19 patients with severe respiratory failure[J]. Cell Host Microbe, 2020, 27(6): 992-1000. DOI:10.1016/j.chom.2020.04.009 |
| [23] |
PALANQUES-PASTOR T, LÓPEZ-BRIZ E, POVEDA ANDRéS J L. Involvement of interleukin 6 in SARS-CoV-2 infection: siltuximab as a therapeutic option against COVID-19[J]. Eur J Hosp Pharm, 2020, 27(5): 297-298. DOI:10.1136/ejhpharm-2020-002322 |
| [24] |
POL J G, CAUDANA P, PAILLET J, et al. Effects of interleukin-2 in immunostimulation and immunosuppression[J]. J Exp Med, 2020, 217(1): e20191247. DOI:10.1084/jem.20191247 |
| [25] |
MEHTA A K, GRACIAS D T, CROFT M. TNF activity and T cells[J]. Cytokine, 2018, 101: 14-18. DOI:10.1016/j.cyto.2016.08.003 |
| [26] |
BAXTER A G, HODGKIN P D. Activation rules: the two-signal theories of immune activation[J]. Nat Rev Immunol, 2002, 2(6): 439-446. DOI:10.1038/nri823 |
| [27] |
CHEN L P, FLIES D B. Molecular mechanisms of T cell co-stimulation and co-inhibition[J]. Nat Rev Immunol, 2013, 13(4): 227-242. DOI:10.1038/nri3405 |
| [28] |
TAYLOR A, VERHAGEN J, BLASER K, et al. Mechanisms of immune suppression by interleukin-10 and transforming growth factor-β: the role of T regulatory cells[J]. Immunology, 2006, 117(4): 433-442. DOI:10.1111/j.1365-2567.2006.02321.x |
| [29] |
JUBEL J M, BARBATI Z R, BURGER C, et al. The role of PD-1 in acute and chronic infection[J]. Front Immunol, 2020, 11: 487. DOI:10.3389/fimmu.2020.00487 |
(编辑 白永平)



