牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)与猪瘟病毒(classical swine fever virus,CSFV)、羊边界病病毒(border disease virus,BDV)同属于黄病毒科(Flaviviridae)、瘟病毒属(Pesztivirus)[1],是牛病毒性腹泻/黏膜病(bovine viral diarrhea/mucosal disease,BVD/MD)的主要病原,易感动物有牛、羊、骆驼等[2]。BVDV感染后会损伤机体的呼吸和生殖系统[3],且病毒会攻击免疫系统,使机体产生免疫抑制[4],随后出现继发感染,对组织、器官等造成严重损伤。近年来,随着畜牧业的快速发展,进出口运输频繁,促进了BVDV的传播,对畜牧养殖业的健康发展造成严重危害,并且对相关生物制品的安全性产生了不利影响。BVDV病毒的致病机制复杂,感染范围较广[5],明确该病毒的感染机制可以为预防和治疗BVD提供高效的方法和新的思路。
热休克蛋白90 β家族成员1(heat shock protein 90 beta family member 1,HSP90B1)是一种由内质网应激(endoplasmic reticulum stress,ERS)诱导的蛋白[6],属于热休克蛋白90(heat shock protein 90 kDa,HSP90)家族,在蛋白折叠和质量控制中发挥关键作用[7],对Ca2+稳态、ERS以及宿主防御有重要影响[7-8]。HSP90家族的分子伴侣活性对于病毒蛋白的组装、成熟和维持都有重要作用,如在麻疹和尼帕病毒的L聚合酶折叠中的作用[9],并且能够参与到柯萨奇病毒、脊髓灰质炎病毒和鼻病毒等小核糖核酸病毒的衣壳加工和组装[10]。有研究显示,调控HSP90B1表达可以抑制黄病毒的复制,包括登革热病毒和寨卡病毒[11],能够导致人免疫缺陷病毒(human immunodeficiency virus,HIV)感染细胞中CD4受体的表达显著增加[12],HSP90B1蛋白表达的差异可能是PEDV致病性差异的原因之一[13],还有研究发现病毒糖蛋白E2能够激活ERS反应并诱导HSP90B1的转录,敲低HSP90B1能够抵消E2的抗细胞凋亡作用[14]。课题组以往研究使用BVDV感染胎牛肾细胞(Madin-Darby bovine kidney,MDBK)细胞后进行蛋白组学分析,结果与空白组相比HSP90B1极显著性差异表达,以此推测HSP90B1可能是影响BVDV复制的关键基因之一,使用BVDV感染MDBK细胞后,通过蛋白和mRNA水平检测了HSP90B1的表达,再利用CRISPR/Cas9基因编辑技术敲除MDBK细胞的HSP90B1基因,构建HSP90B1 KO细胞,感染BVDV后,通过免疫荧光,qRT-PCR,病毒滴度以及CPE检测病毒的复制情况,结果显示BVDV感染MDBK细胞后,HSP90B1的蛋白水平和mRNA的转录水平均显著性上升,敲除MDBK细胞的HSP90B1基因能够显著性抑制BVDV的复制,为研究BVDV的致病机制以及BVD的综合防控奠定基础。
1 材料与方法 1.1 病毒、质粒及细胞BVDV TC分离株由新疆农业大学动物医学学院传染病实验室冉多良教授惠赠[15];pSPAX2、pMD2.G、lentiCRISPR v2、pLenti-GFP质粒购自Addgene公司;胎牛肾细胞和人胚肾293T细胞(Human embryo kidney 293T,HEK-293T)购自中国科学院典型培养物保藏委员会细胞库。
1.2 主要试剂兔抗GRP94抗体(bs-0194R)购自北京博奥森生物技术有限公司;大肠杆菌Stbl3感受态细胞购自北京博迈德基因技术有限公司;普通琼脂糖凝胶DNA回收试剂盒和SuperReal PreMix Plus(SYBR Green)购自北京天根生化科技有限公司;苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)、RIPA裂解液、BeyoECL Moon化学发光试剂盒和嘌呤霉素购自上海碧云天生物技术有限公司;胰蛋白胨、酵母浸粉、固体琼脂粉购自上海生工生物工程股份有限公司;TRIzol购自Ambion公司;高糖DMEM和胎牛血清(Fetal bovine serum,FBS)购自BI公司;Endofree PlasmidMiniprep Kit购自BIOMIGA公司;磷酸盐缓冲液(phosphate buffered saline,PBS)和0.25%Trypsin-EDTA购自GIBCO公司;T4 DNA Ligase和BsmBⅠ购自New England Biolabs公司;聚乙烯亚胺(Poly ethylenimine,PEI)购自Polysciences公司;GAPDH MAb、HRP标记的山羊抗兔IgG(H+L)和Cy3标记山羊抗鼠IgG(H+L)购自Proteintech公司;J2 anti-dsRNA IgG2a单克隆抗体(MAb)购自Scicons公司;聚凝胺购自Sigma公司;PrimeScriptTM RT Master Mix(Perfect Real Time)试剂盒购自TaKaRa公司。
1.3 qRT-PCR检测HSP90B1 mRNA转录水平将MDBK细胞按3×105个·孔-1的密度接种至6 cm细胞培养皿,置于细胞培养箱中培养至汇合度约70%时,加入10 000 TCID50 BVDV TC株感染细胞,分别于24、36和48 h时,加入TRIzol裂解液提取细胞和培养液的总核糖核酸(RibonucleicAcid,RNA),测定浓度后将1 μg总RNA反转录为cDNA;以此为模板,按照PrimeScriptTM RT Master Mix(Perfect Real Time)说明书配制体系[16],qRT-PCR检测HSP90B1 mRNA的转录水平。
1.4 Western blot检测HSP90B1蛋白表达水平将1×106个MDBK细胞接种至10 cm细胞培养皿,待细胞密度达到80%左右时,感染10 000 TCID50 BVDV TC株,48 h后加入600 μL含1 mmol·L-1 PMSF的RIPA裂解液提取总蛋白,测定浓度后变性60 μg总蛋白,利用Western blot检测HSP90B1蛋白含量,一抗分别为GRP94抗体(1∶1 000) 和GAPDH抗体(1∶1 000),二抗为山羊抗兔IgG-HRP(1∶5 000)。
1.5 构建lentiCRISPR v2-HSP90B1/Scramble-sgRNA重组质粒根据GenBank数据库中牛源HSP90B1的基因序列(登录号:282646),使用Benchling(www.benchling.com)和Chop-Chop(www.chopchop.cbu.uib.no)设计HSP90B1-sgRNA和Scramble序列(表 1),送至金唯智生物(苏州)科技有限公司合成;将合成的HSP90B1-sgRNA和Scramble的Forward、Reverse各取10 μL(100 μmol·L-1),37 ℃孵育30 min,95 ℃孵育5 min后梯度降温至25 ℃(5 ℃·min-1),合成双链sgRNA。利用限制性内切酶BsmBⅠ酶切lentiCRISPR v2质粒,利用1%琼脂糖凝胶电泳验证后,回收12 000 bp处的目的条带,将合成的双链sgRNA连接至回收的线性载体中构建lentiCRISPR v2-HSP90B1/Scramble-sgRNA重组质粒;连接产物转化至大肠杆菌Stbl3感受态细胞,挑取单克隆菌落,对转化后的lentiCRISPR v2-HSP90B1/Scramble-sgRNA菌液进行PCR和测序鉴定。
|
|
表 1 sgRNA序列 Table 1 SgRNA sequence |
6 cm细胞培养皿用0.1%明胶包被30 min后,接种3×105个HEK-293T细胞,培养至汇合度约80%时,将3 μg pSPAX2、1.5 μg pMD2.G和3 μg lentiCRISPR v2-HSP90B1/Scramble-sgRNA质粒在1.5 mL离心管中混匀,加入37.5 μL PEI (1 mg·mL-1),细胞弃原培养液,加入2.5 mL DMEM和上述混合液,置于细胞培养箱中孵育3 h后更换含10% FBS的新鲜细胞培养液,置于细胞培养箱中培养48 h,收集上清液得到慢病毒HSP90B1-sgRNA和Scramble-sgRNA。同时转染pLenti-GFP质粒,包装GFP慢病毒,倒置荧光显微镜下观察绿色荧光表达情况,估算慢病毒包装效率。
向慢病毒HSP90B1-sgRNA和Scramble-sgRNA加入聚凝胺(终浓度为8 μg·mL-1)后悬浮感染MDBK细胞,同时设立GFP对照组以观察慢病毒感染效率;细胞培养箱中孵育24 h后更换含10% FBS的新鲜培养液,置于细胞培养箱中继续培养48 h,加入终浓度为3 μg·mL-1的嘌呤霉素,连续筛选4代获得HSP90B1 KO细胞和Scramble阳性细胞。分别收集5×106个HSP90B1 KO和Scramble细胞,提取总蛋白,测定蛋白浓度,检测HSP90B1的敲除效率。
1.7 细胞生长情况检测按3×105个细胞·孔-1的密度将HSP90B1 KO、Scramble和MDBK细胞接种至6孔细胞培养板中,置于细胞培养箱中培养,分别于接种后24、48、72、96、120 h时用0.25% Trypsin-EDTA完全消化后收集细胞,1 000 r·min-1离心5 min后弃上清,加入1 mL培养液重悬细胞,显微镜下进行细胞计数。
1.8 qRT-PCR检测BVDV 5′UTR RNA水平分别接种3×105个·孔-1HSP90B1 KO和Scramble细胞至6孔细胞培养板中,待细胞密度达到80%时,感染10 000 TCID50的BVDV TC株,于感染后12、24、36、48 h时收集细胞及培养液提取总RNA,反转录为cDNA,采用qRT-PCR检测BVDV 5′UTR RNA水平[17]。
1.9 免疫荧光检测BVDV dsRNA含量24孔细胞培养板铺爬片并用1%明胶包被30 min,按1×105个·孔-1的密度将HSP90B1 KO和Scramble细胞接种至细胞培养板中,待细胞贴壁后感染10 000 TCID50的BVDV TC株,于感染后12、24、36、48 h后收集爬片;PBS清洗后,加入200 μL 4%多聚甲醛,室温条件下固定15 min;清洗后加入200 μL含1%山羊血清的封闭液,室温孵育1 h;清洗3次后加入J2 anti-dsRNA IgG2a单克隆抗体(1∶1 200),4 ℃孵育过夜;清洗并加入Cy3标记山羊抗鼠IgG(H+L)二抗(1∶200),室温下避光孵育1 h;PBS清洗,滴加5 μL抗荧光猝灭封片剂,将爬片置于封闭液上进行封片;利用激光共聚焦显微镜观察荧光分布情况及强度。
1.10 BVDV感染HSP90B1 KO细胞后病毒滴度检测以3×105个·孔-1的密度将HSP90B1 KO细胞和对照组Scramble细胞接种至6孔细胞培养板中,置于细胞培养箱中静置培养;待细胞贴壁后,加入10 000 TCID50 BVDV TC株感染细胞,于感染后12、24、36、48 h收集细胞和培养液,置于-80 ℃冰箱中反复冻融3次,液体转移至2 mL离心管,4 ℃ 1 000 r·min-1离心10 min,收集上清,采用Reed-Muench法测定各上清液中的病毒滴度。
1.11 BVDV感染HSP90B1 KO细胞CPE情况按3×105个·孔-1的密度接种HSP90B1 KO和Scramble细胞至6孔细胞培养板中,置于细胞培养箱中培养,细胞密度约70%时,接种10 000 TCID50的BVDV TC株感染细胞,于感染后12、24、36和48 h时,使用倒置显微镜(TE2000U)观察细胞病变效应(cytopathic effects,CPE),并拍照进行对比。
1.12 统计分析利用SPSS 19.0 for Windows(SPSS Inc. Chicago,IL,USA)对结果进行统计学分析。通过t检验确定统计学显著性(*.P<0.05;**.P<0.01)。
2 结果 2.1 qRT-PCR检测HSP90B1 mRNA转录水平为检测BVDV感染MDBK对HSP90B1 mRNA转录水平的影响,使用BVDV TC株感染MDBK细胞后不同时间收集细胞总RNA,反转录cDNA,进行qRT-PCR检测,结果如图 1所示,与空白组相比病毒感染24 h时HSP90B1 mRNA转录水平显著升高(P<0.05),36和48 h时极显著升高(P<0.01),表明BVDV感染MDBK细胞导致HSP90B1 mRNA转录增加。
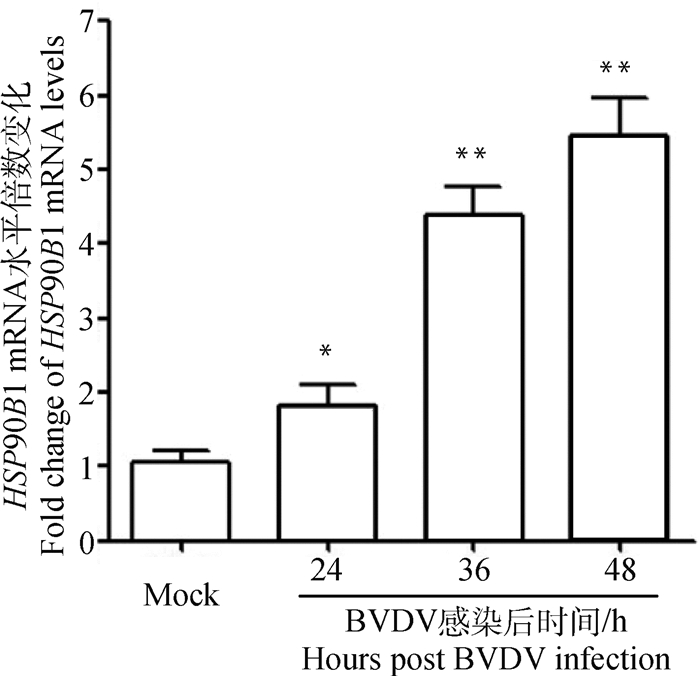
|
*. P<0.05; **. P<0.01;下同 *. P < 0.05; **. P < 0.01; the same as below 图 1 qRT-PCR检测BVDV感染MDBK细胞中HSP90B1 mRNA转录水平 Fig. 1 qRT-PCR detection of HSP90B1 mRNA transcript levels in BVDV-infected MDBK cells |
为进一步检测BVDV感染MDBK细胞对HSP90B1表达的影响,使用BVDV TC株感染MDBK细胞48 h后提取蛋白,进行Western blot检测,结果与空白组相比BVDV感染细胞后细胞中的HSP90B1蛋白表达水平明显增加(图 2),表明BVDV感染MDBK细胞使MDBK细胞内HSP90B1蛋白的表达量升高。
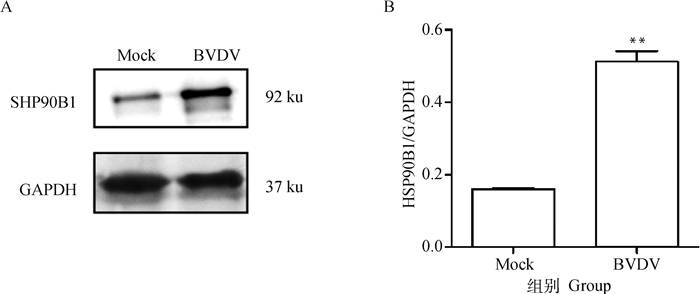
|
A. Western blot检测结果;B. 灰度值分析 A. Western blot assay results; B. grey scale value analysis 图 2 Western blot检测BVDV感染MDBK细胞中HSP90B1蛋白表达 Fig. 2 Western blot detection of HSP90B1 protein expression in BVDV-infected MDBK cells |
为构建lentiCRISPR v2-HSP90B1/Scramble-sgRNA重组质粒,利用限制性内切酶BsmBⅠ酶切lentiCRISPR v2质粒,1%琼脂糖凝胶进行电泳检测,结果显示得到两条大小不同的条带,一条在12 000 bp,一条在2 000 bp(图 3),与预期结果一致,回收12 000 bp处的目的条带,将连接构建的重组质粒lentiCRISPR v2-HSP90B1/Scramble-sgRNA转化至Stbl3感受态细胞,挑取单克隆菌落PCR后,利用2%琼脂糖凝胶电泳检测重组质粒中HSP90B1 sgRNA和Scramble sgRNA是否连接成功,结果在260 bp处显示条带(图 4),同时送至公司进行测序并使用Snapgene (v4.2.4)软件绘制图谱,以上结果表明lentiCRISPR v2-HSP90B1/Scramble-sgRNA重组质粒构建成功。
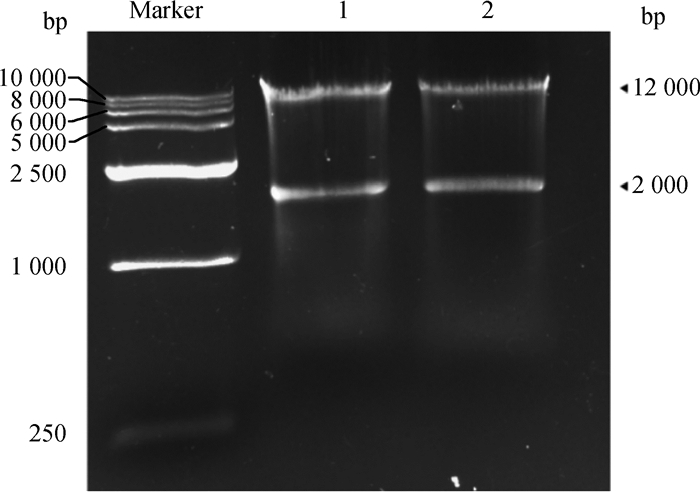
|
Marker. DL10000 bp DNA相对分子质量标准;1、2. 酶切后lentiCRISPR v2 Marker. DL10000 bp DNA marker; 1, 2. lentiCRISPR v2 after digestion 图 3 lentiCRISPR v2酶切电泳结果 Fig. 3 LentiCRISPR v2 digestion electrophoresis results |

|
Marker. DL500 bp DNA相对分子质量标准;1~12. lentiCRISPR v2-HSP90B1-sgRNA;13. 阴性对照 Marker. DL500 bp DNA marker; 1-12. lentiCRISPR v2-HSP90B1-sgRNA; 13. Negative control 图 4 菌液PCR电泳结果 Fig. 4 PCR electrophoresis results of bacterial solution |
为得到HSP90B1 KO/Scramble细胞,转染包装HSP90B1-sgRNA、Scramble-sgRNA和GFP慢病毒,悬浮感染MDBK细胞,使用荧光倒置显微镜观察GFP对照组的感染效率,结果在显微镜下观察到绿色荧光蛋白的表达量约为50%,表明感染效率为50%(图 5);加入终浓度为3 μg·mL-1的嘌呤霉素,连续筛选4代获得阳性细胞,提取细胞总蛋白,进行Western blot,结果与对照组相比HSP90B1蛋白的表达量明显降低(图 6),表明HSP90B1 KO细胞构建成功。

|
A. 明场下HEK-293T;B. 荧光通路下HEK-293T;C. 合并图。扫描文章首页OSID码可查看彩图 A. HEK-293T under bright field; B. HEK-293T under fluorescent pathway; C. Merged image. The color pictures can be found by scanning the OSID code on the front page of the article 图 5 慢病毒感染效率 Fig. 5 Lentiviral infection efficiency |

|
A. Western blot检测结果;B. 灰度值分析 A. Western blot assay results; B. Grey scale value analysis 图 6 Western blot检测HSP90B1 KO细胞中HSP90B1蛋白的表达 Fig. 6 Western blot detection of HSP90B1 protein expression in HSP90B1 KO cells |
为检测敲除HSP90B1基因对细胞生长的影响,将相同数量的不同细胞接种至6孔细胞培养板中,分时间段利用0.25%Trypsin-EDTA消化后,进行细胞计数,结果显示相同时间的Scramble、HSP90B1 KO细胞的数量与MDBK细胞相比未见差异(图 7),表明敲除HSP90B1对于细胞的生长没有影响。
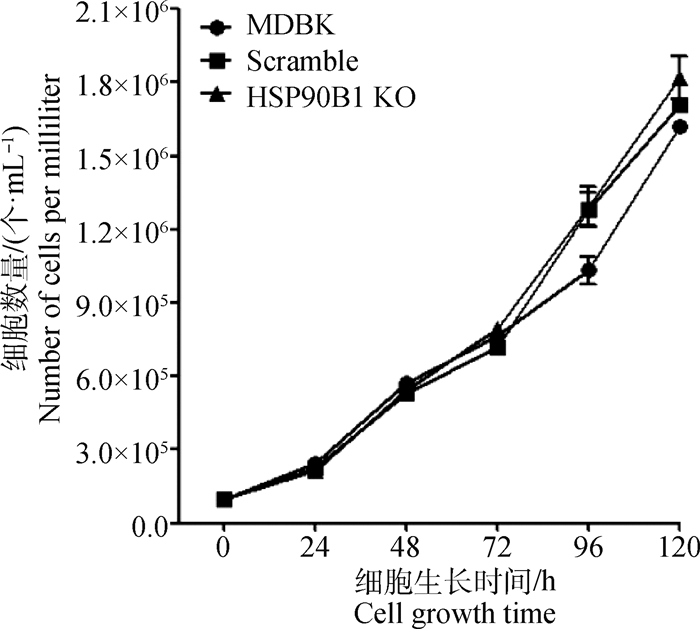
|
图 7 细胞生长情况检测结果 Fig. 7 Cell growth test results |
为检测HSP90B1对BVDV 5′UTR RNA表达的影响,于BVDV感染后不同时间收集细胞及培养液,提取总RNA,应用qRT-PCR检测BVDV 5′UTR RNA水平,结果如图 8所示,与对照组Scramble细胞相比,病毒感染HSP90B1 KO细胞12 h后BVDV 5′UTR RNA水平显著降低(P<0.05),感染36 h后极显著性降低(P<0.01),表明敲除HSP90B1基因会抑制BVDV 5′UTR RNA的表达水平。

|
图 8 qRT-PCR检测BVDV感染HSP90B1 KO细胞中BVDV 5′UTR RNA Fig. 8 Detection of BVDV 5′UTR RNA in BVDV-infected HSP90B1 KO cells by qRT-PCR |
为明确HSP90B1对BVDV dsRNA在细胞中形成的影响,BVDV感染HSP90B1 KO和Scramble细胞后不同时间收集细胞爬片,利用激光共聚焦显微镜观察荧光分布及强度,结果BVDV dsRNA呈现绿色荧光,细胞核显示红色荧光。与对照组相比,HSP90B1 KO细胞中的绿色荧光明显减少(图 9),表明敲除HSP90B1能够减少BVDV dsRNA在细胞中的形成。

|
扫描文章首页OSID码可查看彩图 The color pictures can be found by scanning the OSID code on the front page of the article 图 9 免疫荧光检测BVDV感染HSP90B1 KO细胞中的BVDV dsRNA Fig. 9 Immunofluorescence detection of BVDV dsRNA in BVDV-infected HSP90B1 KO cells |
为验证HSP90B1对BVDV子代病毒形成的影响,BVDV TC株感染HSP90B1 KO细胞和对照Scramble细胞后,分别于12、24、36、48 h收集病毒液,利用Reed-Muench法测定不同病毒液中的病毒滴度,结果在BVDV感染HSP90B1 KO细胞12 h后与对照组相比,病毒滴度显著降低(P<0.05),感染36 h后病毒滴度极显著性降低(P<0.01)(图 10),表明敲除HSP90B1能够抑制BVDV子代病毒的形成。

|
图 10 BVDV感染HSP90B1 KO后病毒滴度检测 Fig. 10 Detection of virus titer after BVDV infection with HSP90B1 KO |
为验证HSP90B1对BVDV致细胞病变能力的影响,使用BVDV TC感染HSP90B1 KO细胞和对照Scramble细胞后,于不同时间利用倒置显微镜观察细胞病变效应,结果BVDV感染对照组Scramble细胞12和24 h后出现明显CPE,而HSP90B1 KO细胞很难观察到CPE,感染36和48 h HSP90B1 KO细胞出现明显CPE,但对照组Scramble细胞已出现大量CPE并有细胞脱落(图 11),结果表明敲除HSP90B1能够降低BVDV的致细胞病变能力。
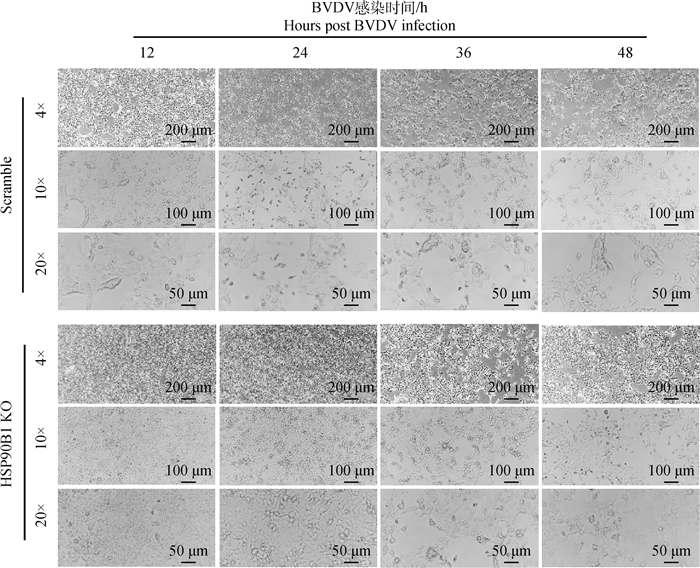
|
扫描文章首页OSID码可查看彩图 The color pictures can be found by scanning the OSID code on the front page of the article 图 11 BVDV感染HSP90B1 KO细胞CPE情况 Fig. 11 CPE of HSP90B1 KO cells infected with BVDV |
牛病毒性腹泻病毒是一类无细胞结构、个体极小的微生物[18],由于病毒缺少细胞结构特征,导致其必须依赖于宿主细胞进行复制和增殖,病毒从进入细胞,到细胞内的组装、复制、合成等都需要细胞内基因的辅助[19]。HSP90B1是一种热休克蛋白,主要参与ERS和细胞凋亡过程,Sengupta等[20]发现HSP90B1在日本脑炎病毒(Japanese encephalitis virus,JEV)感染的小鼠大脑和Neuro2a细胞中显示出差异性,并强调了其在黄病毒感染期间对ER膜重塑和ERS的重要性[12];Zhong等[21]通过STRING分析,发现HSPA5、HSPA1B、HSP90B1和HSPA6四种热休克蛋白可能与MDBK细胞中山羊副流感病毒3型(caprine parainfluenza virus type 3,CPIV3)的增殖有关;本研究组前期使用BVDV TC感染MDBK细胞后进行蛋白质谱筛选差异基因,结果显示HSP90B1具有显著性差异(未发表)。为验证蛋白质谱的结果,本研究使用qRT-PCR检测BVDV感染MDBK细胞后HSP90B1 mRNA的转录水平,结果感染24 h时HSP90B1 mRNA转录水平显著升高(P<0.05),36和48 h时极显著升高(P<0.01),利用Western blot检测BVDV感染MDBK细胞后HSP90B1蛋白表达水平,显示感染后HSP90B1蛋白的表达量明显升高;表明BVDV感染能够诱导MDBK细胞中HSP90B1的表达,猜测HSP90B1基因可能会影响BVDV的复制。
为研究基因对病毒的影响,Liang等[22]敲低三基序蛋白26(tripartite motif containing 26,TRIM26)发现,TRIM26参与丙型肝炎病毒(hepatitis C virus,HCV)的复制,并且减少TRIM26的表达能够降低HCV RNA和NS3蛋白表达水平;Mladinich等[23]利用CRISPR/Cas9技术发现C-C基序趋化因子配体5(C-C motif chemokine ligand 5,CCL5)是寨卡病毒(Zika virus, ZIKV)持久性需要的重要因素;Isken等[24]敲除DNAJC14研究了该基因对于瘟病毒RNA复制的影响。为研究HSP90B1基因对BVDV复制的影响,作者应用CRISPR/Cas9基因编辑技术敲除MDBK细胞的HSP90B1基因,利用Western blot技术检测敲除效率,结果显示HSP90B1 KO细胞中的HSP90B1蛋白表达极明显降低,表明HSP90B1基因被敲除,成功构建HSP90B1 KO细胞,为后期研究HSP90B1对BVDV的复制提供细胞基础。分不同时间段进行细胞计数,结果显示相同时间生长内的细胞数量未见明显差异,表明敲除HSP90B1基因对细胞生长没有影响。
利用BVDV TC感染HSP90B1 KO和对照组Scramble细胞后,进行病毒含量检测。宋爽等[25]依据高度保守的BVDV 5′UTR基因,进行特异性引物设计,用荧光定量PCR检测BVDV,显示该方法具有灵敏度高、特异性好等优点,通过qRT-PCR检测BVDV 5′UTR RNA水平,结果与对照组相比,病毒感染HSP90B1 KO细胞12和24 h后BVDV 5′UTR RNA水平显著降低(P<0.05),36和48 h后极显著降低(P<0.01);间接免疫荧光法在临床中能够高效快速地检测BVDV分子,并且具有较高的特异性和可靠性,利用免疫荧光染色后BVDV dsRNA呈现绿色荧光,细胞核显示红色荧光与对照组相比HSP90B1 KO细胞中的绿色荧光明显减少;病毒滴度及CPE也是显示病毒表达量的方法之一,利用病毒滴度及CPE检测感染HSP90B1 KO细胞后的病毒含量,与对照组相比感染HSP90B1 KO细胞的病毒滴度在12 h后显著降低(P<0.05),36 h后极显著降低(P<0.01),CPE结果显示在感染12 h后对照组Scramble细胞出现明显CPE,而HSP90B1 KO细胞很难观察到CPE,感染36 h后HSP90B1 KO细胞出现CPE,但此时对照组Scramble细胞已出现大量CPE并有细胞脱落;以上结果显示HSP90B1 KO细胞中的病毒含量明显少于对照组Scramble细胞,表明敲除HSP90B1基因能够抑制BVDV的复制。
HSP90B1主要富集于ERS和细胞凋亡通路,有研究显示BVDV感染能够诱导ERS信号通路的激活[26],而且抑制内质网葡糖苷酶的活性,能够阻止BVDV E2蛋白在高尔基体内的加工,并且降低病毒粒子的感染性[27],以此推测HSP90B1基因可能通过调控内质网应激通路影响BVDV的复制,具体机制还需进一步研究。
4 结论BVDV感染MDBK细胞能够诱导HSP90B1表达;CRISPR/Cas9成功敲除MDBK细胞的HSP90B1基因,构建HSP90B1 KO细胞,敲除HSP90B1能够抑制BVDV的复制。
| [1] |
PETERHANS E, BACHOFEN C, STALDER H, et al. Cytopathic bovine viral diarrhea viruses (BVDV): emerging pestiviruses doomed to extinction[J]. Vet Res, 2010, 41(6): 44. DOI:10.1051/vetres/2010016 |
| [2] |
DIAO N C, GONG Q L, LI J M, et al. Prevalence of bovine viral diarrhea virus (BVDV)in yaks between 1987 and 2019 in mainland China: a systematic review and meta-analysis[J]. Microb Pathog, 2020, 144: 104185. DOI:10.1016/j.micpath.2020.104185 |
| [3] |
YEŞILBAǦ K, FÖRSTER C, OZYIǦIT M O, et al. Characterisation of bovine viral diarrhea virus (BVDV) isolates from an outbreak with haemorrhagic enteritis and severe pneumonia[J]. Vet Microbiol, 2014, 169(1-2): 42-49. DOI:10.1016/j.vetmic.2013.12.005 |
| [4] |
张国华, 吴丹丹, 周玉龙, 等. 牛病毒性腹泻病毒黑龙江分离株的分离鉴定[J]. 中国预防兽医学报, 2015, 37(10): 805-807. ZHANG G H, WU D D, ZHOU Y L, et al. Isolation and identification of bovine viral diarrhea virus from Heilongjiang Province[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(10): 805-807. (in Chinese) |
| [5] |
张国奇, 李尤简, 肖红冉, 等. 牛病毒性腹泻病毒纳米抗体文库的构建与鉴定[J]. 西北农业学报, 2015, 24(3): 20-25. ZHANG G Q, LI Y J, XIAO H R, et al. Construction and characterization of a nanobody library against BVDV[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2015, 24(3): 20-25. (in Chinese) |
| [6] |
IYER K, CHAND K, MITRA A, et al. Diversity in heat shock protein families: functional implications in virus infection with a comprehensive insight of their role in the HIV-1 life cycle[J]. Cell Stress Chaperones, 2021, 26(5): 743-768. DOI:10.1007/s12192-021-01223-3 |
| [7] |
ELETTO D, DERSH D, ARGON Y. GRP94 in ER quality control and stress responses[J]. Semin Cell Dev Biol, 2010, 21(5): 479-485. DOI:10.1016/j.semcdb.2010.03.004 |
| [8] |
RANDOW F, SEED B. Endoplasmic reticulum chaperone gp96 is required for innate immunity but not cell viability[J]. Nat Cell Biol, 2001, 3(10): 891-896. DOI:10.1038/ncb1001-891 |
| [9] |
BLOYET L M, WELSCH J, ENCHERY F, et al. HSP90 chaperoning in addition to phosphoprotein required for folding but not for supporting enzymatic activities of measles and Nipah virus L polymerases[J]. J Virol, 2016, 90(15): 6642-6656. DOI:10.1128/JVI.00602-16 |
| [10] |
GELLER R, VIGNUZZI M, ANDINO R, et al. Evolutionary constraints on chaperone-mediated folding provide an antiviral approach refractory to development of drug resistance[J]. Genes Dev, 2007, 21(2): 243-251. |
| [11] |
ROTHAN H A, ZHONG Y W, SANBORN M A, et al. Small molecule grp94 inhibitors block dengue and Zika virus replication[J]. Antiviral Res, 2019, 171: 104590. DOI:10.1016/j.antiviral.2019.104590 |
| [12] |
LANDI A, VERMEIRE J, IANNUCCI V, et al. Genome-wide shRNA screening identifies host factors involved in early endocytic events for HIV-1-induced CD4 down-regulation[J]. Retrovirology, 2014, 11: 118. DOI:10.1186/s12977-014-0118-4 |
| [13] |
LI Z H, CHEN F Z, YE S Y, et al. Comparative proteome analysis of porcine jejunum tissues in response to a virulent strain of porcine epidemic diarrhea virus and its attenuated strain[J]. Viruses, 2016, 8(12): 323. DOI:10.3390/v8120323 |
| [14] |
KHACHATOORIAN R, FRENCH S W. Chaperones in hepatitis C virus infection[J]. World J Hepatol, 2016, 8(1): 9-35. DOI:10.4254/wjh.v8.i1.9 |
| [15] |
梁霄勇, 季新成, 冉多良. 牛病毒性腹泻病毒TC株的分离鉴定及E0基因的序列分析[J]. 畜牧与兽医, 2016, 48(7): 36-40. LIANG X Y, JI X C, RAN D L. Isolation and identification of bovine viral diarrhea virus TC strain and sequence analysis of E0 gene[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(7): 36-40. (in Chinese) |
| [16] |
田瑞鑫. 牛miR-29b过表达影响牛病毒性腹泻病毒感染BALB/c小鼠的作用研究[D]. 乌鲁木齐: 新疆农业大学, 2019. TIAN R X. Analysis of the effects of bovine miR-29b overexpression on BALB/c mice infected with bovine viral diarrhea virus[D]. Urumqi: Xinjiang Agricultural University, 2019. (in Chinese) |
| [17] |
付强, 陈俊贞, 郭妍婷, 等. 应用CRISPR/Cas9技术敲除SERPINF2基因对牛病毒性腹泻病毒复制的影响[J]. 生物技术通报, 2021, 37(5): 267-272. FU Q, CHEN J Z, GUO Y T, et al. Effects of knockout of gene SERPINF2 via CRISPR/Cas9 on the replication of bovine viral diarrhea virus[J]. Biotechnology Bulletin, 2021, 37(5): 267-272. (in Chinese) |
| [18] |
FU Q, SHI H J, CHEN C F. Roles of bta-miR-29b promoter regions DNA methylation in regulating miR-29b expression and bovine viral diarrhea virus NADL replication in MDBK cells[J]. Arch Virol, 2017, 162(2): 401-408. DOI:10.1007/s00705-016-3107-1 |
| [19] |
VAN LEUR S W, HEUNIS T, MUNNUR D, et al. Pathogenesis and virulence of Flavivirus infections[J]. Virulence, 2021, 12(1): 2814-2838. DOI:10.1080/21505594.2021.1996059 |
| [20] |
SENGUPTA N, GHOSH S, VASAIKAR S V, et al. Modulation of neuronal proteome profile in response to Japanese encephalitis virus infection[J]. PLoS One, 2014, 9(3): e90211. DOI:10.1371/journal.pone.0090211 |
| [21] |
ZHONG C Y, LI J Z, MAO L, et al. Proteomics analysis reveals heat shock proteins involved in caprine parainfluenza virus type 3 infection[J]. BMC Vet Res, 2019, 15(1): 151. |
| [22] |
LIANG Y S, ZHANG G G, LI Q H, et al. TRIM26 is a critical host factor for HCV replication and contributes to host tropism[J]. Sci Adv, 2021, 7(2): eabd9732. |
| [23] |
MLADINICH M C, CONDE J N, SCHUTT W R, et al. Blockade of autocrine CCL5 responses inhibits Zika virus persistence and spread in human brain microvascular endothelial cells[J]. MBio, 2021, 12(4): e01962-21. |
| [24] |
ISKEN O, POSTEL A, BRUHN B, et al. CRISPR/Cas9-mediated knockout of DNAJC14 verifies this chaperone as a pivotal host factor for RNA replication of pestiviruses[J]. J Virol, 2019, 93(5): e01714-18. |
| [25] |
宋爽, 赵柏林, 曲萍, 等. 牛病毒性腹泻病毒、牛传染性支气管炎病毒和口蹄疫病毒多重TaqMan荧光定量PCR检测方法的建立[J]. 中国预防兽医学报, 2017, 39(2): 133-136. SONG S, ZHAO B L, QU P, et al. Establishment of multiplex TaqMan real-time PCR for the detection of bovine viral diarrhea virus, infectious bovine rhinotracheitis virus and foot-mouth disease virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(2): 133-136. (in Chinese) |
| [26] |
JORDAN R, WANG L J, GRACZYK T M, et al. Replication of a cytopathic strain of bovine viral diarrhea virus activates PERK and induces endoplasmic reticulum stress-mediated apoptosis of MDBK cells[J]. J Virol, 2002, 76(19): 9588-9599. |
| [27] |
JORDAN R, NIKOLAEVA O V, WANG L J, et al. Inhibition of host ER glucosidase activity prevents Golgi processing of virion-associated bovine viral diarrhea virus E2 glycoproteins and reduces infectivity of secreted virions[J]. Virology, 2002, 295(1): 10-19. |
(编辑 孟培)



