2. 中国农业科学院特产研究所, 长春 130122;
3. 吉林农业大学动物科学技术学院, 长春 130118;
4. 吉林大学动物科学学院, 长春 130012;
5. 吉林省动物疫病预防控制中心, 长春 133000
2. Institute of Special Economic Animal and Plant Sciences, Chinese Academy of Agricultural Sciences, Changchun 130122, China;
3. College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China;
4. Animal Sciences College, Jilin University, Changchun 130012, China;
5. Jilin Animal Epidemic Disease Prevention and Control Center, Changchun 133000, China
牛冠状病毒病是由牛冠状病毒(bovine coronavirus,BCoV)引起的犊牛腹泻、呼吸道为主要临床特征的牛病毒性传染病[1]。Mebus等[2]最早于1972年在牛腹泻病例的粪便中分离到BCoV。BCoV属于套式病毒目冠状病毒科冠状病毒属单股正链RNA病毒,有囊膜,具有多形性,是目前自然界已知的最大RNA病毒[3],分属于冠状病毒属中的β类。冠状病毒属分为α、β、γ、δ类,其中,β类主要感染哺乳动物[4]。BCoV与人冠状病毒OC43(HCoV-OC43)的基因具有较高相似性,是否存在跨种传播仍需进一步研究。BCoV编码5种主要结构蛋白:核衣壳蛋白(N)、嵌膜蛋白(M)、血凝素-酯酶蛋白(HE)、纤突蛋白(S)、次要嵌膜蛋白E。HE蛋白由两个单体经二硫键连接形成,可发挥乙酰酯酶的生物学活性,参与病毒的早期吸附,引起红细胞的凝集[5]。HE蛋白可以引发阻断病毒附着的中和抗体,又具有感染性,对免疫及疫苗研究具有重要意义[6]。S蛋白包含S1和S2两个亚基,S1负责病毒、宿主细胞的识别与结合,而S2与病毒细胞的融合有关[7]。S蛋白能诱导机体产生免疫应答,从而产生中和抗体,因此在病毒的附着及进入宿主细胞内具有重要作用[8]。牛冠状病毒病可发生于各年龄段牛,春冬季发病率最高,犊牛腹泻和呼吸道症状明显,呼吸困难,严重者出现血便,直至死亡[9]。成年牛呼吸道症状更为突出,或呈隐性感染,持续带毒排毒,在牛群内迅速传播[10-11]。近两年发病逐渐增多,表现在3~4月龄犊牛死亡率增加,呼吸道症状严重,偶有猝死现象,个别牛场全群发病,且与呼吸道及腹泻等病毒病混合感染,病情更加复杂,给牛场带来巨大经济损失。本研究对吉林省东中西地区的牛场进行了BCoV的抗原和抗体的流行病学调查,了解掌握BCoV在调查地区的流行情况,血清抗体阳性率1.08%,抗原阳性率21.10%。并对流行毒株进行了测序分析,调查地区主要流行毒株与中国四川株亲缘关系最近,为吉林省牛冠状病毒病的发病、流行情况及疫病防控提供了科学数据。
1 材料与方法 1.1 样品从吉林省德惠市、延吉市、双辽市、九台区、柳河县、伊通县、东辽县、农安县、前郭县、镇赍县、吉林市、双阳区12个市(县、区)的规模化牛场、养殖合作社及家庭养殖户共计462头牛采集了497份临床样品,包括粪便、鼻拭子、咽拭子、血液、乳液及肺等组织样品。组织样品主要采自发病牛。
从吉林省东中西部地区的前郭县、东丰县、公主岭市、长岭市、安定镇、德惠市、蛟河市、柳河县、扶余市9个市(县、区)的规模化牛场、养殖合作社及家庭养殖户等45个场点于春防与秋防期间采集了1 298头成年牛和犊牛的牛血清样本。除组织样品采集自临床上表现呼吸急促,咳喘,腹泻,并伴有血痢疾的病死牛外,其余样品均为随机采样(血清样本由吉林省动物疫病预防控制中心提供)。
1.2 主要试剂BCoV标准阳性质粒、BCoV鉴定引物均由中国农业科学院特产研究所分子生物学重点实验室保存。琼脂糖购自Promega公司;RNA提取试剂盒、反转录试剂盒购自北京全式金生物技术公司;胶回收试剂盒购自OMEGA公司;BCoV抗体检测试剂盒(MM-154801)购自青岛凯泰克工贸有限公司。
1.3 主要仪器PCR扩增仪:美国Bio-Rad公司;凝胶成像系统:美国Bio-Rad公司;酶标仪Synergy H1:美国BioTeke公司。
1.4 样品处理将采集的组织样品进行液氮研磨处理,加入PBS中进行混匀,粪、鼻、咽喉拭子类棉签浸入含1%双抗的DMEM拭子液中,所有样品充分混匀后离心去沉淀留液体备用。
1.5 引物设计与合成根据NCBI数据库中获得的全长序列(GenBank登录号:KX982264.1),选择相对保守区域N基因,利用软件Primer 5.0设计一对N基因的检测引物、1对HE全基因扩增引物、6对S全基因扩增引物(表 1)。引物由长春库美生物有限公司合成。
|
|
表 1 BCoV N、HE和S基因引物信息 Table 1 Primers for amplification of BCoV N, HE and S gene |
将462份样品(每牛1份)分别提取总RNA后进行反转录,具体操作见试剂盒说明书,反转录后cDNA均保存于-80 ℃冰箱备用。
1.7 纳米PCR的检测利用本实验室已建立的对BCV特异,与BRV、BVDV、IBRV、BRSV、BPIV3均无交叉反应的BCoV nano-PCR新型核酸检测方法[12],对临床样品进行PCR扩增,反应体系及条件如下,总体系:25 μL,12.5 μL的2×HiFi Taq高保真预混PCR反应体系,409 bp大小的N基因检测上下游引物各0.5 μL,模板1 μL,纳米粒子1.5 μL,去离子水补至25 μL。反应条件:94 ℃,2 min;94 ℃,30 s;55 ℃,30 s;72 ℃,30 s,共35个循环,最后72 ℃总延伸5 min。PCR之后进行1%琼脂糖凝胶电泳观察结果,得到的阳性产物,扩增产物片段大小为409 bp,纯化后送库美生物公司测序分析。
1.8 HE、S全基因的扩增以上述提取的病毒核酸反转录后的cDNA为模板,通过上述表 1中S基因、HE基因的全基因扩增引物进行PCR分段扩增,扩增过程中各段引物的退火温度Tm值,则根据引物不同进行调整,PCR反应体系:总体系为25 μL,12.5 μL的2×HiFi Taq高保真预混PCR反应体系,上下游引物各0.5 μL,模板1 μL,去离子水补至25 μL。PCR反应条件:94 ℃ 2 min; 94 ℃ 30 s, 55~58 ℃ 30 s, 72 ℃ 50~80 s,35个循环;72 ℃延伸5 min。PCR产物经琼脂糖凝胶电泳检测,并按照琼脂糖凝胶RNA/DNA回收试剂盒说明书进行纯化, 纯化后送至库美生物公司测序分析。测序结果使用DNAMAN软件进行拼接,并使用Megalign软件进行比对分析建立系统发育树。
1.9 牛冠状病毒病的抗体检测对2020-2021年春防与秋防期间采集的1 298份牛血清样本,应用ELISA抗体试剂盒进行BCoV抗体检测,检测前将所有的试剂盒组分从冰箱中取出放置室温下3~4 h后再使用,具体操作详见说明书。
2 结果 2.1 BCoV病原核酸检测结果对462份临床样品提取核酸后,使用特异性引物进行纳米PCR扩增,结果扩增出目的片段为409 bp大小的样品有97份,部分BCoV阳性样品琼脂糖凝胶电泳图如图 1所示。

|
M.DNA相对分子质量标准;N.阴性对照;1~3.肺组织样品;4~6.鼻拭子;7、8.粪拭子;9、10.肠组织样品 M. DNA marker; N. Negative control; 1-3. Lung tissue samples; 4-6. Nose swab; 7, 8. Fecal swab; 9, 10. Intestinal tissue samples 图 1 部分样品纳米PCR检测结果电泳结果 Fig. 1 Electrophoretic maps of the results of sample nanoscale PCR detection |
对各个地区的462份临床样品进行检测后可知,共有97份阳性样品,总体阳性率为21.10%,吉林省东、中、西部地区均有BCoV病原的存在,从平均阳性率上来看,东部地区阳性率最高,其次为西部地区,最后为中部地区。东部地区采集的122份临床样品主要包括延吉市81份(阳性率11.11%)和柳河县41份(阳性率68.29%),该地区平均阳性率为30.33%。西部地区的135份临床样品主要来自于双辽市、伊通县、前郭县、镇赍县四个地方,其中双辽市31份样品中有18份阳性样品,阳性率最高,达58.06%;伊通县次之,44份样品中检出9份为阳性,阳性率为20.45%;30份前郭县样品和30份镇赍县样品均未检出BCoV;西部地区的平均阳性率为20.00%。最后为中部地区,平均阳性率为16.10%。中部地区的205份临床样品包括50份东辽县样品,阳性率最高,为30.00%;34份双阳区样品阳性率次之,为29.41%;23份九台区样品和23份德惠市样品,阳性率均为17.39%;农安县的51份样品和吉林市的24份样品阳性率均为0%。吉林省各地区牛冠状病毒病原核酸阳性率结果如表 2所示。
|
|
表 2 吉林省各地区牛冠状病毒病原核酸检测结果 Table 2 Results of nucleic acid detection of bovine coronavirus pathogens in various areas of Jilin Province |
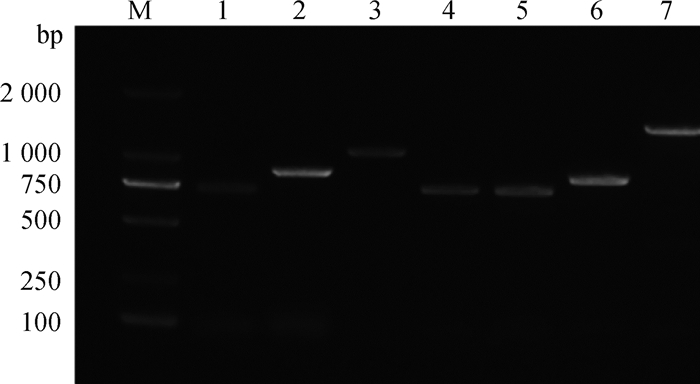
对BCoV特异性引物检测出的阳性样品进行测序比对发现序列一致。以阳性样品的cDNA为模板使用普通PCR方法进行HE、S基因的全长扩增,结果所扩增的HE序列比对后均一致,由于S基因因变异性高,仅完整扩增出一条,经琼脂糖凝胶电泳图可知(图 2),获得了预期目的片段。
|
M.DNA相对分子质量标准;1.S1-894 bp;2.S2-887 bp;3.S3-1 108 bp;4.S4-756 bp;5. S5-748 bp;6. S6-813 bp;7. HE-1201 bp M. DNA marker; 1.S1-894 bp; 2.S2-887 bp; 3.S3-1 108 bp; 4.S4-756 bp; 5. S5-748 bp; 6. S6-813 bp; 7. HE-1201 bp 图 2 S1-S6和HE基因的扩增结果 Fig. 2 Amplification results of S1-S6 and HE genes |
将PCR扩增产物使用琼脂糖凝胶纯化回收试剂盒对目的片段进行回收纯化,送至测序公司。测序成功的序列HE、S1-S6分别应用DNAMAN软件进行拼接,HE、S两条序列均拼接成功。登录NCBI网站,分别将HE、S序列进行blast比对,结果表明其与BCoV的相似性高达99%,证实所扩增的序列确实为BCoV的HE、S序列。
应用DNAStar软件中的Megaline,将HE、S基因序列同GenBank上传的30条国内外BCoV序列进行同源性分析及遗传进化树的构建。发现此研究中的HE基因序列同GenBank中不同毒株序列的核苷酸相似性均较高(96.20%~99.60%),其中,与中国四川株(MW711306.1)相似性最高,相似性为99.60%;与美国经典株Mebus株相似性为96.90%。通过构建进化树发现,此研究中的BCoV-JL的HE基因序列与中国四川株(MW711306.1)亲缘关系最近,位于同一分支,并与另外3株中国四川株、1株中国青海株(MW711309.1、MH475914.1、MN982191.1、MW711319.1)聚为一小分支,亲源关系较近(图 3、4)。S基因同GenBank中不同毒株序列的核苷酸相似性均较高(89.50%~99.10%),其中,与中国四川株(MN982198.1、MW711287.1、MN982199.1)相似性均达99%以上,与美国经典株Mebus株相似性为89.90%。通过构建遗传进化树发现,此研究中的BCoV-JL株与中国河北株(MK903506.1)距离最近,并与中国四川株(MN982198.1、)MN982199.1、MW711287.1)中国新疆株(KU886219.1)聚为一小分支(图 5、6)。

|
图 3 HE基因核苷酸同源性 Fig. 3 Nucleotide homology of HE genes |

|
▲.本研究扩增的毒株;△.与所扩增的毒株亲缘关系相近的毒株 ▲.The strain amplified in this study; △.The strain with similar affinity to the amplified strain 图 4 HE基因遗传进化树 Fig. 4 Phylogenetic trees based on HE gene |

|
图 5 S基因核苷酸同源性 Fig. 5 Nucleotide homology of S genes |

|
▲.本研究扩增的毒株;△.与所扩增的毒株亲缘关系相近的毒株 ▲.The strain amplified in this study; △.The strain with similar affinity to the amplified strain 图 6 S基因遗传进化树 Fig. 6 Phylogenetic trees based on S gene |
通过调查吉林省各地区1 298份血清样品的BCoV的抗体水平发现:吉林省各地区BCoV的总体抗体阳性率为1.08%,东中西部平均抗体阳性率为1.39%, 其中东、西、中部地区的阳性率分别为2.50%、1.10%、0.56%,结果见表 3。
|
|
表 3 吉林省各地区牛冠状病毒病抗体情况 Table 3 Antibodies to bovine coronavirus disease in various regions of Jilin Province |
牛冠状病毒(BCoV)在全球范围内流行,该病是牛呼吸道疾病综合征(BRDC)重要的病毒性病原之一[13-15],可引起包括严重的呼吸道病和消化道腹泻症状,可导致病牛死亡,目前缺少有效的防制手段。自1990年我国学者姚火春等[16]首次发现牛冠状病毒病后, 牛冠状病毒在我国各省份牛临床样本中陆续检出[17-21]。近两年在临床腹泻和呼吸道疫病的临床样本中,牛冠状病毒的检测逐年增加。2020年以前,吉林省中部地区牛呼吸道及腹泻样本核酸检测以牛病毒性病毒(BVDV)、牛传染性鼻气管炎病毒(BHoV-1)和牛呼吸道合胞体病毒(BRSV)较为常见,以BVDV最多[22-24]。2020年以后,在吉林省各个地区均有大量临床样检测到BCoV,或者BCoV与其他病毒混合感染的情况,混合感染的牛场犊牛病死率更高,总体来看,吉林省各地区均存在牛冠状病毒的感染情况,BCoV的流行主要集中在吉林省的东部地区,中部地区和西部地区感染率稍低。2020年冬季,吉林双辽某牛场规模化犊牛因BCoV单纯感染,导致3~4月龄犊牛死亡率接近70%。吉林四平某规模化牛场因BCoV与BVDV混合感染导致新生犊牛死亡率高达76.8%,吉林丰满区某家庭型养牛户6只牛犊5头死亡,损失惨重。本研究调查显示,急性发病期牛临床剖检肺部、心脏及肠道病变严重,且可形成毒血症,侵袭动物机体各组织脏器,同时鼻拭子及粪便中均可检测到病毒。BCoV的HE蛋白的单克隆抗体在体外有效中和了BCoV感染性,并在体内保护牛的肠上皮免受病毒感染[25],与S蛋白有相似功能,在诱导BCoV感染的保护作用中发挥重要作用。另外BCoV的S蛋白参与受体识别、宿主特异性、抗原多样性和免疫原性[26]。其基因序列是可变的,该蛋白的突变与病毒抗原性、病毒致病性、宿主范围和组织取向的改变有关[27],因此对吉林省内BCoV流行毒株的HE、S基因进行了分析,其序列同GenBank中29株代表性毒株序列分析结果显示,不同毒株序列的核苷酸相似性均较高,相似性均达90%以上,与中国四川株、河北株亲缘关系最近,处于同一分支,与美国经典株Mebus株亲缘关系较远,属于国内流行毒株。
该病入秋以后陆续发生,冬春两季高发,与抗原检测的阳性率相比,牛血清样品中BCoV抗体阳性率较低,分析原因可能与采样时间有关,部分血清采集自发病牛场,处于疫病急性期,血清抗体滴度低,一部分采集自9月份,可能原因为春季疫病流行过后抗体持续期时间较短导致,但未见有相关研究文献报道,是否为抗体阳性率低的原因尚待进一步研究分析。后续将对病原学阳性地区和阳性牛群进行重点采样,进行血清流行病学检测,以进一步评估BCoV的流行分布情况,支撑对BCoV的流行病学调查及综合防控的理论指导。
新冠疫情的突然暴发,对养殖业行业也产生了深远影响,非洲猪瘟暴发之后,畜牧业动荡,产业格局正在发生变化。吉林省是我国肉牛业大省,是东北肉牛优势产业带的核心,肉牛业为吉林省畜牧业支柱产业之一。虽然我国养牛业发展迅速,牛存栏数量和牛肉消费量位于世界前列水平,但肉牛养殖水平整体落后,科学研究技术水平相对滞后,尤其疫病研究起步晚,可用于支持产业的发展的生物制品少,重视度不够。近年来规模化养殖场逐渐增多,但标准化科学养殖体系尚未形成,疫病防控监管力度不够,防病意识薄弱,尤其以牛呼吸道疾病问题突出,本病秋冬两季发病率高,死亡率也呈上升趋势,严重制约产业的发展。本研究对吉林省中部地区BCoV流行情况进行了全面调查,丰富了牛冠状病毒的流行病学调查数据,为指导牛冠状病毒的防控工作奠定了基础,为制定和指导牛冠状病毒的防控提供科学依据。
4 结论吉林省地区牛冠状病毒已广泛流行与传播,2021—2022年间,平均感染率为21.10%,犊牛更易感,多发病于冬春季节,东部地区属于高发,属于国内流行毒株。
| [1] |
SAIF L J. Animal coronaviruses: what can they teach us about the severe acute respiratory syndrome?[J]. Rev Sci Tech, 2004, 23(2): 643-660. DOI:10.20506/rst.23.2.1513 |
| [2] |
MEBUS C A, STAIR E L, RHODES M B, et al. Pathology of neonatal calf diarrhea induced by a coronavirus-like agent[J]. Vet Pathol, 1973, 10(1): 45-64. DOI:10.1177/030098587301000105 |
| [3] |
ClARK M A. Bovine coronavirus[J]. Br Vet J, 1993, 149(1): 51-70. DOI:10.1016/S0007-1935(05)80210-6 |
| [4] |
SAIF L J. Bovine respiratory coronavirus[J]. Vet Clin North Am Food Anim Pract, 2010, 26(2): 349-364. DOI:10.1016/j.cvfa.2010.04.005 |
| [5] |
ZHANG J Y, ZENG H, GU J, et al. Progress and prospects on vaccine development against SARS-CoV-2[J]. Vaccines, 2020, 8(2): 153. DOI:10.3390/vaccines8020153 |
| [6] |
STORZ J, ZHANG X M, ROTT R. Comparison of hemagglutinating, receptor-destroying, and acetylesterase activities of avirulent and virulent bovine coronavirus strains[J]. Arch Virol, 1992, 125(1-4): 193-204. DOI:10.1007/BF01309637 |
| [7] |
LI F. Structure, function, and evolution of coronavirus spike proteins[J]. Ann Rev Virol, 2016, 3: 237-261. DOI:10.1146/annurev-virology-110615-042301 |
| [8] |
PRÉVOST J, GASSER R, BEAUDOIN-BUSSIÈRES G, et al. Cross-sectional evaluation of humoral responses against SARS-CoV-2 Spike[J]. Cell Rep Med, 2020, 1(7): 100126. DOI:10.1016/j.xcrm.2020.100126 |
| [9] |
LORENZETTI E, DE ARRUDA LEME R, RIBEIRO J, et al. Diarreia neonatal por coronavírus bovino (BCoV) em rebanhos bovinos de corte[J]. Semin: Ciênc Agrár, 2013, 34(6Supl2): 3795-3800. DOI:10.5433/1679-0359.2013v34n6Supl2p3795 |
| [10] |
LEWIS L D, PHILLIPS R W. Pathophysiologic changes due to coronavirus-induced diarrhea in the calf[J]. J Am Vet Med Assoc, 1978, 173(5 Pt 2): 636-642. |
| [11] |
SMITH D R, FEDORKA-CRAY P J, MOHAN R, et al. Epidemiologic herd-level assessment of causative agents and risk factors for winter dysentery in dairy cattle[J]. Am J Vet Res, 1998, 59(8): 994-1001. |
| [12] |
孙飞雁, 李智杰, 魏宇, 等. 牛冠状病毒纳米PCR检测方法的建立及初步应用[J]. 中国兽医科学, 2021, 51(10): 1221-1226. SUN F Y, LI Z J, WEI Y, et al. Establishment and preliminary application of a Nano-PCR method for detection of bovine coronavirus[J]. Chinese Veterinary Science, 2021, 51(10): 1221-1226. (in Chinese) |
| [13] |
STUDER E, SCHÖNECKER L, MEYLAN M, et al. Prevalence of BRD-related viral pathogens in the upper respiratory tract of Swiss veal calves[J]. Animals, 2021, 11(7): 1940. DOI:10.3390/ani11071940 |
| [14] |
ELLIS J. What is the evidence that bovine coronavirus is a biologically significant respiratory pathogen in cattle?[J]. Can Vet J, 2019, 60(2): 147-152. |
| [15] |
刘志鹏, 董秀梅, 师东方, 等. 牛呼吸道疾病综合征的主要病原[J]. 畜牧兽医科技信息, 2012(12): 9-11. LIU Z P, DONG X M, SHI D F, et al. Main pathogens of Bovine respiratory disease complex[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2012(12): 9-11. (in Chinese) |
| [16] |
姚火春, 杜念兴, 徐为燕, 等. 牛冠状病毒的血清流行病学调查[J]. 南京农业大学学报, 1990, 13(2): 117-121. YAO H C, DU N X, XU W Y, et al. Seroepizootiological survey of bovine coronavirus in cattle, human and other animals[J]. Journal of Nanjing Agricultural University, 1990, 13(2): 117-121. (in Chinese) |
| [17] |
马忠贤. 河南省清丰县牛冠状病毒流行学调查[J]. 中国乳业, 2017(6): 65-66. MA Z X. Epidemiological investigation of Bovine Coronavirus in Henan province Qingfeng county[J]. China Dairy, 2017(6): 65-66. (in Chinese) |
| [18] |
彭昊, 吴翠兰, 李军, 等. 广西部分地区牛腹泻病例的冠状病毒检测与分析[J]. 动物医学进展, 2020, 41(11): 122-124. PENG H, WU C L, LI J, et al. Detection and analysis of bovine coronavirus in cattle with diarrhea in part area of Guangx[J]. Progress in Veterinary Medicine, 2020, 41(11): 122-124. (in Chinese) |
| [19] |
沙金明, 卡卓措, 汪正顺. 青海省黄南州牛群3种病毒性腹泻疾病的血清学调查[J]. 畜牧与兽医, 2014, 46(10): 94-96. SHA J M, KA Z C, WANG Z S. Serological investigation of three viral diarrheal diseases in cattle in Huangnan Prefecture[J]. Animal Husbandry & Veterinary Medicine, 2014, 46(10): 94-96. (in Chinese) |
| [20] |
杨海峰, 粟灵琳, 王婧, 等. 我国14省市呼吸道综合征患牛冠状病毒感染的检测[J]. 畜牧与兽医, 2019, 51(11): 92-96. YANG H F, SU L L, WANG J, et al. Detection of bovine coronavirus infection in calves with respiratory disease syndrome in 14 provinces of China[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(11): 92-96. (in Chinese) |
| [21] |
张坤, 剡根强, 王静梅, 等. 新疆北疆部分地区致犊牛腹泻冠状病毒的分子流行病学调查[J]. 中国兽医科学, 2015, 45(12): 1270-1276. ZHANG K, YAN G Q, WANG J M, et al. Molecular epidemiological investigation of calf diarrhea coronavirus in parts of northern Xinjiang[J]. Chinese Veterinary Science, 2015, 45(12): 1270-1276. (in Chinese) |
| [22] |
刘泽余, 李健友, 刘占悝, 等. 吉林省牛病毒性腹泻病毒流行病学调查分析[J]. 黑龙江畜牧兽医, 2019(24): 62-67, 174. LIU Z Y, LI J Y, LIU Z K, et al. Epidemiological investigation and analysis of Bovine viral diarrhea virus in Jilin province[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(24): 62-67, 174. (in Chinese) |
| [23] |
刘泽余, 刘占悝, 李智杰, 等. 吉林省部分牛场BVDV、IBRV、BRSV的感染情况调查[J]. 畜牧与兽医, 2019, 51(12): 101-105. LIU Z Y, LIU Z K, LI Z J, et al. Investigation of BVDV, IBRV and BRSV infection in some cattle farms of Jilin province[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(12): 101-105. (in Chinese) |
| [24] |
王喜伟, 孙亮, 郭利, 等. 三种牛病血清流行病学调查[J]. 吉林畜牧兽医, 2020, 41(12): 101. WANG X W, SUN L, GUO L, et al. Serological epidemiological investigation of three bovine disease[J]. Jilin Animal Husbandry and Veterinary Medicine, 2020, 41(12): 101. (in Chinese) |
| [25] |
DEREGT D, BABIUK L A. Monoclonal antibodies to bovine coronavirus: characteristics and topographical mapping of neutralizing epitopes on the E2 and E3 glycoproteins[J]. Virology, 1987, 161(2): 410-420. |
| [26] |
LI F. Evidence for a common evolutionary origin of coronavirus spike protein receptor-binding subunits[J]. J Virol, 2012, 86(5): 2856-2858. |
| [27] |
GALLAGHER T M, BUCHMEIER M J. Coronavirus spike proteins in viral entry and pathogenesis[J]. Virology, 2001, 279(2): 371-374. |
(编辑 白永平)



