鸡传染性法氏囊病(IBD)是由鸡传染性法囊病病毒(IBDV)引起的主要感染雏鸡的一种急性、高度接触性和免疫抑制性传染病[1-3]。该病于1957年首发于美国甘布罗地区,又被称为“甘布罗病”。60多年来,该病一直威胁着养禽业的发展,世界动物卫生组织认为IBD已成为影响社会经济的重要疾病[4-6]。抗原变异、免疫抑制,特别是超强毒株(vvIBDV)的出现,使得该病的防控形势更加严峻[7-9]。IBDV基因组由两个双股RNA节段组成,分别为A节段和B节段。A节段编码的VP2蛋白构成病毒的外衣壳,是IBDV的主要结构蛋白。VP2可以诱导机体产生中和抗体,是IBDV主要的宿主保护性抗原[10]。目前,IBD主要通过传统活疫苗和灭活疫苗进行防控,但活疫苗免疫效果易于受到母源抗体干扰,中毒力活疫苗会造成接种鸡法氏囊损伤,引起免疫抑制;灭活疫苗免疫持续期较短,需多次加强免疫[11]。因此研制安全性好、不受母源抗体干扰、免疫持续期长的新型基因工程疫苗对IBD的防控具有重要意义。
鸡马立克病(MD)是由马立克病病毒引起的一种鸡的传染性肿瘤病,以淋巴组织增生和肿瘤形成为特征,该病是鸡的主要疾病之一,也是国内外20世纪50年代以来最受重视的鸡病[12-14]。火鸡疱疹病毒(HVT)在国内外被广泛用于MD的防控。HVT基因组较大,可供外源基因插入的复制非必需区多,是构建重组活载体疫苗的理想载体[15-18]。本研究利用HVT多片段黏粒拯救系统和LR重组技术,将IBDV VP2基因表达框架插入HVT基因组,构建了表达VP2基因的重组病毒rHVT-VP2,并对其体外生物学特性进行了分析,为研制IBD重组HVT活载体疫苗奠定了基础。
1 材料与方法 1.1 质粒、菌株和病毒pCI载体由中国农业科学院哈尔滨兽医研究所保存;pENTR入门载体、克隆有Kan/ccdB基因的重组黏粒H3-Kan/ccdB、克隆有HVT-FC126株基因组片段的5个重组黏粒H1、H2、H3、H4、H5由中国农业科学院哈尔滨兽医研究所构建并保存。大肠杆菌EPI300株购自EPICENTRE公司;IBDV超强毒株HLJ0504株由中国农业科学院哈尔滨兽医研究所鉴定并保存。
1.2 主要试剂常规PCR反应酶、限制性内切酶、连接酶购自TaKaRa公司;Gateway®LR ClonaseTM II Enzyme Mix和磷酸钙转染试剂盒均购自Invitrogen公司;质粒中提试剂盒购自QIAGEN公司;细胞裂解液,购自碧云天公司;细胞培养基及胎牛血清购自Gibco公司;二甲基亚砜(DMSO)购自BioFroxx公司;鼠抗兔IgG-FITC、IRDye-800标记的羊抗兔IgG,购自Licor公司;VP2单克隆抗体(MAb)由中国农业科学院哈尔滨兽医研究所制备并保存。
1.3 引物的设计与合成根据IBDV超强毒HLJ0504株VP2基因序列,利用Oligo 7.0软件设计扩增VP2基因的引物VP2F:5′- GAA TTC GCC ACC ATG ACA AAC CTG CAA GAT CAA ACC -3′和VP2R:5′- ATC GAT TCA CCT CCT TAA GGC CCG AAT TAT GTC -3′,预期扩增片段长度为1.4 kb。根据HVT FC126株基因组序列设计1条引物H45R:5′- ATA AAT AAA ACA CAG TAA CCG TTA-3′,VP2F和H45R组成1对引物,用于鉴定重组黏粒及重组病毒,预期扩增片段长度为1.6 kb。引物均由吉林省库美生物公司合成。
1.4 表达VP2基因的重组粘粒的构建及鉴定以IBDV HLJ0504株基因组为模板,利用引物VP2F、VP2R经RT-PCR扩增获得VP2基因。将纯化后的VP2基因经EcoRⅠ、KpnⅠ酶切后克隆入pCI载体,构建重组质粒pCI-VP2。将该重组质粒经BglⅡ、BamHⅠ酶切后获得VP2表达框架,将其克隆入pENTR入门载体的BglⅡ、BamH1位点,获得含有VP2表达框架的重组入门质粒pENTR-VP2。将pENTR1-VP2与重组黏粒H3-Kan/ccdB均稀释至300 ng·μL-1,各取1与2 μL的Gateway LR ClonaseTM Ⅱ Enzyme Mix混合,置于室温作用1 h。将反应产物转化大肠杆菌EPI300并涂布在氯霉素抗性LB平板上,37 ℃过夜培养。挑取平板上的单个菌落加入氯霉素抗性LB液体培养基中扩大培养,提取黏粒,用引物VP2F、H45R经PCR鉴定重组黏粒是否插入VP2表达框架,并对PCR产物测序鉴定,鉴定正确的重组黏粒命名为H3-VP2。
1.5 表达VP2基因的重组HVT的拯救及鉴定利用质粒提取试剂盒提取VP2重组黏粒H3-VP2以及其他4个克隆有HVT基因组片段的亲本黏粒H1、H2、H4、H5,通过磷酸钙法将5个经SbfⅠ酶切线性化的黏粒共转染CEF细胞,4 ~5 d后,观察转染的细胞是否出现HVT特异性蚀斑病变。出现蚀斑后收获病毒,并在CEF细胞中连续传20代。利用试剂盒提取第5、10、15、20代重组病毒的基因组DNA,同时设亲本病毒基因组DNA对照,利用引物VP2F/H45R经PCR鉴定,并测序鉴定,鉴定正确的重组病毒命名为rHVT-VP2。
1.6 重组病毒rHVT-VP2表达VP2蛋白的检测将第20代重组病毒rHVT-VP2与亲本病毒分别接种CEF,培养3~4 d出现蚀斑病变后,用无水乙醇固定细胞,并以VP2蛋白MAb(1∶400)作为一抗,以FITC标记的羊抗鼠IgG(1∶200)作为二抗,采用间接免疫荧光试验(IFA)鉴定VP2蛋白的表达。同时,以VP2蛋白MAb(1∶500)作为一抗,以IRDye-800标记的羊抗鼠IgG(1∶10 000)作为二抗,采用蛋白质印迹试验(Western blot)鉴定VP2蛋白的表达。以上试验均以亲本病毒接毒的CEF作阴性对照。
1.7 重组病毒rHVT-VP2体外生长曲线的测定将重组病毒rHVT-VP2和亲本病毒HVT-FC126株以100个蚀斑形成单位(PFU)的剂量接种于48孔板中的CEF上,感染后每隔24 h收集含毒细胞,持续至感染后144 h。将各个时间点所收集病毒接种CEF,测定各时间点病毒液的蚀斑数目,绘制生长曲线,分析重组病毒rHVT-VP2和亲本病毒在CEF中的体外复制特性。
1.8 重组病毒rHVT-VP2免疫原性检测取1日龄SPF鸡40只,分成4组,每组10只。组1和组2分别以4 000 PFU·只-1剂量颈部皮下接种重组病毒rHVT-VP2和亲本病毒HVT-FC126;组3和组4不接种,作为对照组。免疫后28 d,组1~组3试验鸡分别采血,分离血清,检测IBDV中和抗体[11];组1~组3试验鸡经滴鼻、点眼途径接种IBDV超强毒HLJ0504株(0.1 mL·只-1),组4不攻毒作为健康对照。攻毒后观察7 d,统计各组鸡存活情况。
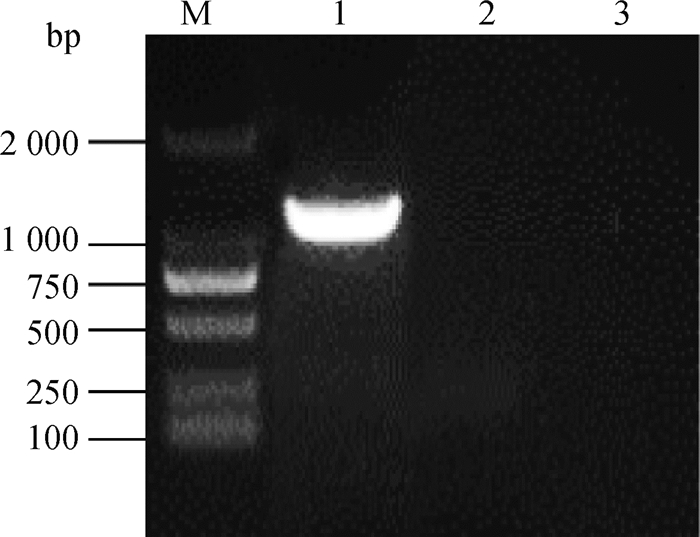
2 结果 2.1 表达VP2基因的重组黏粒的构建及鉴定将RT-PCR扩增获得的VP2基因插入到pCI载体,构建获得重组真核表达质粒pCI-VP2。通过酶切获得VP2基因表达框架并将其克隆至pENTR入门载体,构建获得重组入门质粒pENTR-VP2。通过LR重组反应,使VP2表达框架替换H3-Kan/ccdB中的Kan/ccdB筛选基因并克隆至HVT重组黏粒H3中,构建获得在HVT基因组UL45和UL46基因之间插入VP2基因表达框架的重组黏粒H3-VP2。用VP2F、H45R对重组黏粒进行PCR及测序鉴定,结果显示,获得的PCR产物长度为1.6 kb(图 1),测序结果显示,PCR产物包含VP2基因和VP2表达盒下游polyA序列。而阴性对照样品(亲本黏粒H3)无VP2基因插入序列,PCR结果为阴性。以上结果表明,重组黏粒H3-VP2构建正确。
|
M.DL2000 DNA相对分子质量标准;1.H3-VP2; 2.H3; 3.ddH2O M.DL2000 DNA marker; 1.H3-VP2; 2.H3; 3.ddH2O 图 1 重组黏粒H3-VP2 PCR鉴定 Fig. 1 Identification of recombinant fosmid H3-VP2 by PCR |
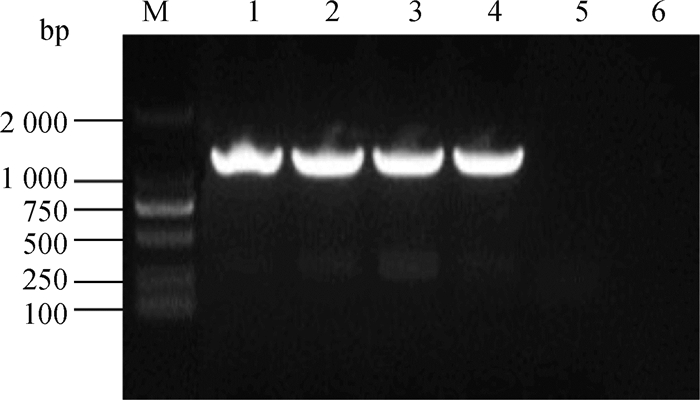
将重组黏粒H3-VP2与其他4个克隆有HVT基因组片段的重组黏粒H1、H2、H4、H5共转染CEF,转染后4 d出现HVT特异性蚀斑病变,拯救获得重组病毒rHVT-VP2。将重组病毒在CEF上进行连续传代,每隔5代提取病毒基因组DNA进行PCR鉴定及测序。结果表明,PCR产物长度均为1.6 kb,与预期结果相符(图 2),测序结果显示,插入序列与预期一致。亲本病毒HVT-FC126株基因组DNA扩增结果为阴性。以上结果表明,VP2基因正确插入HVT基因组中且能够稳定存在,重组病毒rHVT-VP2构建正确。
|
M.DL2000 DNA相对分子质量标准;1.rHVT-VP2_F05; 2.rHVT-VP2_F10; 3.rHVT-VP2_F15; 4.rHVT-VP2_F20; 5.HVT-FC126; 6.ddH2O M.DL2000 DNA marker; 1.rHVT-VP2_F05; 2.rHVT-VP2_F10; 3.rHVT-VP2_F15; 4.rHVT-VP2_F20; 5.HVT-FC126; 6.ddH2O 图 2 不同代次重组病毒rHVT-VP2 PCR鉴定 Fig. 2 PCR identification of different generations of recombinant virus rHVT-VP2 |
将第20代重组病毒rHVT-VP2与亲本病毒分别接种CEF,培养3~4 d出现蚀斑病变后进行IFA和Western blot,检测VP2蛋白表达情况。结果显示,重组病毒rHVT-VP2感染的细胞与VP2单克隆抗体反应,可见绿色荧光信号;HVT亲本病毒以及没有接毒的对照细胞未见荧光(图 3)。Western blot试验结果显示,重组病毒rHVT-VP2感染的细胞中可以检测到VP2蛋白的表达,表达蛋白大小约50 ku,大小与预期相符(图 4)。HVT亲本病毒以及没有接毒的对照细胞未检测到VP2蛋白表达,对照蛋白β-actin在重组病毒rHVT-VP2、亲本病毒以及未接毒对照中均检测到表达。以上结果表明重组病毒rHVT-VP2可在感染细胞中稳定表达VP2蛋白。

|
图 3 间接免疫荧光试验检测重组病毒(rHVT-VP2)和亲本病毒(HVT-FC126)感染CEF中VP2蛋白表达情况 Fig. 3 The VP2 expression results in CEFs infected with recombinant virus rHVT-VP2 or parental virus HVT-FC126 using IFA test |

|
M.蛋白质相对分子质量标准;1.HVT-FC126;2.rHVT-VP2;3.细胞对照 M.Protein marker; 1.HVT-FC126;2.rHVT-VP2;3.Mock 图 4 蛋白质印迹试验检测重组病毒(rHVT-VP2)和亲本病毒(HVT-FC126)VP2蛋白表达情况 Fig. 4 The VP2 expression from recombinant virus HVT-VP2 or the parental virus HVT-FC126 by Western blot test |
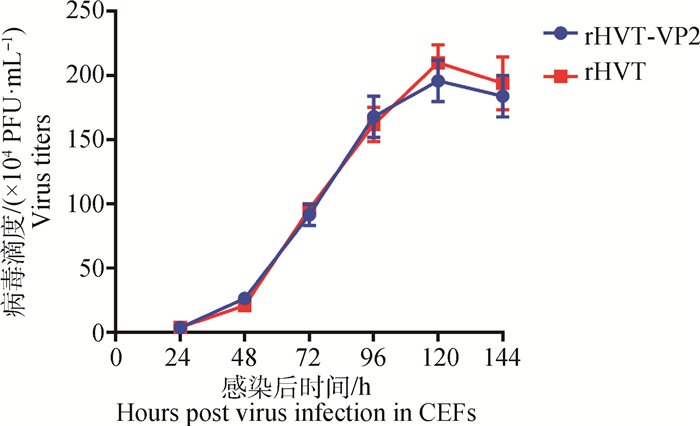
将重组病毒rHVT-VP2和亲本病毒HVT-FC126以100 PFU接种CEF,每隔24 h收集细胞,滴定病毒的体外复制动力学曲线。结果显示,重组病毒rHVT-VP2与亲本病毒HVT-FC126均在感染后120 h复制滴度达到最高峰,分别为1.96×106 PFU·mL-1和2.10×106 PFU·mL-1,感染CEF后各个时间点重组病毒的滴度与亲本病毒均无明显差异(P>0.05)(图 5)。以上结果表明重组病毒rHVT-VP2株在CEF中的复制特性与亲本病毒一致。
|
图 5 重组病毒(rHVT-VP2)和亲本病毒(HVT-FC126)在CEF上的复制动力学曲线 Fig. 5 Growth curve of recombinant virus rHVT-VP2 and parental virus HVT-FC126 in CEFs |
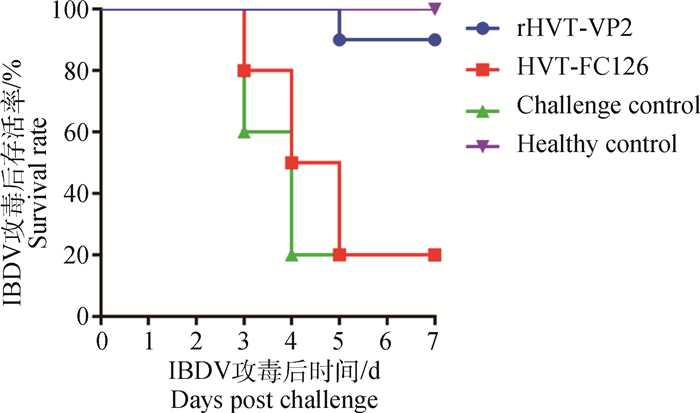
将重组病毒rHVT-VP2以4 000 PFU·只-1剂量接种1日龄SPF鸡,免疫后28 d采血,分离血清,检测IBDV中和抗体。结果如图 6所示,重组病毒rHVT-VP2免疫鸡血清中IBDV中和抗体平均滴度可以达到26.4,免疫亲本病毒HVT-FC126的鸡以及不免疫对照鸡IBDV中和抗体为阴性。以上结果表明,重组病毒rHVT-VP2免疫雏鸡后诱导产生了良好的免疫反应。免疫后28 d,对免疫组和对照组分别攻毒,结果显示免疫重组病毒rHVT-VP2的10只鸡攻毒IBDV后有9只鸡健康存活,亲本病毒HVT-FC126免疫组和对照组攻毒IBDV后均表现出明显临床症状,10只鸡死亡8只(图 7)。以上结果表明,重组病毒rHVT-VP2免疫后对IBDV强毒攻击能够提供90%的免疫保护。

|
图 6 重组病毒rHVT-VP2免疫后IBDV中和抗体检测 Fig. 6 IBDV Virus neutralization antibody titers induced by rHVT-VP2 in chickens |
|
图 7 重组病毒rHVT-VP2免疫鸡攻毒IBDV强毒的存活率 Fig. 7 Survival rate of rHVT-VP2-vaccinated chickens after IBDV challenge |
IBD是一种严重危害养禽业的高致死性和免疫抑制性传染病,自1957年发现以来,已有60多年历史[1-3]。目前,用于预防IBD的疫苗主要是传统活疫苗和灭活疫苗,其中弱毒活疫苗免疫效果易于受到母源抗体干扰,中毒力活疫苗副作用大,能够引起接种鸡法氏囊损伤和免疫抑制,影响其他疫苗免疫保护效果[19]。全病毒灭活疫苗和亚单位疫苗不适于早期免疫且免疫持续期短,需要多次加强免疫,造成养殖环节免疫负担过重[20]。因此,研制安全性好、适于孵化场出壳免疫且免疫持续期长的新型疫苗对我国IBD的防控意义重大。活载体疫苗诱导机体产生的免疫比较广泛,可以同时表达多种抗原,制成多价或多联疫苗,是当今和未来疫苗研发的主要方向之一[16]。HVT作为一种疱疹病毒,具有基因组大、复制非必需区多且能容纳较大外源片段的优势,是研制活载体疫苗的理想载体。然而,目前我国还没有自主知识产权的IBD重组HVT活载体疫苗。
以往构建重组HVT大多采用同源重组法或细菌人工染色体(BAC)法[21]。同源重组法以及近年来新兴的CRISPR/Cas9方法在构建重组病毒过程中均需要引入筛选标记基因,且需要蚀斑纯化,难以短时间内获得纯净的重组病毒,多次细胞传代纯化蚀斑也会影响重组病毒免疫原性。BAC技术虽然能够在细菌中利用Red/ET重组技术对病毒基因组进行改造,进而拯救重组病毒,但后期需要采取一定的手段去除残留的BAC序列[13]。本研究在拯救表达VP2基因的重组HVT时采用了新型Fosmid黏粒拯救系统,该系统与BAC相比,具有稳定性好、无偏向性、构建周期短等诸多优点。由于HVT基因组分为不同节段克隆入黏粒中,在构建重组病毒时便于对不同的基因组片段分别进行操作,因此该系统更加适于插入多个外源基因的重组病毒的构建。
本研究将IBDV保护性抗原VP2基因表达框架插入HVT基因组UL45、UL46基因之间,构建获得重组病毒rHVT-VP2。rHVT-VP2在CEF传代20代后仍然能够高效表达VP2蛋白,且插入序列未见突变发生,表明该重组病毒具有良好的遗传稳定性。体外复制动力学曲线显示,rHVT-VP2在CEF上具有良好的复制能力,复制特性与亲本病毒无显著差异,表明VP2基因的插入不会对亲本病毒的复制造成显著影响。将重组病毒rHVT-VP2免疫雏鸡后可以诱导产生IBDV中和抗体,且能够对IBDV超强毒株攻毒造成的死亡提供90%免疫保护,表明该重组病毒具有良好的免疫原性。以上研究表明,重组病毒rHVT-VP2有望开发为一种预防IBD的新型疫苗。
4 结论本研究应用HVT新型Fosmid黏粒拯救系统,构建获得表达IBDV保护性抗原VP2的重组病毒rHVT-VP2。rHVT-VP2插入序列正确,能够稳定表达VP2蛋白,在CEF上具有良好的复制能力,免疫鸡后能够诱导产生IBDV中和抗体,并对IBDV强毒攻击提供良好免疫保护。重组病毒rHVT-VP2的成功构建为IBD重组HVT活载体疫苗的研制奠定了基础。
| [1] |
VAN DEN BERG T P. Acute infectious bursal disease in poultry: a review[J]. Avian Pathol, 2000, 29(3): 175-194. DOI:10.1080/03079450050045431 |
| [2] |
NOORUZZAMAN M, HOSSAIN I, RAHMAN M M, et al. Comparative pathogenicity of infectious bursal disease viruses of three different genotypes[J]. Microb Pathog, 2022, 169: 105641. DOI:10.1016/j.micpath.2022.105641 |
| [3] |
CHEN Z X, LIAN J M, LIANG Z S, et al. Characterization and pathogenicity of infectious bursal disease virus in Southern China[J]. Poult Sci, 2022, 101(10): 102018. DOI:10.1016/j.psj.2022.102018 |
| [4] |
ALIYU H B, HAMISU T M, BEJO M H, et al. Comparative pathogenicity of Malaysian variant and very virulent infectious bursal disease viruses in chickens[J]. Avian Pathol, 2022, 51(1): 76-86. DOI:10.1080/03079457.2021.2006604 |
| [5] |
SNYDER D B, LANA D P, SAVAGE P K, et al. Differentiation of infectious bursal disease viruses directly from infected tissues with neutralizing monoclonal antibodies: evidence of a major antigenic shift in recent field isolates[J]. Avian Dis, 1988, 32(3): 535-539. DOI:10.2307/1590924 |
| [6] |
JIANG N, WANG Y L, ZHANG W Y, et al. Genotyping and molecular characterization of infectious bursal disease virus identified in important poultry-raising areas of China during 2019 and 2020[J]. Front Vet Sci, 2021, 8: 759861. DOI:10.3389/fvets.2021.759861 |
| [7] |
VAN DEN BERG T P, GONZE M, MEULEMANS G. Acute infectious bursal disease in poultry: isolation and characterisation of a highly virulent strain[J]. Avian Pathol, 1991, 20(1): 133-143. DOI:10.1080/03079459108418748 |
| [8] |
WANG Y S, WANG Z C, TANG Y D, et al. Comparison of four infectious bursal disease viruses isolated from different bird species[J]. Arch Virol, 2007, 152(10): 1787-1797. DOI:10.1007/s00705-007-1022-1 |
| [9] |
VAN DEN BERG T P, MORALES D, ETERRADOSSI N, et al. Assessment of genetic, antigenic and pathotypic criteria for the characterization of IBDV strains[J]. Avian Pathol, 2004, 33(5): 470-476. DOI:10.1080/03079450400003650 |
| [10] |
LI G P, KUANG H Y, GUO H X, et al. Development of a recombinant VP2 vaccine for the prevention of novel variant strains of infectious bursal disease virus[J]. Avian Pathol, 2020, 49(6): 557-571. DOI:10.1080/03079457.2020.1791314 |
| [11] |
LI K, GAO H L, GAO L, et al. Adjuvant effects of interleukin-18 in DNA vaccination against infectious bursal disease virus in chickens[J]. Vaccine, 2013, 31(14): 1799-1805. DOI:10.1016/j.vaccine.2013.01.056 |
| [12] |
TENG M, ZHENG L P, LI H Z, et al. Pathogenicity and pathotype analysis of henan isolates of Marek's disease virus reveal long-term circulation of highly virulent MDV variant in China[J]. Viruses, 2022, 14(8): 1651. DOI:10.3390/v14081651 |
| [13] |
ZELNÍK V. Marek's disease virus research in the post-sequencing era: new tools for the study of gene functions and virus-host interactions[J]. Avian Pathol, 2003, 32(4): 323-333. DOI:10.1080/0307945031000121068 |
| [14] |
BIGGS P M, NAIR V. The long view: 40 years of Marek's disease research and Avian pathology[J]. Avian Pathol, 2012, 41(1): 3-9. DOI:10.1080/03079457.2011.646238 |
| [15] |
REDDY S M, IZUMIYA Y, LUPIANI B. Marek's disease vaccines: Current status, and strategies for improvement and development of vector vaccines[J]. Vet Microbiol, 2017, 206: 113-120. DOI:10.1016/j.vetmic.2016.11.024 |
| [16] |
ROMANUTTI C, KELLER L, ZANETTI F A. Current status of virus-vectored vaccines against pathogens that affect poultry[J]. Vaccine, 2020, 38(45): 6990-7001. DOI:10.1016/j.vaccine.2020.09.013 |
| [17] |
REEMERS S, VERSTEGEN I, BASTEN S, et al. A broad spectrum HVT-H5 avian influenza vector vaccine which induces a rapid onset of immunity[J]. Vaccine, 2021, 39(7): 1072-1079. DOI:10.1016/j.vaccine.2021.01.018 |
| [18] |
JIA W F, ZHANG X H, WANG H R, et al. Construction and immune efficacy of a recombinant turkey herpesvirus vaccine strain expressing fusion protein of genotype Ⅶ Newcastle disease virus[J]. Vet Microbiol, 2022, 268: 109429. DOI:10.1016/j.vetmic.2022.109429 |
| [19] |
SHARMA J M, KIM I J, RAUTENSCHLEIN S, et al. Infectious bursal disease virus of chickens: pathogenesis and immunosuppression[J]. Dev Comp Immunol, 2000, 24(2-3): 223-235. DOI:10.1016/S0145-305X(99)00074-9 |
| [20] |
MVLLER H, ISLAM M R, RAUE R. Research on infectious bursal disease - the past, the present and the future[J]. Vet Microbiol, 2003, 97(1-2): 153-165. DOI:10.1016/j.vetmic.2003.08.005 |
| [21] |
LIAO Y L, BAJWA K, REDDY S M, et al. Methods for the manipulation of herpesvirus genome and the application to Marek's disease virus research[J]. Microorganisms, 2021, 9(6): 1260. DOI:10.3390/microorganisms9061260 |
(编辑 白永平)



