2. 贵州大学动物科学学院, 贵阳 550025
2. College of Animal Sciences, Guizhou University, Guiyang 550025, China
关岭牛具有体质强壮、抗病力强等优良特性,其自身的独特基因是生物多样性的重要组成部分[1-2]。与其它黄牛品种相比,关岭牛产肉率低、生长迟缓,限制了高原山地畜牧业的发展。肌原性细胞的增殖分化是影响肌肉生长发育的关键,肌细胞增强因子2(myocyte enhancer factor2, MEF2)在肌肉细胞中广泛存在,可将该基因视作肌源性基因表达的主要调节物[3-4]。
研究表明,MEF2通过调节肌肉特异基因的表达影响骨骼肌发育分化进程,MEF2属于转录调节因子MADS-Box家族,该家族包括微小染色体维持蛋白(MCM1)、AGAMOUS、DEFICIENS和血清反应因子(SRF)等成员[5]。MEF2蛋白具备DNA结合活性,拥有结合肌肉肌酸激酶(MCK)基因启动子中富含A/T的DNA序列的能力[6]。前期研究中,MEF2基因家族在脊椎动物中包括MEF2A、MEF2B、MEF2C和MEF2D四个成员[7],该家族成员结构相似,皆含有中心MEF2结构域、N端结合DNA的MADS区域和C端转录激活区域;C末端区域主要由选择性拼接而成,MEF2因子可发生同源二聚化和多种异源二聚化,以具体的方式参与细胞生命周期中许多重要的转录过程[8]。MEF2主要通过MADS-box结构域和MEF2结构域与其他转录辅因子的互作来调控其下游靶基因的转录活性,具备调控细胞凋亡(包括神经元、肌肉、血管、淋巴细胞)和骨骼在内的多种组织的分化、形态发生和维持的作用[9-10]。
MEF2A基因是具有bHLH(basic helix-loop-helix)结构域的转录因子,包含MADS-box和HJURP-C两个保守结构域,两个结构域可识别肌肉调控基因启动区中E-box元件(CANNTG),进而激活下游基因的特异性表达[11-12]。Edmondson等[13]研究表明,在肌再生过程中,MEF2A是最早可检测到的基因之一,在骨骼肌中高度表达,对肌纤维聚合形成、骨骼肌干细胞和成肌细胞增殖分化具有不可或缺的作用[14-15]。Wu等[16]研究发现,MEF2A具备承接结构蛋白与调控因子的功能,该基因异位表达可结合Capn3启动子区域的预测位点,二者互作可影响L6成肌细胞的分化模型。MEF2A具备独特的转录活性,能够维持出生后心肌细胞结构的完整性,Clark和Naya[17]研究证实,MEF2A可通过调节Gtl2/Dio3位点,进而刺激转录辅因子CITED2来促进心肌细胞的增殖;此外,MEF2A可通过激活SIRT1的表达来保护血管内皮细胞[18]。Blixt等[19]研究报道,MEF2A基因在小鼠破骨细胞模型中具有性别特异性调节作用。因此,MEF2A对于肌肉组织生长发育的调控作用因组织类型而异,对骨骼肌成肌细胞增殖分裂具有重要作用。
目前,有关MEF2A基因在关岭牛(Bos taurus)成肌细胞上的研究鲜有报道,影响成肌细胞的机理尚不明确。因此,本试验以关岭牛成肌细胞作为研究对象,构建筛选MEF2A基因的最佳干扰载体,转染载体至细胞后,qRT-PCR法检测成肌细胞中肌生成相关基因的表达;检测细胞周期与活力特性。为进一步探索MEF2A基因对关岭牛肌肉发育的分子效应及调控机制提供数据参考。
1 材料与方法 1.1 试剂及仪器Lipofectamine TM3000CD Reagent脂质体转染试剂盒购自Thermo Fisher Scientific(美国);DMEM/F12培养基、Gibco澳洲胎牛血清均购自重庆奥怡生物技术有限公司;PBS溶液、青链霉素、Opti-MEMTM均购自广西卓一生物技术有限公司;Trizol试剂购自英骏生物技术有限公司(美国);SYBR Green qPCR Master Mix、逆转录试剂盒均购自Genstar公司(北京)。超微量紫外分光光度计购自美国Thermo Fisher公司;酶标仪购自美国Bio Tek公司;实时荧光定量PCR仪(型号为CFX96 Touch)、多功能梯度扩增PCR仪(型号为ABIVeriti-TM)、凝胶成像系统(型号为Uni-versal Hood Ⅱ)均购自美国BIO-RAD有限公司。
1.2 成肌细胞的培养与鉴定试验动物来自贵州省安顺市西秀区幺铺镇屠宰场,选择健康的3日龄犊牛,采集犊牛背最长肌,生理盐水(0.9% NaCl)冲洗后放入含双抗的PBS溶液中保存带回实验室。成肌细胞分离培养与鉴定参照宋林锦等[20]的操作方法。率先清理筋膜与杂质,剪碎肌肉组织后加入Ⅱ型胶原酶,放置37 ℃恒温摇床消化1 h,加入培养基混匀,依次通过灭菌纱布、200目和400目细胞筛,滤液以8 000 r·min-1离心8 min,弃上清液后加入10% DMEM/F-12培养基重悬细胞,放置于37 ℃,5% CO2的细胞培养箱中。利用免疫荧光法鉴定成肌细胞纯度,将细胞悬液接种在置有玻璃片的24孔板中,细胞培养箱中培养2 h;细胞爬片后,加入4%多聚甲醛于4 ℃条件下固定35 min,PBS洗涤3次后置于培养皿支撑物上。吸取60 μL破膜封闭液滴于防水膜上,2 h破膜封闭,取60 μL一抗(α-actin)于防水膜上,盖上玻片于4 ℃放置;避光孵育二抗(goat anti-rabbit lgG)2 h后,PBS洗涤3次,每次4 min,DAPI染色5 min,PBS洗涤3次,每次4 min。加1滴荧光封片剂于玻片上,将有细胞的一面盖上,用于后续拍照储存。
1.3 shRNA引物设计与合成参考NCBI数据库中的MEF2A基因编码区序列(GenBank登录号:NM_001083638.2)与短发夹RNA(short hairpin RNA, shRNA)设计原则,设计MEF2A基因的shRNA片段引物,共设置4个干扰组靶序列和1个NC组序列,分别命名为shRNA-MEF2A-1、shRNA-MEF2A-2、shRNA-MEF2A-3、shRNA-MEF2A-4与shRNA-NC。于序列两端添加EcoR Ⅰ与Sal Ⅰ酶切位点,序列中段插入Loop (TCAAGAG)结构,序列最后加上6个T,可作为RNA聚合酶Ⅲ的转录终止子发挥作用。由上海吉玛制药技术有限公司合成片段引物,引物序列信息见表 1。
|
|
表 1 shRNA信息 Table 1 shRNA primers information |
复苏空载体质粒,利用EcoRⅠ与SalⅠ同时进行酶切,取1.5 μL pGPU6-GFP-Neo、3 μL10×Green Buffer、1.5 μL EcoRⅠ、1.5 μL SalⅠ,加ddH2O补足30 μL,37 ℃条件下酶切2 h,酶切产物用1.2%的琼脂糖凝胶电泳检测并切胶回收;将shRNA片段连接到pGPU6-GFP-Neo载体,16 ℃金属浴过夜连接。连接产物转化到DH5α感受态细胞中,挑选单克隆菌落扩大培养,37 ℃,200 r·min-1振荡培养16 h,将菌液送至上海生工生物工程股份有限公司进行测序验证。
1.5 干扰载体转染与检测成肌细胞接种于6孔细胞培养板中,待细胞生长至80%~90%的融合度时,利用Lipofectamine 3000进行转染,分别将重组载体pGPU6-GFP-Neo-NC、pGPU6-GFP-Neo-MEF2A-1、pGPU6-GFP-Neo-MEF2A-2、pGPU6-GFP-Neo-MEF2A-3、pGPU6-GFP-Neo-MEF2A-4转染至成肌细胞内,各孔转染质粒2 500 ng,空白组不转染质粒,各转染组设置3个生物学重复,放置于37 ℃,5% CO2的培养箱中。48 h后将细胞置于荧光倒置显微镜下观察生长状态并检测MEF2A基因shRNA干扰效率。
1.6 qRT-PCR检测基因表达Trizol法提取细胞总RNA,反转录得到cDNA作为模板。依据NCBI中公布的基因序列,利用Primer 5.0设计牛肌细胞增强因子家族基因以及细胞生长相关基因CDK2、BCL2与CCNA2的荧光引物(表 2)。qRT-PCR检测肌细胞增强因子家族基因(MEF2A、MEF2B、MEF2C、MEF2D)以及BCL2、CDK2与CCNA2基因在最佳干扰组和对照组中的表达水平,GAPDH为内参基因。PCR反应体系10 μL:SYBR Green Mix 5 μL,上、下游引物各0.5 μL,cDNA 0.5 μL,ddH2O 3.5 μL。每个样品做3个生物学重复,反应条件为95 ℃预变性30 s;95 ℃变性5 s,退火5 s,95 ℃延伸5 s,共39个循环。
|
|
表 2 引物信息 Table 2 Primers information |
将最佳干扰组与对照组载体分别转染至成肌细胞,用4 ℃预冷的PBS洗涤,加入1 mL 0.25%不含EDTA的胰酶进行消化,1 000 r·min-1离心5 min,弃上清液,加入预冷的1.5 mL的70%乙醇吹打细胞,4 ℃储存过夜。离心乙醇固定过的细胞,弃上清液;PBS洗涤细胞3次;加入100 μL RNase A重悬细胞,37 ℃水浴锅中放置30 min,加入500 μL PI染色液,4 ℃避光反应30 min;利用流式细胞仪进行检测。
1.8 成肌细胞活性检测最佳干扰组与对照组载体分别转染至成肌细胞后,消化计数并接种于96孔细胞板中,各组别设置3个重复,在0、6、12、24、48和72 h时间段内进行检测,各孔添加10 μL的CCK8试剂,放置于37 ℃,5% CO2培养箱中培养2 h,利用酶标仪(SynerGyH1, BioTek)检测各组别在450 nm波长处的吸光度。
1.9 关岭牛MEF2A基因生物信息学分析利用在线软件ProtParam(https://web.expasy.org/protparam/)、PSORT II Preadict (https://psort.hgc.jp/form2.html)与STRING(https://string-db.org/)分别对关岭牛MEF2A的蛋白理化特性、亚细胞结构定位与蛋白网络图谱进行预测分析。
1.10 数据分析采用2-ΔΔCt法计算基因表达量,各组别设置3个生物学重复,数据均用“平均值±标准误”表示,采用独立样本t检验和单因素方差分析进行数据处理(SPSS 25.0),多重比较采用Duncan’s多重极差检验法,运用Graphpad 6.0作图。
2 结果 2.1 关岭牛成肌细胞培养与鉴定如图 1所示,固定细胞后,α-actin经异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记后在细胞质内阳性表达为绿色发光状态。细胞核为椭圆形状态,经4′, 6-二脒基-2-苯基吲哚(DAPI)染色后发蓝色光。细胞核与细胞质染色重合良好,表明成功培养鉴定关岭牛成肌细胞,进一步鉴定细胞纯度达到90%左右,可开展后续试验。
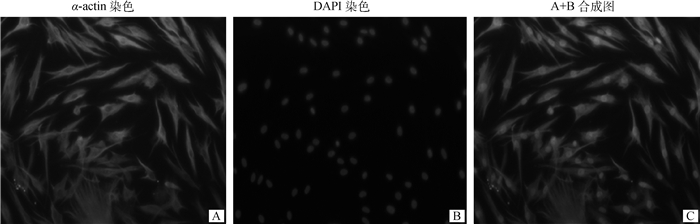
|
图 1 成肌细胞免疫荧光鉴定(200×) Fig. 1 Immunofluorescence identification of myoblasts(200×) |
将酶切纯化回收的pGPU6-GFP-Neo载体与退火后的shRNA置于16 ℃恒温金属浴中过夜连接,连接产物转化到DH5α感受态细胞中,挑选单克隆菌落进行摇菌培养,筛选阳性菌液送至上海生工生物工程股份有限公司测序验证。测序结果如图 2所示,插入的重组质粒片段与设计合成的序列一致,说明成功构建了重组质粒。
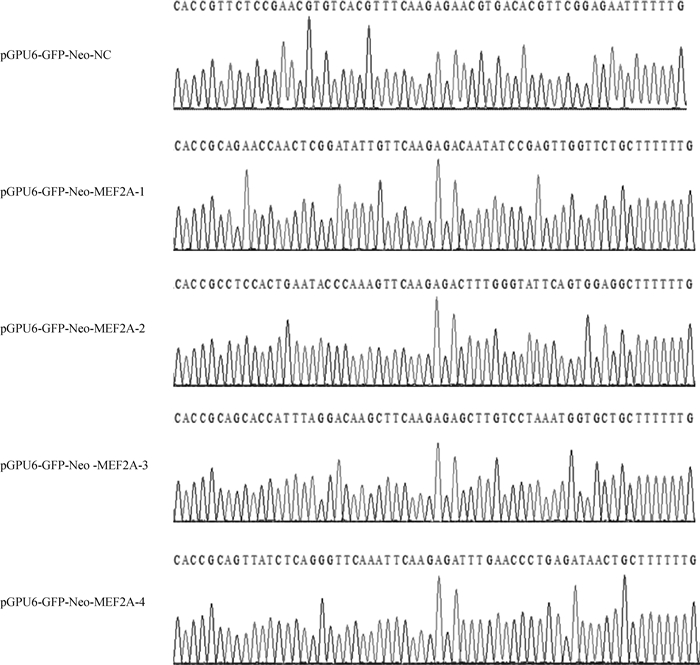
|
图 2 重组质粒测序分析结果 Fig. 2 Results of recombinant plasmid sequencing analysis |
将成肌细胞接种到6孔板中,细胞融合度达到90%左右时,将各干扰组与阴性对照组转染至成肌细胞,放置于细胞培养箱中48 h后用荧光倒置显微镜观察各组别绿色荧光蛋白的发光情况。结果如图 3所示,在荧光倒置显微镜下的各干扰组、阴性对照组均有清晰明亮的绿色荧光,其中空白组不发光,说明转染成功。
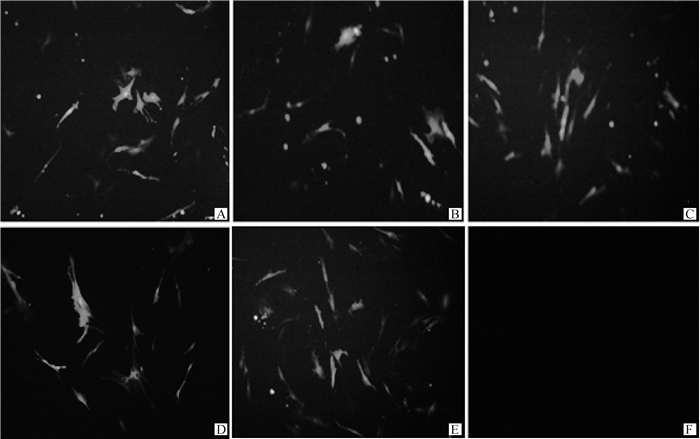
|
A. shRNA-MEF2A-1;B. shRNA-MEF2A-2;C. shRNA-MEF2A-3;D. shRNA-MEF2A-4;E. shRNA-NC;F. 空白对照 A. shRNA-MEF2A-1;B. shRNA-MEF2A-2;C. shRNA-MEF2A-3;D. shRNA-MEF2A-4;E. shRNA-NC; F. Blank control 图 3 干扰载体转染成肌细胞结果(100×) Fig. 3 Results of interfering vector transfection into myoblasts(100×) |
将各重组质粒分别转染至牛成肌细胞48 h,提取细胞RNA并逆转录为cDNA,qRT-PCR法检测MEF2A基因在不同组别中的表达量特性,筛选干扰效果最佳的试验组别。如图 4所示,shRNA-MEF2A-1、shRNA-MEF2A-2与shRNA-MEF2A-3和shRNA-MEF2A-4干扰效率依次为74.45%、58.67%、94.66%与62.98%。结果表明,4个干扰载体均能极显著下调MEF2A基因表达量(P<0.01),选用干扰效率最高的shRNA-MEF2A-3干扰载体开展后续试验。
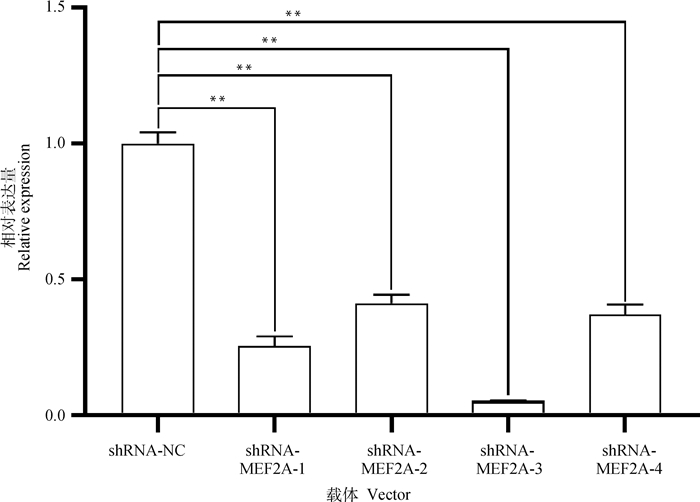
|
*. 表示差异显著(P < 0.05);**. 表示差异极显著(P < 0.01),下同 *. Represents significant difference (P < 0.05);**. Represents extremely significant difference (P < 0.01), the same as below 图 4 不同载体组别干扰效率 Fig. 4 Interference efficiency of different vector groups |
分别提取转染shRNA-MEF2A-3最佳干扰组和shRNA-NC对照组的细胞总RNA,对肌生成基因及周期与凋亡相关基因表达量进行qRT-PCR检测。结果如图 5所示,干扰MEF2A基因表达后,肌细胞增强因子MEF2B、MEF2C与MEF2D基因表达量均极显著上调(P < 0.01);细胞周期因子CDK2表达量显著下调(P < 0.05),CCNA2表达量极显著下调(P < 0.01);抗凋亡因子BCL2表达量显著下调(P < 0.05)。推断MEF2A基因在关岭牛成肌细胞中作用显著,与家族其他成员具有相互调控关系;干扰MEF2A可延长关岭牛成肌细胞周期,对其增殖具有抑制作用。
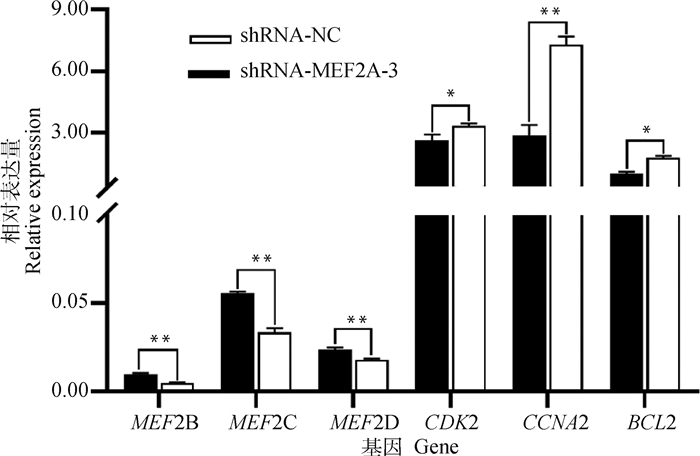
|
图 5 干扰MEF2A对成肌细胞基因表达的影响 Fig. 5 Effects of MEF2A interference on genes expression in myoblasts |
利用流式细胞仪检测转染shRNA-MEF2A-3干扰组和shRNA-NC对照组的细胞周期特性。结果如图 6所示,与shRNA-NC相比,转染shRNA-MEF2A-3的成肌细胞数量在G1期显著增多(P < 0.05),S期与G2/M期细胞数量极显著减少(P < 0.01)。研究结果表明,干扰MEF2A后,细胞周期G1至S期的进程被阻滞,细胞增殖受到抑制。
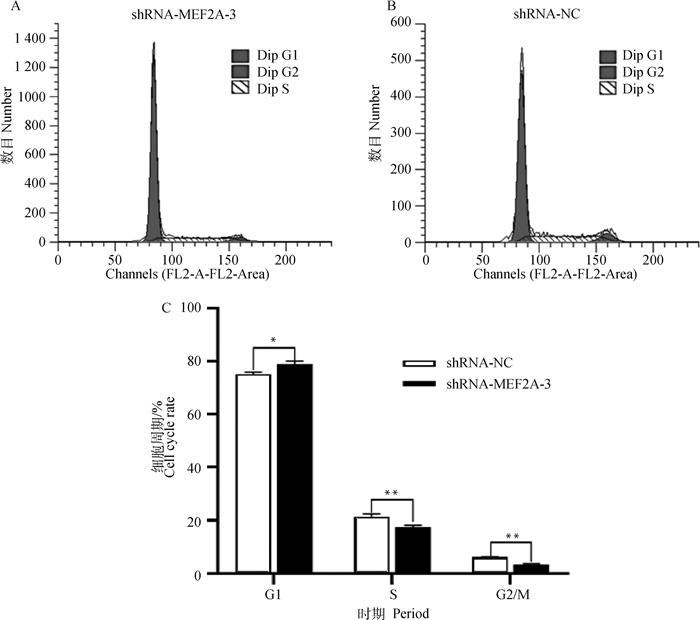
|
A. 干扰组细胞周期;B. NC组细胞周期;C. 细胞周期比例 A. Cell cycle in interference group; B. Cell cycle in NC group; C. Cell cycle ratio 图 6 干扰MEF2A对成肌细胞生长周期的影响 Fig. 6 Effects of interfering MEF2A on myoblasts growth cycle |
分别在0、6、12、24、48和72 h检测shRNA-MEF2A-3干扰组和shRNA-NC对照组的细胞生长增殖特性。CCK8检测结果如图 7所示,自6 h后,shRNA-MEF2A-3干扰组和shRNA-NC对照组在5个不同时间段内的细胞生长情况均达到极显著差异水平(P < 0.01)。
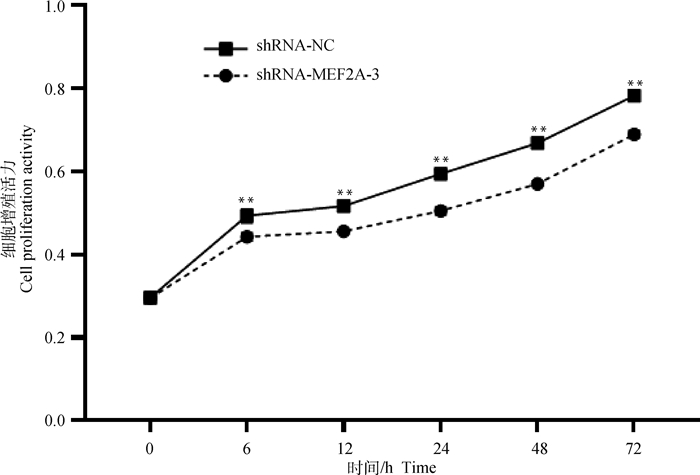
|
图 7 干扰MEF2A对成肌细胞增殖的影响 Fig. 7 Effects of interfering MEF2A on myoblasts proliferation |
在线软件预测MEF2A(No.: NM_001083638.2) 基因的mRNA序列为5 568 bp,编码492个氨基酸。MEF2A蛋白分子式为C2282H3649N659O737S21,相对分子质量约为52 782.31 u;丝氨酸(13.8%)在氨基酸中组成含量最高,色氨酸(0.4%)组成含量最低;带正电荷的氨基酸残基数量(精氨酸+赖氨酸)为45个;带负电荷的氨基酸残基数量(天冬氨酸+谷氨酸)为39个。亚细胞定位显示,MEF2A主要位于细胞核(60.9%)。STRING预测牛MEF2A蛋白互作网络图谱,结果如图 8所示,包含组蛋白去乙酰化酶(HDAC)家族蛋白成员HDAC4、HDAC5与HDAC7,参与核心组蛋白(H2A、H2B、H3和H4)N末端部分赖氨酸残基的去乙酰化[21];丝裂原蛋白活化激酶(MAPK)家族蛋白成员MAPK11、MAPK14,可通过激活环中TGY基序的双重磷酸化发挥功效[22],调节细胞分化与生长凋亡,在细胞反应级联中起重要作用,以及影响心肌发育和成肌细胞分化的MEF2C、EP300、MEF2D、MYOD1、NKX2-5等相关蛋白。
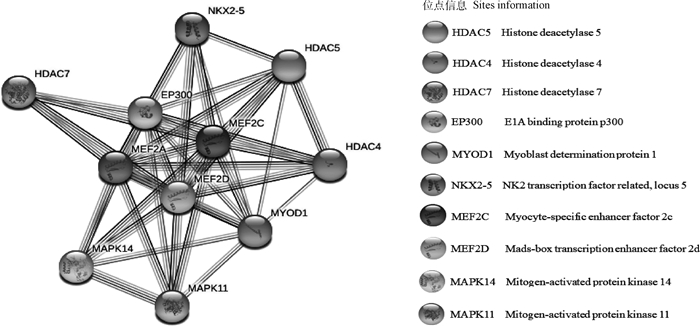
|
图 8 牛MEF2A蛋白互作网络预测分析 Fig. 8 Predictive analysis of bovine MEF2A protein interaction network |
MEF2本身不具备肌源性活性,当与bHLH(basic helix-loop-helix)蛋白家族互作时,可驱动并放大肌源性分化程序[23]。MEF2蛋白N端具备结合DNA功能的MADS区域和中心MEF2结构域,C端为转录激活区域,该区域包含大量的核定位序列和磷酸化位点,在MEF2基因家族成员及不同物种间的保守性较低且序列变化多样,与基因转录活性关系密切,可进一步调控MEF2蛋白活性[24-25]。MEF2主要通过CaMK-HDACs(Ca2+-钙调素依赖的蛋白激酶-组蛋白去乙酰化酶)、Calcineurin(钙调磷酸酶)和MAPK(丝裂原活化蛋白激酶)3种信号通路发挥作用[26]。MEF2基因大多通过MADS-box和MEF2结构域与其他转录辅因子协同作用,家族成员与许多参与肌生成的基因相结合,以启动或加强肌源性基因的表达[27-28],通过控制下游靶基因的转录活性来调控细胞的分裂、分化和凋亡过程。目前已证实,牛MEF2A基因被定位于21号染色体[29],是一种广谱表达基因,在肌肉发育过程中,该基因表达具有发育时空性与组织特异性。MEF2A基因的多态性对畜禽屠宰性能存在一定的影响,且该基因为影响畜禽屠宰性状的候选基因之一[30]。Liu等[31]研究发现,同时敲除MEF2A、MEF2C和MEF2D后,小鼠肌损伤修复过程受到显著抑制,成肌细胞增殖受到严重阻碍。而本试验在抑制MEF2A基因表达后,关岭牛成肌细胞生长活性下降,细胞增殖同样受到严重阻碍。同时,有研究表明MEF2A、MEF2C表达水平在蛙类动物冬眠期具有重要作用[32]。
MEF2A作为一种较为保守的转录因子,广泛分布于各种组织或器官中,在包括决定细胞命运、迁移和形状在内的多种生物学过程中发挥关键作用[33]。MEF2A是肌生成的关键调节因子和肌再生的重要激活剂,也可参与脂质代谢途径[34]。Wang等[35]研究发现,MEF2A下游的MEG3-DIO3 miRNA在牛成肌细胞可调节PP2A信号;MEF2A-MEG3/DIO3-PP2A轴在肌再生过程中发挥重要作用,为骨骼肌的发育机制研究提供了新的线索。Hennebry等[36]研究报道,MSTN可通过调控MEF2与MyoD基因家族表达进而调节骨骼肌纤维类型组成;在转基因小鼠中表达过活性形式的MEF2可促进慢肌纤维形成,但MEF2的失活会导致慢肌纤维形成的丧失[37]。Schiaffino与Serrano[38]研究发现,细胞内Ca2+浓度较低时,HDAC、HDAC5、HDAC7与MEF2蛋白N末端的MADS/MEF2结构域相互作用而抑制MEF2的活性;当Ca2+浓度升高时,Ca2+与钙调蛋白结合并激活CaMK,其中CaMKIV发挥磷酸化作用使HDACs失去活性,MEF2从HDACs上脱离,与本研究中预测的MEF2A蛋白网络图谱结果相吻合。此外,有研究表明MEF2A在抗炎症和治疗癫痫等方面有着重要作用[39-41]。
本试验初步分析了关岭牛MEF2A基因的蛋白理化性质,利用qRT-PCR法检测发现抑制MEF2A基因表达后,肌细胞增强因子MEF2B、MEF2C与MEF2D的表达量均极显著高于shRNA-NC对照组,进一步推测该家族成员具有协同作用的特性,且MEF2A基因在成肌细胞中的作用比家族其它成员更加显著。CDK2作为细胞周期蛋白依赖性激酶家族中的一员,与细胞周期蛋白CCNA2相互作用可调控细胞周期进程[42]。MEF2A基因被抑制后,相较于shRNA-NC对照组,成肌细胞中CDK2与CCNA2基因表达量皆降低;流式细胞结果显示,G1期细胞数量显著增多,S期细胞数量极显著减少,表明细胞周期进程受到阻滞。同时发现干扰MEF2A基因可导致细胞抗凋亡因子BCL2基因表达量下降,进一步研究发现转染干扰组的成肌细胞自6 h后的细胞增殖能力相较于对照组下降明显。由此推断,干扰MEF2A基因导致成肌细胞周期延长,细胞增殖受到抑制,与Wang等[43]的研究结果相似。然而,MEF2A影响成肌细胞的具体分子机制还需要更进一步的探究。
4 结论本研究成功构建了关岭牛MEF2A干扰载体,干扰MEF2A基因明显抑制关岭牛成肌细胞的增殖。同时推测,MEF2A通过调控成肌细胞中肌细胞增强因子基因和相关生长凋亡基因的表达来影响肌肉发育性能,为进一步完善MEF2A基因对关岭牛生长发育的影响和探究地方优质种质资源提供了理论参考。
| [1] |
刘鹏程. TBC1D7、GRB10基因表达调控及其与关岭牛生长性状相关性研究[D]. 贵阳: 贵州大学, 2021. LIU P C. Expression regulation of TBC1D7 and GRB10 genes and correlation between two genes and growth traits of Guanling cattle[D]. Guiyang: Guizhou University, 2021. (in Chinese) |
| [2] |
彭梦阳, 王大会, 贺花, 等. 贵州地方黄牛种业现状、存在问题及对策[J]. 中国牛业科学, 2019, 45(4): 55-58. PENG M Y, WANG D H, HE H, et al. Current situation, problems and countermeasures of Guizhou local cattle breeding industry[J]. China Cattle Science, 2019, 45(4): 55-58. DOI:10.3969/j.issn.1001-9111.2019.04.013 (in Chinese) |
| [3] |
SHAHJAHAN M. Skeletal muscle development in vertebrate animals[J]. Asian J Med Biol Res, 2015, 1(2): 139-148. DOI:10.3329/ajmbr.v1i2.25592 |
| [4] |
GONG H J, XIE J, ZHANG N, et al. MEF2A binding to the glut4 promoter occurs via an AMPKα2-dependent mechanism[J]. Med Sci Sports Exerc, 2011, 43(8): 1441-1450. DOI:10.1249/MSS.0b013e31820f6093 |
| [5] |
叶涛, 杨华婷, 李辉, 等. 兴义鸭MEF2C基因可变剪切体的组织表达差异研究[J]. 农业生物技术学报, 2021, 29(10): 1990-1998. YE T, YANG H T, LI H, et al. Study on differential tissue expression of MEF2C splice Variants in Xingyi duck (Anas platyrhynchos)[J]. Journal of Agricultural Biotechnology, 2021, 29(10): 1990-1998. (in Chinese) |
| [6] |
BRAND N J. Myocyte enhancer factor 2 (MEF2)[J]. Int J Biochem Cell Biol, 1997, 29(12): 1467-1470. DOI:10.1016/S1357-2725(97)00084-8 |
| [7] |
AKHTAR M W, KIM M S, ADACHI M, et al. In vivo analysis of MEF2 transcription factors in synapse regulation andneuronal survival[J]. PLoS One, 2012, 7(4): e34863. DOI:10.1371/journal.pone.0034863 |
| [8] |
ZHU B F, CARMICHAEL R E, VALOIS L S, et al. The transcription factor MEF2A plays a key role in the differentiation/maturation of rat neural stem cells into neurons[J]. Biochem Biophys Res Commun, 2018, 500(3): 645-649. DOI:10.1016/j.bbrc.2018.04.125 |
| [9] |
PON J R, MARRA M A. MEF2 transcription factors: developmental regulators and emerging cancer genes[J]. Oncotarget, 2016, 7(3): 2297-2312. DOI:10.18632/oncotarget.6223 |
| [10] |
WVST S, DRÖSE S, HEIDLER J, et al. Metabolic maturation during muscle stem cell differentiation is achieved by miR-1/133a-mediated inhibition of the DLK1-DIO3 mega gene cluster[J]. Cell Metab, 2018, 27(5): 1026-1039. e6. DOI:10.1016/j.cmet.2018.02.022 |
| [11] |
BLACK B L, MOLKENTIN J D, OLSON E N. Multiple roles for the MyoD basic region in transmission of transcriptional activation signals and interaction with MEF2[J]. Mol Cell Biol, 1998, 18(1): 69-77. DOI:10.1128/MCB.18.1.69 |
| [12] |
CORRE S, GALIBERT M D. USF as a key regulatory element of gene expression[J]. Med Sci (Paris), 2006, 22(1): 62-67. DOI:10.1051/medsci/200622162 |
| [13] |
EDMONDSON D G, LYONS G E, MARTIN J F, et al. Mef2 gene expression marks the cardiac and skeletal muscle lineages during mouse embryogenesis[J]. Development, 1994, 120(5): 1251-1263. DOI:10.1242/dev.120.5.1251 |
| [14] |
CHEN X, GAO B, PONNUSAMY M, et al. MEF2 signaling and human diseases[J]. Oncotarget, 2017, 8(67): 112152-112165. DOI:10.18632/oncotarget.22899 |
| [15] |
ESTRELLA N L, DESJARDINS C A, NOCCO S E, et al. MEF2 transcription factors reguLate distinct gene programs in mammalian skeletal muscle differentiation[J]. J Biol Chem, 2015, 290(2): 1256-1268. DOI:10.1074/jbc.M114.589838 |
| [16] |
WU R H, WANG J, YAO J, et al. MEF2A regulates Calpain 3 expression in L6 myoblasts[J]. Gene, 2018, 668: 204-210. DOI:10.1016/j.gene.2018.05.056 |
| [17] |
CLARK A L, NAYA F J. MicroRNAs in the myocyte enhancer factor 2 (MEF2)-regulated Gtl2-Dio3 noncoding RNA locus promote cardiomyocyte proliferation by targeting the transcriptional coactivator cited2[J]. J Biol Chem, 2015, 290(38): 23162-23172. DOI:10.1074/jbc.M115.672659 |
| [18] |
LIU B R, WANG L, JIANG W Y, et al. Myocyte enhancer factor 2A delays vascular endothelial cell senescence by activating the PI3K/p-Akt/SIRT1 pathway[J]. Aging (Albany NY), 2019, 11(11): 3768-3784. |
| [19] |
BLIXT N, NORTON A, ZHANG A Q, et al. Loss of myocyte enhancer factor 2 expression in osteoclasts leads to opposing skeletal phenotypes[J]. Bone, 2020, 138: 115466. DOI:10.1016/j.bone.2020.115466 |
| [20] |
宋林锦, 许厚强, 李永, 等. 关岭牛IGF1基因干扰载体构建及其对成肌细胞的影响[J]. 农业生物技术学报, 2022, 30(5): 896-907. SONG L J, XU H Q, LI Y, et al. Construction of IGF1 gene interference vector in guanling cattle (Bos taurus) and its effect on myogenic cells[J]. Journal of Agricultural Biotechnology, 2022, 30(5): 896-907. (in Chinese) |
| [21] |
KUMAR V, KUNDU S, SINGH A, et al. Understanding the role of histone deacetylase and their inhibitors in neurodegenerative disorders: current targets and future perspective[J]. Curr Neuropharmacol, 2022, 20(1): 158-178. DOI:10.2174/1570159X19666210609160017 |
| [22] |
YOKOTA T, LI J, HUANG J J, et al. p38 Mitogen-activated protein kinase regulates chamber-specific perinatal growth in heart[J]. J Clin Invest, 2020, 130(10): 5287-5301. DOI:10.1172/JCI135859 |
| [23] |
BLACK B L, OLSON E N. Transcriptional control of muscle development by myocyte enhancer factor-2 (MEF2) proteins[J]. Annu Rev Cell Dev Biol, 1998, 14: 167-196. DOI:10.1146/annurev.cellbio.14.1.167 |
| [24] |
MCKINSEY T A, ZHANG C L, OLSON E N. MEF2:a calcium-dependent regulator of cell division, differentiation and death[J]. Trends Biochem Sci, 2002, 27(1): 40-47. DOI:10.1016/S0968-0004(01)02031-X |
| [25] |
MEDRANO J L, NAYA F J. The transcription factor MEF2A fine-tunes gene expression in the atrial and ventricular chambers of the adult heart[J]. J Biol Chem, 2017, 292(51): 20975-20988. DOI:10.1074/jbc.M117.806422 |
| [26] |
王亚宁. MEF2A对秦川牛骨骼肌成肌细胞增殖和分化的调控作用及机理研究[D]. 杨凌: 西北农林科技大学, 2019. WANG Y N. The roles of MEF2A in the regulation of skeletal muscle myoblasts proliferation and differentiation in Qinchuan beef cattle[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [27] |
VARGAS M A X, TIRNAUER J S, GLIDDEN N, et al. Myocyte enhancer factor 2 (MEF2) tethering to muscle selective A-kinase anchoring protein (mAKAP) is necessary for myogenic differentiation[J]. Cell Signal, 2012, 24(8): 1496-1503. DOI:10.1016/j.cellsig.2012.03.017 |
| [28] |
SNYDER C M, RICE A L, ESTRELLA N L, et al. MEF2A regulates the Gtl2-Dio3 microRNA mega-cluster to modulate WNT signaling in skeletal muscle regeneration[J]. Development, 2013, 140(1): 31-42. DOI:10.1242/dev.081851 |
| [29] |
JUSZCZUK-KUBIAK E, FLISIKOWSKI K, WICIŃSKA K. Nucleotide sequence and variations of the bovine myocyte enhancer factor 2C (MEF2C) gene promoter in Bos taurus cattle[J]. Mol Biol Rep, 2011, 38(2): 1269-1276. DOI:10.1007/s11033-010-0226-8 |
| [30] |
杨涛. 牛MEF2家族转录因子与MSTN启动子相互作用的机制研究[D]. 贵阳: 贵州大学, 2019. YANG T. Study on interaction mechanism of MEF2 family transcription factors and MSTN promoter in cattle[D]. Guiyang: Guizhou University, 2019. (in Chinese) |
| [31] |
LIU L, NELSON B R, BEZPROZVANNAYA S, et al. Requirement of MEF2A, C, and D for skeletal muscle regeneration[J]. Proc Natl Acad Sci U S A, 2014, 111(11): 4109-4114. DOI:10.1073/pnas.1401732111 |
| [32] |
HOYECK M P, HADJ-MOUSSA H, STOREY K B. The role of MEF2 transcription factors in dehydration and anoxia survival in Rana sylvatica skeletal muscle[J]. PeerJ, 2017, 5: e4014. DOI:10.7717/peerj.4014 |
| [33] |
POTTHOFF M J, OLSON E N. MEF2:a central regulator of diverse developmental programs[J]. Development, 2007, 134(23): 4131-4140. DOI:10.1242/dev.008367 |
| [34] |
ZHAO X, LI X T, SHI X Y, et al. Diet-MEF2 interactions shape lipid droplet diversification in muscle to influence Drosophila lifespan[J]. Aging Cell, 2020, 19(7): e13172. |
| [35] |
WANG Y N, MEI C G, SU X T, et al. MEF2A regulates the MEG3-DIO3 miRNA mega cluster-targeted PP2A signaling in bovine skeletal myoblast differentiation[J]. Int J Mol Sci, 2019, 20(11): 2748. DOI:10.3390/ijms20112748 |
| [36] |
HENNEBRY A, BERRY C, SIRIETT V, et al. Myostatin regulates fiber-type composition of skeletal muscle by regulating MEF2 and MyoD gene expression[J]. Am J Physiol Cell Physiol, 2009, 296(3): C525-C534. DOI:10.1152/ajpcell.00259.2007 |
| [37] |
POTTHOFF M J, WU H, ARNOLD M A, et al. Histone deacetylase degradation and MEF2 activation promote the formation of slow-twitch myofibers[J]. J Clin Invest, 2007, 117(9): 2459-2467. DOI:10.1172/JCI31960 |
| [38] |
SCHIAFFINO S, SERRANO A L. Calcineurin signaling and neural control of skeletal muscle fiber type and size[J]. Trends Pharmacol Sci, 2002, 23(12): 569-575. DOI:10.1016/S0165-6147(02)02111-9 |
| [39] |
LI H, WANG F, GUO X Q, et al. Decreased MEF2A expression regulated by its enhancer methylation inhibits autophagy and may play an important role in the progression of Alzheimer's disease[J]. Front Neurosci, 2021, 15: 682247. DOI:10.3389/fnins.2021.682247 |
| [40] |
LU Y W, MARTINO N, GERLACH B D, et al. MEF2 (myocyte enhancer factor 2) is essential for endothelial homeostasis and the atheroprotective gene expression program[J]. Arterioscl Thromb Vasc Biol, 2021, 41(3): 1105-1123. DOI:10.1161/ATVBAHA.120.314978 |
| [41] |
ZHANG M M, WEI Y L, LIU Y B, et al. Metastatic phosphatase PRL-3 induces ovarian cancer stem cell sub-population through phosphatase-independent deacetylation modulations[J]. iScience, 2020, 23(1): 100766. DOI:10.1016/j.isci.2019.100766 |
| [42] |
HARASHIMA H, DISSMEYER N, SCHNITTGER A. Cell cycle control across the eukaryotic kingdom[J]. Trends Cell Biol, 2013, 23(7): 345-356. DOI:10.1016/j.tcb.2013.03.002 |
| [43] |
WANG Y N, YANG W C, LI P W, et al. Myocyte enhancer factor 2A promotes proliferation and its inhibition attenuates myogenic differentiation via myozenin 2 in bovine skeletal muscle myoblast[J]. PLoS One, 2018, 13(4): e0196255. DOI:10.1371/journal.pone.0196255 |
(编辑 郭云雁)



