2. 内蒙古自治区农牧业科学院,呼和浩特 010031
2. Inner Mongolia Academy of Agricultural and Animal Husbandry Sciences, Hohhot 010031, China
哺乳动物脂肪组织主要可以分为白色脂肪组织(white adipose tissue, WAT)和褐色脂肪组织(brown adipose tissue, BAT)[1]。其中,白色脂肪在哺乳动物体内分布最为广泛,主要功能是储存能量。不同于白色脂肪组织,褐色脂肪组织是幼小哺乳动物非颤栗性产热的主要热量来源,同时消耗机体摄取的过剩能量,维持能量平衡[2]。并且褐色脂肪细胞内具有丰富的线粒体与细胞色素,使得细胞呈现褐色[3],线粒体内膜上有解偶联蛋白1(uncoupling protein 1, UCP1)。UCP1蛋白由305个氨基酸组成,形成6个由α-螺旋组成的跨膜结构域,分子量为32 ku。UCP1蛋白能够通过解偶联作用降低膜电位,形成质子渗漏由此介导细胞产热。随着人们生活水平的提高,由饮食引发的糖尿病越来越普遍,研究人员也越来越关注这种高发疾病的治疗方法。其中褐色脂肪组织与糖尿病以及肥胖的治疗密切相关,因此一直备受关注。鉴于褐色脂肪的特殊性,越来越多关于褐色脂肪的研究也开始转向大型哺乳动物,尤其是家畜。研究人员期望通过提高家畜的褐色脂肪含量来减少白色脂肪沉积,提高瘦肉率,由此提高肉品风味和口感。
在世界各地众多的绵羊品种中,蒙古羊是历史悠久、分布广泛、种群多样、特征明显、品种众多、规模最大的亚洲种群之一。其主体分布于蒙古高原及其周边高原,其中规模最大、最有特色、综合性能最突出的种群分布于蒙古高原东部[4]。例如生活在内蒙古自治区的锡林郭勒半干旱草原上的苏尼特羊。苏尼特羊属于蒙古系绵羊的一种,是肉脂兼用粗毛型地方绵羊品种[5],具有耐寒、抗旱、适应性强、肉鲜嫩多汁、无膻味、胴体丰满,肉层厚实紧凑、高蛋白、低脂肪、瘦肉率高、板皮厚等优点[5]。苏尼特羊的相关研究大多集中在肉品质与脂肪沉积等方面,但是很少与褐色脂肪相关。利用体外培养技术可以充分研究和利用褐色脂肪细胞,从胚胎或羔羊的BAT中分离出褐色脂肪前体细胞,在体外研究褐色脂肪的分化和功能以及与白色脂肪之间的关系。进而深入研究苏尼特羊BAT在体内的生物学功能并进一步利用BAT选育和培育耐寒和瘦肉型的苏尼特羊。但是对于苏尼特羊褐色脂肪特点并没有较为系统的研究,为弥补这一空白,本研究从细胞形态学水平、细胞超微结构、基因水平和蛋白水平系统探究苏尼特羊褐色脂肪的分布特点,初步了解苏尼特羊的BAT分布。对进一步研究褐色脂肪在家畜个体生长代谢方面以及优化育种方面具有重要意义。
1 材料与方法 1.1 材料1.1.1 试验动物 苏尼特羊来源于巴彦淖尔市乌拉特中旗苏尼特羊种羊场,相同饲养条件下(母乳喂养),选择出生1、7和30 d的苏尼特羊各3只,包括2只公羊1只母羊。不同日龄苏尼特羊平均体重分别为3.83、6.75、11.17 kg。
1.1.2 主要试剂及仪器 无水乙醇、二甲苯、盐酸、氨水、中性树胶均购自国药集团化学试剂有限公司;苏木素-伊红染液购自武汉谷歌生物科技;脂肪专用固定液、电镜固定液、BSA均购自武汉赛维尔生物科技有限公司;RNAiso Plus、PrimeScriptTM RT Master Mix、TB Green Premix Ex TaqTM Ⅱ均购自TaKaRa公司。Anti-UCP1 Antibody购自Abcam;Anti β-Actin Mouse Monoclonal Antibody、Goat Anti-Mouse IgG,HRP Conjugated、Goat Anti-Rabbit IgG,HRP Conjugated均购自康为世纪。脂肪组织蛋白提取试剂盒、BCA法蛋白定量试剂盒均购自百奥莱博。
脱水机、包埋机、冻台购自武汉俊杰电子有限公司、病理切片机购自上海徕卡仪器有限公司、组织摊片机购自浙江省金华市科迪仪器设备有限公司、NIKON ECLIPSE CI正置光学显微镜厂家为日本尼康、Leica UC7切片机购自Leica公司、TECNAI G2 20 TWIN透射电子显微镜厂家为FEI、荧光定量PCR仪、垂直电泳槽、半干转印仪和高压电泳仪购自美国BIO-RAD公司、全波长扫描式多功能读数仪、低温高速离心机购自美国THERMO FISHER公司。
1.2 方法1.2.1 样品采集与处理 采用放血法处死羔羊后,采集皮下脂肪,包括颈部、背部、尾部、胸部和腹股沟脂肪,以及内脏脂肪,包括肾周脂肪和心包脂肪。采集的脂肪一部分立即投入脂肪专用固定液中,一部分投入电镜固定液中,用于切片的制作;一部分投入液氮中,后转入-80 ℃冰箱保存,用于提取RNA及蛋白。
1.2.2 石蜡切片与HE染色 固定至少24 h后,将脂肪组织从固定液中取出,进行修块。经过脱水浸蜡、包埋后,切成厚度为4 μm的薄片,再进行脱蜡、染色、脱水、封片等步骤。在光学显微镜下镜检,进行图像采集。在200倍视野下,选取脂肪组织切片的5个视野,利用软件Image-Pro Plus 6.0,对脂滴面积进行统计。
1.2.3 免疫组织化学 石蜡切片脱蜡后将切片放在盛满柠檬酸抗原修复缓冲液的修复盒中,于微波炉内进行抗原修复,脱色摇床上晃动洗涤。切片放入3%双氧水中,避光、室温条件下孵育25 min,阻断内源性过氧化物酶。3% BSA室温封闭。在切片上滴加配好的一抗,4 ℃孵育过夜。洗涤后加二抗孵育。洗涤后稍甩干后滴加DAB显色液,在显微镜下观察控制显色时间,显色棕黄色为阳性位点,自来水冲洗切片终止显色。苏木素复染细胞核,脱水封片。
1.2.4 透射电镜 将脂肪组织在4 ℃条件下固定2~4 h后取出,进行漂洗、固定、脱水、渗透、包埋等步骤,切成60~80 nm的超薄切片。在进行铀铅双染色,在透射电子显微镜下观察,采集图像分析。
1.2.5 RNA提取、反转录与实时荧光定量PCR 用TRIzol法提取各部位脂肪组织的总RNA,对RNA的浓度与纯度进行检测。利用TaKaRa公司的PrimeScriptTM RT Master Mix试剂盒进行反转录。
在GenBank数据库中查找目的基因Ucp1和内参基因GAPDH的序列。利用Primer Premier 5.0设计引物(表 1)。通过比对确保其特异性后交由生工生物工程(上海)股份有限公司合成。
|
|
表 1 Ucp1和GAPDH基因引物序列 Table 1 Primer sequences of Ucp1 and GAPDH |
实时荧光定量PCR体系为:95 ℃ 3 min;95 ℃ 5 s;62 ℃ 20 s;72 ℃ 30 s;72 ℃ 7 min;40个循环,每个样品进行3次技术重复。
1.2.6 蛋白提取以及Western blot 脂肪组织总蛋白提取:取200 mg脂肪组织样本剪碎,加入500 μL蛋白提取液,震荡使其充分匀浆。将组织匀浆转移到一预冷的干净离心管中,置于冰上1 h,每隔5~6 min用移液器吹打混匀。在4 ℃,12 000×g条件下离心15 min。将上清吸入另一预冷的干净离心管,得到蛋白样品。用BCA法测定蛋白浓度。进行SDS-PAGE电泳,半干转进行转膜。5%脱脂奶粉封闭,一抗1∶1 000稀释后4 ℃孵育过夜,洗涤后二抗孵育,洗涤后ECL显色。按照Western blot试验条件重复3次。
1.2.7 数据统计与分析 根据2-ΔCt方法计算不同组织间基因相对表达水平,用Graphpad Prism6.0软件进行作图。对不同部位以及不同日龄脂肪组织的基因表达量进行独立性t检验,以P<0.05表示差异显著,以P<0.01表示差异极显著。
2 结果 2.1 苏尼特羊褐色脂肪组织和白色脂肪组织特点2.1.1 不同类型脂肪组织的HE染色 对苏尼特羔羊的各部位脂肪进行HE染色,有两种不同类型的脂肪细胞,褐色脂肪细胞和白色脂肪细胞。褐色脂肪细胞内为多室的小脂滴。白色脂肪细胞为空泡状的单室大脂滴,细胞核被大脂滴挤压到细胞边缘(图 1A、1B)。BAT的脂滴面积小于WAT的脂滴面积,且差异显著(P<0.05,图 1C)。

|
*. 差异显著(P<0.05),下同 *. Significant difference(P < 0.05), the same as below 图 1 BAT(A)和WAT(B)的HE染色与脂滴面积(C) Fig. 1 HE staining of BAT (A) and WAT (B) and the lipid droplet area (C) |
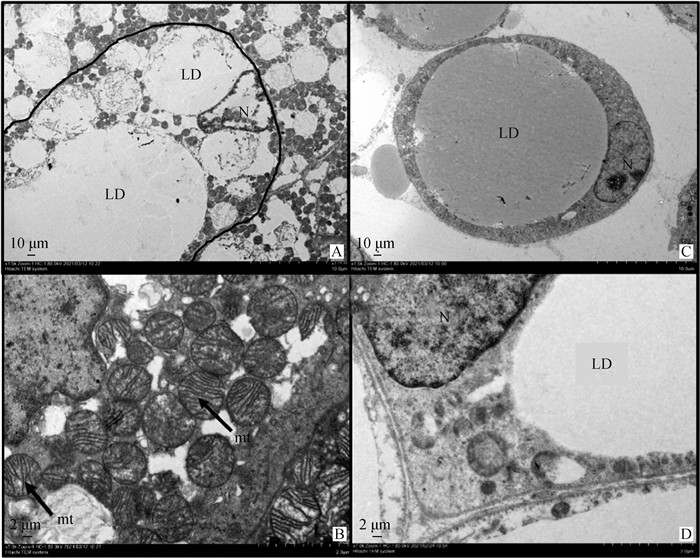
2.1.2 不同类型脂肪组织的透射电镜 通过对不同类型脂肪组织进行透射电镜观察,褐色脂肪细胞内脂滴为多室的小脂滴,并且在脂滴之间分布着大量有嵴的线粒体,线粒体呈现圆形或椭圆形(图 2A、2B)。白色脂肪细胞内只有一个空泡状的大脂滴,几乎占满了细胞的整个空间,细胞核被大脂滴挤压到了细胞的边缘,细胞内只有少量的线粒体(图 2C、2D)。
|
N.细胞核;LD.脂滴;mt.线粒体,下同。A、C. 放大倍数1 500;B、D.放大倍数7 000 N. Nucleus; LD. Lipid droplet; mt. Mitochondria, the same as below. A, C. Magnification 1 500;B, D. Magnification 7 000 图 2 BAT(A、B)和WAT(C、D)的超微结构 Fig. 2 Transmission electron microscopy of WAT (A, B) and ultrastructure (C, D) |
2.1.3 不同类型脂肪组织的免疫组化 对BAT和WAT切片进行免疫组化,观察BAT特异性蛋白UCP1在细胞中的分布。BAT中有大量显示棕黄色的阳性位点(图 3A),同时也能观察到组织中含有小脂滴的细胞,在细胞中间或边缘有蓝紫色的细胞核。而WAT中没有阳性位点(图 3B)。对免疫组化的阳性位点统计分析表明,BAT与WAT的阳性位点差异极显著(P<0.01,图 3C)。

|
***. 差异极显著(P<0.01),下同 ***. Extremely significant difference (P < 0.01), the same as below 图 3 BAT(A)和WAT(B)的免疫组织化学和阳性位点统计(C) Fig. 3 Immunohistochemistry of BAT (A) and WAT (B) statistics of immunohistochemical positive sites (C) |
对不同日龄苏尼特羊各部位脂肪进行HE染色。可以观察到出生1 d时肾周、颈部、背部、腹股沟和心包脂肪都有褐色脂肪细胞的分布。出生7 d时肾周、颈部、腹股沟和心包脂肪有褐色脂肪细胞。出生30 d时,肾周、颈部、心包脂肪依旧有少量的褐色脂肪细胞分布在白色脂肪细胞之间。而尾部脂肪和胸部脂肪都是白色脂肪细胞(图 4)。

|
PrF. 肾周脂肪;CF. 颈部脂肪;DF. 背部脂肪;TF. 尾部脂肪;StF. 胸部脂肪;IngF. 腹股沟脂肪;PcF. 心包脂肪; 下同 PrF. Perirenal fat; CF. Cervical fat; DF. Dorsal fat, TF. Tail fat; StF. Sternal fat; IngF. Inguinal fat; PcF. Pericardial fat; The same as below 图 4 不同日龄苏尼特羔羊各部位脂肪的HE染色 Fig. 4 HE staining of adipose tissue sections of Sonid lambs at different days after birth |
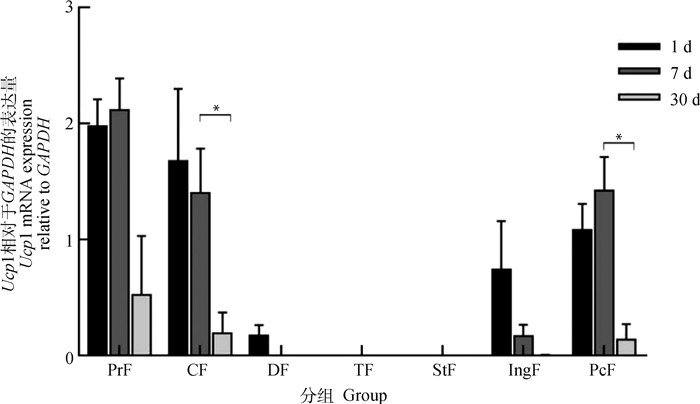
通过实时荧光定量PCR检测不同日龄苏尼特羊各部位脂肪组织Ucp1基因的表达。出生1 d时,肾周脂肪的Ucp1基因表达量最高,颈部、背部、腹股沟和心包脂肪都有Ucp1基因表达。7 d时,肾周、颈部、心包脂肪基因表达量较高,与出生1 d时差异不显著。30 d时,Ucp1基因表达量较低,下降幅度较大。尾部和胸部脂肪组织已检测不到Ucp1基因的表达(图 5)。
|
图 5 不同日龄苏尼特羊各部位脂肪组织的Ucp1基因表达 Fig. 5 Ucp1 gene expression of adipose tissue in Sonid lambs at different days after birth |
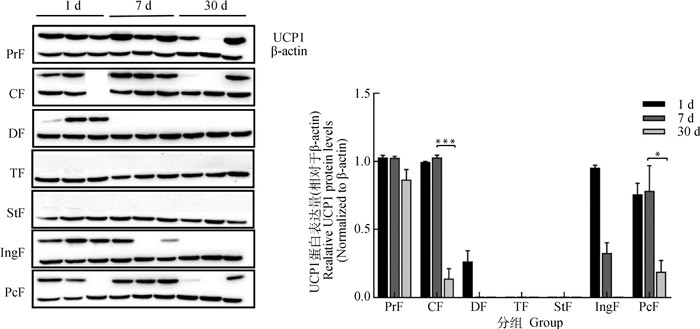
通过Western blot检测不同日龄苏尼特羊各部位脂肪组织UCP1蛋白的表达。出生1 d时,肾周脂肪的UCP1蛋白表达量最高,颈部、背部、腹股沟和心包脂肪都有UCP1蛋白表达。7 d时,肾周、颈部、心包脂肪蛋白表达量较高,与出生1 d时差异不显著。30 d时,除了肾周脂肪,其他部位UCP1蛋白表达量较低,下降幅度较大。尾部和胸部脂肪组织已检测不到UCP1蛋白表达(图 6)。
|
图 6 不同日龄苏尼特羊各部位脂肪组织的UCP1蛋白表达 Fig. 6 UCP1 protein expression of adipose tissue in Sonid sheep at different days after birth |
事实上,BAT它既不能称为脂肪,也不能称为肉,介于两者之间,类似于牛乳腺,这是最早对于褐色脂肪的形态描述。通过对苏尼特羊脂肪的组织学观察,本研究发现苏尼特羊的褐色脂肪和白色脂肪有明显的形态学差异。类似于小鼠褐色脂肪与白色脂肪的颜色[6],通过解剖苏尼特羔羊,采集不同部位的脂肪,可以观察到苏尼特羊褐色脂肪颜色呈现类似肌肉的红褐色,与白色脂肪相比颜色更深。苏尼特羊脂肪经过HE染色之后,褐色脂肪由于细胞内脂滴为多室的小脂滴,而白色脂肪细胞内单室的大脂滴占满细胞的整个空间。白色脂肪的脂滴面积显著大于褐色脂肪的脂滴面积。通过脂肪细胞的形态学观察和褐色脂肪特异性标记基因Ucp1的检测,能够鉴定出不同部位、日龄的脂肪类型。Basse等[7]对特克赛尔羊和哥特羊杂交的后代绵羊进行褐色脂肪的相关研究,不同类型脂肪组织的HE染色显示出同样的结果。Gemmell等[8]早在1972年就通过透射电镜对绵羊褐色脂肪线粒体进行了系统地观察,表明褐色脂肪具有较多的线粒体,并且线粒体的嵴较多且平行排列。随着脂肪类型的变化,线粒体数量逐渐变少,线粒体嵴变得不规则。本试验中,苏尼特羊褐色脂肪的透射电镜也显示细胞内分布着大量的具有规则嵴的线粒体;而在白色脂肪细胞内,线粒体数量极少,且并不是所有线粒体嵴都规则排列。通过不同类型脂肪细胞的结构以及分子特点,确定了不同的脂肪组织类型。
3.2 苏尼特羊褐色脂肪分布部位苏尼特羊7个部位中,肾周、颈部、背部、腹股沟和心包都有褐色脂肪细胞分布。褐色脂肪在人体内主要分布在肾周、颈部、肩胛部、腋下和脊柱旁等部位[9],在小鼠体内的分布与在人体内分布相似。2009年,Marken等[10]通过正电子发射断层-X射线计算机断层扫描(positron emission tomography, computer tomography,PET-CT)发现成人体内,主要为肩胛部有褐色脂肪的分布。关于啮齿类动物褐色脂肪的研究,褐色脂肪来源部位一般为肩胛部[6, 11]。绵羊褐色脂肪的研究也大多集中于肾周脂肪[12-13],在本试验中也发现肾周脂肪中褐色脂肪细胞数量最多,UCP1表达量最高。而苏尼特羊尾部和前胸部脂肪都是白色脂肪。绵羊尾部脂肪在胚胎时期就开始沉积,出生后脂尾已经基本形成,但是无论在哪个时期都没有研究表明尾脂中有褐色脂肪细胞。本试验得出相同的结论,说明尾部是白色脂肪的经典部位。Thompson等[14]的研究通过褐色脂肪的特异性标记蛋白UCP1的表达证明在绵羊体内背部脂肪有褐色脂肪细胞。也有研究表明绵羊心包脂肪中有UCP1的表达[15]。本研究也发现背部和心包脂肪有褐色脂肪细胞。2017年Henry等[16]研究了雌性绵羊胸骨脂肪的产热作用,研究结果表明成年母羊胸部脂肪有褐色脂肪细胞存在,但是在本试验中没有检测到胸部脂肪有褐色脂肪细胞。
3.3 不同日龄苏尼特羊褐色脂肪变化反刍动物常常作为研究褐色脂肪分化的动物模型,很早就有研究发现绵羊在出生时UCP1表达处于峰值,随着个体生长,WAT不断增加,UCP1表达逐渐下降[17-20]。在140 d的胎羊中可以检测到Ucp1的表达,说明从妊娠后期开始,胎羊开始分化出褐色脂肪[20]。随着时间的增长,UCP1表达逐渐下降,到1个月时已完全没有褐色脂肪细胞[15]。有研究测定了出生1、7和30 d绵羊Ucp1基因的表达,结果显示在出生1 d时其表达达到峰值,随后下降,到30 d时没有表达[18]。还有研究表明,Ucp1 mRNA在绵羊所有组织和2~12个月龄各阶段均有表达,但在肾周脂肪中的表达水平明显高于其他组织,皮下脂肪的表达水平低于深部脂肪[21]。本试验表明,苏尼特羊在出生1和7 d时都有褐色脂肪细胞,UCP1的表达量较高,到出生30 d时UCP1的表达降低。在出生30 d时肾周、颈部和心包等部位依旧有褐色脂肪细胞。推测苏尼特羊褐色脂肪的这种分布特点可能是对环境产生的一种应激,以此来弥补本身发育的不完善。
褐色脂肪的分布本身就具有异质性,激活褐色脂肪活性的因素较多。包括环境以及营养条件等都会不同程度地影响绵羊褐色脂肪,尤其母羊妊娠后期的环境会极大地影响出生羔羊的褐色脂肪含量。例如高海拔缺氧环境[22]、寒冷环境[23]和脂肪酸摄入[24]等。因此在不同品种绵羊中褐色脂肪分布的差异性可能与外界环境有较大的关系。要研究绵羊的褐色脂肪特点以及这种差异产生的原因则需要设置更加密集的时间点、选择更多品种的绵羊进行比较以及通过转录组测序等方法进行更深入的研究。
4 结论本研究通过形态学观察和BAT标记基因、蛋白检测区分并鉴定了苏尼特羔羊的褐色脂肪和白色脂肪,证明了褐色脂肪的主要来源部位是肾周,而尾部是白色脂肪的主要来源部位。出生1和7 d时褐色脂肪细胞数量较多,出生30 d时,褐色脂肪细胞数量,标记基因、蛋白表达呈现下降趋势。
| [1] |
CANNON B, NEDERGAARD J. Brown adipose tissue: Function and physiological significance[J]. Physiol Rev, 2004, 84(1): 277-359. DOI:10.1152/physrev.00015.2003 |
| [2] |
ROTHWELL N J, STOCK M J. A role for brown adipose tissue in diet-induced thermogenesis[J]. Nature, 1979, 281(5726): 31-35. DOI:10.1038/281031a0 |
| [3] |
GUY-GRAND B, AILHAUD G. Progress in obesity research[M]. London: John Libbey, 1999.
|
| [4] |
刘永斌. 蒙古羊的遗传育种[M]. 北京: 中国科学技术出版社, 2020. LIU Y B. Genetic breeding of Mongolian sheep[M]. Beijing: Science and Technology of China Press, 2020. (in Chinese) |
| [5] |
旭日干. 中国肉用型羊主导品种及其应用展望[M]. 北京: 中国农业科学技术出版社, 2016. BOU S G. Leading breeds of mutton sheep in China and application prospects[M]. Beijing: China Agricultural Science and Technology Press, 2016. (in Chinese) |
| [6] |
LIM S, HONEK J, XUE Y, et al. Cold-induced activation of brown adipose tissue and adipose angiogenesis in mice[J]. Nat Protoc, 2012, 7(3): 606-615. DOI:10.1038/nprot.2012.013 |
| [7] |
BASSE A L, DIXEN K, YADAV R, et al. Global gene expression profiling of brown to white adipose tissue transformation in sheep reveals novel transcriptional components linked to adipose remodeling[J]. BMC Genomics, 2015, 16(1): 215. DOI:10.1186/s12864-015-1405-8 |
| [8] |
GEMMELL R T, BELL A W, ALEXANDER G. Morphology of adipose cells in lambs at birth and during subsequent transition of brown to white adipose tissue in cold and in warm conditions[J]. Am J Anat, 1972, 133(2): 143-163. DOI:10.1002/aja.1001330203 |
| [9] |
SOLER-VÁZQUEZ M C, MERA P, ZAGMUTT S, et al. New approaches targeting brown adipose tissue transplantation as a therapy in obesity[J]. Biochem Pharmacol, 2018, 155: 346-355. DOI:10.1016/j.bcp.2018.07.022 |
| [10] |
VAN MARKEN LICHTENBELT W D, VANHOMMERIG J W, SMULDERS N M, et al. Cold-activated brown adipose tissue in healthy men[J]. N Engl J Med, 2009, 360(15): 1500-1508. DOI:10.1056/NEJMoa0808718 |
| [11] |
WANG Y Q, GAO M, ZHU F X, et al. METTL3 is essential for postnatal development of brown adipose tissue and energy expenditure in mice[J]. Nat Commun, 2020, 11(1): 1648. DOI:10.1038/s41467-020-15488-2 |
| [12] |
DOU J, PUTTABYATAPPA M, PADMANABHAN V, et al. Developmental programming: adipose depot-specific transcriptional regulation by prenatal testosterone excess in a sheep model of PCOS[J]. Mol Cell Endocrinol, 2021, 523: 111137. DOI:10.1016/j.mce.2020.111137 |
| [13] |
MYERS D A, SINGLETON K, HYATT K, et al. Long term hypoxia during gestation alters perirenal adipose tissue gene expression in the lamb[J]. Adipocyte, 2020, 9(1): 223-233. DOI:10.1080/21623945.2020.1763726 |
| [14] |
THOMPSON M P, SINGH K, CANHAM M, et al. Brown adipose tissue in lean and fat selection lines of sheep identified by immunodetection of uncoupling protein in western blots of tissue homogenates[J]. Comp Biochem Physiol B, 1989, 94(3): 493-498. |
| [15] |
TRAYHURN P, THOMAS M E, DUNCAN J S, et al. Presence of the brown fat-specific mitochondrial uncoupling protein and iodothyronine 5'-deiodinase activity in subcutaneous adipose tissue of neonatal lambs[J]. FEBS Lett, 1993, 322(1): 76-78. DOI:10.1016/0014-5793(93)81115-G |
| [16] |
HENRY B A, POPE M, BIRTWISTLE M, et al. Ontogeny and thermogenic role for sternal fat in female sheep[J]. Endocrinology, 2017, 158(7): 2212-2225. DOI:10.1210/en.2017-00081 |
| [17] |
CASTEILLA L, CHAMPIGNY O, BOUILLAUD F, et al. Sequential changes in the expression of mitochondrial protein mRNA during the development of brown adipose tissue in bovine and ovine species. Sudden occurrence of uncoupling protein mRNA during embryogenesis and its disappearance after birth[J]. Biochem J, 1989, 257(3): 665-671. DOI:10.1042/bj2570665 |
| [18] |
MOSTYN A, WILSON V, DANDREA J, et al. Ontogeny and nutritional manipulation of mitochondrial protein abundance in adipose tissue and the lungs of postnatal sheep[J]. Br J Nutr, 2003, 90(2): 323-328. DOI:10.1079/BJN2003912 |
| [19] |
SYMONDS M E. Brown adipose tissue growth and development[J]. Scientifica (Cairo), 2013, 2013: 305763. |
| [20] |
POPE M, BUDGE H, SYMONDS M E. The developmental transition of ovine adipose tissue through early life[J]. Acta Physiol (Oxf), 2014, 210(1): 20-30. DOI:10.1111/apha.12053 |
| [21] |
SUÁREZ-VEGA A, ARRANZ J J, PÉREZ V, et al. Early adipose deposits in sheep: comparative analysis of the perirenal fat transcriptome of Assaf and Churra suckling lambs[J]. Anim Genet, 2018, 49(6): 605-617. DOI:10.1111/age.12725 |
| [22] |
MYERS D A, HANSON K, MLYNARCZYK M, et al. Long-term hypoxia modulates expression of key genes regulating adipose function in the late-gestation ovine fetus[J]. Am J Physiol Regul Integr Comp Physiol, 2008, 294(4): R1312-R1318. DOI:10.1152/ajpregu.00004.2008 |
| [23] |
BISPHAM J, HEASMAN L, CLARKE L, et al. Effect of maternal dexamethasone treatment and ambient temperature on prolactin receptor abundance in Brown adipose and hepatic tissue in the foetus and new-born lamb[J]. J Neuroendocrinol, 1999, 11(11): 849-856. |
| [24] |
CHEN C Y, CARSTENS G E, GILBERT C D, et al. Dietary supplementation of high levels of saturated and monounsaturated fatty acids to ewes during late gestation reduces thermogenesis in newborn lambs by depressing fatty acid oxidation in perirenal brown adipose tissue[J]. J Nutr, 2007, 137(1): 43-48. |
(编辑 孟培)



