2. 长江大学农学院, 荆州 434025;
3. 农业农村部长江中游作物绿色高效生产重点实验室(部省共建), 长江大学农学院, 荆州 434025
2. College of Agriculture, Yangtze University, Jingzhou 434025, China;
3. MARA Key Laboratory of Sustainable Crop Production in the Middle Reaches of the Yangtze River (Co-construction by Ministry and Province), College of Agriculture, Yangtze University, Jingzhou 434025, China
鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)属于冠状病毒科Gamma冠状病毒属,是具有囊膜的单股正链RNA病毒[1]。IBV是一种常见的呼吸道疾病病原体,对家禽业构成严重威胁。截至目前,已鉴定出多种具有持续突变能力的IBV毒株,并且由于不同毒株间可以进行不断重组,导致IBV的基因型和血清型更加多样化和复杂,这是目前预防和控制传染性支气管炎(infectious bronchitis,IB)面临的主要难题。因此,制定一些新的策略对于防治IBV感染,减少与IBV感染相关的经济损失迫在眉睫[2-4]。
在抗病毒方面,中草药因其安全、有效及低成本而备受关注,多种植物提取物或植物中的有效成分被证实在体内外具有积极的抗病毒作用[5]。黄芩苷是从黄芩(Scutellari)根中分离出的黄酮类化合物[6],具有抗病毒、抑菌、抗肿瘤和抗氧化等多种药理活性,其中以抗病毒活性著称[7],对流感病毒(influenza virus,Ⅳ)、乙型肝炎病毒(hepatitis B virus,HBV)、柯萨奇病毒(coxsackieviruses,CV)、呼吸道合胞病毒(respiratory syncytial virus,RSV)、严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)以及严重急性呼吸综合征冠状病毒2(SARS-CoV-2)等均具有一定的抑制作用[8-11]。在IB防治方面,黄芩苷的抗病毒作用及其作用机制仍知之甚少。有报道指出,黄芩苷在鸡胚及雏鸡上对IBV感染具有一定的抑制效果[12-13],但其潜在的作用机制尚不清楚。另有报道显示,黄芩苷可通过靶向Ras-GTPase激活蛋白结合蛋白1(Ras GTPase-activating protein-binding protein 1,G3BP1)诱导PKR/eIF2α通路磷酸化及应急颗粒(stress granules,SG)形成,启动抗病毒反应,抑制IBV在Vero细胞中的复制[14]。在本课题前期研究中,中草药黄芩乙醇提取物对IBV在H1299细胞中的复制有较明显的抑制效果[15]。中草药具有多种化学成分,其发挥某种药效可能是由单个化学成分起作用或由多个化学成分共同起作用。为确定黄芩提取物中发挥抗IBV药理活性的关键药效物质,本研究将进一步分析黄芩的主要活性成分黄芩苷对IBV的抑制作用。
先天免疫系统是保护宿主免受病毒感染的第一道防线,而诱导Ⅰ型干扰素(interferon,IFN)合成是先天免疫系统的重要抗病毒机制[16]。越来越多的研究表明,传统中草药可以通过调节宿主的先天免疫反应发挥抗病毒作用[17-18]。在一项研究中,黄芩苷可通过上调干扰素的表达,激活其下游JAK-STAT通路,在RSV-感染小鼠中发挥抗病毒活性[19]。但目前未见黄芩苷参与调控Ⅰ型干扰素产生与IBV感染之间关系的报道。本研究拟在分析黄芩苷对IBV抑制作用的基础上,进一步探究黄芩苷对宿主细胞Ⅰ型干扰素信号通路的调控作用,明晰黄芩苷影响IBV复制的作用机制,为黄芩苷在兽医临床上的应用及相关靶点药物的研究提供理论依据。
1 材料与方法 1.1 材料1.1.1 细胞和病毒 H1299细胞(人非小细胞肺癌细胞)系由新加坡南洋理工大学生物学院病毒实验室惠赠;Vero细胞(非洲绿猴肾细胞)由本实验室保存。因固有的基因缺陷,Vero细胞不能表达抗病毒干扰素,文章中除病毒噬斑分析,其余研究均在能表达干扰素的H1299细胞中进行。病毒IBV Beaudette株(IBV-p65)由长江大学农学院病毒学实验室保存;重组病毒IBV-3ab-luc由长江大学农学院病毒学实验室构建,是利用反向遗传学技术,在IBV全基因组的基础上,用荧光素酶(luciferase)的基因序列替代IBV-p65的3ab片段构建而成。
1.1.2 主要试剂 黄芩苷(批号:N15GB167969),购自上海源叶生物科技有限公司;胎牛血清FBS、0.25% 胰酶、基础培养基DMEM购自Gibco公司;2× Taq PCR StarMix为GenStar公司产品;苯甲基磺酰氟PMSF、RIPA组织/细胞裂解液购自Solarbio公司;IBV N多克隆抗体由本实验室制备并保存;IL-6抗体、IFN-β抗体、STAT1抗体、p-STAT1抗体、SOCS3抗体购自ABclonal公司;IRF3抗体、p-IRF3抗体购自Abcam公司;ExFect转染试剂购自Vazyme公司;质粒小量提取试剂盒购自Omega公司。
1.2 黄芩苷对H1299细胞活性影响分析称取黄芩苷粉末500 μg溶于1 mL的无血清DMEM培养液中,制成浓度为500 μg·mL-1的黄芩苷母液,随后用一定体积的DMEM将黄芩苷母液倍比稀释成500、250、125、62.5、31.3 μg·mL-1 5个不同浓度。H1299细胞在96孔板中培养至覆盖率达90%左右时,加入不同浓度的黄芩苷,100 μL·孔-1,每浓度设3个复孔,留一列细胞作为正常细胞对照,每孔只加100 μL DMEM,37 ℃,50 mL·L-1 CO2条件下培养24 h。每孔加10 μL MTT溶液和90 μL DMEM培养液,细胞继续培养4 h, 1 000 r·min-1离心5 min,再用150 μL甲瓒溶液孵育10 min。在酶联免疫检测仪OD490 nm处测量各孔的吸光值,并计算不同浓度药物处理下对应的细胞抑制率。计算公式如下:抑制率(%)=(1-加药组OD值/对照组OD值)×100%。本试验中,对细胞的抑制率低于10%的黄芩苷浓度被选为无毒浓度,被用于后续试验。
1.3 黄芩苷对IBV的抑制作用分析1.3.1 病毒感染前加药 在12孔板中,待H1299细胞覆盖率达90%左右时,去掉上清液,加入不含血清的DMEM培养液1 mL,先用黄芩苷预处理细胞3 h,再用MOI=0.5的IBV-3ab-luc感染细胞,每浓度设3个复孔,同时设病毒对照,即只用病毒感染不加黄芩苷处理。24 h后观察病毒感染情况,按照荧光素酶检测试剂盒说明书进行病毒荧光值检测,分析病毒复制情况。
1.3.2 病毒感染后加药 在12孔板中,待H1299细胞覆盖率达90%左右时,去掉上清液,加入1 mL不含血清的DMEM培养液,先用MOI=0.5的IBV-3ab-luc病毒感染细胞3 h,再加入黄芩苷,每个浓度设3个复孔,同时设病毒对照。按“1.3.1”方法检测病毒荧光值,分析病毒复制情况。
1.3.3 不同浓度的黄芩苷对IBV的抑制作用 将黄芩苷以最大无毒浓度为起点,倍比稀释成不同浓度,在12孔板中,待H1299细胞覆盖度达90%左右时,去掉上清液,加入1 mL不含血清的DMEM培养液,再分别加入MOI=0.5的重组病毒IBV-3ab-luc和不同浓度的黄芩苷,各浓度均设复孔。按前述步骤进行病毒荧光值检测,分析病毒复制情况。
1.4 病毒噬斑分析将Vero细胞接种于6孔板,待细胞覆盖率达90%左右时弃去培养液,用1%的PBS缓冲液润洗细胞2次,加入1 mL无血清的DMEM培养液。将“1.3”中收集到的各组病毒原液梯度稀释101倍~106倍,每孔中加入200 μL病毒稀释液,每个稀释梯度3个重复,放入培养箱中培养。待病毒吸附细胞2~3 h,弃去6孔板中培养液,往每孔中加入3 mL含0.4%琼脂糖的稀释液覆盖细胞,培养72 h,10%的甲醛液固定10 min,结晶紫染色。选取噬斑清楚且便于计数的视野统计噬斑数,计算病毒滴度。
1.5 实时荧光定量PCR检测干扰素通路相关基因mRNA表达水平1.5.1 引物设计及合成 根据GenBank中IL-6、IRF3、IFN-β、SOCS3基因序列,利用Premier3.0软件设计PCR引物,引物信息见表 1。引物均由华大基因有限公司合成。
|
|
表 1 引物信息 Table 1 Primer information |
1.5.2 实时荧光定量PCR检测基因的mRNA表达水平 将试验设为4组:空白组(normal)、IBV组、病毒感染前加药组(pre-treatment)、病毒感染后加药组(post-treatment),在病毒感染细胞24 h后收集各组细胞,提取总RNA并反转录合成cDNA。按照表 1设计的引物以合成的cDNA为模板,qPCR扩增相关基因片段。PCR反应体系20 μL: 2× TSINGKE Master qPCR Mix 10 μL,上、下游引物各1 μL,模板cDNA 1.0 μg,ddH2O补足总体积至20 μL。PCR反应程序: 95 ℃ 3 min,95 ℃ 10 s,61 ℃ 30 s,40个循环。
1.6 Western blot检测干扰素通路相关基因蛋白表达水平试验分组同“1.5.2”,按照分组加入病毒和药物。病毒感染细胞24 h后弃去培养液,采用一定体积RIPA与PMSF(体积比100 ∶1)混合液裂解各组细胞提取总蛋白,经SDS-PAGE凝胶电泳分离,低温下转至PVDF膜上,采用5%脱脂奶粉室温封闭2 h,TBST清洗PVDF膜。将PVDF膜与IL-6、SOCS3、IRF3、p-IRF3、IFN-β、STAT1、p-STAT1一抗4 ℃孵育过夜,次日TBST清洗3次。加入辣根过氧化物酶标记的山羊抗兔IgG二抗,37 ℃条件下摇床孵育2 h,TBST清洗3次,ECL发光底液进行显色。
1.7 IBV对干扰素治疗的敏感性分析将重组人IFN-α(100 ng·mL-1)在病毒感染细胞2 h后加入IBV组和加药组细胞培养体系中。18 h后,间接免疫荧光检测IBV N蛋白的表达,分析各组在IFN-α处理后病毒的复制情况。
1.8 间接免疫荧光检测p-STAT1核移位将H1299细胞接种于24孔板,按分组加入病毒和药物。病毒感染细胞24 h后弃去培养液,PBS润洗2遍,4%多聚甲醛固定15 min,0.5% Triton-100透膜15 min。加入含3% BSA的封闭液室温封闭1 h,滴加特异性一抗(p-STAT1,l∶200稀释度),4 ℃过夜,PBS漂洗3次,每次5 min。滴加与第一抗体种属匹配的荧光素标记二抗,37 ℃避光孵育30 min,PBS漂洗3次,每次5 min,4′,6-二脒基-2-苯基吲哚(DAPI)复染细胞核15~20 min,甘油磷酸缓冲液封片,荧光显微镜下观察、拍照。
1.9 RNA干扰试验分析STAT1沉默对病毒复制的影响根据GenBank中STAT1基因序列,以其mRNA转录本不同区域为靶点设计两对STAT1 shRNA序列:pLKO.1-STAT1-1(Forwards: 5′-GATCCGCAGGTTCACCAGCTTTATGATTCAAGAG-ATCATAAAGCTGGTGAACCTGCTTTT-TTG-3′,Reverses: 5′-AATTCAAAAAAGCAGGTTCA-CCAGCTTTATGATCTCTTGAATCATAAAGC-TGGTGAACCTGCG-3′),pLKO.1-STAT1-2 (Forwards: 5′-GATCCGCTGAATGTCACTGAACTT-ACTTCAAGAGAGTAAGTTCAGTGACATTCA-GCTTT TTTG-3′,Reverses: 5′-AATTCAAAAAA-GCTGAATGTCACTGAACTTACTCTCTTGAA-GTAAGTTCAGTGACATTCAGCG-3′)。用T4 DNA连接酶将载体pLKO.1和shRNA过夜连接,转化大肠杆菌感受态细胞后挑取单菌落进行测序鉴定,将鉴定正确的菌落摇菌后提取质粒转染H1299细胞,使用Western blot鉴定表达。用重组病毒IBV-3ab-luc分别感染正常H1299细胞和干扰质粒转染后的H1299细胞后用黄芩苷处理,分析STAT1沉默对黄芩苷抗病毒作用的影响。
1.10 数据统计分析用2-ΔΔCt法计算各基因mRNA相对表达量,ImageJ软件计算蛋白灰度值,GraphPadPrism8.0软件绘图,SPSS13.0软件进行单因素方差分析,组间差异采用t检验,结果用“平均值±标准差”表示。P<0.05表示差异显著,P<0.01表示差异极显著。
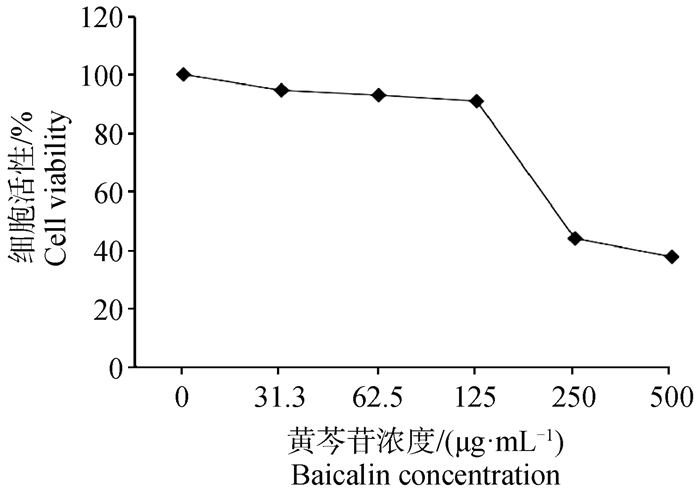
2 结果 2.1 不同浓度的黄芩苷对H1299细胞活性的影响黄芩苷按浓度500、250、125、62.5、31.3 μg·mL-1加入H1299细胞培养体系中,MTT法检测不同浓度黄芩苷对细胞活性的影响。结果显示,黄芩苷在31.3、62.5和125 μg·mL-1浓度下对细胞活性无明显影响,细胞活性均在90%以上,而250和500 μg·mL-1浓度对H1299细胞活性具有显著影响(图 1)。因此,选择浓度为125 μg·mL-1的黄芩苷用于后续研究。
|
图 1 不同浓度的黄芩苷对H1299细胞活性影响 Fig. 1 Effects of different concentrations of baicalin on the viability of H1299 cells |
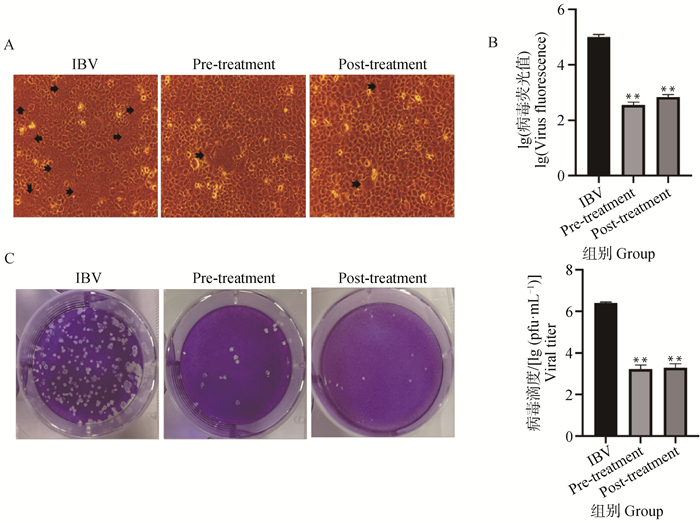
本研究主要利用重组病毒IBV-3ab-luc研究黄芩苷对IBV的抑制作用及作用机制。采用细胞病变效应(cytopathic effect,CPE)、噬斑分析、病毒荧光值测定分析黄芩苷对IBV复制的影响。结果显示,IBV感染H1299细胞24 h后观察到明显的合胞体细胞,即由病毒复制而产生的CPE。当分别在病毒感染前或感染后经黄芩苷处理后由病毒感染形成的CPE明显减轻(图 2A)。病毒荧光值检测显示,感染前加药组及感染后加药组所测得的病毒荧光值均极显著低于IBV组(P<0.01)(图 2B)。进一步,将上述各试验组收集的病毒原液连续稀释后接种于Vero细胞上,观察噬斑形态并定量病毒滴度。与IBV组相比,黄芩苷处理后病毒噬斑数量、大小和病毒滴度均极显著降低(P<0.01)(图 2C)。上述结果表明,黄芩苷在体外对IBV的复制具有明显的抑制作用。
|
A.不同试验组IBV感染后H1299细胞的形态学变化。箭头表示CPE;B.不同试验组病毒荧光值检测;C.不同试验组IBV感染Vero细胞后病毒噬斑形成和滴度测定。与IBV组相比,**. P<0.01 A. Morphological changes of IBV-infected H1299 cells in different experimental groups. Arrows represent CPE; B. Detection of virus fluorescence value in different experimental groups; C. Virus plaque formation and titer determination of IBV-infected Vero cells in different experimental groups. Compared with IBV group, **. P<0.01 图 2 黄芩苷抑制IBV在Vero细胞及H1299细胞中的复制 Fig. 2 Baicalin inhibits IBV replication in Vero cells and H1299 cells |
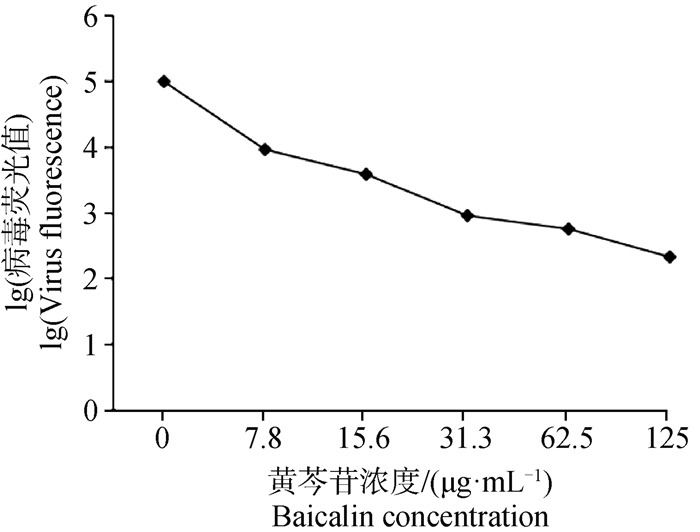
将黄芩苷倍比稀释成不同浓度后处理IBV感染的H1299细胞,24 h后检测各组病毒荧光值,分析病毒复制情况。结果显示,黄芩苷浓度越高,病毒荧光值越低,说明黄芩苷对IBV的抑制呈浓度依赖性(图 3)。
|
图 3 不同浓度的黄芩苷对IBV抑制作用 Fig. 3 Inhibiting effect of IBV by baicalin with different concentration |
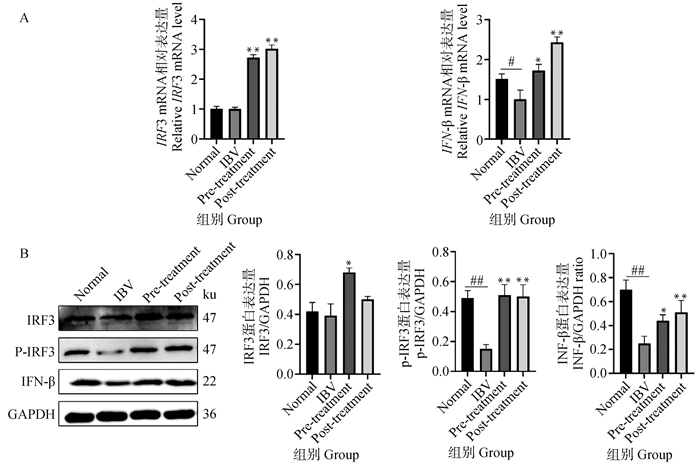
利用qRT-PCR和Western blot方法检测干扰素相关基因IRF3、p-IRF3和IFN-β的转录和表达。PCR结果显示,IBV感染会降低宿主细胞IFN-β的mRNA表达水平(P<0.05),用黄芩苷处理后,IRF3和IFN-β的mRNA表达水平均显著增加(P<0.05)(图 4A)。Western blot结果显示,与正常对照组相比,IBV组p-IRF3和IFN-β的蛋白表达水平极显著降低(P<0.01),用黄芩苷处理后,病毒感染前加药组IRF3(P<0.05)、p-IRF3(P<0.01)和IFN-β(P<0.05)的蛋白表达水平均显著增加,病毒感染后加药组p-IRF3和IFN-β的蛋白表达水平也极显著增加(P<0.01)(图 4B)。这些结果表明黄芩苷可通过IRF3途径促进宿主细胞内IFN-β的表达。
|
A. qRT-PCR检测IBV感染细胞中IRF3、IFN-β mRNA表达;B. Western blot检测IBV感染细胞中IRF3、p-IRF3和IFN-β蛋白表达。IBV组与正常对照组相比,#.P<0.05,##.P<0.01;黄芩苷组与IBV组相比,*. P<0.05,**. P<0.01 A. The mRNA expressions of IRF3 and IFN-β were detected by qRT-PCR in IBV-infected cells; B. The protein expressions of IRF3, p-IRF3 and IFN-β were detected by Western blot in IBV-infected cells. When IBV group compared with normal control group, #.P<0.05, ##.P<0.01; When baicalin and ribavirin groups compared with IBV group, *. P<0.05, **. P<0.01 图 4 黄芩苷上调IBV感染细胞中IRF3诱导的IFN-β表达 Fig. 4 Baicalin promotes IRF3-mediated IFN-β production in IBV-infected cells |
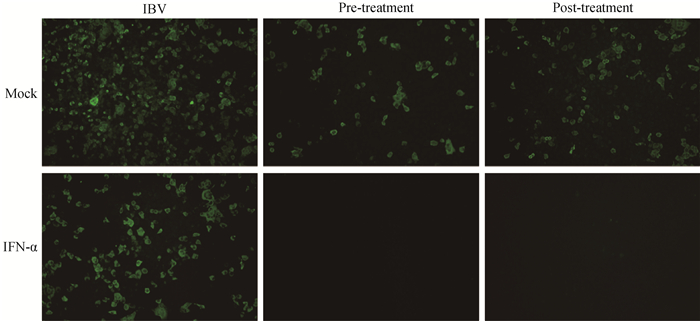
用重组人IFN-α处理黄芩苷组和IBV组病毒感染的细胞后,以间接免疫荧光检测IBV N的蛋白表达水平,分析病毒的复制情况。结果显示,在未经黄芩苷处理的IBV感染细胞中加入IFN-α对病毒的复制影响较小,而黄芩苷处理后再加入IFN-α,病毒复制明显减弱(图 5)。因此,黄芩苷可以增加IBV对IFN治疗的敏感性。
|
图 5 黄芩苷增加了IBV对干扰素治疗的敏感性 Fig. 5 Baicalin increases the sensitivity of IBV to interferon therapy |
Western blot检测STAT1及p-STAT1的蛋白表达水平,结果显示,STAT1总蛋白的表达在各组间差异无显著性,而p-STAT1的表达在各组间差异具有显著性。与正常组相比,IBV组p-STAT1蛋白表达水平显著降低(P<0.05),用黄芩苷处理后,在感染前加药组及感染后加药组p-STAT1表达水平显著或极显著(P<0.05或P<0.01)增加(图 6A)。进一步,间接免疫荧光分析显示,黄芩苷处理能显著增加p-STAT1的核移位(P<0.01)(图 6B)。因此,黄芩苷可以促进STAT1的磷酸化和p-STAT1核移位。

|
A. Western blot检测IBV感染细胞中STAT1和p-STAT1蛋白表达;B.间接免疫荧光分析IBV感染细胞中p-STAT1的核表达。IBV组与正常对照组相比,#.P<0.05,##.P<0.01;黄芩苷组与IBV组相比,*. P<0.05,**. P<0.01 A. The protein expressions of STAT and p-STAT1 were detected by Western blot in IBV-infected cells; B. Immunofluorescence detection of p-STAT1 nuclear expression in IBV-infected cells. When IBV group compared with normal control group, #.P<0.05, ##.P<0.01; When baicalin and ribavirin groups compared with IBV group, *. P<0.05, **. P<0.01 图 6 黄芩苷促进IBV感染细胞中STAT1的磷酸化和p-STAT1核移位 Fig. 6 Baicalin promotes STAT1 phosphorylation and nuclear translocation of p-STAT1 in IBV-infected cells |
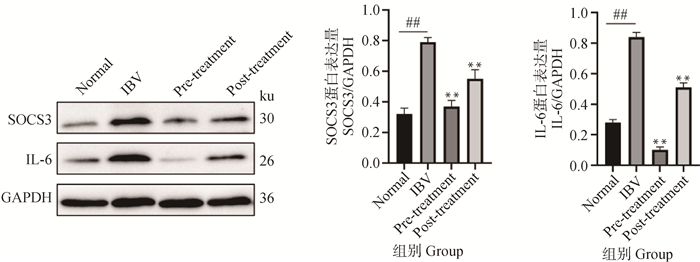
SOCS3是JAK-STAT信号通路的负调控因子,IL-6是SOCS3的刺激因子。Western blot检测SOCS3和IL-6的蛋白表达情况。结果显示,与正常组相比,IBV组SOCS3和IL-6表达水平极显著增加(P<0.01)。用黄芩苷处理后,感染前加药组及感染后加药组SOCS3和IL-6表达水平均极显著降低(P<0.01)(图 7)。因此,黄芩苷能负调控SOCS3和IL-6的表达,从而拮抗SOCS3对干扰素通路的抑制作用。
|
IBV组与正常对照组相比,#.P<0.05,##.P<0.01;黄芩苷组与IBV组相比,*. P<0.05,**. P<0.01 When IBV group compared with normal control group, #.P<0.05, ##.P<0.01; When baicalin and ribavirin groups compared with IBV group, *. P<0.05, **. P<0.01 图 7 Western blot检测IBV感染细胞中SOCS3和IL-6蛋白的表达 Fig. 7 The protein expressions of SOCS3 and IL-6 were detected by Western blot in IBV-infected cells |
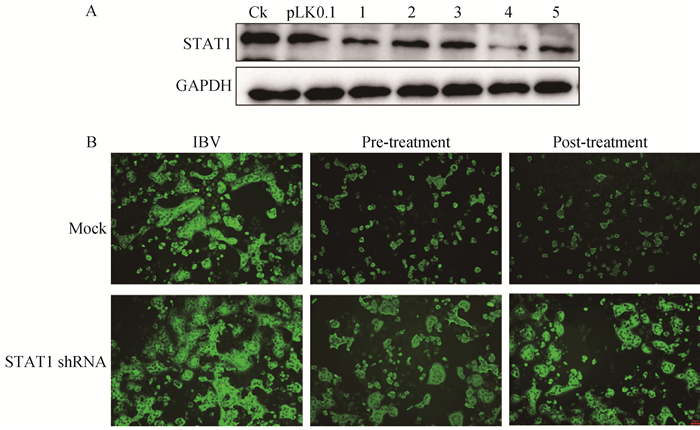
用真核表达质粒pLKO.1-STAT1转染H1299细胞对STAT1进行敲低,分析敲低STAT1对黄芩苷抗病毒作用的影响。结果显示,敲低STAT1后再用黄芩苷处理病毒感染的细胞,与敲低前相比病毒的复制能力明显增加,说明敲低STAT1会减弱黄芩苷的抗病毒药理活性,从而促进病毒复制(图 8)。
|
A. pLKO.1-STAT1-1/2干扰效果验证,1、2、3、4、5分别代表真核表达质粒pLKO.1-STAT1 1、2、3、4、5;B.间接免疫荧光分析病毒复制情况 A. pLKO.1-STAT1 interference effect verification, 1, 2, 3, 4, 5 represented the eukaryotic expression plasmid pLKO.1-STAT1 1, 2, 3, 4, 5, respectively; B. Indirect immunofluorescence analysis of virus replication. 图 8 STAT1沉默减弱了黄芩苷对IBV的抑制作用 Fig. 8 STAT1 silencing weakens the inhibition of baicalin on IBV replication |
IB、禽流感、新城疫等由病毒感染引起的呼吸道疾病给世界范围内的家禽业造成了巨大的经济损失。目前,疫苗接种是预防IBV感染和控制IB最有效的策略。然而,一些商业疫苗对异种血清型IBV毒株提供的保护作用有限[20],因此,IB的防治仍然是一个挑战,有必要开发一些新的有效的抗病毒策略或药物来对抗IBV感染。中医药在病毒病防治方面受到了许多研究者的关注,一些有效的中药产品已被用于预防或治疗病毒性疾病。如蛇肝地龙颗粒联合强力霉素可预防IBV感染[21];植物精油通过抑制病毒增殖和调控宿主免疫功能在肉鸡中发挥抗IBV作用[22]。黄芩苷是从黄芩根中分离出的黄酮类化合物,黄酮类化合物可通过抑制病毒感染周期的不同阶段发挥直接的抗病毒作用,也可通过调节宿主与病毒之间的相互作用产生间接抗病毒作用[23]。本研究对黄芩苷在Vero细胞和H1299细胞中对IBV的抗病毒活性进行了评价,结果显示黄芩苷在体外对IBV的复制具有显著的剂量依赖性抑制作用,这表明黄芩苷可能是一种潜在的用于家禽业防治IBV感染的药物。
IBV Beaudette株最初只适应鸡胚,后经多次连续传代适应了鸡原代肾细胞(chicken kidney cell,CKC)和Vero细胞,进而Vero细胞适应株IBV经传代也可感染人类细胞系H1299和Huh[24]。在感染宿主细胞的过程中,IBV编码4种结构蛋白(S、E、M和N)和15种非结构蛋白(nonstructural protein,nsp)参与病毒复制、吸附、入侵和释放[25]。吸附是病毒感染细胞的第一步,RNA病毒借助S蛋白与宿主细胞受体结合进入宿主细胞,随后,在S蛋白介导下病毒-细胞和细胞-细胞融合形成合胞体细胞,即CPE,CPE形成是病毒进入宿主细胞并向邻近细胞传播感染的必要条件[26]。在本研究中,IBV感染Vero细胞和H1299细胞后观察到明显的CPE形成,随着感染时间的延长,CPE逐渐蔓延至几乎整个单层细胞。在黄芩苷处理后,IBV感染细胞中CPE的形成显著降低,与此同时,病毒噬斑数量也减少。这提示,黄芩苷可抑制IBV感染后S蛋白介导的合胞体细胞的形成,阻止病毒向邻近细胞的传播,抑制IBV在细胞内的复制。有报道显示,黄酮类化合物可通过竞争性抑制S蛋白与宿主细胞受体结合从而阻止病毒吸附进入宿主细胞[27-28]。本研究中,黄芩苷在IBV感染前预处理对病毒复制也起到抑制作用,该抑制作用是否与阻止病毒吸附进入宿主细胞有关有待进一步研究。
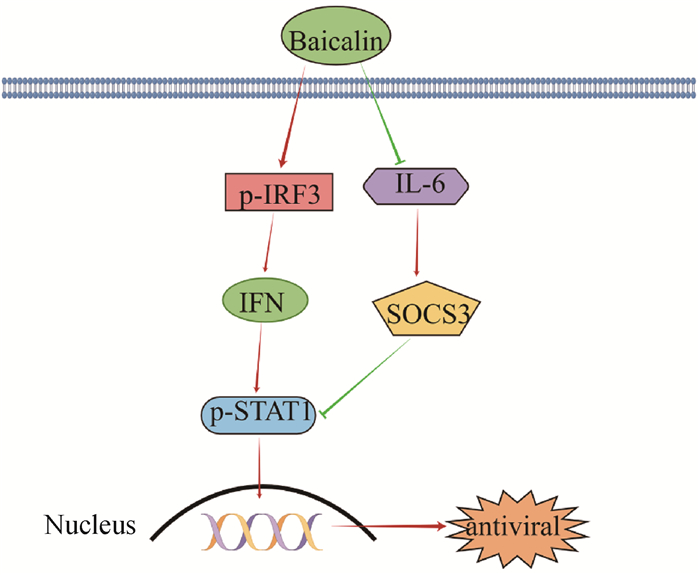
干扰素作为主要的抗病毒分子,在宿主被病毒感染的靶细胞和器官中发挥免疫调节作用,限制病毒的传播。然而,冠状病毒已经进化出多种策略拮抗宿主的先天免疫反应,为病毒复制创造有利的环境。SARS-CoV、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)和IBV的结构蛋白(M和N)、非结构蛋白(nsp1和nsp3)以及辅助蛋白均可以作为IFN拮抗剂,抑制宿主天然免疫反应[29-31]。此外,IBV可通过抑制STAT1的磷酸化和核移位阻断干扰素下游信号通路,促进病毒复制[32]。因此,研究病毒与宿主之间的互作并寻找有效的干预措施对冠状病毒相关疾病的防治也至关重要。本研究在对黄芩苷抗病毒的作用机制中发现黄芩苷处理上调了宿主细胞IFN-β的表达,增加了IBV对干扰素治疗的敏感性,提示黄芩苷对IBV的抑制作用与干扰素通路的调控有关。随后对干扰素下游的STAT信号通路的研究发现,干扰素介导的STAT1磷酸化在黄芩苷处理组的感染细胞中显著增加。磷酸化是干扰素诱导STAT1核移位的关键步骤,只有p-STAT1才能与STAT2和IRF9结合形成干扰素刺激基因因子3 (interferon stimulator gene factor 3,ISGF3),ISGF3转位进入细胞核后,结合到ISG启动子调控区的干扰素刺激应答元件上,启动ISG的转录[33],发挥抗病毒效应。作者的研究也证实了黄芩苷处理后p-STAT1核移位增加。因此,黄芩苷影响IBV对干扰素治疗的敏感性与其促进STAT1磷酸化和p-STAT1核移位有关。利用RNA干扰技术对STAT1进行沉默后发现,STAT1沉默减弱了黄芩苷对IBV的抑制作用,这进一步说明,黄芩苷对IBV的抑制作用与STAT1通路的调控有关。综上所述,黄芩苷可通过诱导干扰素产生并进一步激活干扰素下游的信号通路而发挥抗病毒作用(图 9)。
|
图 9 黄芩苷抗IBV作用的分子机制 Fig. 9 The molecular mechanism for the anti-IBV properties of baicalin |
细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling 3,SOCS3)是SOCS家族的重要分子之一,可以通过负反馈调控机制抑制JAK-STAT信号通路,在病毒免疫逃避中发挥重要作用[34]。SOCS3的表达受多种炎症因子的调控,其中IL-6是主要因子之一,IL-6可通过激活STAT3诱导SOCS1和SOCS3基因表达[35]。在本研究中,黄芩苷处理显著下调了宿主细胞SOCS3和IL-6蛋白表达水平,这说明,黄芩苷不仅能正向调控干扰素信号通路,同时也能负调控干扰素信号通路的抑制因子,通过不同途径促进宿主天然免疫反应,抑制IBV复制(图 9)。
4 结论黄芩苷可通过诱导宿主细胞Ⅰ型干扰素产生、激活干扰素下游信号通路而抑制IBV复制,减轻病毒感染对细胞造成的免疫损伤。该研究为寻找抗IBV的天然药物提供了新的思路。
| [1] |
ZHANG Y, XU Z C, CAO Y C. Host antiviral responses against avian infectious bronchitis virus (IBV): focus on innate immunity[J]. Viruses, 2021, 13(9): 1698. DOI:10.3390/v13091698 |
| [2] |
CAVANAGH D. Coronavirus avian infectious bronchitis virus[J]. Vet Res, 2007, 38(2): 281-297. DOI:10.1051/vetres:2006055 |
| [3] |
LEGNARDI M, TUCCIARONE C M, FRANZO G, et al. Infectious bronchitis virus evolution, diagnosis and control[J]. Vet Sci, 2020, 7(2): 79. DOI:10.3390/vetsci7020079 |
| [4] |
FRANZO G, LEGNARDI M, TUCCIARONE C M, et al. Evolution of infectious bronchitis virus in the field after homologous vaccination introduction[J]. Vet Res, 2019, 50(1): 92. DOI:10.1186/s13567-019-0713-4 |
| [5] |
SHAHZAD M I, ANWAR S, ASHRAF H, et al. Antiviral activities of Cholistani plants against common poultry viruses[J]. Trop Biomed, 2020, 37(4): 1129-1140. DOI:10.47665/tb.37.4.1129 |
| [6] |
KONG N, CHEN X Y, FENG J, et al. Baicalin induces ferroptosis in bladder cancer cells by downregulating FTH1[J]. Acta Pharm Sin B, 2021, 11(12): 4045-4054. DOI:10.1016/j.apsb.2021.03.036 |
| [7] |
LI K W, LIANG Y Y, CHENG A, et al. Antiviral properties of baicalin: a concise review[J]. Rev Bras Farmacogn, 2021, 31(4): 408-419. DOI:10.1007/s43450-021-00182-1 |
| [8] |
LI R, WANG L X. Baicalin inhibits influenza virus A replication via activation of type Ⅰ IFN signaling by reducing miR-146a[J]. Mol Med Rep, 2019, 20(6): 5041-5049. |
| [9] |
QIN S, HUANG X Z, QU S G. Baicalin induces a potent innate immune response to inhibit respiratory syncytial virus replication via regulating viral non-structural 1 and matrix RNA[J]. Front Immunol, 2022, 13: 907047. DOI:10.3389/fimmu.2022.907047 |
| [10] |
CHEN K H, WANG S F, WANG S Y, et al. Pharmacological development of the potential adjuvant therapeutic agents against coronavirus disease 2019[J]. J Chin Med Assoc, 2020, 83(9): 817-821. DOI:10.1097/JCMA.0000000000000375 |
| [11] |
LIN C J, TSAI F J, HSU Y M, et al. Study of baicalin toward COVID-19 treatment: in silico target analysis and in vitro inhibitory effects on SARS-CoV-2 proteases[J]. Biomed Hub, 2021, 6(3): 122-137. DOI:10.1159/000519564 |
| [12] |
陈功义, 郝振芳, 王建超. 黄芩苷在鸡胚上对鸡常见病毒AIV、NDV、IBV的作用效果[J]. 中兽医医药杂志, 2015, 34(2): 5-7. CHEN G Y, HAO Z F, WANG J C. Effect of baicalin on several fowl viruses in chicken embryos[J]. Journal of Traditional Chinese Veterinary Medicine, 2015, 34(2): 5-7. (in Chinese) |
| [13] |
薛洋, 闫延华, 付敬敬, 等. 黄芩苷防治雏鸡传染性支气管炎的药理作用[J]. 江苏农业学报, 2017, 33(5): 1082-1092. XUE Y, YAN Y H, FU J J, et al. Pharmacology of prevention and control of avian infectious bronchitis by baicalin[J]. Jiangsu Journal of Agricultural Sciences, 2017, 33(5): 1082-1092. DOI:10.3969/j.issn.1000-4440.2017.05.019 (in Chinese) |
| [14] |
FENG H P, ZHANG K, ZHANG K, et al. Antiviral activity and underlying mechanisms of baicalin against avian infectious bronchitis virus in vitro[J]. Avian Pathol, 2022, 51(6): 574-589. DOI:10.1080/03079457.2022.2109453 |
| [15] |
刘卫容, 李明佳, 向谈婷, 等. 黄芩抑制鸡传染性支气管炎病毒增殖的作用机制研究[J]. 中国家禽, 2019, 41(18): 24-27. LIU W R, LI M J, XIANG T T, et al. Study on the inhibiting mechanism of IBV by Scutellaria baicalensis[J]. China Poultry, 2019, 41(18): 24-27. (in Chinese) |
| [16] |
CHEN S W, LIU Q, ZHANG L N, et al. The role of REC8 in the innate immune response to viral infection[J]. J Virol, 2022, 96(6): e0217521. DOI:10.1128/jvi.02175-21 |
| [17] |
TAO W, FU T, HE Z J, et al. Immunomodulatory effects of Radix isatidis polysaccharides in vitro and in vivo[J]. Exp Ther Med, 2021, 22(6): 1405. DOI:10.3892/etm.2021.10841 |
| [18] |
ZHANG F L, YIN X J, YAN Y L, et al. Pharmacokinetics and pharmacodynamics of Huanglian-Houpo decoction based on berberine hydrochloride and magnolol against H1N1 influenza virus[J]. Eur J Drug Metab Pharmacokinet, 2022, 47(1): 57-67. DOI:10.1007/s13318-021-00724-x |
| [19] |
詹铀超, 秦笙, 陈富. 黄芩苷抗呼吸道合胞病作用的研究[J]. 国际检验医学杂志, 2017, 38(14): 1907-1909. ZHAN Y C, QIN S, CHEN F. Study on effect and mechanism of baicalin on antiviral effects about respiratory syncytial virus[J]. International Journal of Laboratory Medicine, 2017, 38(4): 1907-1909. (in Chinese) |
| [20] |
GAO M Y, WANG Q L, ZHAO W J, et al. Serotype, antigenicity, and pathogenicity of a naturally recombinant TW Ⅰ genotype infectious bronchitis coronavirus in China[J]. Vet Microbiol, 2016, 191: 1-8. DOI:10.1016/j.vetmic.2016.05.018 |
| [21] |
FENG H P, WANG X Z, ZHANG J Y, et al. Combined effect of Shegandilong granule and doxycycline on immune responses and protection against avian infectious bronchitis virus in broilers[J]. Front Vet Sci, 2021, 8: 756629. DOI:10.3389/fvets.2021.756629 |
| [22] |
ZHANG Y, LI X Y, Zhang B S, et al. In vivo antiviral effect of plant essential oils against avian infectious bronchitis virus[J]. BMC Vet Res, 2022, 18(1): 90. DOI:10.1186/s12917-022-03183-x |
| [23] |
KHAZEEI TABARI M A, IRANPANAH A, BAHRAMSOLTANI R, et al. Flavonoids as promising antiviral agents against SARS-CoV-2 infection: a mechanistic review[J]. Molecules, 2021, 26(13): 3900. DOI:10.3390/molecules26133900 |
| [24] |
FANG S G, SHEN S, TAY F P L, et al. Selection of and recombination between minor variants lead to the adaptation of an avian coronavirus to primate cells[J]. Biochem Biophys Res Commun, 2005, 336(2): 417-423. DOI:10.1016/j.bbrc.2005.08.105 |
| [25] |
FRANZO G, TUCCIARONE C M, LEGNARDI M, et al. Effect of genome composition and codon bias on infectious bronchitis virus evolution and adaptation to target tissues[J]. BMC Genomics, 2021, 22(1): 244. DOI:10.1186/s12864-021-07559-5 |
| [26] |
FANG S G, CHEN B, TAY F P L, et al. An arginine-to-proline mutation in a domain with undefined functions within the helicase protein (Nsp13) is lethal to the coronavirus infectious bronchitis virus in cultured cells[J]. Virology, 2007, 358(1): 136-147. DOI:10.1016/j.virol.2006.08.020 |
| [27] |
ZHAN Y Z, TA W J, TANG W J, et al. Potential antiviral activity of isorhamnetin against SARS-CoV-2 spike pseudotyped virus in vitro[J]. Drug Dev Res, 2021, 82(8): 1124-1130. DOI:10.1002/ddr.21815 |
| [28] |
SONG J K, ZHANG L, XU Y F, et al. The comprehensive study on the therapeutic effects of baicalein for the treatment of COVID-19 in vivo and in vitro[J]. Biochem Pharmacol, 2021, 183: 114302. DOI:10.1016/j.bcp.2020.114302 |
| [29] |
FUNG T S, LIU D X. Human coronavirus: host-pathogen interaction[J]. Annu Rev Microbiol, 2019, 73: 529-557. DOI:10.1146/annurev-micro-020518-115759 |
| [30] |
OJHA N K, LIU J J, YU T Q, et al. Interplay of the ubiquitin proteasome system and the innate immune response is essential for the replication of infectious bronchitis virus[J]. Arch Virol, 2021, 166(8): 2173-2185. DOI:10.1007/s00705-021-05073-3 |
| [31] |
LEI J, KUSOV Y, HILGENFELD R. Nsp3 of coronaviruses: structures and functions of a large multi-domain protein[J]. Antiviral Res, 2018, 149: 58-74. DOI:10.1016/j.antiviral.2017.11.001 |
| [32] |
KINT J, DICKHOUT A, KUTTER J, et al. Infectious bronchitis coronavirus inhibits STAT1 signaling and requires accessory proteins for resistance to type Ⅰ interferon activity[J]. J Virol, 2015, 89(23): 12047-12057. DOI:10.1128/JVI.01057-15 |
| [33] |
YANG H, DONG Y R, BIAN Y, et al. The influenza virus PB2 protein evades antiviral innate immunity by inhibiting JAK1/STAT signalling[J]. Nat Commun, 2022, 13(1): 6288. DOI:10.1038/s41467-022-33909-2 |
| [34] |
MA Y L, WANG C L, XUE M, et al. The coronavirus transmissible gastroenteritis virus evades the type Ⅰ interferon response through IRE1α-mediated manipulation of the microRNA miR-30a-5p/SOCS1/3 axis[J]. J Virol, 2018, 92(22): e00728-18. DOI:10.1128/JVI.00728-18 |
| [35] |
CROKER B A, KIU H, PELLEGRINI M, et al. IL-6 promotes acute and chronic inflammatory disease in the absence of SOCS3[J]. Immunol Cell Biol, 2012, 90(1): 124-129. DOI:10.1038/icb.2011.29 |
(编辑 孟培)



