2. 河南农业大学动物医学院, 郑州 450002
2. College of Veterinary Medicine, Henan Agricultural University, Zhengzhou 450002, China
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),俗称蓝耳病,是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种高度接触性传染病,其临床症状主要为猪的繁殖机能障碍、仔猪生长缓慢、生产性能下降以及呼吸系统症状。自PRRS在美国和欧洲等地被发现以来,便开始在全球范围内广泛流行,严重危害国内外养猪业的发展。目前PRRSV分为两种基因型,欧洲型为PRRSV-1,北美型为PRRSV-2[1-2]。PRRSV是一种包膜的单股正链RNA病毒,基因组长度大约为15 kb,含有至少12个开放阅读框(open reading frame,ORF),编码16种非结构蛋白和8种结构蛋白[3]。PRRSV具有易突变、持续性感染、感染后能产生抗体依赖性增强(antibody dependent enhancement, ADE)效应等特点,这也加剧了PRRSV的防控难度。目前国内预防PRRSV感染的主要途径是接种疫苗,但疫苗的持久性和有效性仍存在问题,因此如何精准防控病毒感染是目前急需解决的科学问题[4-5]。病毒感染宿主后,与宿主发生相互作用,逃逸宿主的免疫应答,从而在宿主体内增殖,这是病毒生存的关键。因此可以通过研究这些病毒与宿主之间的相互作用,开发新的抗PRRSV策略,以期更好地预防和治疗PRRSV感染。
天然免疫是宿主抵抗病毒感染的第一道防线,病毒入侵宿主后,不同的模式识别受体(pattern recognition receptors,PRRs)能够识别不同的病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),通过刺激细胞中的信号分子,进而诱导下游干扰素(interferon,IFN)的产生以及一些干扰素刺激基因(IFN-stimulated genes,ISGs)的表达[6-7]。TRIM(tripartite motif protein,TRIM)家族蛋白作为ISGs的一员,同时也属于E3泛素连接酶家族成员之一,广泛参与了多种生物学过程,如限制病毒感染、调控天然免疫信号通路、自噬、细胞发育、凋亡和癌症等[8]。TRIM蛋白由N端的一个RING结构域、一个或两个B-Box结构域、一个coiled-coil结构域和C端的非特异性结构域组成。RING结构域是一个锌指结构域,可以特异性地结合E2偶联酶,从而发挥E3泛素连接酶的作用[9]。许多TRIM蛋白可以通过调节抗病毒天然免疫信号通路或直接靶向病毒蛋白调控病毒复制, 如病毒感染后上调TRIM14,TRIM14通过招募去泛素化酶USP14逆转cGAS的泛素化降解,提高其稳定性并增强对HSV-1的抗病毒应答[10]。TRIM11通过与TBK1相互作用,抑制IRF3介导的IFN-β产生[11]。TRIM25能够靶向IBDV的VP3蛋白,并泛素化降解VP3,从而抑制IBDV复制[12]。最近的研究表明TRIM家族蛋白在调控PRRSV感染中发挥重要作用,如TRIM59能够抑制PRRSV-2的体外复制[13];本实验室前期的研究结果也显示,TRIM22在调控PRRSV复制过程中发挥了重要作用[14]。因此深入探究TRIM家族蛋白调控PRRSV复制的分子机制,可以为PRRS的防控提供新靶点和新思路。
MID2(midline 2)属于TRIM蛋白家族C-Ⅰ类成员,也被称作TRIM1。与其他TRIM家族蛋白不同的是,对MID2的研究集中于Opitz G/BBB综合征(Opitz BBB/G syndrome,OS)及对细胞周期的调控作用。近期的研究表明,MID2还能通过泛素化修饰LRRK2(leucine-rich repeat kinase 2),并控制其定位、降解和毒性进而参与到调控家族性帕金森病的过程[15]。此前已有报道表明,人源MID2能够激活核因子κB(nuclear factor-κB,NF-кB)和激活子蛋白-1(activator protein 1,AP-1)的信号转导[16],但是MID2在先天免疫和炎症信号转导中的作用目前尚不清楚。在本研究中作者发现MID2可能作为一种新的调控因子,通过正向调控Ⅰ-IFN信号通路,抑制PRRSV复制。
1 材料与方法 1.1 试验材料1.1.1 细胞、病毒和质粒 人胚胎肾上皮细胞(HEK293 T),非洲绿猴肾细胞(MARC-145),PRRSV BJ-4毒株,pCMV-Flag载体,pCAGGS-HA载体,pGL3-basic和pGL3-IFN-β-Luc荧光素酶报告载体均由本实验室保存。
1.1.2 试剂和抗体 双荧光素酶报告基因检测试剂盒购自Promega公司;PrimeSTAR Ⓡ Max DNA Polymerase、RNAiso Plus、PrimeScriptTMRT reagent Kit with gDNA Eraser和TB Green Ⓡ Premix Ex TaqTM Ⅱ均购自TaKaRa公司;LipofectamineTM 2000转染试剂购自Invitrogen公司;DMEM高糖培养基购自北京索莱宝科技有限公司;胶回收试剂盒购自天根生化科技有限公司;无内毒素质粒提取试剂盒购自康为世纪生物科技有限公司;兔抗HA多克隆抗体(51064-2-AP)、HRP-β-actin抗体(HRP-60008)和HRP-山羊抗兔IgG(H+L)抗体(SA00001-2)均购自Proteintech公司;兔抗Flag多克隆抗体(14793 s)购自CST公司;鼠抗Flag单克隆抗体(F1804)购自Sigma公司;兔抗PRRSV N蛋白多克隆抗体由本实验室制备保存;HRP-山羊抗鼠IgG(H+L)抗体(5220-0341)购自SeraCare公司。兔源MID2特异性抗体购自Abclonal公司。
1.2 引物和siRNA的设计与合成根据NCBI公布的猴源MID2(GenBank No.: XM_015127967)、PRRSV ORF7和猴源β-actin(GenBank: AB004 047.1)的基因序列,利用Primer Premier 5软件设计MID2的扩增引物、RT-qPCR引物,及PRRSV ORF7和猴源β-actin的RT-qPCR引物,由上海生工生物工程股份有限公司合成。MID2特异性siRNA和阴性对照NC siRNA由上海吉玛基因公司设计合成。引物及siRNA序列如表 1所示。
|
|
表 1 引物及siRNA序列 Table 1 Primers and siRNA sequences |
1.3.1 Western blot检测过表达MID2对PRRSV N蛋白表达水平的影响 将pCMV-Flag质粒和pCMV-Flag-MID2质粒分别转染至MARC-145细胞中,转染24 h后将PRRSV以MOI=0.1感染细胞。病毒感染24 h后收集细胞至离心管中,加入RIPA高强度裂解液,蛋白上样缓冲液以及PMSF,煮沸后离心10 min,再进行SDS-PAGE电泳。转膜后分别用兔抗Flag多克隆抗体(1 ∶4 000)和兔抗PRRSV N多克隆抗体(1 ∶200)4 ℃过夜孵育,再用HRP-山羊抗兔IgG(1 ∶8 000)于室温孵育1 h,PBST清洗3次后进行ECL显影。
1.3.2 RT-qPCR检测过表达MID2对PRRSV ORF7转录水平的影响 将pCMV-Flag质粒和pCMV-Flag-MID2质粒分别转染至MARC-145细胞中,转染24 h后将PRRSV以MOI=0.1感染细胞。病毒感染24 h后收获细胞,提取细胞总RNA并反转录为cDNA作为RT-qPCR反应的模板。反应所需的各个引物见表 1,反应体系:10 μL SYBR qPCR mix,0.5 μL上游引物,0.5 μL下游引物,1 μL cDNA模板,8 μL ddH2O,具体反应程序按照试剂说明书进行。
1.4 敲低MID2对PRRSV复制的影响1.4.1 Western blot检测敲低MID2对PRRSV N蛋白表达水平的影响 将阴性对照siRNA-NC和siRNA-MID2分别转染至MARC-145细胞中,转染24 h后将PRRSV以MOI=0.1感染细胞。病毒感染24 h后按“1.3.1”的方法进行处理。
1.4.2 RT-qPCR检测敲低MID2对PRRSV ORF7转录水平的影响 将阴性对照siRNA-NC和siRNA-MID2分别转染至MARC-145细胞中,转染24 h后将PRRSV以MOI=0.1感染细胞。病毒感染24 h后按“1.3.2”的方法进行处理。
1.5 双荧光素酶基因报告试验检测MID2对IFN-β启动子活性的影响取生长状态良好的HEK293T细胞均匀铺种至24孔板中,待孔中细胞密度长至80%时,将pCMV-Flag-MID2质粒以不同转染剂量(0、50、100、300和500 ng)分别与pGL3-IFN-β-Luc质粒、p-Renilla质粒共转染至细胞中,对照组转染相应剂量的pCMV-Flag质粒及pGL3-IFN-β-Luc质粒、p-Renilla质粒,每组试验设计三个重复。转染18 h后,加入poly(I: C)或PBS刺激上述各组细胞,6 h后收集细胞样品,利用双荧光素酶试剂盒检测荧光强度,计算相应的启动子活性。
1.6 MID2和RIG-Ⅰ的Co-IP试验将pCMV-Flag质粒和pCMV-Flag-MID2质粒分别与pCMV-Myc-RIG-Ⅰ质粒共转染至HEK293 T细胞中,转染后36 h收获细胞。首先用弱裂解液NP 40裂解细胞1 h,离心后取30 μL上清作为Input组样品,在剩余上清中加入protein A/G琼脂糖珠子进行除杂,再用偶联Flag标签抗体的琼脂糖凝珠4 ℃过夜孵育。用PBS清洗琼脂糖凝珠5次,再加入RIPA裂解液和PMSF进行裂解,最后将得到的样品煮沸离心后,进行SDS-PAGE电泳。转膜后分别用兔抗Flag多克隆抗体(1 ∶4 000),兔抗Myc多克隆抗体(1 ∶2 000)和HRP-β-actin抗体(1 ∶1 000)4 ℃过夜孵育后,再用HRP-山羊抗兔IgG室温孵育1 h后进行ECL显影。
1.7 统计学分析所有试验均平行重复3次,并通过GraphPad Prism 8.0软件中t-test对试验数据进行统计学分析。
2 结果 2.1 MID2真核表达质粒的构建将生长状态良好的MARC-145细胞裂解后,提取总RNA反转录为cDNA作为MID2的扩增模板,进行PCR扩增。电泳结果显示,在2 000 bp左右有单一条带(图 1A),与预期结果相符。扩增片段经同源重组酶连接至pCMV-Flag真核表达载体,将重组载体转化至大肠杆菌DH5α后,进行菌液PCR筛选鉴定。选取4株阳性菌株提取重组质粒,进行双酶切电泳鉴定,结果显示在2 000、5 000 bp附近各有单一条带,分别与目的基因和载体大小相符(图 1B)。最后任选一个质粒送至生物公司进行测序,测序结果与NCBI上下载的基因序列完全一致。另将pCMV-Flag-MID2质粒及pCMV-Flag空载转染至HEK293T细胞中进行Western blot检测,发现在80 ku处出现特异性条带,确认pCMV-Flag-MID2真核表达质粒构建成功(图 1C)。以上结果说明,pCMV-Flag-MID2真核表达质粒正确构建并成功表达。
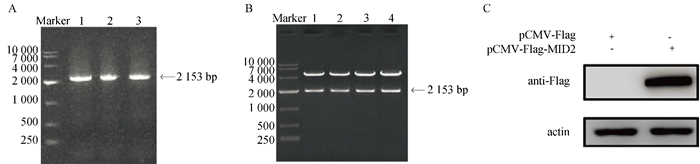
|
A. PCR扩增MID2目的条带(1~3);B. 双酶切后的pCMV-Flag-MID2重组质粒(1~4);C. Western blot检测pCMV-Flag-MID2质粒表达 A. PCR amplification of MID2 (1-3); B. pCMV-Flag-MID2 plasmid after double digestion (1-4);C. The identification of expression of pCMV-Flag-MID2 by Western blot 图 1 pCMV-Flag-MID2真核表达质粒的构建及鉴定 Fig. 1 Construction and identification of MID2 eukaryotic expression plasmid |
将PRRSV BJ-4毒株(MOI=0.1)感染MARC-145细胞,通过RT-qPCR检测病毒感染24 h后细胞中MID2的转录水平。结果表明,感染PRRSV后,MARC-145细胞中MID2的mRNA表达水平明显上调(P < 0.05,图 2A)。随后,作者通过Western blot试验检测未感染PRRSV和感染PRRSV 24 h后细胞中内源性MID2和PRRSV N蛋白的表达水平,结果显示,PRRSV成功感染MARC-145细胞,且细胞中内源性MID2的表达水平在病毒感染后显著上调(图 2B)。以上结果表明,PRRSV感染上调MID2的表达。

|
A. RT-qPCR检测接种PRRSV对MID2 mRNA转录水平的影响(*.P < 0.05);B. Western blot检测接种PRRSV对MID2蛋白表达水平的影响 A. The effect of PRRSV inoculation on MID2 mRNA transcription was detected by RT-qPCR (*.P < 0.05); B. The effect of PRRSV inoculation on MID2 protein expression was detected by Western blot 图 2 PRRSV感染上调MID2的表达 Fig. 2 MID2 is upregulated upon PRRSV infection |
为了进一步研究MID2对PRRSV感染的调控作用,首先将构建的MID2真核表达质粒pCMV-Flag-MID2转染至MARC-145细胞,同时转染pCMV-Flag空载作为空白对照,24 h后接种PRRSV(MOI=0.1)。接毒后24 h收取细胞样品,通过RT-qPCR和Western blot试验分别检测细胞中PRRSV ORF7 mRNA转录水平以及N蛋白的表达水平。结果显示,过表达MID2明显降低PRRSV ORF7的转录水平以及N蛋白表达水平,说明过表达MID2能够抑制PRRSV的复制(图 3A~C)。随后将siRNA-MID2(siRNA 1、siRNA 2、siRNA 3)与对照siRNA(siRNA-NC)分别转染至MARC-145细胞,经Western blot检测siRNA在细胞中的干扰效率,结果显示,转染siRNA 3的细胞中MID2蛋白的表达水平下降最为明显,说明siRNA 3的干扰效率最好,可用于后续试验(图 3D、E)。将siRNA3及阴性对照分别转染到MARC-145细胞以敲低内源性MID2的表达,然后接种PRRSV(MOI=0.1)。通过RT-qPCR检测接毒24 h后细胞中PRRSV ORF7转录水平,同时通过Western blot检测了敲低MID2后,病毒感染24 h时细胞中PRRSV N蛋白的表达水平,结果发现,敲低MID2明显上调PRRSV N蛋白的表达水平及ORF7的转录水平(图 3F、G),表明敲低MID2能够促进PRRSV复制。以上结果表明,MID2是PRRSV复制的负调控因子,能够显著抑制PRRSV复制。
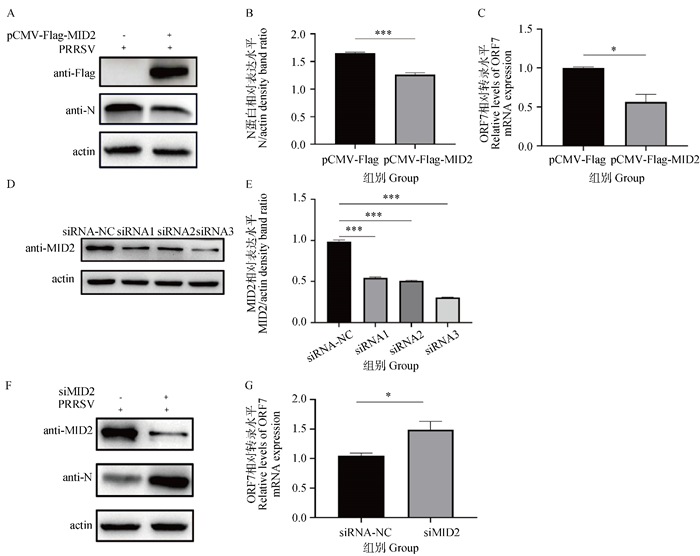
|
A、B. 过表达MID2对PRRSV N蛋白表达水平的影响;C. 过表达MID2对PRRSV ORF7 mRNA转录水平的影响;D、E. MID2干扰效率验证;F. 敲低MID2对PRRSV N蛋白表达水平的影响;G. 敲低MID2对PRRSV ORF7 mRNA转录水平的影响。*.P < 0.05,***.P < 0.001 A, B.Effects of overexpression of MID2 on PRRSV N protein expression levels; C. Effect of overexpression of MID2 on PRRSV ORF7 mRNA transcription levels; D, E. MID2 interference efficiency verification; F. Effects of knockdown of MID2 on PRRSV N protein expression levels; G. Effect of knockdown of MID2 on PRRSV ORF7 mRNA transcription levels.*.P < 0.05, ***.P < 0.001 图 3 MID2是PRRSV复制的负调控因子 Fig. 3 MID2 is a negative regulator of PRRSV replication |
为了探究MID2是否通过调控天然免疫信号通路影响PRRSV复制,作者将pGL3-IFN-β-Luc质粒与pCMV-Flag-MID2真核表达质粒共转染到HEK293T细胞中,对照组转染pCMV-Flag空载,并分别用PBS和poly(I: C)进行刺激,通过双荧光素酶基因报告试验检测IFN-β的启动子活性。结果显示,过表达MID2能够显著上调IFN-β的启动子活性水平,且这种上调作用在poly(I: C)刺激后表现的更加明显(P < 0.05,图 4A)。为了验证MID2的剂量是否会影响其对IFN-β的启动子活性的调节作用,作者分别将不同剂量的pCMV-Flag-MID2(50、100、200和400 ng)与pGL3-IFN-β-Luc质粒共转染至HEK293T细胞中,进行双荧光素酶基因报告试验。结果显示,过表达MID2能够剂量依赖性上调poly(I: C)诱导的IFN-β的启动子活性(P < 0.05,图 4B)。随后将siRNA-MID2及其阴性对照分别转染到HEK293T细胞中,分别用poly(I: C)和PBS进行刺激,再次对IFN-β的启动子活性进行检测,发现poly(I: C)刺激后IFN-β的启动子活性显著升高,且敲低MID2明显下调poly(I: C)诱导的IFN-β的启动子活性(P < 0.05,图 4C)。另外,作者在HEK293T细胞中过表达了pCMV-Flag-MID2质粒,经poly(I: C)刺激后,RT-qPCR检测IFN-β、ISG15(IFN-stimulated gene 15)及ISG56(IFN-stimulated gene 56)基因的mRNA转录水平。结果显示,过表达MID2能够显著上调poly(I: C)诱导的IFN-β、ISG15及ISG56的mRNA转录水平(图 4D~F)。以上结果说明MID2能够正向调控Ⅰ-IFN信号通路。
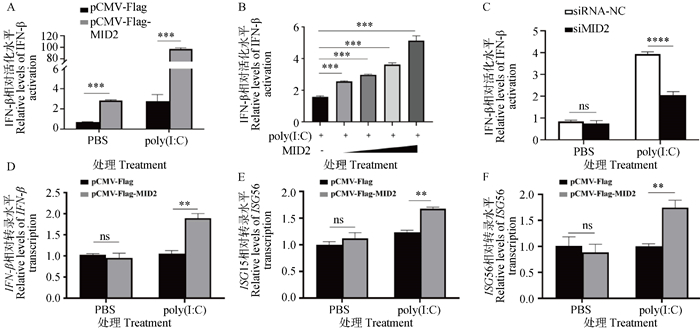
|
A. poly(I: C)刺激后,过表达MID2对IFN-β启动子活性的影响;B. poly(I: C)刺激后,梯度过表达MID2对IFN-β启动子活性的影响;C. poly(I: C)刺激后,敲低MID2对IFN-β启动子活性的影响;D~F. poly(I: C)刺激后,过表达MID2对IFN-β及部分ISGs的mRNA转录水平的影响。ns. P>0.05,**. P < 0.01, *** P < 0.001, ****. P < 0.000 1 A. Effect of overexpression of MID2 on IFN-β promoter activity after poly(I: C) stimulation; B. Effect of gradient overexpression of MID2 on IFN-β promoter activity after poly(I: C) stimulation; C. Effect of MID2 knockdown on IFN-β promoter activity after poly(I: C) stimulation; D-F. Effects of overexpression of MID2 on mRNA transcription levels of IFN-β and some ISGs after poly(I: C) stimulation. ns. P>0.05, **. P<0.01, *** P < 0.001, ****. P < 0.000 1 图 4 MID2正向调控Ⅰ-IFN信号通路 Fig. 4 MID2 positively regulates the Ⅰ-IFN signaling pathway |
根据相关文献报道,MID2与TRIM25的蛋白结构域非常相似,二者的C端均含有PRY/SPRY结构域。且有研究表明,TRIM25能与RIG-Ⅰ发生相互作用[17]。因此,我们将pCMV-Flag-MID2真核表达质粒和pCMV-Flag质粒分别与pCMV-Myc-RIG-Ⅰ真核表达质粒共转染到HEK293T细胞中,转染36 h后收样,通过Co-IP试验检测二者之间是否存在相互作用。Western blot结果显示,只有共转染pCMV-Flag-MID2和pCMV-Myc-RIG-Ⅰ后,在IP组能检测到RIG-Ⅰ蛋白,与预期结果一致,表明MID2和RIG-Ⅰ之间存在相互作用(图 5A)。为了研究MID2对RIG的翻译表达量是否有影响,作者分别将不同剂量的pCMV-Flag-MID2质粒(0、1和2 μg)与1 μg的pCMV-Myc-RIG-Ⅰ质粒共转染到HEK293T细胞中。Western blot结果显示,随着MID2转染剂量的增加,RIG-Ⅰ的蛋白表达水平也显著上调(图 5B)。以上结果说明,MID2与RIG-Ⅰ之间存在相互作用,且MID2以剂量依赖的方式促进RIG-Ⅰ的表达。随后将pCMV-Flag空载、pCMV-Flag-MID2和pCMV-Flag-RIG-Ⅰ质粒单独转染或共转至HEK293T细胞中,通过双荧光素酶基因报告试验和RT-qPCR试验分别检测IFN-β的启动子活性水平、IFN-β以及下游ISGs的mRNA转录水平。结果显示,MID2和RIG-Ⅰ共转时,IFN-β的启动子活性水平、IFN-β mRNA转录水平以及下游ISGs的mRNA转录水平显著高于单独转染RIG-Ⅰ时的水平(图 5C~F),说明MID2能够通过与RIG-Ⅰ相互作用,促进RIG-Ⅰ的蛋白表达,进而促进RIG-Ⅰ介导的Ⅰ-IFN信号通路,进一步增强抗病毒天然免疫反应。

|
A. Co-IP检测pCMV-Flag-MID2与pCMV-Myc-RIG-Ⅰ的互作; B.梯度过表达pCMV-Flag-MID2质粒,Western blot检测RIG-Ⅰ的表达水平; C. 双荧光素酶报告基因检测单独转染MID2、RIG-Ⅰ及MID2与RIG-Ⅰ共转时IFN-β的启动子活性; D~F. RT-qPCR检测单独转染MID2、RIG-Ⅰ及MID2与RIG-Ⅰ共转时,IFN-β、ISG15、ISG56的mRNA转录水平。***. P < 0.001 A. Co-IP detects the interaction between pCMV-Flag-MID2 and pCMV-Myc-RIG-Ⅰ; B. After gradient overexpression of pCMV-Flag-MID2 plasmid, the expression levels of RIG-Ⅰ was detected by Western blot; C. Dual-luciferase reporter gene assay were used to detect the promoter activity of IFN-β transfected with MID2, RIG-Ⅰ alone, and MID2 cotransfected with RIG-Ⅰ; D-F. mRNA transcription levels of IFN-β, ISG15 and ISG56 were determined by RT-qPCR when MID2 and RIG-Ⅰ were transfected alone or MID2 was co-transfected with RIG-Ⅰ. ***. P < 0.001 图 5 MID2能够和RIG-Ⅰ发生互作 Fig. 5 MID2 interacts with RIG-Ⅰ |
作为一种重要的病毒性传染病,PRRS对世界各国的养猪业造成了严重的威胁。在过去的三十年里,尽管在PRRSV的结构、致病性、遗传变异及免疫调控等方面取得了一定的研究进展,但是对于其入侵机体以及免疫逃逸的具体分子机制仍有待完善[1]。病毒与宿主蛋白之间的相互作用是病毒入侵机体的感染基础和必然过程,同时也是宿主对抗病毒感染的重要手段。因此,深入研究病毒与宿主之间的相互作用有利于更好地了解病毒的感染机制,同时也能寻找到新的抗病毒因子,为病毒感染的精准防控以及抗病毒药物的研发提供理论依据。
最近的研究表明,多数TRIM家族蛋白都具有抗病毒的功能,在抑制病毒复制的过程中发挥重要作用。TRIM家族蛋白主要通过两种途径来发挥功能:一种是通过调节抗病毒先天免疫应答的信号通路来抑制病毒复制,如TRIM56能诱导cGAS的Lys335位点泛素化,促进HSV-1感染后HEK293 T和Vero细胞中cGAS介导的IFNα/β的产生[18];TRIM21能与MAVS相互作用,催化MAVS发生K27连接的多泛素化,促进IRF3的激活,从而增强I型IFN信号通路,抑制CVB3在心肌细胞中的复制[19]。TRIM蛋白发挥功能的另一种方式是直接靶向病毒成分,通过降解或非降解机制导致病毒蛋白的降解或功能抑制,从而中断病毒的生命周期,如TRIM32通过直接靶向PB1聚合酶并对其进行泛素化修饰来感知和抑制甲型流感病毒复制[20]。此外,有些TRIM家族蛋白还能够同时进行以上两种途径来调控病毒的复制,如在感染IAV后,TRIM35一方面通过对TRAF3进行K63连接的泛素化修饰,促进RIG-Ⅰ抗病毒信号级联反应的激活和I型IFN的产生,另一方面通过泛素-蛋白酶体系统降解病毒的PB2蛋白,从而抑制IAV复制[20]。在本研究中,作者通过双荧光素酶报告基因试验检测到过表达MID2能够促进IFN-β的启动子活性,说明MID2可能是通过上调I型干扰素信号通路来抑制PRRSV的复制。
MID2的C端具有PRY/SPRY结构域,该结构域在TRIM家族蛋白中最为常见。PRY/SPRY结构域可以帮助TRIM蛋白形成多聚信号体,与细胞内抗体相互作用,参与调节体内免疫应答,被认为是TRIM家族蛋白与其他蛋白质和RNA结合的部位,具有非常重要的研究价值[21]。此外,对TRIM5α、TRIM25等蛋白的研究表明,该结构域还与限制病毒复制的功能有关。如:TRIM5α能够通过SPRY与coiled-coil结构域之间的互作提高自身识别逆转录病毒衣壳蛋白的能力[22];TRIM25能够通过SPRY结构域与RIG-Ⅰ发生相互作用,并对RIG-Ⅰ进行K63连接的泛素化修饰,导致RIG-Ⅰ下游信号传导活性显著增加[17]。在本研究中,作者通过Co-IP试验,发现MID2能够与RIG-Ⅰ相互作用,且以剂量依赖的方式促进RIG-Ⅰ的表达,进一步增强RIG-Ⅰ介导的Ⅰ-IFN信号通路的激活及下游抗病毒基因的表达,但二者发生互作的具体结构域有待后续深入研究。
4 结论MID2是PRRSV复制过程中一个重要的负调控因子,在PRRSV感染后表达上调,且MID2能够上调IFN-β的启动子活性。此外,MID2通过靶向RIG-Ⅰ从而正调控Ⅰ-IFN抗病毒免疫应答,从而抑制PRRSV的增殖。
| [1] |
郭振华, 陈鑫鑫, 李睿, 等. 中国猪繁殖与呼吸综合征病毒流行历史及现状[J]. 畜牧兽医学报, 2018, 49(1): 1-9. GUO Z H, CHEN X X, LI R, et al. The prevalent history and current status of porcine reproductive and respiratory syndrome in China[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(1): 1-9. DOI:10.11843/j.issn.0366-6964.2018.01.001 (in Chinese) |
| [2] |
KAPPES M A, FAABERG K S. PRRSV structure, replication and recombination: Origin of phenotype and genotype diversity[J]. Virology, 2015, 479-480: 475-486. DOI:10.1016/j.virol.2015.02.012 |
| [3] |
DOKLAND T. The structural biology of PRRSV[J]. Virus Res, 2010, 154(1-2): 86-97. DOI:10.1016/j.virusres.2010.07.029 |
| [4] |
MA J, MA L, YANG M, et al. The function of the PRRSV-host interactions and their effects on viral replication and propagation in antiviral strategies[J]. Vaccines (Basel), 2021, 9(4): 364. DOI:10.3390/vaccines9040364 |
| [5] |
RISSER J, ACKERMAN M, EVELSIZER R, et al. Porcine reproductive and respiratory syndrome virus genetic variability a management and diagnostic dilemma[J]. Virol J, 2021, 18(1): 206. DOI:10.1186/s12985-021-01675-0 |
| [6] |
KAWAI T, AKIRA S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors[J]. Nat Immunol, 2010, 11(5): 373-384. DOI:10.1038/ni.1863 |
| [7] |
CROW M K, OLFERIEV M, KIROU K. A. Targeting of type Ⅰ interferon in systemic autoimmune diseases[J]. Transl Res, 2015, 165(2): 296-305. DOI:10.1016/j.trsl.2014.10.005 |
| [8] |
HATAKEYAMA S. TRIM family proteins: Roles in autophagy, immunity, and carcinogenesis[J]. Trends Biochem Sci, 2017, 42(4): 297-311. DOI:10.1016/j.tibs.2017.01.002 |
| [9] |
VAN GENT M, SPARRER K M J, GACK M U. TRIM proteins and their roles in antiviral host defenses[J]. Annu Rev Virol, 2018, 5(1): 385-405. DOI:10.1146/annurev-virology-092917-043323 |
| [10] |
CHEN M, MENG Q, QIN Y, et al. TRIM14 inhibits cGAS degradation mediated by selective autophagy receptor p62 to promote innate immune responses[J]. Mol Cell, 2016, 64(1): 105-119. DOI:10.1016/j.molcel.2016.08.025 |
| [11] |
LEE Y, SONG B, PARK C, et al. TRIM11 negatively regulates IFNβ production and antiviral activity by targeting TBK1[J]. PLoS One, 2013, 8(5): e63255. DOI:10.1371/journal.pone.0063255 |
| [12] |
WANG S, YU M, LIU A, et al. TRIM25 inhibits infectious bursal disease virus replication by targeting VP3 for ubiquitination and degradation[J]. PLoS Pathog, 2021, 17(9): e1009900. DOI:10.1371/journal.ppat.1009900 |
| [13] |
JING H, KE W, TAO R, et al. TRIM59 inhibits porcine reproductive and respiratory syndrome virus (PRRSV)-2 replication in vitro[J]. Res Vet Sci, 2019, 127: 105-112. DOI:10.1016/j.rvsc.2019.10.004 |
| [14] |
CHEN J, ZHAO S, CUI Z, et al. MicroRNA-376b-3p promotes porcine reproductive and respiratory syndrome virus replication by targeting viral restriction factor TRIM22[J]. J Virol, 2022, 96(2): e0159721. DOI:10.1128/JVI.01597-21 |
| [15] |
STORMO AED, SHAVAREBI F, FITZGIBBON M, et al. The E3 ligase TRIM1 ubiquitinates LRRK2 and controls its localization, degradation, and toxicity[J]. J Cell Biol, 2022, 221(4): e202010065. DOI:10.1083/jcb.202010065 |
| [16] |
UCHIL PD, HINZ A, SIEGEL S, et al. TRIM protein-mediated regulation of inflammatory and innate immune signaling and its association with antiretroviral activity[J]. J Virol, 2013, 87(1): 257-272. DOI:10.1128/JVI.01804-12 |
| [17] |
GACK M U, SHIN Y C, JOO C H, et al. TRIM25 RING-finger E3 ubiquitin ligase is essential for RIG-Ⅰ-mediated antiviral activity[J]. Nature, 2007, 446(7138): 916-920. DOI:10.1038/nature05732 |
| [18] |
SEO G J, KIM C, SHIN W J, et al. TRIM56-mediated monoubiquitination of cGAS for cytosolic DNA sensing[J]. Nat Commun, 2018, 9(1): 613. DOI:10.1038/s41467-018-02936-3 |
| [19] |
LIU H, LI M, SONG Y, et al. TRIM21 restricts Coxsackievirus B3 replication, cardiac and pancreatic injury via interacting with MAVS and positively regulating IRF3-mediated type-Ⅰ interferon production[J]. Front Immunol, 2018, 9: 2479. DOI:10.3389/fimmu.2018.02479 |
| [20] |
FU B, WANG L, DING H, et al. TRIM32 senses and restricts influenza A virus by ubiquitination of PB1 polymerase[J]. PLoS Pathog, 2015, 11(6): e1004960. DOI:10.1371/journal.ppat.1004960 |
| [21] |
刘艳美, 孙萌, 马瑞瑞. TRIM家族蛋白结构和功能研究进展[J]. 黑龙江畜牧兽医, 2022(8): 29-36. LIU Y M, SUN M, MA R R. Advances in the structure and function of TRIM family protein[J]. Heilongjiang Animal Science and Veterinary Medicine, 2022(8): 29-36. DOI:10.13881/j.cnki.hljxmsy.2022.02.0166 (in Chinese) |
| [22] |
ROGANOWICZ MD, KOMURLU S, MUKHERJEE S, et al. TRIM5α SPRY/coiled-coil interactions optimize avid retroviral capsid recognition[J]. PLoS Pathog, 2017, 13(10): e1006686. DOI:10.1371/journal.ppat.1006686 |
(编辑 白永平)



