2. 中国农业科学院北京畜牧兽医研究所, 北京 100193;
3. 内蒙古赤峰市敖汉旗农牧局, 赤峰 024300;
4. 山西农业大学动物科学学院, 太谷 030801;
5. 吉林农业大学动物科学技术学院, 长春 130118
2. Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Aohan Animal Husbandry Bureau, Chifeng 024300, China;
4. College of Animal Science, Shanxi Agricultural University, Taigu 030801, China;
5. College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China
准确、高效的鉴定母牛发情是奶牛场繁殖管理的重点,也是人工授精成功的前提基础[1]。为此,研发了人工观察法[2]、直肠检查法[3]、激素检测[4]以及超声波法[5]等发情鉴定方法,这些方法联合使用,准确率高,但耗时费力,且需要较高的技术水平和责任心,最重要的是难以解决夜间发情及时鉴定问题。近年来,基于加速度传感器研发的计步器发情鉴定方法[6],实现了自动化,解决了夜间发情无人值守问题。但是,安静发情使计步器鉴定发情面临巨大挑战[7]。另外,还有阴道温度[8]和阴道黏液电阻监测设备[9]虽能有效鉴定出安静发情牛,但两种设备的侵入性易使动物应激,且黏液电阻值监测法所受影响因素较多,自动检测难度大,其结果重复性难以保证。然而,公母牛交配前的信息交流,为突破安静发情的鉴定瓶颈、及时准确无侵入式母牛发情鉴定技术研发,提供重要参考。这种母牛释放出的用来刺激公牛爬跨的化合物被称为信息素,通过种内信息素交流可能是生物进化的结果[10],这点在昆虫相关研究中表现尤为明显[11-16],并且在其它哺乳动物繁殖过程中也发挥了重要作用[17-20]。
唾液是一种含有无机盐、脂肪酸、蛋白质等多种成分的生物体液[21-24],其成分复杂性也赋予了复杂的功能,尤其是动物发情时唾液中的一些化合物在动物繁殖过程中发挥了化学信号(信息素)作用,并对其繁殖和社会等行为产生了重要影响[25-26]。目前,从尿液、粪便、阴道黏液中找到的化合物较少,有些研究根据这些代谢物中检测出的化合物,研发出相关的发情鉴定装置或设备,但检测效率较低(65%~ 75%)[27-28]。母牛唾液中也发现了一些发情相关化合物,但目前未见以这些化合物作为检测目标的发情鉴定方法。在先前的研究中,已经对母牛发情不同阶段唾液中的挥发性化合物进行了比较分析,发现一些化合物仅存在于发情时的唾液中,并且其中有些化合物能引发公牛产生性行为[29-31]。但是,目前的研究结果还存在着一些问题,例如,不同研究者通过不同萃取方法得到的特异性化合物并不完全相同,唾液中存在多种能够影响公牛性行为的化合物,并且组合使用不同化合物也会诱使公牛产生性行为。在奶牛粪便相关文章中,Sankar和Archunan[32]仅在母牛发情时鉴定出的化合物,在Mozūraitis等[33]的研究中只是含量上存在差异,这种差异可能是受限于检测仪器的精密度,发情前后该化合物含量过少而未检测到;Sankar和Archunan[32]将来自不同牛相同阶段的粪便混在一起,对里面化合物种类及含量进行群体特征的研究,其研究结果无法体现不同牛个体特征,而Mozūraitis等[33]对牛粪便化合物的研究结果发现,不同牛粪便中化合物含量差异较大。目前在牛唾液相关研究中,同样缺乏对母牛个体特征、安静发情母牛发情时的这些特异性化合物的变化特点以及与正常发情母牛有何异同的研究。
为促进母牛唾液中挥发性化合物应用于发情鉴定,本研究通过采用SPME方法提取母牛不同发情阶段的唾液,获取其它可能作为发情标记的化合物;探究母牛个体间化合物的含量差异,以及呈现的个体特征与群体特征是否一致;探究安静发情母牛唾液中存在的特异性化合物含量与正常发情母牛的差异。
1 材料与方法 1.1 试验动物选择与样品采集预选择石家庄天泉良种奶牛有限公司的25头健康、产后15~35 d的可繁荷斯坦母牛进行样品采集,饲喂全混合日粮(total mixed rations, TMR),并保证每头牛能自由、清洁饮水。在发情鉴定时,根据活动量变化和母牛外部表现初步进行发情鉴定,再对具有发情表现的母牛采用直肠检查和B超检测进行发情确认;对于安静发情母牛,因其无明显发情表现,故根据产后时间进行行为跟踪,一旦观察到母牛趴卧时阴道流出清亮黏液,再采用直肠检查和B超检测等方法,通过卵泡的发育状态判断其是否发情。发情时样品采集于母牛卵泡发育至成熟大小(约1.5 cm),根据发情当天时间,选择发情前第2~4天采集到的样品作为发情前样品,发情后第4天采集发情后样品。使用针管从牛口腔抽取唾液,并将其放入10 mL的冻存管中。最终共采集到9头母牛(4头正常发情牛和5头安静发情牛)不同发情阶段(发情前、发情时、发情后)的唾液样品,并暂时保存在牧场的-20 ℃冰箱,后转移至-40 ℃冰箱进行保存。
1.2 样品检测方法及流程试验样品采用固相微萃取-气相色谱-质谱(SPME-GC-MS)联用法进行检测分析。首先利用相似相溶原理制的固相微萃取纤维,对母牛代谢物中的挥发性化合物进行富集,故固相微萃取纤维的选择对试验结果至关重要,这是本试验成败的关键。固相微萃取纤维主要从膜成分(种类)和膜厚度(规格)两方面进行选择。按膜成分的性质大致可分为非极性、中等极性和极性3种,市面上常见的纤维根据成分又可分为PDMS(非极性)、PDMS/DVB(非极性)、CAR/PDMS(中等极性)、PDMS/DVB/CAR(中等极性)、CW/DVB(极性)、PA(极性)等6种。本研究打算从不同性质的纤维中各选一个进行预试验,再从中选出最适合本试验使用的纤维,根据前人的研究[34],PDMS提取效率远低于的PDMS/DVB,而CW/DVB对于极性化合物的提取效率低于PA。所以选择两个效果较好的纤维,再加上CAR/PDMS以及PDMS/DVB/CAR进行预试验。种类确定之后需要选择规格,相同种类的纤维有不同规格的膜厚度,不同种类的纤维规格也不一样,总的来说膜厚度在10~100 μm之间。膜厚度对化合物富集的影响存在以下特点:膜越厚富集分子量小的化合物能力越强,反之,膜越薄富集分子量大的化合物能力越强。从前人的研究结果发现,牛代谢物中大部分为小分子化合物(相对分子质量<1 000),故选择膜厚度较厚的纤维进行预试验[34]。
所以,利用PDMS/DVB(65 μm)、CAR/PDMS(75 μm)、PA(85 μm)以及PDMS/DVB/CAR(80 μm)对相关样品进行检测,并根据对同一样本的4种富集结果,从提取到的化合物总量以及种类两方面进行分析:从检测的化合物总峰面积(含量)来看,检测到其中CAR/PDMS在3个时期最高(发情前为5.52×108,发情时为1.07×109,发情后为7.60×108),PA最低(3.8×107,2.94×107,3.24×107),PDMS/DVB(1.55×108,2.10×108,1.60×108)以及DVB/CAR/PDMS(1.96×108,1.98×108,1.34×108)二者检测到的含量处于中游,由此可见,CAR/PDMS检测到的化合物总量显著高于其它3种纤维;从化合物富集种类数量来看,DVB/CAR/PDMS富集的化合物种类最多(发情前92种,发情时88种,发情后81种),其余3种分别为:PDMS/DVB(76、75、75种)、CAR/PDMS(78、67、79种)、PA(68、72、60种),相较于峰面积成倍的差异,化合物种类上的差异并不明显。综合考虑后选择CAR/PDMS纤维用于后续唾液检测试验。
将冷冻保存的唾液2 mL转移到玻璃瓶中解冻,然后转移至用磁性吸附金属盖封闭的20 mL棕色磁性吸附螺口顶空瓶(盖和瓶均购自北京华威思科科技有限公司)中。用固相微萃取方法(solid-phase microextraction,SPME)萃取唾液中挥发出的化合物。升高温度有助于提高方法的灵敏度(挥发的物质可能更多),但有些化合物可能对更高的温度敏感,从而被顶空瓶中的空气氧化。鉴于此,每个样品预热至约38 ℃(接近奶牛体温)15 min。每次富集前,在270 ℃下在GC注射器中净化SPME纤维8 min,消除SPME纤维中的化合物残留。随后SPME注射器的针头刺穿小瓶隔膜,将纤维暴露于顶空瓶中,并停置于样品上方几毫米处,并在38 ℃下富集化合物1 h。
使用Y156气相-超高分辨质谱联用仪(型号:Q-Exactive GC,Thermo Fisher,美国)进行对样品中化合物进行分离鉴定,使用WAX气相色谱柱(长度30 m;内径0.25 mm;膜厚0.25 μm)进行色谱分离;GC条件设定:以氦气作为载气,进样口温度设定为200 ℃,色谱柱温度开始时设置为40 ℃,运行2 min,然后以4 ℃·min-1的速度增加至132 ℃,最后以10 ℃·min-1增加至230 ℃,运行15 min,检测器温度控制为250 ℃。质谱条件设定为:电子电离(离子源);电子轰击能量:70 eV;离子源温度:200 ℃。
通过将挥发性化合物的色谱与质谱数据与计算机谱库(NIST、wiley9、Home Flavor(自建库))中提供的数据进行比对后,确定化合物的种类。
1.3 样品中化合物的相对定量为了在一定程度上消除操作条件以及仪器状态带来的系统误差,通过测量内标物及被测组分的峰面积的相对值来计算被测组分的相对含量。本研究采用氘代乙酸-d{4}(99.5%,北京伊诺凯科技有限公司)作为内标物,使用甲醇作为溶剂,向待测样品中加入20 μL 5 mg·mL-1的氘代乙酸。
1.4 数据分析采用IBM SPSS Statistics软件(版本26;IBM SPSS Inc., Chicago, USA)运行Wilcoxon配对检验[35],比较发情前后和发情时样品中化合物含量的差异;利用单因素方差分析(one-way ANOVA)比较正常发情牛和安静发情牛不同阶段的化合物含量。显著性差异分析水平为0.05。
2 结果 2.1 奶牛不同发情阶段唾液中化合物气相色谱结果通过SPME-GC-MS法检测奶牛唾液样品,得到相应色谱图(图 1)。色谱图出峰情况显示,母牛发情不同阶段所有唾液样品都得到有效检测,各样品化合物成分大致相同,但是含量间存在不同程度差异,有些成分甚至达到显著差异,说明不同发情阶段母牛唾液存在化合物成分差异。
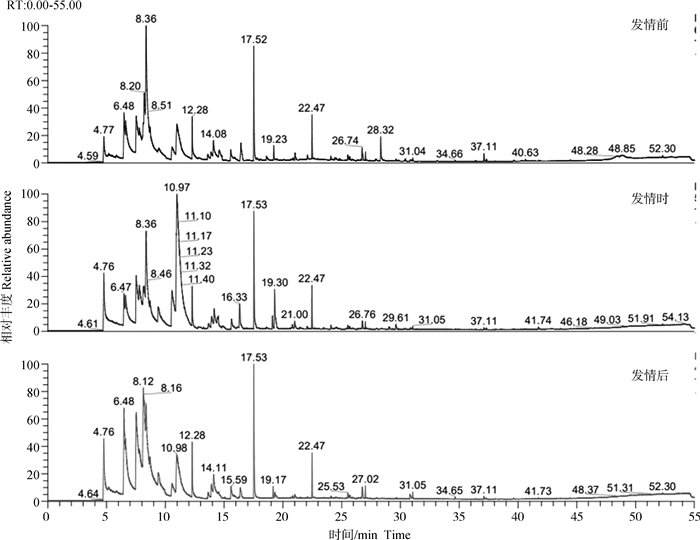
|
以1号正常发情牛为例,说明对不同发情阶段样品中挥发性化合物富集后的气相色谱检测结果。X轴表示各化合物的保留时间(RT),Y轴表示各化合物的相对离子丰度,体现了所分析化合物的含量。每个色谱峰代表一个化合物,色谱峰上所标数字为该化合物的具体出峰时间(由软件自动生成) Taking cow No. 1 with normal estrus as an example, the gas chromatography detection results of volatile compounds enriched in samples at different estrus stages are showed. The X-axis represents the retention time (RT) of each compound, and the Y-axis represents the relative ion abundance of each compound, reflecting the content of the analyzed compounds. Each chromatographic peak represents a compound, and the number marked on the chromatographic peak is the specific peak time of the compound (generated by software) 图 1 不同发情阶段母牛唾液样品的化合物气相色谱检测结果 Fig. 1 Gas chromatography detection results of compounds in saliva samples of cows at different estrus stages |
本研究对每头牛唾液样品进行了色谱检测,通过研究分析检测结果,筛选出40个共有化合物,分析这些化合物在发情周期不同阶段的含量差异,以寻找能够作为母牛发情标记的化合物,指示母牛发情。共有化合物信息见表 1。
|
|
表 1 不同时期母牛唾液中40个共有化合物含量分析(n=9) Table 1 Content analysis of 40 common compounds in saliva of cows at different periods (n=9) |
表 1显示,母牛唾液中的40个共有化合物含量差异较大,例如,发情时2-甲基-1-戊醇含量高达2 425.51 μg·mL-1,而邻氨基苯乙酮含量低至1.4 μg·mL-1,这种量的差异或许说明了各化合物生理意义存在重要差异;平均数的标准差差异也很大,说明不同母牛间相同发情阶段该化合物存在较大个体差异。为找出能作为母牛发情标记的化合物,对40个共有化合物进行了含量配对分析,并进行了含量特征分析。配对分析后共找出23个化合物,分为两种类型,一种化合物发情时含量显著高于发情前后,另一种发情时显著高于发情前,结果见表 2。
|
|
表 2 发情时显著高于发情前的23个化合物的分类 Table 2 Classification of 23 compounds significantly higher during estrus than that before estrus |
表 2筛选出的23个化合物共分为7类,分别是醇类、酮类、酯类、砜类、烯烃类、苯环类、杂环类,其中,醇、酮类数量较多,可能是发情母牛吸引公牛的重要性信息信号源。有些化合物间存在相似结构,可能在公母畜交流中发挥相似的生物学功能,例如,1-丙醇、1-丁醇、1-戊醇和1-己醇等醇类均为直链一元醇,不同分子间仅相差一个或多个CH2原子团;6-甲基-2-庚酮、6-甲基-5-庚烯-2-酮和7-甲基-6-辛烯-2-酮等酮类的羰基均在2号位,并且侧链基团在末位(图 2)。
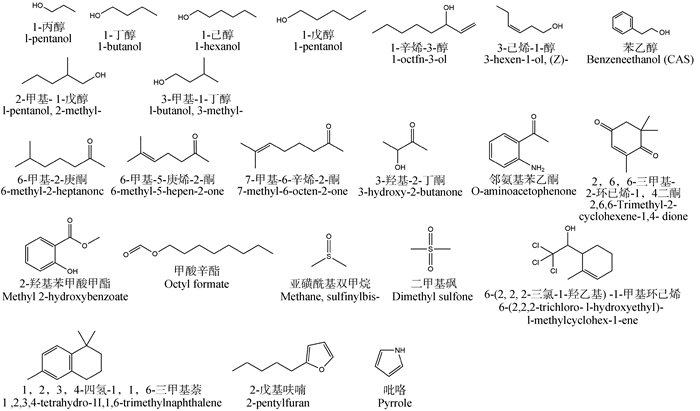
|
图 2 发情时显著高于发情前期的23个化合物的结构式 Fig. 2 Structural formulas of 23 compounds significantly higher during estrus than that before estrus |
上述配对检验表明,母牛唾液中发情特异化合物的含量在发情时显著高于发情前期(P<0.05),但还不知道正常发情和安静发情牛是否存在差异,为此进一步统计分析了23个化合物在正常发情和安静发情时的差异,并比较了这些成分在正常发情和安静发情牛中发情期显著增加的比例,结果如图 3所示。
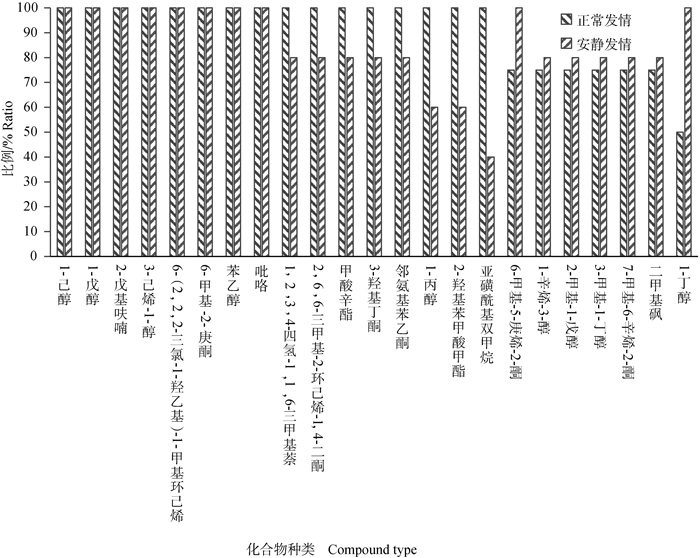
|
图 3 发情时含量显著高于发情前的23个化合物在正常发情和安静发情牛中出现的比例(n=9) Fig. 3 Proportion of 23 compounds with significantly higher content during estrus than that before estrus in normal estrus and silent estrus cows (n=9) |
图 3显示,23个发情时含量显著高于发情前化合物在不同母牛发情期呈现个体分泌差异,其中,有8个化合物(1-戊醇、吡咯、1-己醇、3-己烯-1-醇、苯乙醇、6-甲基-2-庚酮、6-(2,2,2-三氯-1-羟乙基)-1-甲基环己烯和2-戊基呋喃)在9头牛(4头正常发情,5头安静发情)中均表现出发情特异性(发情时含量高于发情前、后),可能是母牛发情标记物。另外,有8个化合物(1,2,3,4-四氢-1,1,6-三甲基萘、甲酸辛酯、邻氨基苯乙酮、3-羟基丁酮、1-丙醇、2-羟基苯甲酸甲酯、二甲基硫醚、亚磺酰基双甲烷)均在牛正常发情时含量升高,仅在部分牛安静发情时含量升高;相反,6-甲基-5-庚烯-2-酮和1-丁醇虽然在牛安静发情时含量均升高,但是,在正常发情牛中仅部分个体含量升高,其是否能作为发情标记物,有待进一步研究。
图 4为筛选出的23个化合物在不同牛中的含量变化趋势。图 4显示,在所有牛中表现出发情特异性的化合物共8个,均存在较大个体差异,发情时均高于发情前、后,例如,1号正常发情牛发情时1-戊醇、1-己醇、2-戊基呋喃的含量远高于其他牛,这些发情特异化合物或许是吸引公牛的性信息素。另外,2-甲基-1-戊醇、2,6,6-三甲基-2-环己烯-1,4-二酮、3-甲基-1-丁醇、二甲基砜、亚磺酰基双甲烷等5种化合物均在牛发情时含量升高,尽管在母牛发情后未全部下降,但可能不影响采用这些化合物去进行发情牛鉴定。此外,对于1-辛烯-3-醇、7-甲基-6-辛烯-2-酮、1-丙醇、1,2,3,4-四氢-1,1,6-三甲基萘、1-丁醇、二甲基硫醚、2-羟基苯甲酸甲酯、甲酸辛酯、邻氨基苯乙酮等化合物,虽然发情时含量显著高于发情前后,但是,仅在部分奶牛中表现出上述特征,可能无法单独应用于母牛发情监测,或许可通过几种化合物组合指示发情。另外,有些化合物与发情特异化合物结构相似,可能也具有类似于信息素的生理学作用,例如1-丙醇、1-丁醇等。
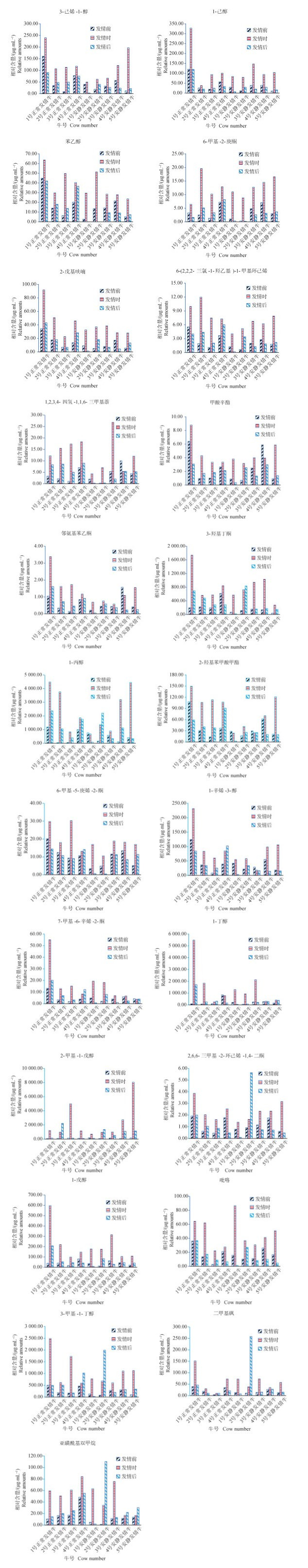
|
图 4 发情时含量高于发情前的23个化合物在不同发情牛唾液中的含量对比 Fig. 4 Comparison of the content of 23 compounds with higher content during estrus than that before estrus in saliva of different estrus cows |
为揭示23个化合物在正常发情和安静发情牛唾液的含量差异,对两类牛不同发情阶段化合物含量进行方差分析(表 3)。结果显示,正常发情牛中大部分化合物平均含量高于安静发情牛,并且,这种特征体现在不同发情阶段。但是,正常发情牛化合物含量平均数的标准差大于安静发情牛,说明正常发情牛发情特异化合物的个体差异大于安静发情牛。这些化合物含量在正常发情和安静发情牛发情前差异不显著(P>0.05);而发情时,正常发情牛中6-(2,2,2-三氯-1-羟乙基)-1-甲基环己烯和2-羟基苯甲酸甲酯两个化合物含量显著高于安静发情牛(P<0.05);发情后,正常发情牛中3-己烯-1-醇、苯乙醇、1,2,3,4-四氢-1,1,6-三甲基萘、6-(2,2,2-三氯-1-羟乙基)-1-甲基环己烯和2-羟基苯甲酸甲酯3个化合物显著高于安静发情牛(P<0.05)。综上,发情时和发情后在正常发情牛和安静发情牛间都存在一些差异化合物,但是,在发情时差异显著的化合物仅有两个(P<0.05)。所以,大部分化合物含量在正常发情与安静发情牛唾液中的差别较小,安静发情与否对于检测发情并无影响。
|
|
表 3 不同时期正常发情牛和安静发情牛唾液中23个化合物含量的对比分析 Table 3 Comparison analysis of the contents of 23 compounds in saliva between normal estrus cows and silent estrus cows at different periods |
本研究从牛唾液中检测到40个共有化合物,从中筛选出23个发情期含量显著高于发情前的化合物,这些化合物大多具有不同的气味(表 4)。以水为对照的研究表明,有气味的物质比水更能吸引奶牛[36],有气味的化合物可能是奶牛性信息素的候选物质。通过母牛卵巢切除试验证明,母牛尿液中性信息素主要来源于卵巢[37],推测,唾液中所含性信息素也由卵巢分泌,而母牛卵巢在不同发情阶段都受到相关激素调控,所以其释放信息素可能也受到相关激素的调控,但是具体是何种激素及如何调控,需进行更加深入的研究。
|
|
表 4 23个化合物的理化性质 Table 4 Physicochemical properties of 23 compounds |
Sankar等[38]将采集的不同娟姗(Jersey)奶牛唾液样品混合,利用乙醚浸提后检测发现,乙酸、丙酸、戊酸、三甲胺、4-甲基苯酚等5个化合物仅存在于发情阶段,这些化合物可使公牛产生兴奋性,引起公牛表现性行为;Aniitaᶊ和Göncü[39]混合不同荷斯坦奶牛唾液,利用自动顶空富集法富集其中的挥发性化合物,对其分析检测发现,发情时仅3-(2-甲氧基乙基)-2-(2-吡啶)-1H-吲哚的含量显著高于发情前和发情后(P<0.05)。本研究仅在部分牛中检测到上述娟姗牛发情相关的3种化合物(乙酸、丙酸和三甲胺),但未检测到在上述荷斯坦牛发情相关化合物,这主要是因为上述研究仅检测发情不同阶段化合物的有无,筛选出的化合物种类少,而本研究兼顾了发情特异化合物质和量上的差异,检测出了更多的发情特异化合物,但发情特异化合物还可能与牛品种、试验条件、试验季节、化合物富集方法有关,不同品种、不同养殖条件、不同季节,母牛唾液挥发性化合物可能也存在较大区别,后续试验有必要针对这些条件进行更深入细致的研究。
有关昆虫信息素的研究发现,不同性信息素分子间存在相似的结构特征[40],Sankar和Archunan[32]在母牛粪便中检测的乙酸、丙酸,结构高度相似,也能够促进公牛产生性行为,说明生物分泌的一些结构相似的化合物可能发挥着相似的功能。并且,一些性信息素成分间存在协同作用,例如,用乙酸、丙酸和1-碘十一烷同时或两两组合刺激公牛,公牛的性行为强于单独用其中一种刺激公牛产生的反应[32]。研究还发现,用结构相似的乙酸和丙酸共同刺激公牛产生的性行为反应强于用两种酸分别与1-碘十一烷组合刺激公牛,说明结构相似的性信息素间协同发挥的作用可能更强[32]。本研究发现,23个化合物在发情时含量显著高于发情前,其中1-戊醇和1-己醇在所有牛中都表现出发情特异性,可能在母牛发情时起到性信息素作用,而具有相似结构的1-丙醇、1-丁醇没有在所有母牛表现出发情特异性,也可能具有相同作用。并且,结构相似的不同化合物在同一头牛中含量差异较大,例如,1号正常发情牛发情时唾液中1-丙醇和1-丁醇含量较高(4 479.7、5 484.1 μg·mL-1),而1-戊醇和1-己醇含量较低(597.62、328.3 μg·mL-1),这种含量上的差异可能与化合物沸点高低关系较小(表 3),但主要源于母牛分泌1-丙醇和1-丁醇更多,而分泌的1-戊醇和1-己醇较少。在母牛粪便检测到乙酸含量高于丙酸[33],又有研究检测到,乙酸对公牛的刺激效果强于丙酸[32],说明结构相似的不同化合物分泌量可能和其性信息素作用大小有关。
本研究对比分析了正常发情和安静发情奶牛唾液中的挥发性化合物成分,发现正常发情和安静发情奶牛中,23个发情标志化合物在发情时含量均显著高于发情前,但是,正常发情牛仅有两种化合物显著高于安静发情牛(P<0.05),据此推测,可能在正常牛中检测到的发情特异化合物也可用于安静发情牛的发情检测。
那么,如何利用这些可能作为发情的标记化合物检测奶牛发情是一个关键问题。公牛是通过与母牛相互接触进行发情鉴定的,但是,仅通过接触母牛体液中的发情特异化合物,公牛也可产生性行为[32],说明这些化合物可以反映母牛繁殖生理状态,为此可研发一些发情鉴定设备。但在实际应用中,利用一种或少数性信息素的发情检测效果不尽人意,例如,Wiegerinck等[27]开发出一套基于乙酸和丙酸含量检测的发情鉴定设备,对母牛粪便进行检测,判断母牛是否发情,检出率仅为70%。本研究分析发情母牛唾液相关化合物成分和含量发现,发情时显著升高的23个化合物在不同牛中含量差别较大,同时,乙酸、戊酸、三甲胺等发情相关化合物仅在部分牛中检测到,说明奶牛唾液的化合物成分和含量存在个体差异,这种差异可能影响了Wiegerinck等[27]开发设备的发情检出率。这给我们启示,集成更多发情标记化合物的智能化检测设备或许能够大大提高母牛发情检出率。至于集成哪些化合物进行联合检测还需更加深入的研究,相关研究或许能突破奶牛安静发情鉴定瓶颈。
4 结论母牛发情时用以吸引公牛的性信息素为突破安静发情鉴定瓶颈的自动化鉴定技术研发提供思路。从母牛唾液检测出的发情特异性化合物可作为发情候选标记用于发情鉴定,且其含量在两种发情状态母牛间差异较小,为同时实现正常发情和安静发情鉴定提供重要参考。
| [1] |
李磊. 奶牛繁殖的重要指标与管理要点[J]. 现代畜牧科技, 2021(9): 76-77. LI L. Important indexes and management points of cow reproduction[J]. Modern Animal Husbandry Science & Technology, 2021(9): 76-77. (in Chinese) |
| [2] |
SVEBERG G, REFSDAL A O, ERHARD H W, et al. Behavior of lactating Holstein-Friesian cows during spontaneous cycles of estrus[J]. J Dairy Sci, 2011, 94(3): 1289-1301. DOI:10.3168/jds.2010-3570 |
| [3] |
HAILE S M, ABEBE B K, TESFA T W. Efficiency evaluation of two estrus synchronization protocols in estrus response and conception rate of dairy cows in the Dalocha district, Ethiopia[J]. Heliyon, 2023, 9(1): e12781. DOI:10.1016/j.heliyon.2022.e12781 |
| [4] |
MADHAVATAR M P, ANKUYA K J, PAWAR M M, et al. Estrus behaviour and estrus intensity score in relation to hormonal profile in Kankrej cows at an organized farm[J]. Indian J Vet Sci Biotechnol, 2023, 19(1): 61-65. DOI:10.48165/ijvsbt.19.1.14 |
| [5] |
DIXIT C P, HALOI S. Clinical application of ultrasound in bovine reproduction: A review[J]. Pharm Innov J, 2022, SP-11(8): 1311-1314. |
| [6] |
MEHTA Y, MISHRA B. Performance evaluation of IoT enabled pedometer for estrus detection in dairy cows in India[C]//Artificial Intelligence Driven Circuits and Systems. Singapore: Springer, 2022: 17-28.
|
| [7] |
周正义, 田莉, 田宏志, 等. 母牛安静发情鉴定技术概况及影响因素分析[J]. 畜牧兽医学报, 2021, 52(4): 862-871. ZHOU Z Y, TIAN L, TIAN H Z, et al. Analysis of identification technology and influence factors on silent estrus of cows[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(4): 862-871. (in Chinese) |
| [8] |
WANG S L, ZHANG H L, TIAN H Z, et al. Alterations in vaginal temperature during the estrous cycle in dairy cows detected by a new intravaginal device-a pilot study[J]. Trop Anim Health Prod, 2020, 52(5): 2265-2271. DOI:10.1007/s11250-020-02199-5 |
| [9] |
韩志强, 王海军, 赵家平, 等. 动物发情鉴定技术的研究进展[J]. 畜牧兽医学报, 2018, 49(10): 2086-2091. HAN Z Q, WANG H J, ZHAO J P, et al. Research progress of estrus identification technology in animals[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(10): 2086-2091. (in Chinese) |
| [10] |
DE PASQUAL C, GROOT A T, MAPPES J, et al. Evolutionary importance of intraspecific variation in sex pheromones[J]. Trends Ecol Evol, 2021, 36(9): 848-859. DOI:10.1016/j.tree.2021.05.005 |
| [11] |
JURENKA R. Regulation of pheromone biosynthesis in moths[J]. Curr Opin Insect Sci, 2017, 24: 29-35. DOI:10.1016/j.cois.2017.09.002 |
| [12] |
靳秀芳, 秦长生, 赵丹阳, 等. 象甲科昆虫性信息素与聚集信息素研究及应用进展[J]. 林业与环境科学, 2019, 35(3): 107-115. JIN X F, QIN C S, ZHAO D Y, et al. The research and application progress of the curculionidae sex pheromones and aggregation pheromone[J]. Forestry and Environmental Science, 2019, 35(3): 107-115. (in Chinese) |
| [13] |
BENELLI G, LUCCHI A. From insect pheromones to mating disruption: Theory and practice[J]. Insects, 2021, 12(8): 698. DOI:10.3390/insects12080698 |
| [14] |
JOHNSON T D, BUFFINGTON M L, GATES M W, et al. Deployment of aggregation-sex pheromones of longhorned beetles (Coleoptera: Cerambycidae) facilitates the discovery and identification of their parasitoids[J]. J Chem Ecol, 2021, 47(1): 28-42. DOI:10.1007/s10886-020-01238-7 |
| [15] |
LUCIA A, GUZMÁN E. Emulsions containing essential oils, their components or volatile semiochemicals as promising tools for insect pest and pathogen management[J]. Adv Colloid Interface Sci, 2021, 287: 102330. DOI:10.1016/j.cis.2020.102330 |
| [16] |
YEW J Y, CHUNG H. Insect pheromones: An overview of function, form, and discovery[J]. Prog Lipid Res, 2015, 59: 88-105. DOI:10.1016/j.plipres.2015.06.001 |
| [17] |
RAJAGOPAL T, ARCHUNAN G. Dominance hierarchy in Indian blackbuck (Antelope cervicapra L.): Sources, behavior and role of pheromone signals[C]//Chemical Signals in Vertebrates 13. Switzerland: Springer, 2016: 217-228.
|
| [18] |
黄大明, 张雪妍, 王瑜琪, 等. 哺乳动物的嗅觉通讯[J]. 中国科技纵横, 2018(3): 217-225. HUANG D M, ZHANG X Y, WANG Y Q, et al. Olfactory communication in mammals[J]. China Science & Technology Overview, 2018(3): 217-225. (in Chinese) |
| [19] |
SILAMBARASAN V, DEEPALAKSHMI G, SANKARGANESH D, et al. Identification of potential pheromone source in sows[J]. Behav Processes, 2019, 168: 103940. DOI:10.1016/j.beproc.2019.103940 |
| [20] |
ROBERTSON S A, MARTIN G B. Perspective: re-defining "pheromone" in a mammalian context to encompass seminal fluid[J]. Front Vet Sci, 2022, 8: 819246. DOI:10.3389/fvets.2021.819246 |
| [21] |
MILANOWSKI M, POMASTOWSKI P, LIGOR T, et al. Saliva- Volatile biomarkers and profiles[J]. Crit Rev Anal Chem, 2017, 47(3): 251-266. DOI:10.1080/10408347.2016.1266925 |
| [22] |
LAMY E, CAPELA-SILVA F, TVARIJONAVICIUTE A. Research on saliva secretion and composition[J]. Biomed Res Int, 2018, 2018: 7406312. |
| [23] |
CONTRERAS-AGUILAR M D, VALLEJO-MATEO P J, LAMY E, et al. Changes in saliva analytes in dairy cows during peripartum: A pilot study[J]. Animals, 2021, 11(3): 749. DOI:10.3390/ani11030749 |
| [24] |
RICCI S, RIVERA-CHACON R, PETRI R M, et al. Supplementation with phytogenic compounds modulates salivation and salivary physico-chemical composition in cattle fed a high-concentrate diet[J]. Front Physiol, 2021, 12: 645529. DOI:10.3389/fphys.2021.645529 |
| [25] |
SANKARGANESH D, KIRKWOOD R N, NAGNAN-LE MEILLOUR N P, et al. Pheromones, binding proteins, and olfactory systems in the pig (Sus scrofa): An updated review[J]. Front Vet Sci, 2022, 9: 989409. DOI:10.3389/fvets.2022.989409 |
| [26] |
PUGLISI I, MASUCCI M, COZZI A, et al. Effects of a novel gel formulation of Dog Appeasing Pheromone (DAP) on behavioral and physiological stress responses in dogs undergoing clinical examination[J]. Animals, 2022, 12(18): 2472. DOI:10.3390/ani12182472 |
| [27] |
WIEGERINCK W, SETKUS A, BUDA V, et al. BOVINOSE: Pheromone-based sensor system for detecting estrus in dairy cows[J]. Procedia Comput Sci, 2011, 7: 340-342. DOI:10.1016/j.procs.2011.09.024 |
| [28] |
MUTHUKUMAR S, MUNIASAMY S, SRINIVASAN M, et al. Evaluation of pheromone-based kit: A noninvasive approach of estrus detection in buffalo[J]. Reprod Domest Anim, 2018, 53(6): 1466-1472. DOI:10.1111/rda.13281 |
| [29] |
DEHNHARD M, CLAUS R. Attempts to purify and characterize the estrus-signalling pheromone from cow urine[J]. Theriogenology, 1996, 46(1): 13-22. DOI:10.1016/0093-691X(96)00137-9 |
| [30] |
KUMAR K R, ARCHUNAN G, JEYARAMAN R, et al. Chemical characterization of bovine urine with special reference to oestrus[J]. Vet Res Commun, 2000, 24(7): 445-454. DOI:10.1023/A:1006495404407 |
| [31] |
SANKAR R, ARCHUNAN G. Flehmen response in bull: role of vaginal mucus and other body fluids of bovine with special reference to estrus[J]. Behav Processes, 2004, 67(1): 81-86. DOI:10.1016/j.beproc.2004.02.007 |
| [32] |
SANKAR R, ARCHUNAN G. Identification of putative pheromones in bovine (Bos taurus) faeces in relation to estrus detection[J]. Anim Reprod Sci, 2008, 103(1-2): 149-153. DOI:10.1016/j.anireprosci.2007.04.014 |
| [33] |
MOZŪRAITIS R, KUTRA J, BORG-KARLSON A K, et al. Dynamics of putative sex pheromone components during heat periods in estrus-induced cows[J]. J Dairy Sci, 2017, 100(9): 7686-7695. DOI:10.3168/jds.2016-12376 |
| [34] |
李佳钰, 吴雨杭, 李昊原, 等. 固相微萃取技术与应用研究进展[J]. 山东化工, 2016, 45(1): 43-45. LI J Y, WU Y H, LI H Y, et al. Solid phase microextraction technique and its latest applications[J]. Shandong Chemical Industry, 2016, 45(1): 43-45. DOI:10.19319/j.cnki.issn.1008-021x.2016.01.017 (in Chinese) |
| [35] |
SOKAL R R, ROHLF F J. Biometry[M]. 3rd ed. New York: Freeman, 1995.
|
| [36] |
RØRVANG M V, JENSEN M B, NIELSEN B L. Development of test for determining olfactory investigation of complex odours in cattle[J]. Appl Anim Behav Sci, 2017, 196: 84-90. DOI:10.1016/j.applanim.2017.07.008 |
| [37] |
DEHNHARD M, CLAUS R, PFEIFFER S, et al. Variation in estrus-related odors in the cow and its dependency on the ovary[J]. Theriogenology, 1991, 35(3): 645-652. DOI:10.1016/0093-691X(91)90460-U |
| [38] |
SANKAR R, ARCHUNAN G, HABARA Y. Detection of oestrous-related odour in bovine (Bos taurus) saliva: bioassay of identified compounds[J]. Animal, 2007, 1(9): 1321-1327. DOI:10.1017/S1751731107000614 |
| [39] |
ANIİTAŞ Ö, GÖNCÜ S. Investigation of body secretions as bioindicators in cattle estrus detection[J]. Turk J Vet Anim Sci, 2020, 44(5): 1070-1086. DOI:10.3906/vet-2002-74 |
| [40] |
王留洋, 杨超霞, 郭兵博, 等. 昆虫性信息素研究进展与应用前景[J]. 农药学学报, 2022, 24(5): 997-1016. WANG L Y, YANG C X, GUO B B, et al. Research progress and application prospects on insect sex pheromone[J]. Chinese Journal of Pesticide Science, 2022, 24(5): 997-1016. (in Chinese) |
(编辑 郭云雁)



