2. 永昌县畜牧兽医站, 金昌 737200;
3. 甘肃元生农牧科技有限公司, 金昌 737100
2. Animal Husbandry and Veterinary Station of Yongchang County, Jinchang 737200, China;
3. Gansu Yuansheng Agriculture and Animal Husbandry Technology Co., Jinchang 737100, China
绵羊产羔性状是指母羊每胎次的产羔数,它是衡量绵羊繁殖力的重要指标[1]。提高绵羊产羔数可降低饲养成本,提高生产效益,促进绵羊养殖业的高效发展。绵羊产羔性状受多种因素的影响,包括遗传因素和环境因素[2-3]。遗传因素主要是指不同品种间的产羔数差异,环境因素主要是指饲养管理、配种控制、疾病防治等方面[4-7]。为了提高绵羊产羔性状,需要采取多种措施,包括优化饲料营养、调整配种时间、加强孕期护理等[8]。此外,利用分子遗传技术对绵羊产羔数相关基因进行挖掘和标记辅助选择,也是一种有效的方法[9-10]。
全基因组关联分析(genome wide association study,GWAS)是一种常用的分子遗传学方法,旨在鉴定复杂性状的遗传基础。通过GWAS分析,研究者可以深入了解绵羊的遗传特征和种群结构,发现与性状相关的基因和变异,为绵羊育种和遗传改良提供重要的信息和指导[11-14]。近年来,GWAS已成为提高绵羊繁殖性能的有效方法之一[15]。可以在全基因组范围内鉴定与繁殖性能相关的基因,进而深入了解繁殖性状的遗传机制和调控网络[10, 16-18]。这些发现有望为改良和优化绵羊繁殖性能提供理论指导和科学依据。同时,GWAS还可以帮助筛选和鉴定出对繁殖性能有积极影响的遗传变异,进而为选育高产优质绵羊提供有力的选育手段[19]。总的来说,GWAS已经成为绵羊育种中不可或缺的工具之一。随着技术的不断进步和方法的不断创新,GWAS在绵羊育种中的应用前景将更加广阔。
现代数量遗传学在动物育种实践中的应用取得了巨大成功,如今它对一些遗传力高且呈连续性正态分布的数量性状仍然是必不可少的选择方法。但对于低遗传力性状,如母畜的产仔数等,选择反应并不理想。因此,可以从分子遗传水平上找到性状的遗传差异或与数量性状连锁的遗传标记,从而实现真正的基因型选择[20-22]。
本试验以东湖杂交奶绵羊为研究对象,对168只东湖杂交奶绵羊进行高深度全基因组重测序,再根据全基因组关联分析技术确定与产羔性状相关的关键基因,最后挑选关键基因的变异位点采用KASP分型技术进行SNP分型检测,并将其与产羔性状进行关联分析,探究其潜在的育种价值。
1 材料与方法 1.1 试验材料试验动物来自西北农林科技大学金昌奶绵羊试验示范基地。选择体况良好、平均年龄一岁半的东湖级杂二代母羊748只,颈静脉采集5 mL血液于抗凝管中,并于-80 ℃保存。其中168只进行全基因组重测序,580只进行SNP分型检测并统计试验羊群不同胎次的产羔数据。
1.2 DNA提取与建库测序本研究通过标准苯-酚氯仿法提取基因组DNA。将检测合格的DNA样品用超声波破碎仪打断至350 bp大小,再经末端修复、加A尾、加测序接头、纯化和PCR扩增等步骤进行文库的制备。文库检测合格后,使用Illumina高通量测序平台Nova-Seq 6000进行测序,生成150 bp的成对末端reads,共获得47 616 147个原始位点。
1.3 质量控制与变异检测本研究利用fastp软件对原始的fastq格式文件进行过滤及质控。质控后的数据使用BWA-MEN对比到Oar_rambouillet_v1.0上,重复reads使用Picard软件进行排序。采用genome analysis toolkit (GATK, version 3.8)提取基因组高质量变异,获取变异数据的VCF集合。使用GATK进行过滤(参数:QD<2.0, FS>60.0, MQ<40.0, MQRankSum<-12.5, ReadPosRankSum<-8.0 and SOR>3.0)。使用GATK软件的SelectVariants模块分别提取SNP和InDel数据集合(参数:-restrict-alleles-to BIALLELIC, -remove-unused-alternates)。为了降低结果的假阳性,本研究将PLINK 1.9软件[23]获取的主成分分析结果作为协变量加入,此外还根据PLINK-missing 0.01参数和—maf 0.01参数进行了SNP位点的过滤,共得到27 750 039个位点。
1.4 全基因组关联分析先使用GEMMA的-gk 2参数生成亲缘关系矩阵,然后结合生成的亲缘关系矩阵使用混合线性模型(MLM)进行GWAS分析(参数:gemma-bfile-k-lmm 1-p)。MLM模型结合了固定效应(配种方式和产羔季节)和随机效应。校正阈值线的确定为0.05/n(总位点数)。根据输出结果,后续使用R语言包CMplot进行曼哈顿图和QQ(Quantiles-Quantiles)图的绘制。
1.5 显著位点的注释使用SnpEff软件构建绵羊参考基因组的本地注释数据库,并使用该软件对本研究构建的VCF集合进行注释,使用自己编写的perl脚本从注释后的VCF集合中提取注释信息。
1.6 注释基因的富集分析本研究中使用北京大学构建的KOBAS 3.0数据库(http://bioinfo.org/kobas/retrieve/?taskid=5f7a3a18b1de4e53a517ffc7c7c86cfb)对注释得到的基因进行富集分析,以探究GWAS显著信号区域的基因在生物学网络中的作用和相互作用。
1.7 连锁不平衡分析使用LDBlockShow软件进行连锁不平衡热图的绘制,突出显著性最强SNPs周边的连锁区域。
1.8 基因型检测从NCBI(national center for biotechnology information)获取GRID2的序列信息(NC_040257.1),根据g.35685218A>G,和g.35685499C>T两个突变的位置,分别设计两条不同的上游引物和一条相同的下游引物。使用KASP进行特异性识别SNP基因型。
1.9 数据统计与分析根据等位基因频率、基因型频率、纯合度和杂合度等参数的计算原理,自行编写Excel函数进行群体遗传学参数的计算,同时检验群体是否符合哈代-温伯格平衡原理。使用SPSS 20.0软件分析基因型与产羔性状之间的关系。线性分析模型为Y=μ+a+b+c+e,其中Y为性状的观察值,μ为均值,a为年季节效应,b为基因型固定效应,c为配种方式固定效应,e为随机误差。
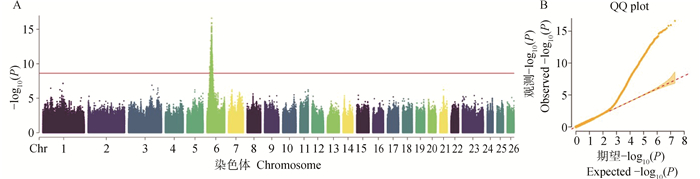
2 结果 2.1 全基因组关联分析结果使用GEMMA软件的混合线性模型进行全基因组SNP的关联分析,设置显著性水平的校正阈值线为1.80×10-9,共检测到1 163个达到全基因组显著性水平的SNPs位点,所有达到显著性水平的位点均分布于绵羊6号染色体上,如图 1A所示。通过SnpEff对所有显著位点进行注释,其中位于外显子区域4个,基因间区708个,内含子区域445个,其他区域6个。注释到与产羔性状相关的基因有BMPR1B、PDLIM5、PDHA2、UNC5C、GRID2、NFKB1、TSPAN5、STPG2、PPP3CA等。其中处于显著性前十的SNPs注释到了BMPR1B、GRID2、PDLIM5、PDHA2基因。
|
图 1 SNP全基因组关联分析的曼哈顿图(A)和QQ-plot图(B) Fig. 1 Manhattan map (A)and QQ-plot(B) of SNP genome-wide association study |
基于GATK提取的InDel集合利用GEMMA混合线性模型进行全基因组InDel关联分析,与SNP的结果相比,信号杂乱(图 2),不具有较好参考价值,这也符合前人研究中多胎性状的主效位点主要为SNP的结果。

|
图 2 InDel全基因组关联分析的曼哈顿图 Fig. 2 Manhattan map of InDel genome-wide association study |
通过KOBAS对GWAS显著位点的注释基因进行KEGG富集分析后,共得到了17个校正P值达到显著性水平(corrected P<0.05)的通路,如图 3所示,表 1列出了KEGG富集分析的前20个通路。其中有多个信号通路已被证明与生殖过程有关。如Wnt信号通路、axon guidance、Th1和Th2细胞分化通路等。

|
图 3 KEGG富集分析气泡图 Fig. 3 Bubble diagram of KEGG enrichment analysis |
|
|
表 1 KEGG富集通路 Table 1 KEGG enrichment pathway |
根据BMPR1B基因在绵羊参考基因组的位置,选择信号最高点6∶34198746上下游10 kb区域、FecB(BMPR1B基因上A746G突变)突变位置上下游10 kb区域进行三角热图的绘制,如图 4A、4B所示,并没有发现显著强连锁的区域。此外,为了研究候选基因GRID2两个SNPs位点和周边区域的连锁情况,选择g.35685218A>G和g.35685499C>T两个位置上下游10 kb区域进行三角热图绘制,发现周边SNP连锁情况相对较强,如图 4C所示。

|
颜色从白色到红色,代表连锁程度从低到高。A.信号最高点6:34198746上、下游10 kb区域;B.FecB突变位置上、下游10 kb区域;C.g.35685218A>G和g.35685499C>T两个位置上、下游10 kb区域 The color ranges from white to red represent a low to high degree of linkage.A.The 10 kb region upstream and downstream of signal peak 6:34198746; B. The 10 kb region upstream and downstream of the FecB mutation site; C.The 10 kb region upstream and downstream of g.35685218A>G and g.35685499C>T 图 4 SNP连锁不平衡热图 Fig. 4 SNP linkage disequilibrium heat map |
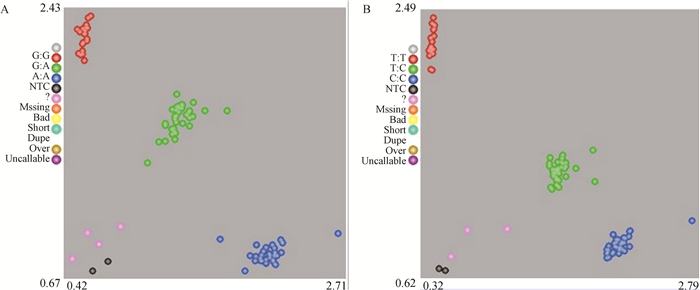
通过KASP基因分型技术对GRID2基因的两个多态位点在560只东湖杂交奶绵羊群体中进行分型检测(图 5),其中g.35685218A>G位点共检测到野生型(AA)的个体有211个,杂合型(AG)266个,突变纯合型(GG)83个。g.35685499C>T位点共检测到野生型(CC)的个体有220个,杂合型(CT)256个,突变纯合型(TT)84个。
|
图 5 GRID2基因g.35685218A>G(A)和g.35685499C>T(B)的KASP基因分型图 Fig. 5 KASP genotyping map of g.35685218A> G (A) and g.35685499C> T (B) in GRID2 gene |
本研究对560只东湖杂交奶绵羊GRID2的两个多态位点进行遗传多样性参数的计算,两个位点的等位基因频率和和基因型频率均十分相似(表 2)。g.35685218A>G野生型(AA)基因型频率为0.377,杂合型(AG)基因型频率为0.475,突变纯合型(GG)基因型频率为0.148,A基因频率为0.614,G基因频率为0.386。g.35685499C>T野生型(CC)基因型频率为0.393,杂合型(CT)基因型频率为0.457,突变纯合型(TT)基因型频率为0.150,C基因频率为0.621,T基因频率为0.379。本研究中,g.35685218A>G位点的实际数值接近预测值(χ2<0.05),而g.35685499C>T位点的实际数值偏离预测值(χ2>0.05)。两个位点的多态信息含量均为中度多态性(0.25<PIC<0.5)。本研究中涉及到的两个位点均处于P>0.05的哈代-温伯格平衡状态,表明这两个位点均没有受到过强选择。
|
|
表 2 GRID2基因g.35685218A>G和g.35685499C>T的遗传多态性参数 Table 2 Genetic polymorphism parameters for the g.35685218A > G and g.35685499C > T loci in GRID2 |
为了系统地研究GRID2基因g.35685218A>G和g.35685499C>T两个位点对产羔数的影响,本研究将不同胎次产羔数与基因型进行了关联分析,如表 3所示。g.35685218A>G位点第一胎的野生型相较于突变杂合型平均产羔数增加了0.34只(P<0.05),相较于突变纯合型增加了0.64只(P<0.05)。第二胎的野生型相较于突变杂合型平均产羔数平均增加了0.57只(P<0.05),相较于突变纯合型增加了1.11只(P<0.05)。第三胎的野生型相较于突变杂合型平均产羔数平均增加了0.20只(P<0.05),相较于突变纯合型增加了1.06只(P<0.05)。
|
|
表 3 GRID2基因g.35685218A>G和g.35685499C>T与产羔数关联分析 Table 3 Correlation analysis between g.35685218A > G and g.35685499C > T in GRID2 gene and lambing number |
g.35685499C>T位点第一胎的野生型相较于突变杂合型平均产羔数增加了0.14只(P<0.05),相较于突变纯合型增加了0.50只(P<0.05)。第二胎的野生型相较于突变杂合型平均产羔数增加了0.41只(P<0.05),相较于突变纯合型增加了1.0只(P<0.05)。第三胎的野生型相较于突变杂合型平均产羔数增加了0.20只(P<0.05),相较于突变纯合型增加了1.15只(P<0.05)。
3 讨论本研究对168只东湖杂交奶绵羊的重测序数据与产羔性状进行了GWAS分析,共获得了1 163个达到显著性水平的SNPs位点。根据注释结果,发现了与产羔性状有关的多个基因和信号通路。其中,BMPR1B基因中FecB(A746G)错义突变导致氨基酸变化(Q249R),从而增加羊的排卵率[24],此突变对羊排卵具有加性效应[25-27],本课题组前期已经在奶绵羊群体中大量检测了FecB突变,研究结果显示,FecB突变显著影响东湖杂交二代羊的产羔数[28]。
根据KEGG富集分析的结果,同样有一些和繁殖过程有关的通路。Wnt信号通路是一个重要的调控机制,在细胞分化、增殖、凋亡和胚胎发育过程中发挥着关键作用。研究表明,Wnt信号通路在小鼠和人类卵巢中的活性会随着动情周期的变化而变化,表明其在生殖周期中起着重要作用[29]。另外一个与繁殖过程相关的通路是轴突导向通路(axon guidance),这个通路在胚胎发育期间,对于神经系统的形成和连接至关重要。研究发现,轴突导向通路的一些关键基因在胚胎期间还会表达于生殖细胞系中,这些基因对于生殖细胞系的发育也有重要的调控作用[30]。Th1和Th2细胞分化通路在免疫调节过程中发挥着关键作用,研究表明,妊娠期间,母体的免疫系统处于一种Th2倾向状态,Th1/Th2平衡的变化可能与早期流产、胎儿生长受限和先兆子痫等疾病有关[31]。此外,HIF-1还被认为在雌性哺乳动物中调节子宫内膜生长和修复,从而有助于维持正常的妊娠[32]。
同时,本研究也发现与东湖杂交奶绵羊产羔数相关的显著性SNPs位点中有几个位于GRID2基因,此基因在大脑皮层和小脑中广泛表达[33]。GRID2基因位于染色体4q22-q23上,包含约118 000个碱基对,并编码约3 930个氨基酸,编码蛋白质为Delta-2,在中枢神经系统中发挥重要作用,参与了许多神经功能的调节,包括学习、记忆、情绪和感知[34]。有报道显示,GRID2可能与动物繁殖性状有关,一项对31只大足黑山羊产羔数的全基因组选择信号研究发现,GRID2可能是影响产羔数的候选基因,LD分析表明,高产大足黑山羊表现出与低产山羊显著不同的连锁不平衡模式[35]。根据Chen等[36]对两个不同FecB基因型小尾寒羊不同生殖周期的垂体组织转录组研究发现,GRID2在不同基因型羊的垂体组织间差异表达,推测该基因可能介导了一些生殖相关激素的释放。此外,GRID2基因也被证明和猪卵母细胞的增殖和凋亡过程相关[37]。另外,6号染色体上存在大量的连锁区域,可能还存在一些其他类型的变异,例如结构变异(structural variation, SV)、拷贝数变异(copy number variation, CNV)等,受二代测序数据的限制,很难检测到这些变异,需要进一步的挖掘。并且,统计学分析发现GRID2基因g.35685218A>G和g.35685499C>T两个位点的野生型均处于优势状态,且两个位点在胎次增加时均值也增加。
4 结论本研究结果表明,通过全基因组关联分析确定了6号染色体上1 163个达到显著性水平的SNPs位点,注释到候选基因有BMPR1B、PDLIM5、PDHA2、UNC5C、GRID2、NFKB1、TSPAN5、STPG2、PPP3CA。其中GRID2基因2个SNPs(g.35685218A>G和g.35685499C>T)对东湖杂交奶绵羊产羔数有负效应,可以作为分子标记辅助选择的候选位点。
| [1] |
种玉晴. 绵羊产羔数性状的分子遗传机理研究[D]. 武汉: 华中农业大学, 2021. CHONG Y Q. Study on molecular genetic mechanism of litter size in sheep[D]. Wuhan: Huazhong Agricultural University, 2021. (in Chinese) |
| [2] |
张仁森, 贺建宁, 魏彩虹, 等. 不同繁殖季节绵羊卵巢组织中piRNAs序列特征及表达差异分析[J]. 中国畜牧兽医, 2020, 47(7): 2081-2092. ZHANG R S, HE J N, WEI C H, et al. Characterization and differentially expression analysis of ovine Ovary piRNAs during different reproductive seasons[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(7): 2081-2092. (in Chinese) |
| [3] |
李亭亭, 刘秋月, 李向臣, 等. 绵羊经济性状相关基因研究进展及其应用[J]. 畜牧兽医学报, 2022, 53(8): 2417-2434. LI T T, LIU Q Y, LI X C, et al. Research progress and applications of genes associated with economic traits in sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(8): 2417-2434. (in Chinese) |
| [4] |
张亮. 营养物质对绵羊繁殖的影响[J]. 黑龙江动物繁殖, 2013, 21(5): 20-21. ZHANG L. Effects of nutrients on sheep reproduction[J]. Heilongjiang Journal of Animal Reproduction, 2013, 21(5): 20-21. (in Chinese) |
| [5] |
狄冉, 郭晓飞, 刘秋月, 等. 生殖激素对绵羊繁殖性能影响的研究进展[J]. 家畜生态学报, 2015, 36(9): 1-6. DI R, GUO X F, LIU Q Y, et al. Research progress in effect of reproductive hormones on ovine reproductive performance[J]. Acta Ecologae Animalis Domastici, 2015, 36(9): 1-6. (in Chinese) |
| [6] |
贺小云, 狄冉, 胡文萍, 等. 绵羊季节性繁殖的神经内分泌研究进展[J]. 畜牧兽医学报, 2018, 49(1): 18-25. HE X Y, DI R, HU W P, et al. Research progress on neuroendocrinology controlling sheep seasonal reproduction[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(1): 18-25. (in Chinese) |
| [7] |
常志, 汪淼. 提高母羊产羔率的措施分析[J]. 畜禽业, 2022, 33(6): 61-63. CHANG Z, WANG M. Analysis of measures to increase lambing rate of ewe sheep[J]. Livestock and Poultry Industry, 2022, 33(6): 61-63. (in Chinese) |
| [8] |
吕桂萍, 文亚洲. 提高绵羊繁殖力的关键措施[J]. 养殖与饲料, 2017(6): 37-38. LV G P, WEN Y Z. Key measures to improve sheep fertility[J]. Animals Breeding and Feed, 2017(6): 37-38. (in Chinese) |
| [9] |
胡瑞雪, 乐祥鹏, 李万宏, 等. 绵羊产羔数相关基因的研究进展[J]. 基因组学与应用生物学, 2017, 36(10): 4141-4148. HU R X, LE X P, LI W H, et al. A review on the genes related to litter size in sheep[J]. Genomics and Applied Biology, 2017, 36(10): 4141-4148. (in Chinese) |
| [10] |
李晓杰, 韩建刚, 梁奔梦, 等. 绵羊重要经济性状可用遗传标记研究进展[J]. 中国畜牧兽医, 2023, 50(8): 3142-3156. LI X J, HAN J G, LIANG B M, et al. Research advance on available genetic markers for important economic traits in sheep[J]. China Animal Husbandry & Veterinary Medicine, 2023, 50(8): 3142-3156. (in Chinese) |
| [11] |
ZHU C J, LI N, CHENG H P, et al. Genome wide association study for the identification of genes associated with tail fat deposition in Chinese sheep breeds[J]. Biol Open, 2021, 10(5): bio054932. |
| [12] |
NICIURA S C M, BENAVIDES M V, OKINO C H, et al. Genome-wide association study for haemonchus contortus resistance in morada nova sheep[J]. Pathogens, 2022, 11(8): 939. |
| [13] |
汪文强, 赵生国, 马利青, 等. 动物基因组学重测序的应用研究进展[J]. 畜牧兽医学报, 2016, 47(10): 1947-1953. WANG W Q, ZHAO S G, MA L Q, et al. The research progress and application of resequencing based on animal genomics[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 1947-1953. DOI:10.11843/j.issn.0366-6964.2016.10.001 (in Chinese) |
| [14] |
苏鹏, 黄洋铭, 徐天琪, 等. 全基因组关联分析在绵羊遗传育种研究中的应用[J]. 中国畜牧杂志, 2023. SU P, HUANG Y M, XU T Q, et al. Application of genome-wide association study in sheep genetics and breeding[J]. Chinese Journal of Animal Science, 2023. DOI:10.19556/j.0258-7033.20220805-07 (in Chinese) |
| [15] |
GEBRESELASSIE G, BERIHULAY H, JIANG L, et al. Review on genomic regions and candidate genes associated with economically important production and reproduction traits in sheep (Ovies aries)[J]. Animals, 2020, 10(1): 33. |
| [16] |
KIJAS J W, LENSTRA J A, HAYES B, et al. Genome-wide analysis of the World's sheep breeds reveals high levels of historic mixture and strong recent selection[J]. PLoS Biol, 2012, 10(2): e1001258. |
| [17] |
欧阳清渊, 胡深强, 王继文. 家禽重要性状的基因组学研究与应用现状[J]. 畜牧兽医学报, 2022, 53(3): 663-679. OUYANG Q Y, HU S Q, WANG J W. Current genomics research and application of important traits in poultry[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(3): 663-679. (in Chinese) |
| [18] |
丁鸿祥, 王净, 刘彦, 等. 组学技术在绵、山羊繁殖性状研究中的应用[J]. 中国草食动物科学, 2022, 42(5): 56-62. DING H X, WANG J, LIU Y, et al. The application of omics technologies in relevant studies of sheep and goat reproductive traits[J]. China Herbivore Science, 2022, 42(5): 56-62. (in Chinese) |
| [19] |
SMOŁUCHA G, GURGUL A, JASIELCZUK I, et al. A genome-wide association study for prolificacy in three Polish sheep breeds[J]. J Appl Genet, 2021, 62(2): 323-326. |
| [20] |
寸静宇, 刘秋月, 王翔宇, 等. 小尾寒羊LHR基因组织表达、多态性及其与产羔性状的关联分析[J]. 畜牧兽医学报, 2019, 50(3): 495-506. CUN J Y, LIU Q Y, WANG X Y, et al. Analysis of tissue expression, polymorphism of LHR gene and its association with litter size in small tail han sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(3): 495-506. (in Chinese) |
| [21] |
周梅, 曹晓涵, 贺小云, 等. 绵羊FGF7基因组织表达及其多态性与产羔数之间的关系[J]. 畜牧兽医学报, 2018, 49(3): 525-533. ZHOU M, CAO X H, HE X Y, et al. Tissue expression and polymorphism of sheep FGF 7 gene and their association with litter size[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(3): 525-533. (in Chinese) |
| [22] |
王宏浩, 靳光, 李博, 等. 数量遗传学在肉牛育种中的应用[J]. 中国畜禽种业, 2023, 19(7): 74-79. WANG H H, JIN G, LI B, et al. Application of quantitative genetics in beef cattle breeding[J]. The Chinese Livestock and Poultry Breeding, 2023, 19(7): 74-79. (in Chinese) |
| [23] |
PURCELL S, NEALE B, TODD-BROWN K, et al. PLINK: a tool set for whole-genome association and population-based linkage analyses[J]. Am J Hum Genet, 2007, 81(3): 559-575. |
| [24] |
SOUZA C J, MACDOUGALL C, MACDOUGALL C, et al. The booroola (FecB) phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B (BMPR1B) gene[J]. J Endocrinol, 2001, 169(2): R1-R6. |
| [25] |
CHONG Y Q, LIU G Q, JIANG X P. Effect of BMPRIB gene on litter size of sheep in China: A meta-analysis[J]. Anim Reprod Sci, 2019, 210: 106175. |
| [26] |
GUO X F, WANG X Y, DI R, et al. Metabolic effects of FecB gene on follicular fluid and ovarian vein serum in sheep (Ovis aries)[J]. Int J Mol Sci, 2018, 19(2): 539. |
| [27] |
杨初蕾, 张译元, 唐红, 等. FecB基因在绵羊繁殖性能上的研究进展[J]. 畜牧兽医学报, 2023, 54(4): 1370-1380. YANG C L, ZHANG Y Y, TANG H, et al. Research progress of FecB gene on reproductive performance of sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(4): 1370-1380. (in Chinese) |
| [28] |
LI D N, ZHANG L, WANG Y C, et al. FecB mutation and litter size are associated with a 90-base pair deletion in BMPR1B in East Friesian and Hu crossbred sheep[J]. Anim Biotechnol, 2023, 34(4): 1314-1323. |
| [29] |
NIU W B, SPRADLING A C. Two distinct pathways of pregranulosa cell differentiation support follicle formation in the mouse ovary[J]. Proc Natl Acad Sci USA, 2020, 117(33): 20015-20026. |
| [30] |
DOVERE L, FERA S, GRASSO M, et al. The niche-derived glial cell line-derived neurotrophic factor (GDNF) induces migration of mouse spermatogonial stem/progenitor cells[J]. PLoS One, 2013, 8(4): e59431. |
| [31] |
CHAOUAT G. The Th1/Th2 paradigm: still important in pregnancy?[J]. Semin Immunopathol, 2007, 29(2): 95-113. |
| [32] |
王步军, 郑飞云, 杨孝军, 等. HIF-1α和VEGF蛋白在子宫内膜异位症中的表达及临床意义[J]. 现代实用医学, 2011, 23(10): 1185-1188. WANG B J, ZHENG F Y, YANG X J, et al. Expression and clinical significance of HIF-1 and VEGF proteins in endometriosis[J]. Modern Practical Medicine, 2011, 23(10): 1185-1188. (in Chinese) |
| [33] |
PANDA P K, SHARAWAT I K, DAWMAN L. GRID2 mutation-related spinocerebellar ataxia type 18:a new report and literature review[J]. J Pediatr Genet, 2022, 11(2): 99-109. |
| [34] |
CEYLAN A C, ACAR ARSLAN E, ERDEM H B, et al. Autosomal recessive spinocerebellar ataxia 18 caused by homozygous exon 14 duplication in GRID2 and review of the literature[J]. Acta Neurol Belg, 2021, 121(6): 1457-1462. |
| [35] |
E G X, DUAN X H, ZHANG J H, et al. Genome-wide selection signatures analysis of litter size in Dazu black goats using single-nucleotide polymorphism[J]. 3 Biotech, 2019, 9(9): 336. |
| [36] |
CHEN S, GUO X F, HE X Y, et al. Insight into pituitary lncRNA and mRNA at two estrous stages in small tail han sheep with different FecB genotypes[J]. Front Endocrinol (Lausanne), 2021, 12: 789564. |
| [37] |
CHERMUŁA B, BRZERT M, JESETA M, et al. The unique mechanisms of cellular proliferation, migration and apoptosis are regulated through oocyte maturational development-a complete transcriptomic and histochemical study[J]. Int J Mol Sci, 2018, 20(1): 84. |
(编辑 郭云雁)



