2. 江苏农牧科技职业学院, 泰州 225300;
3. 南京大学医学院, 南京 210093
2. Jiangsu Agri-Animal Husbandry Vocational College, Taizhou 225300, China;
3. Medical School, Nanjing University, Nanjing 210093, China
随着生活水平的提高,人们对家畜肉品质的要求也日益提高。鹅肉是理想的高蛋白、低脂肪和低胆固醇的营养食品,早在2002年,联合国粮农组织就将鹅肉列为21世纪重点发展的健康产品之一[1]。中国是肉鹅最大的消费国和出口国,鹅肉深受消费者青睐,因而开展鹅产肉性能品种改良,发掘影响鹅肌肉生长的功能基因,探究鹅骨骼肌生长发育调控的分子机理,具有重大的经济效应。
获得具有高分化潜能的鹅骨骼肌卫星细胞是开展鹅肌肉组织生长发育调控机制研究的前提和基础。骨骼肌卫星细胞来源于肌肉中的一部分成肌祖细胞,这些细胞在出生后个体的肌肉组织中保留未分化状态,位于肌膜和基底膜之间,具有很强的分化潜能[2-3]。早在1961年,科学家就通过电子显微镜观察青蛙骨骼肌肌纤维外围区域发现了肌源性卫星细胞[4]。1974年,首次从成年大鼠骨骼肌中分离出卫星细胞[5]。之后,人们通过不断优化分离方法,逐渐分离出人类[6-7]、牛[8-10]、羊[11]、鸡[12]、猪[13-15]等不同物种的卫星细胞。然而到目前为止,有关鹅骨骼肌卫星细胞分离培养方法的研究很少,且现有方法分离得到的细胞分化能力有限[16]。
经过多年的发展,目前常用于分离卫星细胞的方法有单根肌纤维分离法和酶消化法。单根肌纤维法是利用Ⅰ型胶原酶消化肌肉组织并温和研磨,从肌肉组织中分离出单根肌纤维[17-18]。单根肌纤维法分离培养得到的卫星细胞能够达到95%以上的纯度。但是,解剖单根肌纤维非常耗时,因而此方法有较大局限性。为了能够获得大量卫星细胞,研究人员开发了酶消化法。酶消化法利用单酶或者多种酶组合消化肌肉组织将卫星细胞彻底释放到消化液中。不同酶组合的消化效果不同,与其他方法相比,酶消化法耗时短,获得卫星细胞的产量高,但是通常分离得到细胞是卫星细胞、脂肪细胞、成纤维细胞等的混合细胞,如果想要得到较高纯度的卫星细胞,则需要进一步纯化。常用的纯化方法有差速贴壁法、Percoll梯度离心法和流式细胞分选(FACS)等[19-21]。但是,已有分离方法分离得到的细胞普遍存在耗时长、细胞纯度低和存活率低等问题,因此,建立一种简便、高效的体外分离培养骨骼肌卫星细胞的方法尤为重要。鉴于此,本研究对传统分离细胞使用的酶和细胞生长培养基进行了优化,以期获得具有高度分化潜能的鹅骨骼肌卫星细胞,为研究鹅骨骼肌生长和发育调控机制提供细胞模型和材料支撑。
1 材料与方法 1.1 试验材料健康10周龄溆浦鹅仔鹅来自江苏现代畜牧科技示范园(江苏畜禽遗传资源研究所)。
1.2 主要试剂和仪器DMEM/F12高糖培养基(Hyclone);DMEM高糖培养基(Gibco);胎牛血清(FBS,Gemini);马血清(HS,Gibco);青霉素链霉素混合液(索莱宝);磷酸盐缓冲液(Gibco);分散酶Dispase Ⅱ(Roche);胶原酶Ⅱ(Sigma-Aldrich);0.25%胰蛋白酶(索莱宝);重组人碱性成纤维生长因子bFGF(PeproTech);基质胶(BD Biosciences);4%多聚甲醛(索莱宝);鼠抗Pax7抗体(DSHB);鼠抗MyHC/MF20抗体(DSHB);鼠抗GAPDH抗体(翌圣);羊抗鼠594标记二抗(索莱宝);总RNA抽提试剂(碧云天);反转录试剂(诺唯赞);定量试剂2×M5 HiPer SYBR Premix EsTaq plus(聚合美);RIPA蛋白裂解液(碧云天)。其它试剂均为国产优质分析纯。所有PCR产物均由苏州金唯智生物科技有限公司合成。
净化工作实验台(上海智城分析仪器制造有限公司),CO2恒温细胞培养箱(Thermo Fisher),DYY-10C型电泳仪(北京市六一仪器厂);Tanon 5200全自动化学发光图像分析系统(上海天能科技有限公司);QuantStudio 3实时荧光定量PCR仪器(Applied Biosystems);Axio Vert A1倒置荧光显微镜(Zeiss)。
1.3 鹅骨骼肌卫星细胞分离和培养将10周龄溆浦鹅仔鹅麻醉后处死,75%酒精消毒腿部肌肉组织附近皮肤;剪下肌肉组织,用PBS缓冲液冲洗;用无菌剪刀将肌肉组织剪碎成肉糜状;加入消化工作液(消化工作液是含有终浓度为2 mg ·mL-1分散酶Dispase Ⅱ和4 mg ·mL-1胶原酶Ⅱ的高糖DMEM培养基溶液,一般1 cm3的肌肉组织需要5~10 mL消化工作液),吹打混匀,并在37 ℃摇床上震荡消化1 h;消化完成后,加入10 mL含有3% FBS的高糖DMEM培养基终止消化;消化液依次用100 μm和40 μm的细胞筛进行过滤;细胞悬液1 500 r ·min-1离心10 min,弃上层溶液;用3 mL红细胞裂解液处理2 min,再加入5 mL DPBS,1 500 r ·min-1离心5 min;弃上清,此时沉淀中包含大量分离得到的鹅骨骼肌卫星细胞,用5 mL骨骼肌卫星细胞生长完全培养基(骨骼肌卫星细胞生长完全培养基为含20% FBS,1%青霉素链霉素混合液,5 ng ·mL-1 bFGF的DMEM/F12培养基溶液)重悬细胞,轻柔吹打均匀,接种于25 cm2培养瓶中,放入37 ℃,5% CO2细胞培养箱中培养。
1.4 鹅骨骼肌卫星细胞纯化与传代培养用生长完全培养基培养卫星细胞。原代细胞培养时,为促进卫星细胞贴壁,培养过程中使用的培养瓶或培养皿均需使用基质胶进行包被处理(基质胶包被液为基质胶和DMEM按照1 ∶24比例混合的溶液)。同时,为减少细胞损失,最初培养过程中不需要换液,每2 d需添加部分新的生长完全培养基。原代卫星细胞在经基质胶包被后的培养皿中3~7 d汇合度达到80%~90%,此时可进行传代。首次传代时,通过差速贴壁法对卫星细胞进行纯化。消化后,收集细胞到15 mL离心管中,1 500 r ·min-1离心5 min。用生长完全培养基重悬细胞,转移至未经基质胶包被处理的10 cm皿中,放入培养箱中静置。1 h后,此时成纤维细胞已经贴壁,卫星细胞没有贴壁,吸取10 cm皿中上层培养基到新的经基质胶包被好的10 cm皿中,以此除去成纤维细胞。
1.5 鹅骨骼肌卫星细胞诱导分化取正常培养的细胞,待细胞汇合度达到90%以上时,更换分化培养基(分化培养基为含2%马血清的高糖DMEM培养基溶液),诱导分化1~7 d,观察卫星细胞的分化情况。
1.6 鹅骨骼肌卫星细胞免疫荧光鉴定从培养箱中取出原代鹅卫星细胞或诱导分化后的鹅肌管细胞,吸弃原培养基,加入PBS洗涤2次后用4%的多聚甲醛固定20 min;固定完成后,用PBS洗涤3次;向培养孔中加入免疫荧光封闭液,室温封闭1 h;吸净封闭液,加入Pax7、MyHC/MF20一抗(1 ∶100稀释抗体),4 ℃孵育过夜;孵育完成后,用PBS洗涤3次。按照试验需求配制所需二抗;加入羊抗鼠594标记二抗,避光室温孵育1 h;PBS避光洗涤3次;避光将含DAPI抗淬灭封片液加入培养孔中,覆盖细胞;避光4 ℃保存以待显微镜镜检。
1.7 鹅骨骼肌卫星细胞RT-PCR鉴定分别收集诱导分化前(生长培养基,GM)和诱导分化后(分化培养基,DM)的细胞样品,分化前、后每组均3个重复。采用Trizol法进行总RNA的提取,用试剂盒反转录为cDNA,以cDNA为模板,加入Pax7、MyoD1、MyoG、Gapdh基因上、下游引物进行qRT-PCR,引物信息详见表 1;qRT-PCR 15 μL反应体系:2.9 μL 2×SYBR Green Mix,上、下游引物各0.3 μL,4 μL稀释后的cDNA,无酶水补齐至15 μL。反应条件:95 ℃ 60 s;(95 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s)40个循环。
|
|
表 1 本研究所用的引物序列 Table 1 The primer sequences used in this study |
分别收集诱导分化前后的细胞样品,利用添加1%PMSF的RIPA蛋白裂解液提取总蛋白。对蛋白进行变性后,利用Western blotting分别检测鹅骨骼肌卫星细胞增殖期和分化期Pax7、MyHC的表达情况。
1.9 统计分析qRT-PCR结果参照2-ΔΔCt方法来评估Pax7、MyoD1、MyoG的相对表达量,以Gapdh作为内参基因进行待测基因表达差异的检测。结果以“平均数±标准差(Mean±SD)”表示,采用SPSS软件分析,组间差异性采用独立样本t检验的方法进行比较,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 鹅骨骼肌卫星细胞的分离和鉴定采集健康10周龄溆浦鹅仔鹅骨骼肌,利用分散酶Dispase Ⅱ和胶原酶Ⅱ消化处理,分离并通过差速贴壁法纯化获得骨骼肌卫星细胞。分离得到的原代卫星细胞呈球形,体积较小,折光性强(图 1A,红色箭头)。用生长完全培养基培养卫星细胞,经12 h培养后细胞开始缓慢贴壁,呈中间彭起两端针状的梭形结构(图 1A,黄色箭头)。培养24 h后绝大多数卫星细胞完全贴壁,呈纺锤形,贴壁后的卫星细胞开始大量快速增殖(图 1B)。
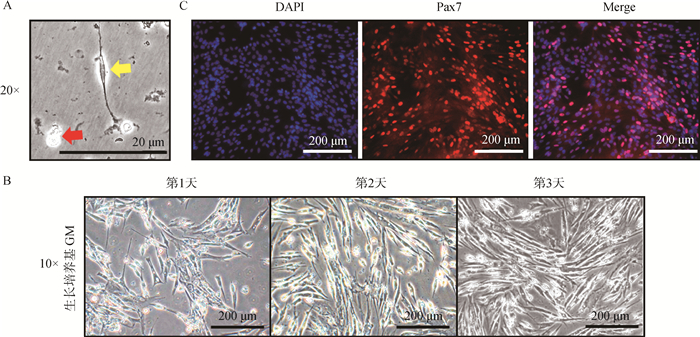
|
A. 鹅骨骼肌卫星细胞培养12 h后形态,比例尺=20 μm (20×);B. 卫星细胞培养不同时间后显微镜下形态,比例尺=200 μm (10×);C. Pax7免疫荧光染色鉴定,比例尺=200 μm (20×) A. Morphology of goose skeletal muscle satellite cells after 12 h culture, scale bar=20 μm (20×); B. Morphology of satellite cells under microscope after different time of culture, scale bar=200 μm (10×); C. Pax7 immunofluorescence staining identification, scale bar=200 μm (20×) 图 1 鹅骨骼肌卫星细胞分离、培养及鉴定 Fig. 1 Isolation, culture and identification of goose skeletal muscle satellite cells |
Pax7是卫星细胞特异性标志基因,经免疫荧光鉴定,原代卫星细胞高表达Pax7(图 1C)。另外,经生长完全培养基培养后,分别提取其RNA和蛋白质,利用qRT-PCR和Western bloting检测Pax7 mRNA和蛋白表达水平,结果显示培养的卫星细胞依旧高表达Pax7。因此,本分离方法能够获得较高纯度的鹅骨骼肌卫星细胞,以及该培养体系能够维持卫星细胞处于较高的未分化状态。
2.2 鹅骨骼肌卫星细胞的体外诱导分化在细胞汇合度达到80%~90%时,进行体外诱导分化。发现细胞在诱导第2天开始拉长、变大,且初显小肌管。诱导第4天,开始有明显的肌管形成。之后,这些肌管继续融合形成成熟较大的肌管(图 2A)。此时,结晶紫染色也显示有大量成熟肌管生成(图 2B)。成熟的肌管能够维持0.5~1 d,由于培养条件限制,之后逐渐脱落。肌球蛋白重链MyHC是肌纤维的组成型蛋白。利用MyHC标记成熟肌管,免疫荧光染色结果显示, 分化后期,肌管与肌管融合形成纵横的更大肌管,肌管中可能包含近百个细胞核(图 3)。此时,细胞的分化指数(含有2个及以上细胞核的肌管中的细胞核数量/细胞核总数)高达78% (图 4,P < 0.01),说明分离得到的卫星细胞体外具有高度分化的能力,保持较高的分化潜能。

|
A. 卫星细胞诱导分化过程中形态变化,比例尺=200 μm (10×);B. 卫星细胞诱导分化后结晶紫染色,比例尺=200 μm(4×) A. Morphological changes of satellite cells during induced differentiation, scale bar=200 μm (10×); B. Crystal violet staining after differentiation of satellite cells, scale bar=200 μm (4×) 图 2 鹅骨骼肌卫星细胞在诱导分化过程中的形态变化 Fig. 2 Morphological changes of goose skeletal muscle satellite cells after induced differentiation |
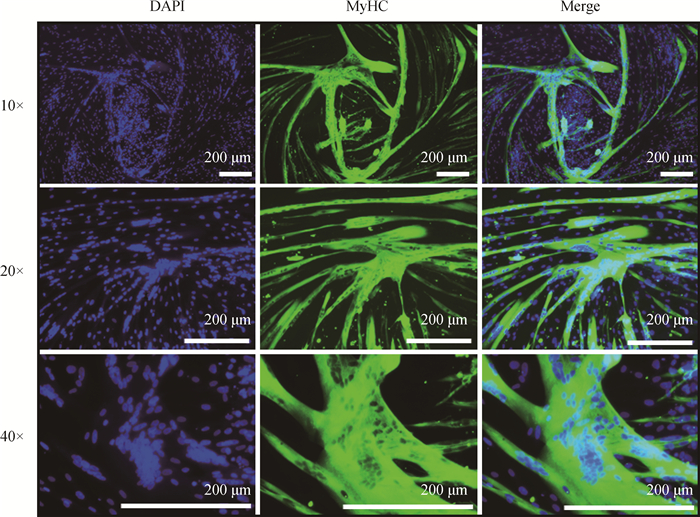
|
图 3 鹅骨骼肌卫星细胞诱导分化第6天MyHC免疫荧光染色鉴定 Fig. 3 MyHC immunofluorescence staining identification of goose skeletal muscle satellite cells after 6 days induced differentiation |
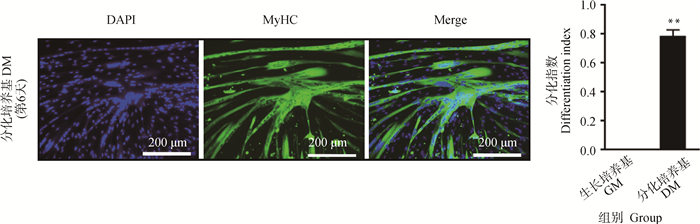
|
**. P < 0.01,下同 **. P < 0.01, the same as below 图 4 鹅骨骼肌卫星细胞诱导分化前后分化指数统计 Fig. 4 Statistics of differentiation index of goose skeletal muscle satellite cells before and after differentiation |
分别收集诱导分化前(GM)和诱导分化后(DM)的细胞样品,提取RNA,反转后通过qRT-PCR检测其标志基因Pax7、MyoD1、MyoG的相对表达水平。结果显示,分化标志基因MyoD1、MyoG的表达均在诱导分化后明显升高,并且分化后MyoD1、MyoG的相对表达量分别是分化前的1.90和44.22倍,而分化前卫星细胞标志基因Pax7的相对表达量是分化后的2.22倍(图 5A,P < 0.01)。另外,Western blotting检测结果也显示,经诱导分化后,Pax7蛋白表达水平降低,而MyHC蛋白表达水平明显升高(图 5B)。从分子水平上说明分离的卫星细胞具有较强的分化潜力,可以作为后续试验的体外分化细胞模型。
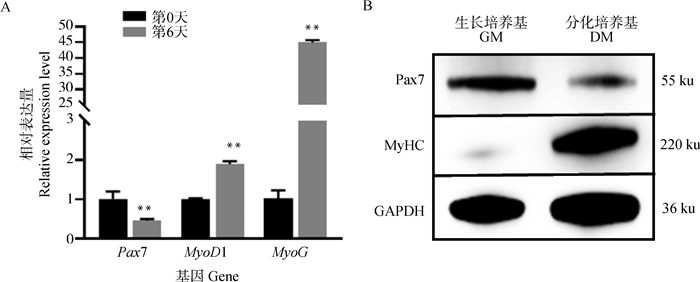
|
A. 分化前后Pax7、MyoD1、MyoG的相对表达量;B. 分化前后Pax7和MyHC蛋白表达水平 A. The relative expression of Pax7, MyoD1 and MyoG before and after differentiation; B. The proteins expression level of PAX7 and MyHC before and after differentiation 图 5 鹅骨骼肌卫星细胞诱导分化前后基因表达变化情况 Fig. 5 Changes of gene expression in goose skeletal muscle satellite cells before and after differentiation |
成体中骨骼肌卫星细胞位于肌肉组织的肌膜和基底膜之间,保留未分化状态,具有很强的分化潜能。卫星细胞的分化潜能也使其成为成体骨骼肌研究的重要细胞模型,用于肌肉组织形成和发育机制[22-25]、分子育种病理、损伤修复[2, 26]、衰老及再生[27-28]等多方面的研究。
目前,人们已经从小鼠[29]、牛[8-9]、猪[13-14]等哺乳动物中分离出骨骼肌卫星细胞。由于年幼个体的卫星细胞含量更丰富,所以对于哺乳动物而言,通常选用低日龄动物肌肉组织作为分离材料。而对于家禽而言,通常选用发育到一定胚龄的胚胎作为材料分选骨骼肌卫星细胞。例如,鸡一般选用12胚龄左右的鸡胚作为生物材料[30-31],鸭一般选用13胚龄左右的鸭胚作为生物材料[32],家鸽一般选用16胚龄左右的鸽胚作为生物材料[33]。但是对于鹅而言,目前关于鹅骨骼肌卫星细胞的报道很少,沈龙仙等[16, 34]选用10~15日龄鹅胚分离培养卫星细胞。鹅胚取材繁琐,而且相关研究甚少涉及对卫星细胞分化能力的评估。在鹅卫星细胞分离中,本研究未选用胚胎,而选用10周龄仔鹅的肌肉组织为试验材料,分离得到大量具有高度分化潜能的卫星细胞,且细胞分化指数高达78%。与一定胚龄的鹅胚胎相比,仔鹅更易获得且个体肌肉组织甚多,从而大大拓宽了鹅卫星细胞分离的取材范围。
大量的文献报道显示,目前实验室多采用多酶混合的方法分离骨骼肌卫星细胞。常用于分离卫星细胞的酶包括胶原蛋白酶、链酶蛋白酶、胰蛋白酶、胶原酶等,不同酶联合消化的时间不同,分离效果也存在较大差异,一些研究比较了不同酶的消化分离效果[35]。目前,比较成熟的卫星细胞的分离以人、小鼠、猪为主,在禽类中尚无很好的卫星细胞分离方法。本研究选择胶原酶Ⅱ和分散酶Dispase Ⅱ的混合液消化剪碎的骨骼肌组织1 h,以彻底将卫星细胞释放出来。胶原酶Ⅱ可以降解具有三股螺旋的胶原纤维,消化组织; Dispase Ⅱ作用温和,对细胞损伤小。试验证实,胶原酶Ⅱ (终浓度为4 mg ·mL-1) 和Dispase Ⅱ (终浓度为2 mg ·mL-1)的组合及浓度的选择能够获得大量具有活力的卫星细胞。
与其他方法相比,酶消化法耗时短,获得卫星细胞的产量高,但是通常分离得到的细胞是卫星细胞、脂肪细胞、成纤维细胞等的混合细胞,如果想要得到较高纯度的卫星细胞,则需要进一步纯化。常用的纯化方法有Percoll梯度离心法、流式细胞分选(FACS)和差速贴壁法等。Percoll不连续密度梯度离心法能获得较纯的卫星细胞,但是由于多次离心造成细胞损失,因此所需初始细胞总量较大。流式细胞分选法操作复杂,成本高。尤其对于禽类来说,由于可用抗体缺乏,导致此方法很难实施。本研究选用差速贴壁法纯化卫星细胞,即在传代时通过差速贴壁1 h对鹅骨骼肌卫星细胞进行纯化,试验证明此方法能够去除成纤维细胞的干扰,获得高纯度卫星细胞。
生长培养基的选择对于卫星细胞分化能力的维持尤为重要。本研究选用含有20%FBS和添加bFGF (终浓度为5 ng ·mL-1)的DMEM/F12培养基培养鹅骨骼肌卫星细胞。高血清浓度能够促进卫星细胞的增殖而抑制其分化。另外,研究证实bFGF在干细胞的体外培养过程中有利于维持干细胞的未分化状态,促进细胞增殖[36]。体外诱导分化试验显示可以形成多核的成熟大肌管,因而说明该生长培养基可以维持鹅骨骼肌卫星细胞保持较高的分化潜能,满足后续的试验需求。
目前,通常采用免疫荧光标记特异基因的方法鉴定卫星细胞。正常生理状态下,卫星细胞处于静止态,此时细胞高表达标志蛋白Pax7,在肌肉损伤或受到生长因子的刺激后,卫星细胞被激活[37-38],激活后的卫星细胞开始表达成肌调节因子MyoD和MyoG[39],分化为成肌细胞和肌细胞[40],进而融合形成肌管,此时细胞高表达肌管标志蛋白MyHC。如果在体内,肌管进一步融合、成熟形成新的肌纤维。因此,本研究采用Pax7鉴定初步卫星细胞的分离及纯度,在后续的试验中,通过检测MyoD、MyoG和MyHC等的表达变化,评估卫星细胞的分化潜能,进一步证实本研究分离的细胞是具有多潜能分化生物学特性的骨骼肌卫星细胞。
4 结论本研究建立了胶原酶Ⅱ和分散酶Dispase Ⅱ组合的混合酶分离鹅骨骼肌卫星细胞的方法,并对细胞的生长完全培养基进行了优化,实现在体外培养过程中维持卫星细胞的高未分化状态,保持其巨大的分化潜能,为鹅肌肉组织生长发育、肉质改良、药理毒理试验、损伤修复等提供了良好的细胞模型及研究基础。
| [1] |
罗庆斌, 何大乾, 尹荣楷, 等. 我国养鹅业现状及发展趋势[J]. 中国家禽, 2006, 28(4): 1-4. LUO Q B, HE D Q, YIN R K, et al. Current situation and development trends on goose industry in China[J]. China Poultry, 2006, 28(4): 1-4. DOI:10.3969/j.issn.1004-6364.2006.04.001 (in Chinese) |
| [2] |
SONG T, SADAYAPPAN S. Featured characteristics and pivotal roles of satellite cells in skeletal muscle regeneration[J]. J Muscle Res Cell Motil, 2020, 41(4): 341-353. DOI:10.1007/s10974-019-09553-7 |
| [3] |
SCHMIDT M, SCHÜLER S C, HÜTTNER S S, et al. Adult stem cells at work: regenerating skeletal muscle[J]. Cell Mol Life Sci, 2019, 76(13): 2559-2570. DOI:10.1007/s00018-019-03093-6 |
| [4] |
MAURO A. Satellite cell of skeletal muscle fibers[J]. J Biophys Biochem Cytol, 1961, 9(2): 493-495. DOI:10.1083/jcb.9.2.493 |
| [5] |
BISCHOFF R. Enzymatic liberation of myogenic cells from adult rat muscle[J]. Anat Rec, 1974, 180(4): 645-661. DOI:10.1002/ar.1091800410 |
| [6] |
BLAU H M, WEBSTER C. Isolation and characterization of human muscle cells[J]. Proc Natl Acad Sci U S A, 1981, 78(9): 5623-5627. DOI:10.1073/pnas.78.9.5623 |
| [7] |
LU S H, WEI C F, YANG A H, et al. Isolation and characterization of human muscle-derived cells[J]. Urology, 2009, 74(2): 440-445. DOI:10.1016/j.urology.2009.01.048 |
| [8] |
DING S J, SWENNEN G N M, MESSMER T, et al. Maintaining bovine satellite cells stemness through p38 pathway[J]. Sci Rep, 2018, 8(1): 10808. DOI:10.1038/s41598-018-28746-7 |
| [9] |
DODSON M V, MARTIN E L, BRANNON M A, et al. Optimization of bovine satellite cell-derived myotube formation in vitro[J]. Tissue Cell, 1987, 19(2): 159-166. DOI:10.1016/0040-8166(87)90001-2 |
| [10] |
洪倩倩, 郭宏, 高树新, 等. 过表达MyBPC1对牛骨骼肌卫星细胞增殖分化的影响[J]. 畜牧兽医学报, 2021, 52(12): 3439-3448. HONG Q Q, GUO H, GAO S X, et al. Effect of overexpression of MyBPC1 on proliferation and differentiation of bovine skeletal muscle satellite cells[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(12): 3439-3448. DOI:10.11843/j.issn.0366-6964.2021.012.011 (in Chinese) |
| [11] |
薛科, 王林杰, 陈利, 等. 高糖诱导山羊骨骼肌卫星细胞成脂分化过程中相关基因表达的变化[J]. 畜牧兽医学报, 2014, 45(5): 706-713. XUE K, WANG L J, CHEN L, et al. Adipogenic-related gene expressions in goat skeletal muscle satellite cells treated with high concentration glucose[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(5): 706-713. (in Chinese) |
| [12] |
ZHAO J, ZHAO X Y, SHEN X X, et al. CircCCDC91 regulates chicken skeletal muscle development by sponging miR-15 family via activating IGF1-PI3K/AKT signaling pathway[J]. Poult Sci, 2022, 101(5): 101803. DOI:10.1016/j.psj.2022.101803 |
| [13] |
WILSCHUT K J, HAAGSMAN H P, ROELEN B A. Extracellular matrix components direct porcine muscle stem cell behavior[J]. Exp Cell Res, 2010, 316(3): 341-352. DOI:10.1016/j.yexcr.2009.10.014 |
| [14] |
DOUMIT M E, MERKEL R A. Conditions for isolation and culture of porcine myogenic satellite cells[J]. Tissue Cell, 1992, 24(2): 253-262. DOI:10.1016/0040-8166(92)90098-R |
| [15] |
METZGER K, TUCHSCHERER A, PALIN M F, et al. Establishment and validation of cell pools using primary muscle cells derived from satellite cells of pig skeletal muscle[J]. In Vitro Cell Dev Biol Anim, 2020, 56(3): 193-199. DOI:10.1007/s11626-019-00428-2 |
| [16] |
WANG H, HE K, ZENG X H, et al. Isolation and identification of goose skeletal muscle satellite cells and preliminary study on the function of C1q and tumor necrosis factor-related protein 3 gene[J]. Anim Biosci, 2021, 34(6): 1078-1087. DOI:10.5713/ajas.20.0430 |
| [17] |
LE GRAND F, GRIFONE R, MOURIKIS P, et al. Six1 regulates stem cell repair potential and self-renewal during skeletal muscle regeneration[J]. J Cell Biol, 2012, 198(5): 815-832. DOI:10.1083/jcb.201201050 |
| [18] |
ROSENBLATT J D, LUNT A I, PARRY D J, et al. Culturing satellite cells from living single muscle fiber explants[J]. In Vitro Cell Dev Biol Anim, 1995, 31(10): 773-779. DOI:10.1007/BF02634119 |
| [19] |
BILLESKOV T B, JENSEN J B, JESSEN N, et al. Fluorescence-activated cell sorting and phenotypic characterization of human fibro-adipogenic progenitors[J]. STAR Protoc, 2023, 4(1): 102008. DOI:10.1016/j.xpro.2022.102008 |
| [20] |
LIU L, CHEUNG T H, CHARVILLE G W, et al. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting[J]. Nat Protoc, 2015, 10(10): 1612-1624. DOI:10.1038/nprot.2015.110 |
| [21] |
PAKULA A, SPINAZZOLA J M, GUSSONI E. Purification of myogenic progenitors from human muscle using fluorescence-activated cell sorting (FACS)[M]//RØNNING S B. Myogenesis. New York: Humana Press, 2019: 1-15.
|
| [22] |
LORETI M, SACCO A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment[J]. NPJ Regen Med, 2022, 7(1): 16. DOI:10.1038/s41536-022-00204-z |
| [23] |
SU Y, YU Y Y, LIU C C, et al. Fate decision of satellite cell differentiation and self-renewal by miR-31-IL34 axis[J]. Cell Death Differ, 2020, 27(3): 949-965. DOI:10.1038/s41418-019-0390-x |
| [24] |
YOSHIDA T, DELAFONTAINE P. Mechanisms of IGF-1-mediated regulation of skeletal muscle hypertrophy and atrophy[J]. Cells, 2020, 9(9): 1970. DOI:10.3390/cells9091970 |
| [25] |
MA N Y, CHEN D L, LEE J H, et al. Piezo1 regulates the regenerative capacity of skeletal muscles via orchestration of stem cell morphological states[J]. Sci Adv, 2022, 8(11): eabn0485. DOI:10.1126/sciadv.abn0485 |
| [26] |
SCHÄTZLEIN E, BLAESER A. Recent trends in bioartificial muscle engineering and their applications in cultured meat, biorobotic systems and biohybrid implants[J]. Commun Biol, 2022, 5(1): 737. DOI:10.1038/s42003-022-03593-5 |
| [27] |
MOISEEVA V, CISNEROS A, SICA V, et al. Senescence atlas reveals an aged-like inflamed niche that blunts muscle regeneration[J]. Nature, 2023, 613(7942): 169-178. DOI:10.1038/s41586-022-05535-x |
| [28] |
TAGLIETTI V, KEFI K, RIVERA L, et al. Thyroid-stimulating hormone receptor signaling restores skeletal muscle stem cell regeneration in rats with muscular dystrophy[J]. Sci Transl Med, 2023, 15(685): eadd5275. DOI:10.1126/scitranslmed.add5275 |
| [29] |
MUSARÒ A, CAROSIO S. Isolation and culture of satellite cells from mouse skeletal muscle[M]//DI NARDO P, DHINGRA S, SINGLA D K. Adult Stem Cells. New York: Humana Press, 2017: 155-167.
|
| [30] |
戴巍, 宋瑞龙, 张远浩, 等. 鸡骨骼肌卫星细胞的分离培养与鉴定[J]. 畜牧兽医学报, 2021, 52(3): 676-682. DAI W, SONG R L, ZHANG Y H, et al. Isolation, culture and identification of muscle satellite cells of chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(3): 676-682. (in Chinese) |
| [31] |
HE H R, YIN H D, YU X K, et al. PDLIM5 Affects chicken skeletal muscle satellite cell proliferation and differentiation via the p38-mapk pathway[J]. Animals (Basel), 2021, 11(4): 1016. |
| [32] |
单艳菊, 束婧婷, 宋迟, 等. 鸭骨骼肌卫星细胞的分离培养与鉴定[J]. 江苏农业科学, 2012, 40(12): 26-28. SHAN Y J, SHU J T, SONG C, et al. Isolation culture and identification of duck skeletal muscle satellite cells[J]. Jiangsu Agricultural Sciences, 2012, 40(12): 26-28. DOI:10.3969/j.issn.1002-1302.2012.12.008 (in Chinese) |
| [33] |
林正浩, 王讯, 李晓开, 等. 鸽骨骼肌卫星细胞的分离、培养及成肌特性[J]. 华南农业大学学报, 2019, 40(1): 53-58. LIN Z H, WANG X, LI X K, et al. Isolation, identification and biological characteristics of skeletal muscle satellite cells in pigeons[J]. Journal of South China Agricultural University, 2019, 40(1): 53-58. (in Chinese) |
| [34] |
沈龙仙, 王丽婷, 何珂, 等. 褪黑素和烟酰胺单核苷酸对鹅骨骼肌卫星细胞增殖的影响[J]. 中国农业科学, 2023, 56(2): 391-404. SHEN L X, WANG L T, HE K, et al. Effects of melatonin and nicotinamide mononucleotides on proliferation of skeletal muscle satellite cells in goose[J]. Scientia Agricultura Sinica, 2023, 56(2): 391-404. (in Chinese) |
| [35] |
DANOVIZ M E, YABLONKA-REUVENI Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system[M]//DIMARIO J X. Myogenesis. Totowa: Humana Press, 2012: 21-52.
|
| [36] |
ZHANG L, WU Y N, LI X, et al. An alternative method for long-term culture of chicken embryonic stem cell in vitro[J]. Stem Cells Int, 2018, 2018: 2157451. |
| [37] |
SOUSA-VICTOR P, GARCÍA-PRAT L, MUÑOZ-CÁNOVES P. Control of satellite cell function in muscle regeneration and its disruption in ageing[J]. Nat Rev Mol Cell Biol, 2022, 23(3): 204-226. DOI:10.1038/s41580-021-00421-2 |
| [38] |
GONZALEZ M L, BUSSE N I, WAITS C M, et al. Satellite cells and their regulation in livestock[J]. J Anim Sci, 2020, 98(5): skaa081. DOI:10.1093/jas/skaa081 |
| [39] |
HERNÁNDEZ-HERNÁNDEZ J M, GARCÍA-GONZÁLEZ E G, BRUN C E, et al. The myogenic regulatory factors, determinants of muscle development, cell identity and regeneration[J]. Semin Cell Dev Biol, 2017, 72: 10-18. DOI:10.1016/j.semcdb.2017.11.010 |
| [40] |
CHEN B D, YOU W J, WANG Y Z, et al. The regulatory role of Myomaker and Myomixer-Myomerger-Minion in muscle development and regeneration[J]. Cell Mol Life Sci, 2020, 77(8): 1551-1569. DOI:10.1007/s00018-019-03341-9 |
(编辑 郭云雁)



