2. 内蒙古农业大学生命科学学院, 呼和浩特 010018;
3. 内蒙古自治区农牧业科学院, 呼和浩特 010031;
4. 内蒙古农业大学兽医学院, 呼和浩特 010018
2. College of Life Science, Inner Mongolia Agricultural University, Hohhot 010018, China;
3. Inner Mongolia Academy of Agriculture and Animal Husbandry Sciences, Hohhot 010031, China;
4. College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot 010018, China
奶牛酮病(ketosis)是围产期奶牛常见的代谢性疾病[1-2]。围产期奶牛由于受孕晚期激素变化、胎儿迅速增长、分娩、泌乳等高耗能生理应激,同时食欲下降、营养摄入不足,因能量“入不敷出”而导致能量负平衡,严重的能量负平衡将导致血酮升高,演变为亚临床酮病或临床酮病[3]。奶牛酮病显著降低奶牛泌乳量和乳品质,降低繁殖效率,也会增加皱胃移位、跛行和子宫炎的风险,常造成较为严重的经济损失[4]。
哺乳动物在营养充足、休息的条件下,以葡萄糖作为主要的能量物质,保证机体正常生命活动。然而,在自然环境中,长期的食物供应受限、能量物质摄入不足和适度的体力活动会显著改变血糖水平,导致基本生理功能更加依赖脂肪酸代谢[5]。例如,长时间的禁食和耐力锻炼会导致血糖水平下降,脂肪组织来源的脂肪酸的β氧化,肝吸收并将脂肪酸转化为酮体,同时导致酮体增加,主要是β-羟丁酸(β-hydroxybutyrate,BHBA)和乙酰乙酸。此外,喂养高脂肪、低碳水化合物生酮饮食的动物(ketogenesis diet,KD)或处于能量负平衡的围产期奶牛,肝脏加强生成酮体,然后输出到几乎所有的肝外身体组织,在肝外组织主要通过线粒体代谢转化为乙酰辅酶A进入三羧酸循环,最终产生“能量货币”三磷酸腺苷(ATP)[6-7]。近年来的研究表明BHBA不仅是一种能量物质,而且在细胞表面和细胞内具有其受体分子,介导多种信号传导功能,可以影响基因表达、脂质代谢、神经元功能,还能够调控炎症反应[6, 8],例如激活羟基羧酸受体2 (hydroxy-carboxylic acid receptor 2, HCA2)[9]和核苷酸结合寡聚化结构域样受体3(NLR family pyrin domain containing 3,NLRP3)炎症小体[10],从而阻断炎症中间体的合成。此外,组蛋白赖氨酸β-羟基丁基化修饰是一种新发现的表观遗传修饰形式[11],BHBA介导的表观遗传修饰参与重要的细胞生理和代谢调节。结合近年来对BHBA的相关研究,本文就BHBA作为信号分子对表观遗传修饰影响、调控炎症作用机制进行综述,以期为科研工作者研究代谢与炎症作用机制提供参考和借鉴,为药物开发、疾病治疗、奶牛酮病的防治提供新思路。
1 BHBA生成与利用BHBA是酮体的重要组成分子,能量限制、生酮饮食、能量负平衡均能够促使机体脂肪动员、脂解,通过肝生酮作用(ketogenesis)最终产生BHBA。脂肪动员生成的脂肪酸经过β氧化,在线粒体内最终生成乙酰辅酶A(acetyl-CoA)。为维持血糖浓度,肝细胞加速糖原异生,大量草酰乙酸进入糖原异生途径,而草酰乙酸是三羧酸循环开始的必要化合物,其缺少导致脂肪酸生成的乙酰辅酶A无法进入三羧酸循环从而进入生成酮体途径[12]。乙酰辅酶A在乙酰基转移酶(acetyl-CoA acetyltransferase 1,ACAT1)的催化下形成乙酰乙酰辅酶A,再通过3-羟甲基戊二酰(HMG)-辅酶A合成酶(mitochondrial hydroxymethyl glutaryl-CoA synthase,HMGCS2)的作用下生成3-羟甲基戊二酰-辅酶A(3-hydroxy-3-methylglutaryl-CoA,HMG-CoA)。HMG-CoA裂解酶将HMG-CoA裂解形成乙酰辅酶A和乙酰乙酸。乙酰乙酸在D-3-羟基丁酸脱氢酶(β-hydroxybutyrate dehydrogenase,BDH1)作用下,还原为BHBA(图 1)。HMGCS2是生成BHBA必须酶,也是酮体生成的限速步骤,该酶主要存在于肝细胞中,因此BHBA主要在肝脏内生成。

|
图 1 β-羟丁酸(BHBA)生成与利用[本文图片使用在线绘图软件BioRender(https://app.biorender.com/)绘制] Fig. 1 Ketogenesis and ketolysis of β-hydroxybutyrate(BHBA) [The images in this article are drew by using the online drawing software BioRender(https://app.BiorenderCom/)] |
由于肝细胞内缺乏酮解作用(ketolysis)的关键酶,肝细胞生成的BHBA转运至肝细胞外随血液进入肝外组织细胞内被氧化利用。BHBA经过膜转运蛋白MCT1/2由肝进入血液循环至外周组织细胞内,经BDH1酶作用氧化为乙酰乙酸。随后,在SCOT转移酶(succinyl-CoA: 3-ketoacid-CoA transferase, SCOT)作用下乙酰乙酸转变为乙酰乙酰辅酶A,该步骤为酮解作用的限速步骤,由于肝细胞不表达SCOT,因此不能利用BHBA,只能运输至肝外作为能量物质供能,是机体的一种自我保护机制,在能量匮乏状态下,尽量为肝外组织提供能量以满足基本代谢需求,维持基本生命活动。最后,ACAT1催化乙酰乙酰辅酶A生成的乙酰辅酶A进入三羧酸循环,最终产生ATP为细胞提供能量(图 1)。BHBA的生成与利用是机体在应对能量短缺情况下,维持机体基本生命活动的生理性反应,但是如果机体长期处于能量负平衡状态,未能及时纠正,BHBA在体内蓄积而导致高酮血症,导致机体产生病理反应,严重者将危及生命。
2 BHBA介导表观遗传修饰调控基因转录表达基因表达是一个受多因素调控的复杂过程,表观遗传修饰是基因转录调控的重要组成部分。组蛋白是染色体基本结构-核小体中的重要组成部分,其N-末端氨基酸残基可发生乙酰化、甲基化、磷酸化、泛素化、多聚ADP糖基化等多种共价修饰作用。组蛋白的修饰可通过影响组蛋白与DNA双链的亲和性,从而改变染色质的疏松或凝集状态,或通过影响其它转录因子与结构基因启动子的亲和性来发挥基因调控作用, 组蛋白修饰对基因表达的调控有类似DNA遗传密码的调控作用。组蛋白赖氨酸乙酰化、甲基化修饰目前研究较为深入的两种组蛋白修饰形式,对基因表达调控具有非常重要的作用,已受到广泛关注。随着蛋白质修饰和单抗技术的发展,越来越多的新型组蛋白赖氨酸修饰被发现,如琥珀酰化、巴豆酰化、丙二酰化、戊二酰化、2-羟基异丁酰化、β-羟基丁酰化等[13]。长期以来,BHBA仅被认为是能量受限条件下的主要能源物质供能,但近年来的研究表明BHBA可以介导表观遗传修饰发挥其调控基因转录表达的作用。
2.1 BHBA介导组蛋白赖氨酸β羟基丁酰化修饰进而调控基因的转录表达BHBA引起蛋白β羟基丁酰化(β-hydroxybutyrylation)最早发现于2016年,组蛋白赖氨酸β羟基丁酰化(lysine β-hydroxybutyrylation,Kbhb)是一种新的组蛋白赖氨酸修饰形式,长期禁食、链唑霉素(streptozotocin)诱导的小鼠糖尿病酮症酸中毒模型中,BHBA升高均能够引起肝细胞组蛋白Kbhb修饰。目前已鉴定44个组蛋白Kbhb位点,这些修饰位点富集于活跃的基因启动子区域[11]。
组蛋白H3第9位赖氨酸位点Kbhb (H3K9bhb)修饰是近年来β羟基丁酰化修饰的研究热点,该修饰位点位于基因转录活跃区域,BHBA影响H3K9bhb修饰,进而影响基因表达调控。由禁食或生酮饮食诱导产生的内源性BHBA和通过注射途径获得外源性BHBA都能够引起组蛋白Kbhb修饰,抑制或缓解炎症反应。生酮饮食诱导小鼠血液BHBA浓度升高,缓解中枢神经的炎症反应,具有抗抑郁作用[14],这种抗抑郁作用与BHBA诱导的组蛋白β羟基丁酰化修饰有关。研究发现小鼠受应激刺激发生抑郁行为,脑部BHBA浓度降低同时H3K9bhb水平也降低,注射BHBA或通过饥饿或生酮饮食提高体内BHBA水平,均能增强H3K9bhb修饰,能够缓解小鼠抑郁行为[15]。在糖尿病大鼠模型中,通过静脉注射中高剂量BHBA提高了基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)基因启动子区域H3K9bhb修饰,从而上调Mmp-2基因表达抵抗肾小球硬化症[16],缓解肾小球肾炎。BHBA通过改变细胞组蛋白Kbhb修饰,调节基因转录,改变细胞炎症反应状态。Zhang等[17]研究发现,形成记忆性CD8+T细胞,需要通过生酮作用产生BHBA,使foxo1和ppargc1基因区域组蛋白发生H3K9bhb修饰,提高了转录因子叉头框蛋白O1(forkhead homeobox type protein O1, FOXO1)和过氧化物酶体增殖物激活受体r辅助因子1α(peroxisome proliferator-activated receptor-r co-activatoro 1 α, PGC1α)表达量,进而上调PCK1表达,促进糖原异生和磷酸戊糖途径,使胞内糖原生成与利用达到平衡状态和维持氧化还原稳态,从而使杀伤性T细胞趋向于形成记忆性T细胞,减缓炎症反应。
泌乳早期奶牛易发生酮病,代谢紊乱对奶牛繁殖有一定的影响。患有酮病的奶牛血液BHBA浓度升高,体内组织蛋白广泛性出现Kbhb修饰[18]。2022年,Sangalli等[18]采集奶牛卵巢、卵丘细胞、肝、乳腺、肾、心、大脑和成纤维细胞培养物样本,利用针对H3K9bhb残基的抗体进行蛋白质印迹分析以鉴定Kbhb,研究结果表明围产期奶牛组织中广泛存在组蛋白H3K9bhb修饰。分别用2、4和6 mmol·L-1 BHBA体外刺激牛成纤维细胞和卵丘细胞,组蛋白H3K9bhb与BHBA处理浓度具有明显的剂量效应。研究者们发现高浓度BHBA促进卵丘-卵母细胞复合体的成熟并且强烈诱导H3K9bhb修饰。卵丘细胞的RNA-seq分析表明,BHBA处理改变了345个基因的表达,下调基因主要参与糖酵解和核糖体组装途径,而上调基因则参与线粒体代谢和卵母细胞发育。该研究进一步丰富了酮病对奶牛繁殖力影响的作用机制。这提示后续的研究者们可以从奶牛组蛋白H3K9bhb对表型相关基因表达调控研究为切入点,开展奶牛酮病相关的分子机制研究。
BHBA通过改变组蛋白β羟基丁酰化修饰,调控基因转录表达,进而影响细胞功能或影响细胞表型转变。因此,这种新的表观遗传修饰方式作为感应环境变化与基因表达调控的桥梁,具有重要的研究意义。
2.2 BHBA影响组蛋白乙酰化修饰组蛋白乙酰化作用指通过组蛋白乙酰化转移酶(histoneacetyltransferas,HAT)通在组蛋白赖氨酸残基乙酰化,激活基因转录,而蛋白去乙酰化酶(histone eacetylases,HDACs)使组蛋白去乙酰化,抑制基因转录[19]。BHBA是HDAC内源性抑制剂。体外细胞学试验显示,HEK293细胞加入BHBA处理,能够抑制HDCA使组蛋白高度乙酰化。小鼠通过注射BHBA,或通过饥饿、能量限制方式使体内BHBA水平升高,小鼠组织乙酰化程度增加,在foxo3a和mt2启动子区域组蛋白乙酰化明显增强,上调了foxo3a和mt2基因的转录水平,从而增强细胞和组织的抗氧化应激能力[20]。由此可见,BHBA可作为内源性HDAC抑制剂发挥抗氧化作用。BHBA抑制HDAC具有组织特异性。饥饿诱导体内BHBA升高,不同组织乙酰化水平变化有所不同,肾脏组蛋白乙酰化水平上升,肝脏无明显变化、心脏呈下降状态[11, 21],这表明其调控机制在不同组织可能存在一定差异,有待进一步深入研究。
酮体BHBA影响奶牛体细胞和胚胎的组蛋白乙酰化修饰,从而影响奶牛胚胎发育。奶牛克隆胚胎的早期合子阶段用BHBA处理胚胎会诱导H3K9ac的增加,并且至少持续到囊胚阶段,通过改变基因表达或代谢重编程来应对环境改变带来的损伤[18, 22]。
2.3 BHBA影响组蛋白其他修饰形式调控基因转录表达BHBA不仅能够直接引起组蛋白β羟丁酰化修饰,促进组蛋白乙酰化修饰,还能够影响组蛋白的其他修饰形式,如甲基化修饰和泛素化修饰[23-24]。在BHBA对脑部影响的研究表明,BHBA可增加海马神经元bdnf启动子Ⅰ、Ⅱ、Ⅳ和Ⅵ区域的H3K4me3甲基化修饰和降低H2AK119ub泛素化修饰的占有率,从而增强脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的表达。进一步研究其作用机制发现,BHBA诱导的H2AK119ub的减少依赖于激活Ⅰ型钙离子通道,而H3K4me3的增加主要由于BHBA激活cAMP/PKA信号,促进了转录因子磷酸化环磷腺苷效应元件结合蛋白(phosphorylated cAMP response element-binding protein, p-CREB)和CREB结合蛋白(CREB binding protein, CBP)与bdnf启动子的结合。这些结果表明,BHBA调节多个组蛋白修饰以协同调节基因表达和细胞信号传导,这也说明BHBA具有广泛的调节作用[25-26]。尽管BHBA影响组蛋白甲基化修饰和泛素化修饰的研究较少,但是这些结果为未来研究BHBA影响多种表遗传修饰的分子机制奠定了理论基础。
3 BHBA调控炎症作用机制免疫、炎症和代谢变化之间的相互作用是一个不断发展的研究领域[27]。酮体是机体应激状态下代谢发生改变而产生的,短期内、适宜的浓度可维持体内平衡稳态。由于酮体BHBA能够缓解脑神经炎性损伤,因此BHBA对炎症的调节机制备受关注。但是,BHBA调控炎症反应具有双面性,通过生酮饮食、禁食或通过注射给药途径短期内适当提高体内BHBA水平,具有抗炎效果;BHBA在体内浓度过高并且持续时间较长时(例如:奶牛酮病),可引起较为严重的炎症反应。BHBA不仅能够影响表观遗传修饰,还能作为信号分子参与调控炎症反应。
3.1 BHBA作用于受体分子调控炎症反应G蛋白偶联受体是信号转导的膜受体家族,在免疫与炎症中发挥重要作用[28]。BHBA可作为直接信号分子与细胞膜表面G蛋白偶联受体结合,调控炎症因子表达。目前已鉴定两个BHBA作用的受体蛋白,分别为HCAR2(即前文的HCA2)和游离脂肪酸受体3(free fatty acid receptor 3, FFAR3)[29]。HCAR2也被称为G蛋白偶联受体109A(G-protein-coupled receptor 109 A, GPR109A),最早被鉴定为烟酸受体,HCAR2也在多种类型细胞中表达,包括脂肪细胞、免疫细胞、小胶质细胞和结肠上皮细胞,在这些细胞中,其激活可诱导抗炎作用[30]。LPS刺激鼠神经小胶质细胞BV-2,BHBA激活GPR109A,促使胞质IκB-α降解,NF-κBB p65易位入核,调控炎症因子基因转录,降低iNOS、COX-2、TNF-α、IL-1β和IL-6表达量(图 2),从而降低炎症反应,对神经炎性损伤具有潜在的保护作用[31]。在视网膜色素上皮细胞(retinal pigment epithelium,RPE)细胞中过表达GPR109A可增强BHBA的抗炎作用,小分子药物抑制GPR109A或基因敲除可消除BHBA的抗炎作用[32],证明BHBA通过作用于GPR109A受体发挥其抗炎作用。
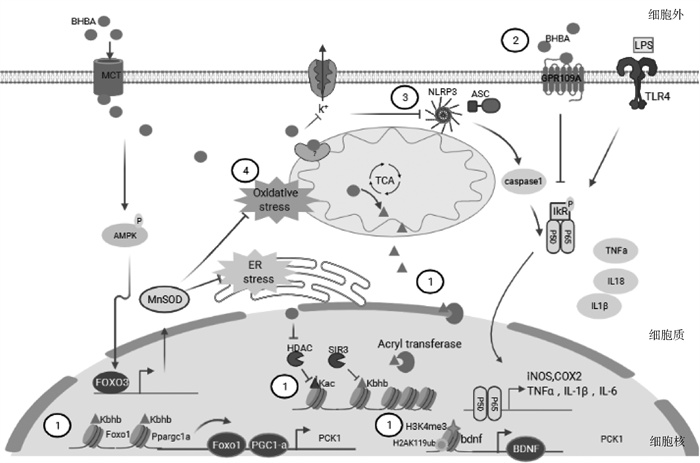
|
①表观遗传修饰;②激活受体;③抑制NLRP3;④抑制氧化应激。 .BHBA; .BHBA;  .β羟丁酰辅酶A
① Epigenetic modification; ② Receptor activation; ③ Inhibited NLRP3;④Inhibition of oxidative stress .β羟丁酰辅酶A
① Epigenetic modification; ② Receptor activation; ③ Inhibited NLRP3;④Inhibition of oxidative stress  .BHBA; .BHBA;  .β-hydroxybutyryl-CoA
图 2 β-羟丁酸(BHBA)调控炎症分子机制
Fig. 2
β-hydroxybutyrate(BHBA) regulated inflammation as a signal molecular .β-hydroxybutyryl-CoA
图 2 β-羟丁酸(BHBA)调控炎症分子机制
Fig. 2
β-hydroxybutyrate(BHBA) regulated inflammation as a signal molecular
|
BHBA通过GPR109A促进酮病奶牛炎症反应进程。适宜浓度的酮体分子BHBA具有抗炎效果,但高浓度BHBA却表现为促炎作用。通常认为奶牛血液酮体BHBA<1.2 mmol·L-1为正常状态,1.2 mmol·L-1≤BHBA<3.0 mmol·L-1为亚临床酮病,BHBA≥3.0 mmol·L-1为临床酮病,奶牛表现为高酮血症[33-34]。酮病奶牛血液BHBA浓度超过生理阈值,易发生各种炎症。GPR109A在奶牛中性粒细胞高表达,使用不同浓度BHBA处理奶牛中性粒细胞发现:当BHBA≥1.2 mmol·L-1时,中性粒细胞趋化能力显著上升。BHBA通过激活GPR109A,使AKT、ERK 1/2和AMPKα磷酸化并增加钙离子释放,诱导中性粒细胞趋化[35]。因此BHBA发挥促炎作用还是抗炎作用与其浓度、细胞类型、处理时间以及共刺激因子有关。
BHBA除了能够激活HCAR2外,还可以阻断FFAR3[也叫G蛋白偶联受体41(G-protein-couled receptor 41, GPCR41)],导致丙酸诱导的cAMP减少,同时ERK级联激活减少。虽然FFAR3在多种组织中表达,但在大脑中,它增强了交感神经系统的活动[36],从而导致代谢率的增加,这个过程可被BHBA阻断[9]。
3.2 BHBA通过调节NLRP3活性调控炎症反应NLRP3炎性小体作为固有免疫的重要组分在机体免疫反应和疾病发生过程中具有重要作用。NLRP3是感知病原体或损伤相关分子模式的先天免疫的重要组成部分。它们是高度调控的多聚蛋白复合物,促进Caspase-1激活白细胞介素-1β (IL-1β)和IL-18的分泌。虽然保护性免疫反应和清除某些感染需要一定程度的炎症小体激活,但过度的病理激活会导致组织损伤和全身炎症[37]。
酮体被认为是炎症和天然免疫的调节剂,尤其是BHBA具有调节中性粒细胞和巨噬细胞炎性小体NLRP3的活性。在PAMPs (pathogen associated molecular patterns)和DAMPs (damage associated molecular patterns) 作用下,BHBA可特异性阻断炎症小体激活。BHBA通过抑制钾离子外流和凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)聚合从而抑制炎症小体NLRP3及其下游caspase-1活化,进而减少NLRP3介导的IL-1β和IL-18表达,抑制炎症反应(图 2)。这些结果通过体外对人单核细胞试验和体内Muckle-Wells综合征、家族性冷自体炎症综合征和尿酸晶体诱导的腹膜炎小鼠模型试验证实,能量限制或生酮饮食增加血液BHBA浓度,能够抑制NLPR3降低炎症因子表达,缓解炎症反应[10]。在生酮饮食升高血液BHBA辅助治疗痛风的研究中得到了一致的结果。痛风是一种由MSU晶体在关节中积累引起的炎症性关节炎。生酮饮食对所有年龄的痛风小鼠模型均有显著影响,抑制中性粒细胞活性,且不降低免疫宿主对感染的反应[38]。
BHBA抑制NLRP3降低神经性炎症反应。对脊髓损伤的研究发现,酮体BHBA抑制NLRP3促进神经胶质细胞/巨噬细胞由M1促炎症表型向M2抑制炎症表型转变,缓解脊髓损伤造成的炎症反应[39]。BHBA能够抑制海马回细胞IL-1β和TNF-α释放,缓解神经性炎症,改善由应激引起的情绪紊乱、抑郁症, 是极具潜力的候选治疗物[40]。
3.3 BHBA参与调控氧化应激氧化应激是指体内氧化与抗氧化作用失衡的一种状态,倾向于氧化,产生大量氧化中间产物。氧化应激是由自由基在体内产生的一种负面作用,并被认为是导致衰老和疾病的一个重要因素。各种活性氧物种的产生超过内源性抗氧化防御机制,促进氧化应激状态的发展,具有重要的生物学后果。氧化应激在炎症的发生和发展中起着至关重要的作用[41]。
BHBA具有抗氧化和缓解氧化应激作用。首先,BHBA作为羟基自由基(·OH)的直接抗氧化剂[42],通过促进NADH氧化,抑制应激神经元线粒体活性氧(reactive oxygen species, ROS)的产生,降低氧化应激引起的炎性损伤。其次,BHBA还可以通过调控FOXO1、FOXO3和NRF2(nuclear factor-erythroid 2-related factor-2)的驱动血红素加氧酶1 (heme oxygenase 1,HO-1)、超氧化物歧化酶2(superoxide dismutase, SOD2)、过氧化氢酶(catalase, CAT)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)醌氧化还原酶1(NQO1)、葡萄糖-6-磷酸脱氢酶(G6PDH)和谷氨酸半胱氨酸连接酶(GCL)的表达抵御高氧化应激条件(图 2)。
高水平的BHBA可引发奶牛氧化应激和炎症反应,导致产奶量下降和多种产后疾病。患有酮病的奶牛表现出严重的代谢应激和免疫功能紊乱,使其更容易受到感染。临床酮病奶牛血液单核细胞的黏附、迁移和吞噬能力较低,而凋亡水平和ROS含量较高[43]。2.4 mmol·L-1 BHBA能够刺激奶牛巨噬细胞氧化应激产生的炎症反应[44]。用3 mmol·L-1 BHBA体外刺激从健康奶牛血液分离的单核细胞,ROS含量升高和凋亡加重,同时NLRP3、caspase 1、IL-1β蛋白含量上升。外源性BHBA通过激活ROS-NLRP3通路,这可能是导致酮病奶牛免疫功能紊乱的部分原因[43]。高浓度BHBA不仅通过激活氧化应激增加单核细胞的炎症反应,也能引起肝脏的炎性损伤。1.8 mmol·L-1 BHBA体外刺激牛原代肝细胞,BHBA能显著提高肝细胞氧化因子[丙二醛(MDA)、NO和iNOS]水平,而抗氧化因子[谷胱甘肽过氧化物酶(GSH-Px)、CAT和SOD]水平显著降低,同时NF-κB调节的炎性细胞因子,即TNF-α、IL-6和IL-1β的表达水平显著升高[45]。高浓度的BHBA可以通过NF-κB信号通路诱导牛肝细胞炎性损伤,该通路可能被氧化应激激活。
4 小结与展望酮体分子BHBA作为机体能量替代物质,在碳水化合物供能不足情况下,如饥饿、长时间运动、能量限制等,为机体提供能量,是机体抵抗应激的重要代谢物。随着对机体代谢的深入研究,BHBA不仅是一种代谢物,还可以通过改变表观遗传修饰调控基因转录表达,还能够与细胞表面受体结合直接参与调节细胞某些重要的生物学过程,并通过改变乙酰辅酶A、琥珀酰辅酶A和NAD+等参与调节代谢的分子水平间接调节细胞过程[46-47]。BHBA促进组蛋白Kbhb和调节HDAC活性的能力以及由此产生的表观遗传基因调控尤其值得注意,因为它提示多种基因作为BHBA的调控靶点,与氧化应激、炎症反应、天然免疫等方面有着密切联系。代谢、炎症与免疫处于动态变化过程,互相影响、互为因果,通过表观遗传学角度利用高通量测序技术将三者有机联系起来做深入分析,是酮体作用机制研究的新方向。
BHBA作为信号分子,调控炎症反应,对抗抑郁、抗癫痫、抗肿瘤、缓解帕金森症等有一定效果[9, 48-50]。酮体本质是机体抵抗不良环境因素而进化产生抵抗应激的一种有效保护措施,但由于BHBA分子在血液中较稳定,不易分解,因此BHBA蓄积使血液pH降低,引起高酮血症、酮症酸中毒,严重时甚至危及生命[51-54]。这种影响对于围产期奶牛尤为明显。围产期奶牛受能量负平衡影响极易发生酮病,使奶牛免疫抑制[55],易发生多种炎症[56]。由于BHBA具有抑制炎症反应的作用,炎症是免疫反应的重要过程,炎症反应一旦受到抑制意味着机体免疫系统受到一定的抑制,增加病原微生物入侵概率,造成感染。为应对感染,机体的免疫系统执行清除异物任务又是耗能过程,这将进一步加重能量负平衡程度,一旦机体BHBA浓度显著上升,发展为酮病状态,会导致机体严重的炎症反应。如何控制围产期奶牛能量负平衡程度,有效利用BHBA抗氧化应激和抗炎作用,以减少奶牛发病率,平稳度过围产期,尚需要开展相关研究。因此,酮体作为破解代谢与免疫之间的密码值得深入研究,为未来药物开发、疾病防控提供新方向。
| [1] |
DUFFIELD T. Subclinical ketosis in lactating dairy cattle[J]. Vet Clin North Am Food Anim Pract, 2000, 16(2): 231-253. DOI:10.1016/S0749-0720(15)30103-1 |
| [2] |
GORDON J L, LEBLANC S J, DUFFIELD T F. Ketosis treatment in lactating dairy cattle[J]. Vet Clin North Am Food Anim Pract, 2013, 29(2): 433-445. DOI:10.1016/j.cvfa.2013.03.001 |
| [3] |
靳军阳, 闫磊, 薛永康, 等. 围产期奶牛的能量负平衡及能量代谢障碍病防治[J]. 湖北畜牧兽医, 2018, 39(12): 22-27. JIN J Y, YAN L, XUE Y K, et al. Negative energy balance and prevention of energy metabolism disorders in periparturient dairy cows[J]. Hubei Journal of Animal and Veterinary Sciences, 2018, 39(12): 22-27. DOI:10.16733/j.cnki.issn1007-273x.2018.12.008 (in Chinese) |
| [4] |
吴怡, 敖日格乐, 王纯洁, 等. 反刍动物围产期能量负平衡的调控研究进展[J]. 饲料研究, 2022, 45(2): 136-140. WU Y, AO R G, WANG C J, et al. Research progress on regulation of negative energy balance in ruminants during perinatal period[J]. Feed Research, 2022, 45(2): 136-140. DOI:10.13557/j.cnki.issn1002-2813.2022.02.029 (in Chinese) |
| [5] |
CAHILL G F. Fuel metabolism in starvation[J]. Annu Rev Nutr, 2006, 26: 1-22. DOI:10.1146/annurev.nutr.26.061505.111258 |
| [6] |
PUCHALSKA P, CRAWFORD P A. Multi-dimensional roles of ketone bodies in fuel metabolism, signaling, and therapeutics[J]. Cell Metab, 2017, 25(2): 262-284. DOI:10.1016/j.cmet.2016.12.022 |
| [7] |
OVERTON T R, MCART J A A, NYDAM D V. A 100-year review: metabolic health indicators and management of dairy cattle[J]. J Dairy Sci, 2017, 100(12): 10398-10417. DOI:10.3168/jds.2017-13054 |
| [8] |
NEWMAN J C, VERDIN E. Ketone bodies as signaling metabolites[J]. Trends Endocrinol Metab, 2014, 25(1): 42-52. DOI:10.1016/j.tem.2013.09.002 |
| [9] |
RAHMAN M, MUHAMMAD S, KHAN M A, et al. The β-hydroxybutyrate receptor HCA2 activates a neuroprotective subset of macrophages[J]. Nat Commun, 2014, 5: 3944. DOI:10.1038/ncomms4944 |
| [10] |
YOUM Y H, NGUYEN K Y, GRANT R W, et al. The ketone metabolite β-hydroxybutyrate blocks NLRP3 inflammasome-mediated inflammatory disease[J]. Nat Med, 2015, 21(3): 263-269. DOI:10.1038/nm.3804 |
| [11] |
XIE Z Y, ZHANG D, CHUNG D, et al. Metabolic regulation of gene expression by histone lysine β-hydroxybutyrylation[J]. Mol Cell, 2016, 62(2): 194-206. DOI:10.1016/j.molcel.2016.03.036 |
| [12] |
RUI L Y. Energy metabolism in the liver[J]. Compr Physiol, 2014, 4(1): 177-197. |
| [13] |
ZHAO S, ZHANG X R, LI H T. Beyond histone acetylation-writing and erasing histone acylations[J]. Curr Opin Struct Biol, 2018, 53: 169-177. DOI:10.1016/j.sbi.2018.10.001 |
| [14] |
MURPHY P, LIKHODⅡ S, NYLEN K, et al. The antidepressant properties of the ketogenic diet[J]. Biol Psychiatry, 2004, 56(12): 981-983. DOI:10.1016/j.biopsych.2004.09.019 |
| [15] |
CHEN L, MIAO Z G, XU X S. β-Hydroxybutyrate alleviates depressive behaviors in mice possibly by increasing the histone3-lysine9-β-hydroxybutyrylation[J]. Biochem Biophys Res Commun, 2017, 490(2): 117-122. DOI:10.1016/j.bbrc.2017.05.184 |
| [16] |
LUO W G, YU Y J, WANG H, et al. Up-regulation of MMP-2 by histone H3K9 β-hydroxybutyrylation to antagonize glomerulosclerosis in diabetic rat[J]. Acta Diabetol, 2020, 57(12): 1501-1529. DOI:10.1007/s00592-020-01552-2 |
| [17] |
ZHANG H F, TANG K, MA J W, et al. Ketogenesis-generated β-hydroxybutyrate is an epigenetic regulator of CD8+ T-cell memory development[J]. Nat Cell Biol, 2020, 22(1): 18-25. DOI:10.1038/s41556-019-0440-0 |
| [18] |
SANGALLI J R, NOCITI R P, DEL COLLADO M, et al. Characterization of histone lysine β-hydroxybutyrylation in bovine tissues, cells, and cumulus-oocyte complexes[J]. Mol Reprod Dev, 2022, 89(9): 375-398. DOI:10.1002/mrd.23630 |
| [19] |
KELLY R D W, CHANDRU A, WATSON P J, et al. Histone deacetylase (HDAC) 1 and 2 complexes regulate both histone acetylation and crotonylation in vivo[J]. Sci Rep, 2018, 8(1): 14690. DOI:10.1038/s41598-018-32927-9 |
| [20] |
SHIMAZU T, HIRSCHEY M D, NEWMAN J, et al. Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor[J]. Science, 2013, 339(6116): 211-214. DOI:10.1126/science.1227166 |
| [21] |
SABARI B R, ZHANG D, ALLIS C D, et al. Metabolic regulation of gene expression through histone acylations[J]. Nat Rev Mol Cell Biol, 2017, 18(2): 90-101. DOI:10.1038/nrm.2016.140 |
| [22] |
SANGALLI J R, SAMPAIO R V, DEL COLLADO M, et al. Metabolic gene expression and epigenetic effects of the ketone body β-hydroxybutyrate on H3K9ac in bovine cells, oocytes and embryos[J]. Sci Rep, 2018, 8(1): 13766. DOI:10.1038/s41598-018-31822-7 |
| [23] |
HU E L, DU H, SHANG S, et al. Beta-hydroxybutyrate enhances BDNF expression by increasing H3K4me3 and decreasing H2AK119ub in hippocampal neurons[J]. Front Neurosci, 2020, 14: 591177. DOI:10.3389/fnins.2020.591177 |
| [24] |
HU E L, DU H, ZHU X L, et al. Beta-hydroxybutyrate promotes the expression of BDNF in hippocampal neurons under adequate glucose supply[J]. Neuroscience, 2018, 386: 315-325. DOI:10.1016/j.neuroscience.2018.06.036 |
| [25] |
XU H W, WU M Y, MA X M, et al. Function and mechanism of novel histone posttranslational modifications in health and disease[J]. Biomed Res Int, 2021, 2021: 6635225. |
| [26] |
NASSER S, VIALICHKA V, BIESIEKIERSKA M, et al. Effects of ketogenic diet and ketone bodies on the cardiovascular system: concentration matters[J]. World J Diabetes, 2020, 11(12): 584-595. DOI:10.4239/wjd.v11.i12.584 |
| [27] |
MCGETTRICK A F, O'NEILL L A J. How metabolism generates signals during innate immunity and inflammation[J]. J Biol Chem, 2013, 288(32): 22893-22898. DOI:10.1074/jbc.R113.486464 |
| [28] |
陈华青, 刘明耀. G蛋白偶联受体及其信号转导在免疫与炎症中的作用[J]. 现代免疫学, 2009, 29(6): 441-446. CHEN H Q, LIU M Y. The role of G protein-coupled receptors and their signal transduction in immunity and inflammation[J]. Current Immunology, 2009, 29(6): 441-446. (in Chinese) |
| [29] |
NEWMAN J C, VERDIN E. β-Hydroxybutyrate: a signaling metabolite[J]. Annu Rev Nutr, 2017, 37: 51-76. DOI:10.1146/annurev-nutr-071816-064916 |
| [30] |
GRAFF E C, FANG H, WANDERS D, et al. Anti-inflammatory effects of the hydroxycarboxylic acid receptor 2[J]. Metabolism, 2016, 65(2): 102-113. DOI:10.1016/j.metabol.2015.10.001 |
| [31] |
FU S P, LI S N, WANG J F, et al. BHBA suppresses LPS-induced inflammation in BV-2 cells by inhibiting NF-κB activation[J]. Mediators Inflamm, 2014, 2014: 983401. |
| [32] |
GAMBHIR D, ANANTH S, VEERANAN-KARMEGAM R, et al. GPR109A as an anti-inflammatory receptor in retinal pigment epithelial cells and its relevance to diabetic retinopathy[J]. Invest Ophthalmol Vis Sci, 2012, 53(4): 2208-2217. DOI:10.1167/iovs.11-8447 |
| [33] |
VANHOLDER T, PAPEN J, BEMERS R, et al. Risk factors for subclinical and clinical ketosis and association with production parameters in dairy cows in the Netherlands[J]. J Dairy Sci, 2015, 98(2): 880-888. DOI:10.3168/jds.2014-8362 |
| [34] |
SHEN T Y, LI X W, LOOR J J, et al. Hepatic nuclear factor kappa B signaling pathway and NLR family pyrin domain containing 3 inflammasome is over-activated in ketotic dairy cows[J]. J Dairy Sci, 2019, 102(11): 10554-10563. DOI:10.3168/jds.2019-16706 |
| [35] |
CARRETTA M D, BARRÍA Y, BORQUEZ K, et al. β-Hydroxybutyrate and hydroxycarboxylic acid receptor 2 agonists activate the AKT, ERK and AMPK pathways, which are involved in bovine neutrophil chemotaxis[J]. Sci Rep, 2020, 10(1): 12491. DOI:10.1038/s41598-020-69500-2 |
| [36] |
MIELENZ M. Invited review: nutrient-sensing receptors for free fatty acids and hydroxycarboxylic acids in farm animals[J]. Animal, 2017, 11(6): 1008-1016. DOI:10.1017/S175173111600238X |
| [37] |
WEN H T, MIAO E A, TING J P Y. Mechanisms of NOD-like receptor-associated inflammasome activation[J]. Immunity, 2013, 39(3): 432-441. DOI:10.1016/j.immuni.2013.08.037 |
| [38] |
GOLDBERG E L, ASHER J L, MOLONY R D, et al. β-hydroxybutyrate deactivates neutrophil NLRP3 inflammasome to relieve gout flares[J]. Cell Rep, 2017, 18(9): 2077-2087. DOI:10.1016/j.celrep.2017.02.004 |
| [39] |
KONG G G, LIU J H, LI R, et al. Ketone metabolite β-hydroxybutyrate ameliorates inflammation after spinal cord injury by inhibiting the NLRP3 inflammasome[J]. Neurochem Res, 2021, 46(2): 213-229. DOI:10.1007/s11064-020-03156-2 |
| [40] |
YAMANASHI T, IWATA M, KAMIYA N, et al. Beta-hydroxybutyrate, an endogenic NLRP3 inflammasome inhibitor, attenuates stress-induced behavioral and inflammatory responses[J]. Sci Rep, 2017, 7(1): 7677. DOI:10.1038/s41598-017-08055-1 |
| [41] |
LUGRIN J, ROSENBLATT-VELIN N, PARAPANOV R, et al. The role of oxidative stress during inflammatory processes[J]. Biol Chem, 2014, 395(2): 203-230. DOI:10.1515/hsz-2013-0241 |
| [42] |
HACES M L, HERNÁNDEZ-FONSECA K, MEDINA-CAMPOS O N, et al. Antioxidant capacity contributes to protection of ketone bodies against oxidative damage induced during hypoglycemic conditions[J]. Exp Neurol, 2008, 211(1): 85-96. DOI:10.1016/j.expneurol.2007.12.029 |
| [43] |
DONG Z H, SUN X D, TANG Y, et al. β-hydroxybutyrate impairs monocyte function via the ROS-NLR family pyrin domain-containing three inflammasome (NLRP3) pathway in ketotic cows[J]. Front Vet Sci, 2022, 9: 925900. DOI:10.3389/fvets.2022.925900 |
| [44] |
GAO X X, ZHANG X, JIANG L Q, et al. Forsythin inhibits β-hydroxybutyrate-induced oxidative stress in bovine macrophages by regulating p38/ERK, PI3K/Akt, and Nrf2/HO-1 signaling pathways[J]. Res Vet Sci, 2023, 154: 59-65. DOI:10.1016/j.rvsc.2022.11.009 |
| [45] |
SHI X X, LI X W, LI D D, et al. β-Hydroxybutyrate activates the NF-κB signaling pathway to promote the expression of pro-inflammatory factors in calf hepatocytes[J]. Cell Physiol Biochem, 2014, 33(4): 920-932. DOI:10.1159/000358664 |
| [46] |
LONGO R, PERI C, CRICRÌ D, et al. Ketogenic diet: a new light shining on old but gold biochemistry[J]. Nutrients, 2019, 11(10): 2497. DOI:10.3390/nu11102497 |
| [47] |
庄一民, 刁其玉, 张乃锋. 幼龄反刍动物瘤胃上皮细胞β-羟基丁酸代谢与调控机制[J]. 畜牧兽医学报, 2020, 51(4): 660-669. ZHUANG Y M, DIAO Q Y, ZHANG N F. Metabolism and regulation mechanism of beta-hydroxybutyric acid in ruminal epithelium cells of young ruminants[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(4): 660-669. (in Chinese) |
| [48] |
NORWITZ N G, JARAMILLO J G, CLARKE K, et al. Ketotherapeutics for neurodegenerative diseases[J]. Int Rev Neurobiol, 2020, 155: 141-168. |
| [49] |
FU S P, WANG J F, XUE W J, et al. Anti-inflammatory effects of BHBA in both in vivo and in vitro Parkinson's disease models are mediated by GPR109A-dependent mechanisms[J]. J Neuroinflammation, 2015, 12: 9. DOI:10.1186/s12974-014-0230-3 |
| [50] |
SHIPPY D C, WILHELM C, VIHARKUMAR P A, et al. β-Hydroxybutyrate inhibits inflammasome activation to attenuate Alzheimer's disease pathology[J]. J Neuroinflammation, 2020, 17(1): 280. DOI:10.1186/s12974-020-01948-5 |
| [51] |
FRISE C J, MACKILLOP L, JOASH K, et al. Starvation ketoacidosis in pregnancy[J]. Eur J Obstet Gynecol Reprod Biol, 2013, 167(1): 1-7. DOI:10.1016/j.ejogrb.2012.10.005 |
| [52] |
WANKHADE P R, MANIMARAN A, KUMARESAN A, et al. Metabolic and immunological changes in transition dairy cows: a review[J]. Vet World, 2017, 10(11): 1367-1377. DOI:10.14202/vetworld.2017.1367-1377 |
| [53] |
STEENEVELD W, AMUTA P, VAN SOEST F J S, et al. Estimating the combined costs of clinical and subclinical ketosis in dairy cows[J]. PLoS One, 2020, 15(4): e0230448. DOI:10.1371/journal.pone.0230448 |
| [54] |
ALBAAJ A, JATTIOT M, MANCIAUX L, et al. Hyperketolactia occurrence before or after artificial insemination is associated with a decreased pregnancy per artificial insemination in dairy cows[J]. J Dairy Sci, 2019, 102(9): 8527-8536. DOI:10.3168/jds.2019-16477 |
| [55] |
ALERI J W, HINE B C, PYMAN M F, et al. Periparturient immunosuppression and strategies to improve dairy cow health during the periparturient period[J]. Res Vet Sci, 2016, 108: 8-17. DOI:10.1016/j.rvsc.2016.07.007 |
| [56] |
赵婉莉, 曹棋棋, 杨悦, 等. 胃肠道菌群与黏膜免疫在围产期奶牛健康中的作用[J]. 畜牧兽医学报, 2023, 54(7): 2751-2760. ZHAO W L, CAO Q Q, YANG Y, et al. The interaction between gastrointestinal microbiota and mucosal immunity in health of perinatal dairy cows[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(7): 2751-2760. (in Chinese) |
(编辑 白永平)



