2. 青岛农业大学动物科技学院, 青岛 266000
2. College of Animal Science and Technology, Qingdao Agricultural University, Qingdao 266000, China
近几年,乳制品行业经营中管理和营养等方面在不断变化[1],奶牛的生产效率逐步提高[2],牛奶产量不断增加[2]。然而,现代高产奶牛在产犊后需每天提供约40 L牛奶,这导致其出现代谢紊乱[3]和繁殖障碍[4]等问题。研究表明,产奶量与繁殖力之间存在着拮抗关系[5],高产奶牛的繁殖力不断下降[2-3, 6],妊娠率从55%下降到35%[7],这种下降与牛奶产量增加、奶牛生理和管理变化有关[7]。奶牛具备良好泌乳性能的先决条件是定期生产后代[8],因此,繁殖力低是现代乳制品行业关注的主要问题[9]。繁殖力不仅是影响奶牛平均产奶量[8, 10]、平均产奶天数[8, 10]、后代数量、世代间隔[8]和乳制品行业经济[8, 11]的主要因素,还与奶牛妊娠期间的健康密切相关[11]。其中,能量平衡是与繁殖性能关系最密切的营养指标[1]。能量平衡(energy balance,EB)是指维持和产奶的能量总和与所需摄入能量之间的差异[1, 5]。产后泌乳奶牛早期的能量状况是影响生殖性能的主要因素[2],EB水平可调节与卵巢功能相关的繁殖和代谢参数[12],EB不仅对卵泡发育、卵母细胞和胚胎质量以及奶牛产后首次排卵时间有影响[6],哺乳期EB还与妊娠率呈正相关[5]。
奶牛健康和繁殖最关键的时期是围产期[13]和哺乳期[3],在此期间,产奶量快速增长[4],代谢和营养需求迅速增加[14]。然而,当奶牛无法通过消耗足够的饲料来满足生产牛奶的能量需求[15-16],产奶和维持的能量需求超过能量摄入时[15-17],奶牛就会发生能量负平衡(negative energy balance,NEB)[3-4, 12, 18-21]。NEB是奶牛泌乳早期的一种生理现象[16],更易发生于高产奶牛[15-16, 22],会影响奶牛的健康、产奶效率和奶质量[23-24]。NEB与繁殖力之间的相互作用已被充分证实[14, 17, 25],其会导致奶牛繁殖力下降[14, 17, 22, 24, 26-27]以及泌乳性能受损[16]。此外,NEB的程度和持续时间因奶牛的遗传价值、产犊前身体状况、产奶量、采食量和饮食而异[13, 28],是奶牛产后卵巢周期恢复正常的重要决定因素[29-30]。探究NEB导致繁殖力下降的机制[23]以及参与NEB发生的遗传基础[16],并提出有效的解决方法[31],可以促进奶牛的健康并加快其产后排卵的恢复[31],降低泌乳早期NEB的强度和持续时间[6, 10],提高奶牛繁殖力[16]。因此,本文总结了NEB导致奶牛繁殖力下降的内分泌机制和代谢机制,旨在为提出缓解NEB的有效方法提供参考。
1 能量负平衡对繁殖力的影响NEB不仅会导致奶牛代谢紊乱[16-17]、繁殖性能变差[4, 13, 16]、生育能力受损[13, 17, 32-33],还会导致产后卵巢周期紊乱[16, 34]、功能受损[5, 9]以及卵巢活动恢复延迟[16, 32]。其中,产后卵巢活动恢复延迟是奶牛产后再次受精的主要障碍[31]。此外,NEB还会导致奶牛出现发情障碍[9]、发情周期延长[5, 10, 13, 31-32]、产后早期排卵延迟[27, 31, 35-37]以及奶牛免疫功能降低[5, 24-25, 33]等问题。奶牛产后首次排卵发生在能量平衡最低点之后几天,因此,到能量平衡最低点所需的时间越长,产后首次排卵的延迟时间就越长[2]。产后首次排卵的间隔时间不仅与开始恢复EB的时间有关[34],还与繁殖后期的受孕率相关[6]。研究表明,卵母细胞和胚胎的质量[8]以及受孕率、早期胚胎死亡率是影响高产奶牛繁殖机制的主要因素[5, 9],提高卵母细胞和胚胎质量对于解决高产奶牛的低生育力问题至关重要[8]。然而,NEB会损害卵母细胞、胚胎的发育[38]和质量[9, 32]以及卵泡发育[32],导致胚胎存活率[5, 10, 16, 32]和受孕率降低[16, 31-32]。此外,NEB还会改变输卵管和子宫对胚胎发育的支持,降低早期胚胎的发育能力及其成功触发母体识别的能力,对母体妊娠的维持产生负面影响[32]。
高产奶牛通过动员脂肪和肌肉来支持泌乳早期的产奶量,然而这会导致身体状况较差,严重的NEB通过多种机制降低奶牛的生育能力[13]。其中,NEB会引起奶牛体内激素和代谢物浓度的改变[32],这影响了奶牛的繁殖力[13, 29]。研究表明,奶牛通过动员脂肪组织和骨骼肌蛋白中脂质来缓解NEB,这个过程是通过内分泌和代谢适应来实现的[29],初产奶牛的代谢和内分泌状况更不平衡,其NEB恢复难度更大[34]。营养状况在调节参与繁殖过程的许多内分泌激素和代谢物的浓度以及卵泡发育方面起着至关重要的作用,在产犊后泌乳开始时NEB期间尤其明显[3, 32]。NEB奶牛的内分泌、代谢和生理状态都发生了显著变化[9, 33],这些途径的破坏在很大程度上损害了奶牛的生育能力[31]。此外,用于评估奶牛能量平衡的参数并不是单一的,不能单独使用,并且代谢物还会通过与控制卵巢功能和繁殖过程的内分泌激素相互作用来影响奶牛的繁殖力[30, 39],其中,瘦素的血浆浓度与血浆胰岛素和葡萄糖的浓度呈正相关,与生长激素和非酯化脂肪酸的血浆浓度呈负相关[10]。
2 能量负平衡导致繁殖力下降的内分泌机制妊娠的建立和维持依赖于母体下丘脑-垂体-性腺轴之间的相互作用[31],动物能量状态的生理途径是复杂的[5, 40],包括特定的营养物质和底物以及代谢物[5, 40],营养控制的激素水平在繁殖过程中起主要作用[41]。在生产系统中,生殖轴能量平衡状态的主要内分泌信号是生长激素(growth hormone,GH)-胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)系统、胰岛素(insulin)和瘦素(leptin)等[30, 34, 42]。这些激素集体作用于卵巢促进卵泡发育和排卵[15],对类固醇生成、卵母细胞成熟和早期胚胎发育有直接影响[5, 40],是能量平衡影响奶牛生育能力的重要介质[5, 10, 42](图 1)。每种激素也可以直接通过卵巢上各自的激素受体起作用,因此,哺乳期通过涉及GH、IGF-1和胰岛素的激素连接与生殖事件相关联[15]。Cavestany等[42]研究表明,产犊前3周补充能量能够增加产奶量,并对卵巢活动的重新开始产生积极影响,这与产前更好的EB、较高的IGF-1、瘦素和胰岛素水平以及产后早期较高的胰岛素水平相一致[42]。
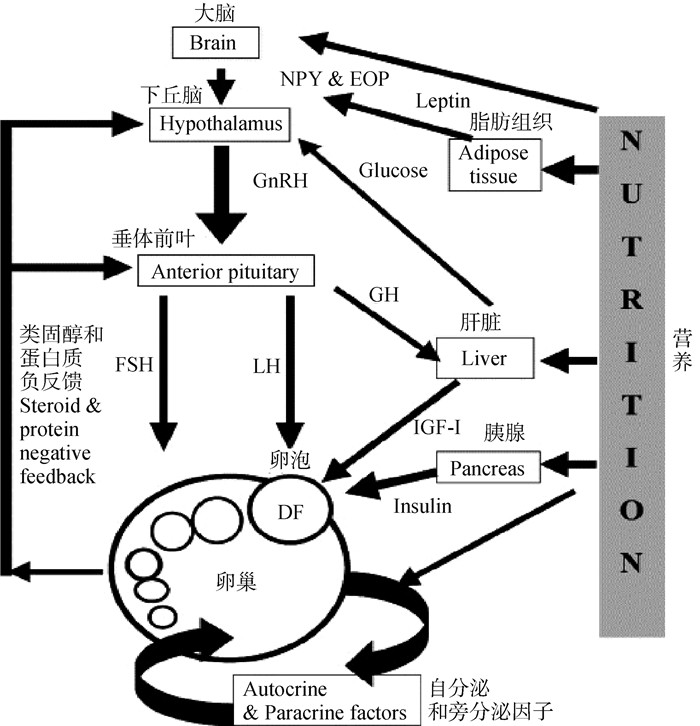
|
图 1 营养影响卵巢卵泡功能的内分泌机制[10] Fig. 1 Endocrine mechanisms by which nutrition affects ovarian follicular function[10] |
研究表明,产后早期NEB与下丘脑-垂体-卵巢-子宫轴之间存在相互作用[8],阻碍了卵泡的发育过程[8],并且NEB会干扰内分泌稳态[43],内分泌紊乱导致产后卵巢周期性恢复延迟,是导致奶牛繁殖力下降的主要因素[3, 8, 14]。其中,NEB主要影响内分泌激素促黄体生成素(luteinizing hormone,LH)、GH、胰岛素和IGF-1以及瘦素的水平,这些内分泌机制直接通过影响卵巢对促性腺激素的敏感性或间接通过降低LH浓度和脉冲性抑制高产奶牛卵泡的生长[8]。NEB通过抑制LH脉冲频率以及降低胰岛素和IGF-1浓度延迟奶牛产后首次排卵的时间并抑制了优势卵泡产生雌激素[28]。奶牛卵泡生长在卵巢水平上取决于这些激素水平,然而,每种激素的独立贡献很难确定,当营养得到改善时,每种激素都会发生协调变化[15]。
2.1 能量负平衡影响促黄体生成素的机制奶牛的生殖事件主要由促性腺激素(促黄体生成素和促卵泡素)控制[15, 44]。促黄体生成素的内分泌调节机制复杂,随着奶牛的营养和生理状况而变化[10]。LH和IGF-1协同作用以促进卵泡发育[33],在黄体酮升高(周期性动物的黄体期)的情况下,LH脉冲频率保持在每4 h一个脉冲,显性卵泡经历闭锁;在卵泡期(周期性动物的排卵前期),LH脉冲频率增加到每1 h一个脉冲,这刺激了卵泡最终成熟[35]。产后早期LH脉冲频率的增加刺激了卵泡分泌雌激素,对于排卵前卵泡生长、雌二醇分泌和优势卵泡排卵是必要的[10, 28],并且在很大程度上决定了卵巢周期性恢复[35]。在自发性黄体水解过程中,随着黄体酮浓度下降、LH脉冲频率增加、促性腺激素释放激素脉冲分泌频率增加[10]以及雌二醇浓度增加,从而诱发排卵[10, 35]。LH脉冲频率与发情期[10]和产后优势卵泡排卵[35]密切相关[10],是排卵延迟的主要原因[28]。此外,排卵前LH激增是恢复减数分裂所必需的关键信号,并且能够引起颗粒细胞产生类固醇,从主要是雌激素的一种环境转变为一种产生孕激素的环境,LH的分泌和排卵前LH激增确保了卵母细胞的发育能力[8]。
研究表明,NEB所影响的激素和代谢环境与LH脉冲的长期抑制有关[35],会降低LH脉冲频率[8, 10, 28, 31]和卵巢对LH刺激的反应性[6, 28, 33]、抑制LH分泌[28, 32]并导致雌二醇浓度降低以及发情较差[6, 33],损害卵泡发育、卵泡细胞功能和卵母细胞发育能力[31],最终导致排卵延迟[8, 28, 33]。NEB奶牛的优势卵泡必须更大才能建立起能够触发排卵的血液雌二醇浓度,因此延迟了排卵[6]。其中,LH峰缺失会导致无排卵[3]。研究表明,NEB会导致卵泡生长速度降低并且变小[6],而在NEB最低点之后出现的卵泡比之前直径更大[6, 10, 28],具有更快的生长速度[10],以及雌二醇分泌增多[6],促进了排卵[6, 10, 28]。此外,NEB虽然不影响中小型卵泡的数量,但会影响优势卵泡的大小和排卵[10]。
2.2 能量负平衡影响生长激素的机制奶牛的营养状况是影响卵泡生长、成熟和排卵能力的重要因素,其主要是通过影响下丘脑促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)和垂体促性腺激素的分泌直接介导或间接通过生长轴介导[10]。生长激素(GH)是一种调控奶牛泌乳的垂体激素[15]。生长激素能够通过增强促性腺激素受体功能来增强促性腺激素的作用[15, 45]。研究表明,外源性GH通过引起代谢反应,能够获得更高的牛奶产量,奶牛的高产奶量与GH浓度呈正相关[2]。哺乳期开始与GH增加有关,GH促进营养物质分配,主要在肝脏和脂肪中,从而支持产奶[15],并且GH和IGF-1协同调节奶牛的哺乳期[15]。此外,奶牛产后恢复排卵是一个协调过程,包括肝脏中GH和IGF-1轴重新偶联、卵泡发育和类固醇生成增加以及下丘脑中雌二醇负反馈消除[31]。
然而,在NEB期间,由于肝脏生长激素受体下调,GH-IGF轴解偶联,这与IGF-1浓度降低和GH浓度升高有关[46]。奶牛在产后的前4~8周内经历一段时间的NEB,在此期间,由生长激素、生长激素受体和IGF-1组成的生长轴功能异常,在循环中存在GH水平升高和IGF-1水平降低的现象[15],并且这些激素浓度的变化与高产奶牛分娩后排卵延迟有关[2, 47]。NEB会改变GH-IGF轴的适应性,这会降低循环IGF-1的生物利用度,是EB状态对生殖功能的关键介质[13]。此外,NEB通过对输卵管和子宫环境的作用延迟第一次排卵的时间并降低受孕率以及降低奶牛产后子宫恢复的能力[13]。
2.3 能量负平衡影响胰岛素的机制胰岛素介导营养状况对子宫和胚胎的影响,以及对卵巢卵泡发育和排卵的影响[47],胰岛素影响着奶牛产后卵巢周期性恢复[39, 42],在产后到第一次排卵的间隔中起着重要调节作用[10, 28, 45]。胰岛素不仅直接作用于卵巢,增加卵巢对LH和FSH的敏感性[15, 47],还对卵巢细胞有直接影响[5, 47],包括刺激颗粒细胞增殖[5, 22]、黄体细胞分泌黄体酮[5]以及生成孕酮、雌二醇[22]、卵泡膜细胞中的雄激素[22]。在泌乳早期,增加胰岛素浓度不仅可以促进产后排卵[45],增加在此期间排卵奶牛的比例[39],还能够促进优势卵泡的分化和成熟,从而增加优势卵泡在LH激增时排卵的机会[30, 42]。Webb等[45]研究表明,将胰岛素输注到母牛体内会扩张优势卵泡的直径和提高能量不足母牛的排卵率[45]。Omari等[3]研究表明,通过增加胰岛素进行良好的饲养管理,可降低发情周期紊乱的发生率[3]。胰岛素作为影响垂体前叶LH释放的代谢信号,在调节卵巢对促性腺激素的反应中起作用[10],其刺激卵巢黄体酮和雌二醇的产生[42]。胰岛素还促进卵泡对促性腺激素的反应[8],从而促进卵泡生长[8, 28, 34, 42, 45],对卵母细胞的发育也有直接刺激作用[8]。此外,胰岛素抵抗减少了具有胰岛素依赖性葡萄糖转运蛋白的组织对葡萄糖的摄取,从而保存了用于牛奶合成的葡萄糖[47]。胰岛素作为介导营养摄入急性变化的物质[45],在能量代谢稳态的控制中起着核心作用,其浓度与能量摄入呈正相关[34, 42]。
研究表明,奶牛生育能力下降与产后NEB以及胰岛素浓度降低有关[28, 45]。NEB会降低胰岛素浓度[8, 10, 28],这抑制了肝脏生长激素受体和胰岛素生长因子的分泌,导致生长轴功能障碍[15, 33]。NEB期间,血液中低浓度的胰岛素会对生殖产生负面影响,不仅会导致胰岛素无法与促性腺激素协同作用于卵巢细胞[48],降低卵巢对促性腺激素的反应[15],阻止显性卵泡排卵[48],导致发情周期不规律[3, 39, 45],还会影响类固醇的生成和卵泡的大小[42],这延迟了卵巢周期性恢复[33, 42]。此外,胰岛素浓度低减少了雄激素和雌二醇的产生,从而损害了卵泡获得LH受体的能力,导致卵泡发育受阻[10]。
2.4 能量负平衡影响胰岛素生长因子的机制IGF-1响应于生长激素从肝脏释放,调控着奶牛的生长和哺乳期[15]。IGF-1不仅能够增加LH结合位点的数量以增强LH刺激雄烯二酮和黄体酮产生的能力,还能增强卵泡细胞对LH的反应性,并促进卵泡分泌雌二醇,这是排卵发生的先决条件[10],血浆雌二醇浓度与IGF-1水平高度相关[28]。营养引起的全身IGF-1浓度变化与卵巢活性有关[45],营养作用部分通过IGF-1介导,对产后奶牛恢复排卵产生影响[10]。血浆中较高的IGF-1浓度能够促进哺乳前期早期排卵的恢复[5, 34],并且产后早期IGF-1浓度与受孕率相关[5]。奶牛血清中的IGF-1浓度对卵泡发育至关重要[8, 28]。产后快速恢复排卵的奶牛和未排卵的奶牛相比,IGF-1水平高出40%~50%[28]。IGF-1浓度的增加增强了细胞发育和颗粒细胞增殖的能力,这表明IGF-1直接影响垂体和下丘脑功能[10]。研究表明,IGF-1直接刺激卵母细胞成熟、促进胚胎发育以及提高胚胎质量[8],奶牛血液中IGF-1浓度不仅与胚胎存活之间呈正相关[8],还与身体状况、营养摄入[10]以及能量状态呈正相关[5, 8, 28],因此,IGF-1是营养调控生育能力的潜在激素介质[5]。此外,调节激素生物活性的IGF-1结合蛋白也会随能量平衡的改变而发生变化[8]。
奶牛发生NEB时,会导致血液中IGF-1浓度降低[13, 22, 42],低浓度的IGF-1不仅会影响卵巢功能和早期胚胎发育[13]、延迟产犊后的子宫修复[10, 13],还会导致母牛生育能力下降[13]并损害犊牛的生长[32]。NEB早期,卵泡产生足够的雌二醇进行排卵的能力取决于血清中胰岛素和IGF-1的浓度以及不断变化的能量平衡谱[28],并且NEB奶牛恢复排卵由IGF-1的分泌介导,围产期IGF-1的循环浓度是NEB奶牛在分娩后恢复周期性能力的良好指标[34]。NEB影响卵泡发育的生理机制与IGF-1有关,IGF-1会改变卵泡对促性腺激素的敏感性和卵母细胞质量,并与子宫容受性和胚胎着床有关[6]。NEB还改变了输卵管和子宫内膜的IGF系统[6],低浓度的IGF-1对卵泡和胚胎发育有害[8],也导致子宫内的微环境较差[8],使子宫无法维持早期胚胎存活[8],影响了子宫容受性和胚胎着床[6],这是NEB高产奶牛受孕率[8]和生育能力[6]低以及早期胚胎死亡率高的原因之一[8]。此外,NEB还导致IGF结合蛋白(IGF-binding proteins,IGFBPs)的循环浓度降低[10]。由于IGFBPs运输并增加胰岛素样生长因子(insulin-like growth factors,IGFs)的半衰期,NEB引起低浓度的IGFBPs将限制IGFs作用于卵泡中的靶细胞,从而限制IGFs与垂体促性腺激素协同作用以刺激细胞增殖和类固醇生成[10]。
2.5 能量负平衡影响瘦素的机制瘦素是另一种与能量平衡相关的激素,瘦素的循环浓度与身体状况评分密切相关[46]。瘦素是食欲中心的共同调节因子[43],其参与EB的调节,表示体内白色脂肪组织沉积物的数量[42],瘦素浓度随体重和体脂百分比的变化而变化[34]。瘦素主要由白色脂肪组织分泌,作为下丘脑区域的能量储备信号,控制新陈代谢和内分泌功能,以维持能量稳态[34]。当瘦素增加到临界阈值0.250~0.312 nmol ·L-1以上时,瘦素在下丘脑-垂体轴的激活和随后的卵巢活动恢复中发挥着作用[34]。瘦素水平较高能够缩短奶牛产后至第一次排卵的间隔[34]。瘦素作为奶牛繁殖能力的主要调节剂,通过调节采食量和卵巢中的局部效应来调节卵泡大小和卵母细胞质量[42],瘦素是高产奶牛能量状态和卵母细胞质量之间联系的关键因素[8]。研究表明,瘦素在体外卵母细胞成熟过程中刺激减数分裂进程,其对成熟卵母细胞周围的卵丘细胞有抗凋亡作用,并且能够增强卵母细胞和胚胎的发育能力,从而帮助发育出更多更好的优质囊胚[8]。生殖性能较好的奶牛具有较高浓度的瘦素和IGF-1[34],这表明IGF-1和瘦素是NEB奶牛生殖轴的主要内分泌信号[34]。
在围产期,奶牛通常处于严重的NEB状态,血液中矿物质、维生素[49]和营养素的浓度会降低[47]。研究表明,瘦素浓度随体重和体脂百分比的变化而变化,奶牛在泌乳早期会失去超过60%的体脂,瘦素浓度也有所降低[34]。产后瘦素浓度降低部分是由于NEB,因为产后未泌乳的奶牛中血浆瘦素浓度仍然很高[34]。NEB时奶牛体内瘦素的减少与产后周期性恢复延迟以及第一次发情间隔延长有关[34, 42],并且从分娩到第一次排卵的间隔与从分娩到瘦素最低点的间隔相关[34]。瘦素的循环浓度在妊娠晚期下降,即使能量平衡有所改善,产后瘦素浓度仍然很低[46]。此外,瘦素影响采食量,这也导致围产期奶牛出现外周胰岛素抵抗[46],瘦素的血浆浓度与胰岛素的血浆浓度呈正相关[50]。
3 能量负平衡导致繁殖力下降的代谢机制奶牛体内细胞能量代谢稳态的调控是必要的,以适应分娩和泌乳[51],然而,奶牛泌乳早期极易发生NEB,会导致奶牛代谢紊乱[18, 52],并损害高产奶牛的健康和生育能力[18]。泌乳早期血浆中代谢物非酯化脂肪酸(nonesterifiedfatty acid,NEFA)和β-羟基丁酸(β-hydroxybutyrate,BHBA)的浓度与能量平衡之间密切相关[5]。高产奶牛NEB导致繁殖力下降与代谢物浓度的变化有关,代谢物的水平能够直接或间接地改变卵泡功能,导致排卵延迟[2]。NEB会导致代谢物BHBA和NEFA的循环水平增加[8, 34, 53]。此外,高产奶牛排卵延迟与NEB导致血浆代谢激素葡萄糖浓度低有关[2, 47](图 2),葡萄糖作为营养物质对生殖有重要影响,其低水平会导致促性腺激素FSH和LH浓度降低[50]。
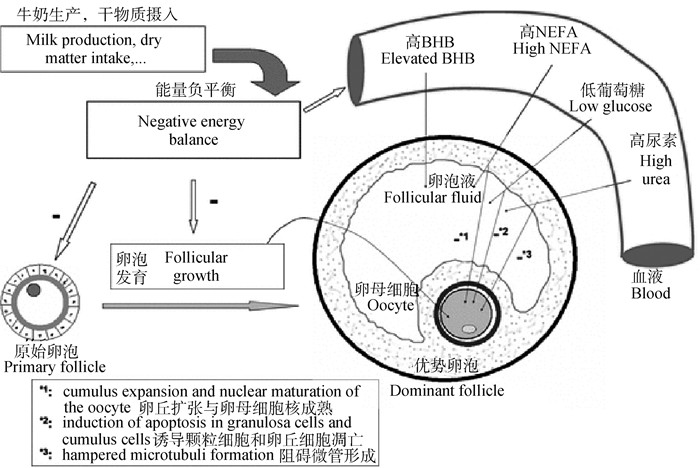
|
图 2 能量负平衡影响繁殖力的代谢机制[8] Fig. 2 Metabolic mechanisms by which negative energy balance affects fecundity[8] |
泌乳初期的奶牛通常不能通过喂养来满足其能量需求,因此奶牛会调动体内脂肪,从而产生酮体,包括β-羟基丁酸(BHBA)等[37]。酮体是一种小分子物质,主要由肝脏在禁食、长时间运动和限制碳水化合物时通过血液循环的脂肪合成[54-55],肝脏释放的酮体能够充当大脑和心脏等组织的替代燃料来源[51]。BHBA是奶牛体内最主要[56-59]、最丰富[54]的酮体,积聚在卵泡液中,其不仅是能量的被动载体,还具有多种信号功能[54]。奶牛饲喂高能量日粮或低能量日粮,其BHBA的浓度有所不同[59]。此外,脂肪组织中的可用脂肪是能量代谢的主要来源,在营养不足时,奶牛脂肪代谢的增加和全身对这种情况的适应可以通过血液BHBA浓度来监测[59]。研究表明,BHBA与哺乳早期EB之间的关联已经确立,并且反映了身体储备的增强和营养物质对牛奶生产的分配[5]。
NEB奶牛利用体内脂肪来满足产奶的能量需求,然而如果过量,从体内脂肪中释放的NEFA会抑制肝脏使用脂肪酸作为燃料的能力,被转化为酮体,如丙酮、乙酰乙酸和BHBA[49, 58]。血液中一定浓度的BHBA是泌乳早期对NEB正常适应的一部分[51],然而,NEB期间BHBA的浓度明显升高[27, 51, 54],表明脂质动员和脂肪酸氧化,过多的脂质动员与代谢和生殖障碍有关[11]。NEB会导致血液中酮体BHBA浓度增加[60],高浓度的BHBA会干扰卵泡和子宫微环境[54],导致发情持续时间变短,从产后到开始第一次发情的时间间隔较长[54],随着NEB的严重程度以及BHBA浓度的增加,奶牛的生育能力会受损[6, 54]。此外,奶牛NEB易引发酮症等代谢紊乱[58, 60],酮症会导致血液和牛奶中BHBA浓度升高[61-62]。酮症通常发生在泌乳早期[60],酮症奶牛会食欲不振,这会进一步加剧NEB[49]。产后血液中BHBA升高可直接损害卵母细胞质量、颗粒细胞活力和随后的胚胎质量[54]以及奶牛健康[51],导致产奶量减少,影响生殖[6, 51],导致产后奶牛的生育能力下降[51, 54]。
3.2 能量负平衡影响非酯化脂肪酸的机制脂肪酸(fatty acid,FA)是具有不同长度和饱和度脂肪链的羧酸,是所有活细胞的基本成分,其作为生物膜、细胞信号传导(类固醇激素和前列腺素)和能量底物(例如二酰基或三酰基甘油)的组分具有重要作用[63]。在营养不足期间,通过激素敏感性脂肪酶的作用,脂肪组织储存的脂质中FA脱酯化,导致血液循环中NEFA暂时升高,以应对身体的能量需求[63],NEFA介导许多不良代谢作用[64]。NEFA是运输储存在脂肪组织中的甘油三酯(triacylglycerol,TG)到其利用部位的载体[64]。NEFA从脂肪组织释放到血液中,与血浆白蛋白结合在血液中循环,NEFA被肝脏和心肌等组织利用,血浆NEFA是以脂肪与蛋白质复合物形式产生肝脂质的主要底物[64]。此外,NEFA周转迅速,在血浆中半衰期约为2~4 min,NEFA周转是TG分泌和血浆TG浓度的决定因素[64]。
严重和不受调节的脂肪分解是各种代谢性疾病的标志,如NEB等,NEB导致奶牛体液中NEFA水平持续升高[63]。奶牛产犊后易发生NEB,为了补偿NEB并保持高产奶量,奶牛动员体内大量脂肪[9],主要以非酯化脂肪酸(NEFA)的形式,作为能量来源释放到血液中[16, 56-57],增加了脂肪酸的循环浓度[52, 57-58],脂肪酸是牛奶生产的重要能量底物[59]。然而,这会导致NEFA水平升高[30],对卵母细胞质量和奶牛的免疫反应产生不利影响,血浆NEFA浓度>0.6 mmol ·L-1通常用作判断奶牛NEB的指标[56],NEFA浓度升高还会增加酮症的风险[54]。血浆NEFA的浓度与NEB程度呈正相关[14],其是神经中枢提供饮食状态的潜在信号[8]。高浓度的NEFA是NEB导致优质奶牛生育能力下降的机制之一,其不仅影响卵巢功能[58],还会抑制细胞成熟,导致卵母细胞质量、受精率、卵裂率和囊胚率降低[8],损害了母牛的生产性能和犊牛的生长[33]。此外,在代谢谱中显示,参与脂质代谢和胆固醇转运的基因在NEB奶牛中表达更高,然而,在NEB奶牛中涉及细胞分裂(BIRC5、CCNB1、CCNE2、CDC20、SKA2、UBE2C、ZWINT)和DNA修复(POLE2、UNG)方面的基因表达水平较低[64]。其中,BIRC5编码Survivin蛋白,Survivin蛋白作为细胞凋亡的抑制剂,对细胞分裂起着至关重要的作用[65]。在NEB奶牛中表达较低的基因还包括11个编码组蛋白的基因,组蛋白是染色质中将DNA包装成核糖体的主要蛋白质,其通过乙酰化、甲基化和磷酸化的翻译后修饰在调控基因转录中起着核心作用[64]。在产后早期,NEB奶牛经历代谢失衡会对免疫系统提出更高的要求,参与免疫反应的关键基因也会上调表达(DEFB13、HP、OAS1、PTX3、TLR4)[64]。
4 展望NEB通过影响奶牛的内分泌和代谢导致奶牛的繁殖力下降,从而影响生产效率,因此,探究NEB导致奶牛繁殖力下降的机制并提出缓解NEB的方法已成为研究热点。与大量关于内分泌紊乱的研究不同,NEB的典型代谢参数目前研究还较少,并且生殖内分泌轴和代谢内分泌轴之间的相互作用和关系目前尚未很好地界定。代谢物β-羟基丁酸酯和非酯化脂肪酸已有较多研究,以及脂肪因子在围产期脂肪动员中的作用机制也得到了很好的描述,但目前对肌因子的影响知之甚少。纤连蛋白Ⅲ型含结构域蛋白是最近发现的肌因子和脂肪因子,在代谢功能障碍中发挥作用。此外,通过检测血液NEFA浓度来识别NEB需费时费力的采样,最近已从牛奶样本中预测出血液NEFA浓度,这表明牛奶代谢物可用作评估NEB和代谢状态的指标。目前,已开发出一种使用牛奶中红外光谱来预测血浆NEFA浓度的模型。
乳制品行业面临的主要挑战之一是设计饲养方案,以改善采食,促进早期泌乳牛的代谢健康,最大限度地减少奶牛产后NEB的程度和持续时间。最近已有研究表明,β-1, 3-葡聚糖有助于改善过渡期奶牛由NEB引发的脂肪代谢紊乱,以及瘤胃保护性葡萄糖也在缓解奶牛NEB方面发挥着重要作用。此外,糖原饮食对生育有益,其能够促进正常内分泌信号的恢复,促进卵巢活动开始。为了避免未来乳制品生产中的这些问题,采取综合方法,选择更健壮的奶牛并终生改善营养管理,并且随着更好的自动化监控系统的开发,在未来变得更加可行。
| [1] |
GRUMMER R R, WILTBANK M C, FRICKE P M, et al. Management of dry and transition cows to improve energy balance and reproduction[J]. J Reprod Dev, 2010, 56 Suppl: S22-S28. |
| [2] |
GUTIERREZ C G, GONG J G, BRAMLEY T A, et al. Selection on predicted breeding value for milk production delays ovulation independently of changes in follicular development, milk production and body weight[J]. Anim Reprod Sci, 2006, 95(3-4): 193-205. DOI:10.1016/j.anireprosci.2005.09.015 |
| [3] |
OMARI M, LANGE A, PLÖNTZKE J, et al. Model-based exploration of the impact of glucose metabolism on the estrous cycle dynamics in dairy cows[J]. Biol Direct, 2020, 15(1): 2. DOI:10.1186/s13062-019-0256-7 |
| [4] |
NTALLARIS T, HUMBLOT P, BÅGE R, et al. Effect of energy balance profiles on metabolic and reproductive response in Holstein and Swedish Red cows[J]. Theriogenology, 2017, 90: 276-283. DOI:10.1016/j.theriogenology.2016.12.012 |
| [5] |
PATTON J, KENNY D A, MCNAMARA S, et al. Relationships among milk production, energy balance, plasma analytes, and reproduction in Holstein-Friesian cows[J]. J Dairy Sci, 2007, 90(2): 649-658. DOI:10.3168/jds.S0022-0302(07)71547-3 |
| [6] |
ROCHE J R, BURKE C R, CROOKENDEN M A, et al. Fertility and the transition dairy cow[J]. Reprod Fertil Dev, 2017, 30(1): 85-100. |
| [7] |
BECKER C A, COLLIER R J, STONE A E. Invited review: physiological and behavioral effects of heat stress in dairy cows[J]. J Dairy Sci, 2020, 103(8): 6751-6770. DOI:10.3168/jds.2019-17929 |
| [8] |
LEROY J L M R, OPSOMER G, VAN SOOM A, et al. Reduced fertility in high-yielding dairy cows: are the oocyte and embryo in danger?Part Ⅰ.The importance of negative energy balance and altered corpus luteum function to the reduction of oocyte and embryo quality in high-yielding dairy cows[J]. Reprod Domest Anim, 2008, 43(5): 612-622. DOI:10.1111/j.1439-0531.2007.00960.x |
| [9] |
LEROY J L M R, VANHOLDER T, OPSOMER G, et al. The in vitro development of bovine oocytes after maturation in glucose and β-hydroxybutyrate concentrations associated with negative energy balance in dairy cows[J]. Reprod Domest Anim, 2006, 41(2): 119-123. DOI:10.1111/j.1439-0531.2006.00650.x |
| [10] |
DISKIN M G, MACKEY D R, ROCHE J F, et al. Effects of nutrition and metabolic status on circulating hormones and ovarian follicle development in cattle[J]. Anim Reprod Sci, 2003, 78(3-4): 345-370. DOI:10.1016/S0378-4320(03)00099-X |
| [11] |
WATHES D C, CHENG Z R, CHOWDHURY W, et al. Negative energy balance alters global gene expression and immune responses in the uterus of postpartum dairy cows[J]. Physiol Genomics, 2009, 39(1): 1-13. DOI:10.1152/physiolgenomics.00064.2009 |
| [12] |
MELLOUK N, RAME C, NAQUIN D, et al. Impact of the severity of negative energy balance on gene expression in the subcutaneous adipose tissue of periparturient primiparous Holstein dairy cows: Identification of potential novel metabolic signals for the reproductive system[J]. PLoS One, 2019, 14(9): e0222954. DOI:10.1371/journal.pone.0222954 |
| [13] |
WATHES D C, FENWICK M, CHENG Z, et al. Influence of negative energy balance on cyclicity and fertility in the high producing dairy cow[J]. Theriogenology, 2007, 68 Suppl 1: S232-S241. |
| [14] |
CARDOSO F C, KALSCHEUR K F, DRACKLEY J K. Symposium review: nutrition strategies for improved health, production, and fertility during the transition period[J]. J Dairy Sci, 2020, 103(6): 5684-5693. DOI:10.3168/jds.2019-17271 |
| [15] |
LUCY M C. Functional differences in the growth hormone and insulin-like growth factor axis in cattle and pigs: implications for post-partum nutrition and reproduction[J]. Reprod Domest Anim, 2008, 43(Suppl 2): 31-39. |
| [16] |
MOZDURI Z, BAKHTIARIZADEH M R, SALEHI A. Integrated regulatory network reveals novel candidate regulators in the development of negative energy balance in cattle[J]. Animal, 2018, 12(6): 1196-1207. DOI:10.1017/S1751731117003524 |
| [17] |
CHURAKOV M, KARLSSON J, EDVARDSSON RASMUSSEN A, et al. Milk fatty acids as indicators of negative energy balance of dairy cows in early lactation[J]. Animal, 2021, 15(7): 100253. DOI:10.1016/j.animal.2021.100253 |
| [18] |
XU W, VERVOORT J, SACCENTI E, et al. Relationship between energy balance and metabolic profiles in plasma and milk of dairy cows in early lactation[J]. J Dairy Sci, 2020, 103(5): 4795-4805. DOI:10.3168/jds.2019-17777 |
| [19] |
MENTA P R, FERNANDES L, POIT D, et al. Association of blood calcium concentration in the first 3 days after parturition and energy balance metabolites at day 3 in milk with disease and production outcomes in multiparous Jersey cows[J]. J Dairy Sci, 2021, 104(5): 5854-5866. DOI:10.3168/jds.2020-19189 |
| [20] |
BECKER V A E, STAMER E, SPIEKERS H, et al. Residual energy intake, energy balance, and liability to diseases: Genetic parameters and relationships in German Holstein dairy cows[J]. J Dairy Sci, 2021, 104(10): 10970-10978. DOI:10.3168/jds.2021-20382 |
| [21] |
STRĄCZEK I, MŁYNEK K, DANIELEWICZ A. The capacity of Holstein-Friesian and Simmental cows to correct a negative energy balance in relation to their performance parameters, course of lactation, and selected milk components[J]. Animals (Basel), 2021, 11(6): 1674. |
| [22] |
JORRITSMA R, WENSING T, KRUIP T A M, et al. Metabolic changes in early lactation and impaired reproductive performance in dairy cows[J]. Vet Res, 2003, 34(1): 11-26. DOI:10.1051/vetres:2002054 |
| [23] |
LEDUC A, SOUCHET S, GELÉ M, et al. Effect of feed restriction on dairy cow milk production: a review[J]. J Anim Sci, 2021, 99(7): skab130. DOI:10.1093/jas/skab130 |
| [24] |
LOPREIATO V, MEZZETTI M, CATTANEO L, et al. Role of nutraceuticals during the transition period of dairy cows: a review[J]. J Anim Sci Biotechnol, 2020, 11: 96. DOI:10.1186/s40104-020-00501-x |
| [25] |
MOORE S M, DEVRIES T J. Effect of diet-induced negative energy balance on the feeding behavior of dairy cows[J]. J Dairy Sci, 2020, 103(8): 7288-7301. DOI:10.3168/jds.2019-17705 |
| [26] |
KOK A, CHEN J, KEMP B, et al. Review: dry period length in dairy cows and consequences for metabolism and welfare and customised management strategies[J]. Animal, 2019, 13(S1): s42-s51. |
| [27] |
POIRIER M, TESFAYE D, HAILAY T, et al. Metabolism-associated genome-wide epigenetic changes in bovine oocytes during early lactation[J]. Sci Rep, 2020, 10(1): 2345. DOI:10.1038/s41598-020-59410-8 |
| [28] |
BUTLER W R. Nutritional interactions with reproductive performance in dairy cattle[J]. Anim Reprod Sci, 2000, 60-61: 449-457. DOI:10.1016/S0378-4320(00)00076-2 |
| [29] |
PUSHPAKUMARA P G A, GARDNER N H, REYNOLDS C K, et al. Relationships between transition period diet, metabolic parameters and fertility in lactating dairy cows[J]. Theriogenology, 2003, 60(6): 1165-1185. DOI:10.1016/S0093-691X(03)00119-5 |
| [30] |
BUTLER W R. Energy balance relationships with follicular development, ovulation and fertility in postpartum dairy cows[J]. Livest Prod Sci, 2003, 83(2-3): 211-218. DOI:10.1016/S0301-6226(03)00112-X |
| [31] |
SANTOS J E P, BISINOTTO R S, RIBEIRO E S. Mechanisms underlying reduced fertility in anovular dairy cows[J]. Theriogenology, 2016, 86(1): 254-262. DOI:10.1016/j.theriogenology.2016.04.038 |
| [32] |
NOYA A, CASASÚS I, RODRÍGUEZ-SÁNCHEZ J A, et al. A negative energy balance during the peri-implantational period reduces dam IGF-1 but does not alter progesterone or pregnancy-specific protein B (PSPB) or fertility in suckled cows[J]. Domest Anim Endocrinol, 2020, 72: 106418. DOI:10.1016/j.domaniend.2019.106418 |
| [33] |
WALSH S W, WILLIAMS E J, EVANS A C O. A review of the causes of poor fertility in high milk producing dairy cows[J]. Anim Reprod Sci, 2011, 123(3-4): 127-138. DOI:10.1016/j.anireprosci.2010.12.001 |
| [34] |
MEIKLE A, KULCSAR M, CHILLIARD Y, et al. Effects of parity and body condition at parturition on endocrine and reproductive parameters of the cow[J]. Reproduction, 2004, 127(6): 727-737. DOI:10.1530/rep.1.00080 |
| [35] |
CROWE M A, DISKIN M G, WILLIAMS E J. Parturition to resumption of ovarian cyclicity: comparative aspects of beef and dairy cows[J]. Animal, 2014, 8(Suppl 1): 40-53. |
| [36] |
SANTOS J E P, RUTIGLIANO H M, SÁ FILHO M F. Risk factors for resumption of postpartum estrous cycles and embryonic survival in lactating dairy cows[J]. Anim Reprod Sci, 2009, 110(3-4): 207-221. DOI:10.1016/j.anireprosci.2008.01.014 |
| [37] |
CHAPUT C, SIRARD M A. Embryonic response to high beta-hydroxybutyrate (BHB) levels in postpartum dairy cows[J]. Domest Anim Endocrinol, 2020, 72: 106431. DOI:10.1016/j.domaniend.2019.106431 |
| [38] |
PASCOTTINI O B, LEROY J L M R, OPSOMER G. Maladaptation to the transition period and consequences on fertility of dairy cows[J]. Reprod Domest Anim, 2022, 57(Suppl 4): 21-32. |
| [39] |
GARNSWORTHY P C, GONG J G, ARMSTRONG D G, et al. Nutrition, metabolism, and fertility in dairy cows: 3.Amino acids and ovarian function[J]. J Dairy Sci, 2008, 91(11): 4190-4197. DOI:10.3168/jds.2008-1035 |
| [40] |
GONG J G. Influence of metabolic hormones and nutrition on ovarian follicle development in cattle: practical implications[J]. Domest Anim Endocrinol, 2002, 23(1-2): 229-241. DOI:10.1016/S0739-7240(02)00159-5 |
| [41] |
D'OCCHIO M J, BARUSELLI P S, CAMPANILE G. Influence of nutrition, body condition, and metabolic status on reproduction in female beef cattle: a review[J]. Theriogenology, 2019, 125: 277-284. DOI:10.1016/j.theriogenology.2018.11.010 |
| [42] |
CAVESTANY D, KULCSÁR M, CRESPI D, et al. Effect of prepartum energetic supplementation on productive and reproductive characteristics, and metabolic and hormonal profiles in dairy cows under grazing conditions[J]. Reprod Domest Anim, 2009, 44(4): 663-671. DOI:10.1111/j.1439-0531.2007.01044.x |
| [43] |
MŁYNEK K, DANIELEWICZ A, STRĄCZEK I. The effect of energy metabolism up to the peak of lactation on the main fractions of fatty acids in the milk of selected dairy cow breeds[J]. Animals (Basel), 2021, 11(1): 112. |
| [44] |
LUCY M C. Mechanisms linking nutrition and reproduction in postpartum cows[J]. Reprod Suppl, 2003, 61: 415-427. |
| [45] |
WEBB R, GARNSWORTHY P C, GONG J G, et al. Control of follicular growth: local interactions and nutritional influences[J]. J Anim Sci, 2004, 82(E-Suppl): E63-E74. |
| [46] |
ESPOSITO G, IRONS P C, WEBB E C, et al. Interactions between negative energy balance, metabolic diseases, uterine health and immune response in transition dairy cows[J]. Anim Reprod Sci, 2014, 144(3-4): 60-71. DOI:10.1016/j.anireprosci.2013.11.007 |
| [47] |
CHAGAS L M, BASS J J, BLACHE D, et al. Invited review: new perspectives on the roles of nutrition and metabolic priorities in the subfertility of high-producing dairy cows[J]. J Dairy Sci, 2007, 90(9): 4022-4032. DOI:10.3168/jds.2006-852 |
| [48] |
BEAM S W, BUTLER W R. Effects of energy balance on follicular development and first ovulation in postpartum dairy cows[J]. J Reprod Fertil Suppl, 1999, 54: 411-424. |
| [49] |
GOFF J P. Major advances in our understanding of nutritional influences on bovine health[J]. J Dairy Sci, 2006, 89(4): 1292-1301. DOI:10.3168/jds.S0022-0302(06)72197-X |
| [50] |
DISKIN M G, MACKEY D R, ROCHE J F, et al. Effects of nutrition and metabolic status on circulating hormones and ovarian follicle development in cattle[J]. Anim Reprod Sci, 2003, 78(3-4): 345-370. DOI:10.1016/S0378-4320(03)00099-X |
| [51] |
MCART J A A, NYDAM D V, OETZEL G R, et al. Elevated non-esterified fatty acids and β-hydroxybutyrate and their association with transition dairy cow performance[J]. Vet J, 2013, 198(3): 560-570. DOI:10.1016/j.tvjl.2013.08.011 |
| [52] |
SWARTZ T H, MOALLEM U, KAMER H, et al. Characterization of the liver proteome in dairy cows experiencing negative energy balance at early lactation[J]. J Proteomics, 2021, 246: 104308. DOI:10.1016/j.jprot.2021.104308 |
| [53] |
SONG Y X, LOOR J J, LI C Y, et al. Enhanced mitochondrial dysfunction and oxidative stress in the mammary gland of cows with clinical ketosis[J]. J Dairy Sci, 2021, 104(6): 6909-6918. DOI:10.3168/jds.2020-19964 |
| [54] |
MISSIO D, FRITZEN A, CUPPER VIEIRA C, et al. Increased β-hydroxybutyrate (BHBA) concentration affect follicular growth in cattle[J]. Anim Reprod Sci, 2022, 243: 107033. DOI:10.1016/j.anireprosci.2022.107033 |
| [55] |
AERNOUTS B, ADRIAENS I, DIAZ-OLIVARES J, et al. Mid-infrared spectroscopic analysis of raw milk to predict the blood nonesterified fatty acid concentrations in dairy cows[J]. J Dairy Sci, 2020, 103(7): 6422-6438. DOI:10.3168/jds.2019-17952 |
| [56] |
HUMER E, BRUGGEMAN G, ZEBELI Q. A meta-analysis on the impact of the supplementation of rumen-protected choline on the metabolic health and performance of dairy cattle[J]. Animals (Basel), 2019, 9(8): 566. |
| [57] |
SHARMA A, BADDELA V S, BECKER F, et al. Elevated free fatty acids affect bovine granulosa cell function: a molecular cue for compromised reproduction during negative energy balance[J]. Endocr Connect, 2019, 8(5): 493-505. DOI:10.1530/EC-19-0011 |
| [58] |
SHEN T Y, XU F, FANG Z Y, et al. Hepatic autophagy and mitophagy status in dairy cows with subclinical and clinical ketosis[J]. J Dairy Sci, 2021, 104(4): 4847-4857. DOI:10.3168/jds.2020-19150 |
| [59] |
THAMMACHAROEN S, SEMSIRMBOON S, CHANPONGSANG S, et al. Seasonal effect of milk yield and blood metabolites in relation to ketosis of dairy cows fed under a high ambient temperature[J]. Vet World, 2021, 14(9): 2392-2396. |
| [60] |
HÄGGMAN J, CHRISTENSEN J M, MÄNTYSAARI E A, et al. Genetic parameters for endocrine and traditional fertility traits, hyperketonemia and milk yield in dairy cattle[J]. Animal, 2019, 13(2): 248-255. DOI:10.1017/S1751731118001386 |
| [61] |
MACRAE A I, BURROUGH E, FORREST J, et al. Risk factors associated with excessive negative energy balance in commercial United Kingdom dairy herds[J]. Vet J, 2019, 250: 15-23. DOI:10.1016/j.tvjl.2019.06.001 |
| [62] |
BADDELA V S, SHARMA A, VANSELOW J. Non-esterified fatty acids in the ovary: friends or foes?[J]. Reprod Biol Endocrinol, 2020, 18(1): 60. DOI:10.1186/s12958-020-00617-9 |
| [63] |
KARPE F, DICKMANN J R, FRAYN K N. Fatty acids, obesity, and insulin resistance: time for a reevaluation[J]. Diabetes, 2011, 60(10): 2441-2449. DOI:10.2337/db11-0425 |
| [64] |
WATHES D C, CHENG Z, SALAVATI M, et al. Relationships between metabolic profiles and gene expression in liver and leukocytes of dairy cows in early lactation[J]. J Dairy Sci, 2021, 104(3): 3596-3616. DOI:10.3168/jds.2020-19165 |
| [65] |
NOGUEIRA-FERREIRA R, VITORINO R, FERREIRA-PINTO M J, et al. Exploring the role of post-translational modifications on protein-protein interactions with survivin[J]. Arch Biochem Biophys, 2013, 538(2): 64-70. DOI:10.1016/j.abb.2013.07.027 |
(编辑 郭云雁)



