2. 杨凌职业技术学院药物与化工分院, 杨凌 712199
2. Pharmaceutical and Chemical Branch, Yangling Vocational and Technical College, Yangling 712199, China
鸡大肠杆菌病是由致病性大肠杆菌引起的一种细菌性感染病,壅结于肠出现拉稀粪,热邪伤肝可见肝表面有灰白色坏死点,其基本证候类型是湿热壅积[1]。当鸡群受该菌感染后会造成严重影响,如:器官受损、饲料利用率降低、死淘率增加等[2]。研究发现,致病性大肠杆菌进入机体后,血液可吸收由菌体裂解释放的内毒素从而引起肝组织病理学损伤、肝细胞凋亡、氧化损伤和脂肪细胞因子增加[3-5],且对肝功能和代谢的影响呈剂量依赖性。肝是机体代谢主要器官,尤其对脂质合成、分解和运输发挥着重要作用[6]。肝组织受损可引起胆固醇代谢活动异常。以往研究发现,用鼠柠檬酸杆菌处理小鼠来模拟大肠杆菌病生理模型,胆固醇生物合成显著上调[7];采用内毒素处理小鼠,肝组织胆固醇和甘油三酯合成增加[8]。然而,有关致病性大肠杆菌感染影响肉鸡肝组织胆固醇代谢的研究目前相对较少。
苦参为豆科槐属植物苦参的干燥根,性寒味苦,其作为一种常用中药已广泛用于生产实践,具有清热燥湿、解毒杀虫等功效,现代药理学研究表明,其还有抗菌消炎和增强机体免疫力等作用[9],同时有研究表明,苦参还具有抗高脂饲料性脂肪性肝炎的作用。研究发现,苦参可使高脂血症大鼠肝组织中甘油三酯(hepatic triglyceride, TG)、总胆固醇(total cholesterol, TCH),血清中TG、TCH、高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)显著降低[10-11]。苍术为菊科植物茅苍术或北苍术的干燥根,有健脾燥湿、祛风散寒等功能,现代药理学研究表明,该药材具有抗菌消炎、保肝、降血糖等作用[12],同时有研究表明,苍术具有抗脂肪形成的作用。研究发现,苍术可抑制由高脂饮食诱导的小鼠体重增加以及血清TCH和肝脂质水平增加[13-14]。苦参苍术均有抗菌消炎作用,两药合用可使抗菌作用增强。研究发现,苦参苍术对炎性物质刺激具有明显抵抗作用,从而减轻炎症反应[15]。它还可以显著降低由大肠杆菌导致的鸡死亡率的增加,改善鸡的生长发育受阻[16]。然而,苦参苍术颗粒是否可通过调控肝组织胆固醇代谢途径,来缓解大肠杆菌所致肉鸡肝组织胆固醇合成异常,目前还不清楚。因此,本试验拟以人工胸部肌肉注射致病性大肠杆菌肉鸡为研究模型,并在饮水中添加不同浓度苦参苍术颗粒,探究其通过影响肝组织胆固醇代谢来缓解肉鸡肝组织胆固醇合成异常的作用机制。
1 材料与方法 1.1 药材苦参苍术颗粒剂,由西安康乐动物药业有限公司赠送,生产工艺:先取苍术加水蒸馏,收集蒸馏液,4 ℃冷藏后分离油层,得挥发油备用;取苦参加水煎煮2次,提取沸液,滤过,浓缩后用75%乙醇4 ℃过夜沉淀,滤过回收乙醇,加水至每1 mL含生药约1.5 g,调节pH至9.0~11.0,用三氯甲烷提取3次,合并三氯甲烷液,滤过,回收溶剂至无三氯甲烷气味,得浸膏,用一步制粒机雾化颗粒备用,苍术挥发油加入吐温-80,随后加入颗粒中混合均匀即可。苦参苍术药物提取生产质量控制标准见表 1,苦参苍术药物制剂质量控制要点见表 2。
|
|
表 1 苦参苍术药物提取生产质量控制标准 Table 1 Quality control standards of extraction and production of kushen-cangzhu granules |
|
|
表 2 苦参苍术药物制剂质量控制要点 Table 2 Key points of quality control of drug preparation of kushen-cangzhu granules |
禽致病性大肠杆菌菌液,由西北农林科技大学微生物实验室提供;苏木精-伊红染色液,购自北京索莱宝科技有限公司;总胆固醇(TCH酶法)测试盒(液体),购自南京建成生物科技有限公司;甘油三酯(TG酶法)测试盒(液体),购自南京建成生物科技有限公司;血清高密度脂蛋白胆固醇(HDL-C)测试盒(液体沉淀分离法),购自南京建成生物科技有限公司;低密度脂蛋白胆固醇(LDL-C)测定试剂盒(双试剂直接法)(酶标仪及生化分析仪),购自南京建成生物科技有限公司;TRIzol总RNA提取试剂盒,购自康润生物科技有限公司;2×SYBR Green qPCR Master mix,购自Vazyme生物科技有限公司;Hiscript Ⅱ Q RT SuperMix for qPCR (+gDNA wiper),购自Vazyme生物科技有限公司。
1.3 试验动物分组与处理试验动物选用1日龄健康白羽肉鸡40只,公母比例1∶1,饲养方式为笼养,室内温度20~25 ℃,相对湿度40%~60%。将白羽肉鸡正常饲喂至21日龄后,随机分为5组,每组8只,编号后由胸部肌肉注射菌液进行致病。
A组为空白对照组,胸部肌肉注射0.9%的氯化钠溶液;
B组为模型对照组,接种0.7 mL致病性大肠杆菌菌液(8.37 ×108 CFU·mL-1);
C组接种菌液24 h后,苦参苍术低剂量(3.6 g·L-1) 饮水给药,给药7 d,同时进行观察记录;
D组接种菌液24 h后,苦参苍术中剂量(5.5 g·L-1) 饮水给药,给药7 d,同时进行观察记录;
E组接种菌液24 h后,苦参苍术高剂量(7.3 g·L-1) 饮水给药,给药7 d,同时进行观察记录。
1.4 样品采集与处理苦参苍术颗粒给药7 d后进行样品采集,每组挑选6只最接近平均体重的肉鸡进行静脉采血,在4 ℃条件下3 500×g离心10 min,取血清-30 ℃保存备用。随后将肉鸡放血处死后,剖开腹腔立即采集肝组织,其中一部分经液氮速冻后-80 ℃保存供后期使用,另一部分组织浸于4%的多聚甲醛溶液中固定供制备石蜡切片备用。
1.5 测定指标与方法1.5.1 器官指数 肉鸡剖前对每只鸡进行称重,称重后解剖,解剖后迅速分离各个脏器,用生理盐水冲洗脏器上的血渍,吸干水分后称重,使用以下公式进行计算:内脏器官指数=内脏器官重量(g)/宰前活重(kg)。
1.5.2 血清胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白水平测定 取-30 ℃保存的血清,送往杨凌示范区医院进行血常规检测。
1.5.3 肝组织胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白测定 先采用氯仿/甲醇萃取法提取,提取方法参考文献[17],然后按照试剂盒说明书操作。
1.5.4 肝组织形态切片的制作和观察 肉鸡解剖后,迅速将肝分离,在肝左叶边缘无损伤部位取样,使用多聚甲醛固定,取适当大小的组织,进行流水冲洗、脱水、透明、浸蜡包埋。使用石蜡切片机切厚度5 μm,进行HE染色。在研究级正置显微镜(Ni-U,尼康公司,东京,日本)下观察,并拍照。
1.5.5 实时荧光定量qPCR检测肉鸡肝组织胆固醇合成相关基因mRNA的表达 将冻存于-80 ℃的肝组织样品取出,剪取50 mg组织样品加入离心管中剪碎,每管加入1 mL TRIzol和陶瓷珠子,在组织破碎仪(欧诺仪器,天津,中国)进行破碎。参考说明书提取总RNA,根据反转录试剂盒说明书反转录为cDNA。合成的cDNA样品,采用RT-qPCR检测胆固醇合成相关因子HMGCR、SREBP2、SCAP、胰岛素诱导基因1(Insig 1)、胰岛素诱导基因2(Insig 2)和CYP7A1的mRNA水平的变化。在PubMed数据库查询相关基因的mRNA序列,截取保守序列区片段,利用Pick Primer设计扩增目的基因的引物序列,引物由北京擎科生物科技有限公司合成,序列详见表 3。
|
|
表 3 引物信息 Table 3 Primers information |
试验数据使用Excel 2019对肉鸡肝脏指数、血清和肝组织胆固醇水平进行数据统计,采用RT-qPCR技术对40只肉鸡胆固醇合成关键因子HMGCR、SREBP2、SCAP、Insig 1、Insig 2、CYP7A1 mRNA相对表达量进行分析后用Excel 2019对肝组织胆固醇合成关键因子进行统计处理,采用SPSS 26.0中的单因子方差分析(one-way ANOVA)、多重比较(LSD)法、独立样本T检验分析添加苦参苍术颗粒及大肠杆菌菌液对肉鸡肝脏指数、血清和肝组织胆固醇水平、肝组织胆固醇合成关键因子的影响。结果以“平均值±标准差”表示。以P<0.01为差异极显著的判断标准,P<0.05为差异显著的判断标准。用Graphpad Prism 7作图。
2 结果 2.1 苦参苍术颗粒剂对白羽肉鸡肝脏指数的影响如表 4所示,和空白对照组相比,模型对照组肉鸡体重显著降低(P<0.05);低剂量组肉鸡体重显著高于模型对照组(P<0.05)。各处理组间肝重无差异。和空白对照组相比,模型对照组肝脏指数显著增加(P<0.05);而低剂量组肝脏指数和模型对照组相比显著降低(P<0.05)。
|
|
表 4 饮水中添加苦参苍术颗粒对肉鸡肝脏指数的影响(n=8) Table 4 Effect of supplemented kushen-cangzhu granules in drinking water on liver index of broilers (n=8) |
饮水中添加苦参苍术颗粒对肉鸡肝组织形态的影响见图 1。如图所示,空白对照组肝组织形态结构未见异常。和空白对照组相比,模型对照组肝血窦扩张充血(见黑色箭头),肝小叶中央静脉周围和肝血窦内有大量炎性细胞浸润(见红色箭头),肝细胞排列紊乱,胞浆界限模糊(见红色圆圈区域)。饮水中添加苦参苍术颗粒后有效缓解致病性大肠杆菌导致的肝组织形态结构异常。
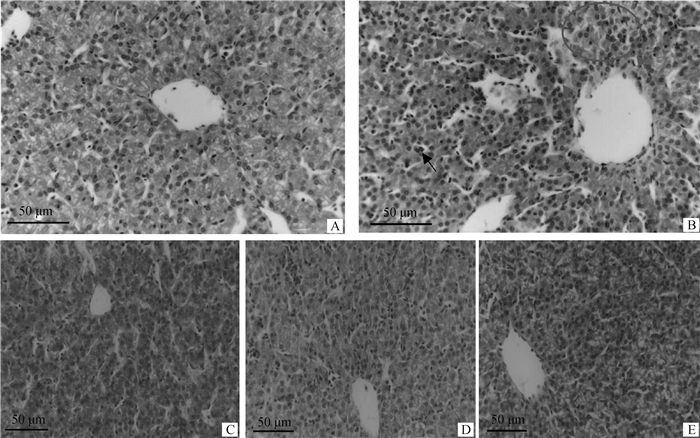
|
A.空白对照组;B.模型对照组;C.低剂量组;D.中剂量组;E.高剂量组 A. Blank control group; B. Model control group; C. Low-dose group; D. Medium-dose group; E. High-dose group 图 1 饮水中添加苦参苍术颗粒对肉鸡肝组织形态的影响(n=3) Fig. 1 Effect of supplemented kushen-cangzhu granules in drinking water on liver histomorphology in broilers (n=3) |
不同处理肉鸡血清TCH和TG的变化见表 5。血清中TCH、HDL-C和LDL-C含量及LDL-C/HDL-C比值在各组间未见差异。和空白对照组相比,模型对照组血清TG含量显著增加(P<0.05);而低、高剂量组血清TG含量与模型对照组相比显著降低(P<0.05)。
|
|
表 5 饮水中添加苦参苍术颗粒对血清胆固醇和甘油三酯的影响(n=6) Table 5 Effect of supplemented kushen-cangzhu granules in drinking water on serum cholesterol and triglyceride (n=6) |
不同处理肉鸡肝组织中总胆固醇和甘油三酯水平的变化见表 6。中、高剂量组肝TCH含量显著高于空白对照组(P<0.05)。模型对照组、各剂量组TG含量均显著低于空白对照组(P<0.05)。中剂量组HDL-C含量显著高于模型对照组(P<0.05),而LDL-C含量在苦参苍术颗粒各剂量组均显著高于模型对照组(P<0.05),中、高剂量组LDL-C/HDL-C的比值均显著高于模型对照组(P<0.05)。
|
|
表 6 饮水中添加苦参苍术对肝组织胆固醇和甘油三酯的影响(n=6) Table 6 Effect of supplemented kushen-cangzhu granules in drinking water on liver cholesterol and triglyceride (n=6) |
不同处理肉鸡肝组织胆固醇代谢相关基因mRNA表达水平如图 2所示。结果表明,与空白对照组相比,模型对照组SCAP mRNA相对表达量显著降低(P<0.05),但与模型对照组相比,中剂量组SCAP mRNA相对表达量显著升高(P<0.05)。同时,与模型对照组相比,中剂量组也均显著提高了HMGCR和SREBP2 mRNA相对表达量(P<0.05)。
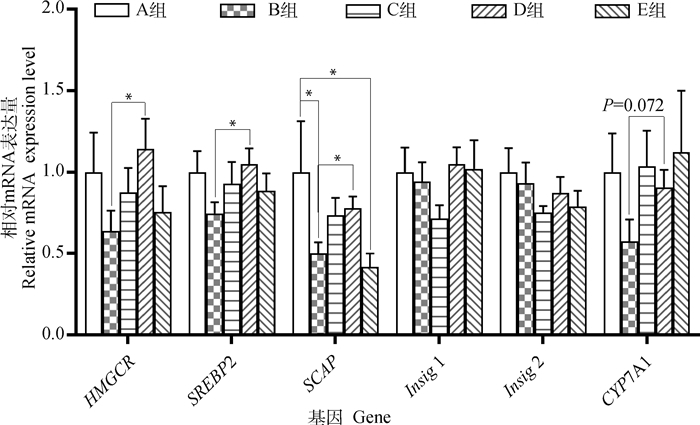
|
*表示差异显著(P<0.05) * indicates the difference is significant (P < 0.05) 图 2 饮水中添加苦参苍术颗粒对肉鸡肝组织胆固醇代谢相关基因mRNA相对表达量的影响(n=8) Fig. 2 Effect of supplemented kushen-cangzhu granules in drinking water on relative mRNA expression of cholesterol metabolism-related genes in liver of broilers (n=8) |
禽致病性大肠杆菌是一种常见致病菌,可影响肉鸡生产性能。在动物试验中,畜禽器官发育情况可作为评价机体能否正常发挥生理功能的指标之一,器官指数在某种程度上反映了动物机体发育情况[18]。研究发现,脂多糖(lipopolysaccharide, LPS)显著降低肝损伤小鼠体重的同时增加肝重[19]。本试验结果也证实了这一点,致病性大肠杆菌可显著降低肉鸡体重,同时显著升高肝脏指数。提示大肠杆菌感染会对肉鸡肝组织产生影响。有研究发现,饮水中添加苦参苍术口服液后对由耐药性大肠杆菌引起的鸡生长发育受阻具有一定程度的改善作用[16],这与本试验饮水中添加苦参苍术颗粒可显著升高肉鸡体重,降低肝脏指数,进而促进肉鸡生长结果一致。表明苦参苍术颗粒可在一定程度上干预大肠杆菌对肉鸡肝组织造成的不良影响。
细菌和病毒感染是肉鸡肝组织发生炎症反应的主要诱因[20]。LPS作为革兰阴性菌(大肠杆菌)细胞壁的结构组分,是其产生毒性作用的主要因素[21]。LPS刺激促进肝巨噬细胞中促炎细胞因子的释放,从而导致肝损伤[22],促进肝损伤同时会增加氧化应激,促进脂质蓄积和糖原耗竭[23]。有研究发现,LPS导致肝小叶结构模糊不清,肝细胞排列紊乱,中央静脉和交界处附近有大量炎性细胞浸润,空泡化和坏死,表现出明显的肝损伤特征[24-26],而在本试验中也发现模型对照组的肝中有一定量的炎性细胞浸润,但还未达到损伤程度。以往研究表明,苦参可通过抗炎、抗氧化等对肝起到一定的保护作用[27],苍术可通过降低血清中转氨酶的水平而对肝起到一定的保护作用[28]。在本试验中同样发现,饮水中添加苦参苍术颗粒后缓解了由大肠杆菌导致的肝组织形态学变化。以上结果表明,苦参苍术颗粒可缓解大肠杆菌导致的肉鸡肝组织炎性细胞浸润。
肝在调节机体代谢稳态和调节机体免疫方面发挥重要作用,其作为一种重要的代谢器官,主要负责葡萄糖、脂质和胆汁酸的代谢[29]。当肝受损时,肝功能发生异常,肝细胞膜被破坏,导致细胞膜通透性增加[30],胞内酶便会大量溢出至细胞外,参与血液循环,导致血清中某些酶类含量发生一定变化。研究发现,给小鼠机体注射LPS后会导致血清中TG和TCH含量显著增加[31]。这与本试验结果一致,据此推断大肠杆菌导致肝内脂代谢发生异常。而饮水中添加苦参苍术颗粒后,显著降低了肉鸡血清和肝中TG含量,从而进一步证明苦参苍术颗粒具有降血脂的作用[12, 32]。低密度脂蛋白的功能主要是将肝组织中的胆固醇运输至肝外,而高密度脂蛋白主要将外周组织中的胆固醇带回肝进行代谢,从而使胆固醇水平处于平衡状态。高、低密度脂蛋白胆固醇含量可以间接反映高、低密度脂蛋白的水平。研究发现,日粮中添加黄酮类化合物(黄芩素),42日龄肉鸡血清中LDL-C及LDL-C/HDL-C显著降低[33],而本研究却发现,饮水中添加苦参苍术颗粒后肉鸡血清中LDL-C/HDL-C没有显著影响,但肝组织HDL-C、LDL-C及LDL-C/HDL-C显著增加,这种差异可能是由于药物种类、肉鸡日龄及品种不同而致。提示苦参苍术颗粒具有降低肝组织胆固醇水平的趋势,对抑制肉鸡脂肪肝的发生发挥着积极的作用。
为明确大肠杆菌引起肉鸡肝组织胆固醇代谢异常的确切机制,本研究进一步检测了胆固醇合成相关基因的mRNA相对表达量。以往研究发现,LPS处理巨噬细胞可通过上调SCAP和SREBP2的表达来激活HMGCR的转录,从而导致细胞内胆固醇积累[34],同时在HepG2和Huh7细胞中也显著上调了HMGCR和SREBP2的表达[35]。相反,在SH-SY5Y细胞中,LPS处理抑制了HMGCR的表达[36]。本试验研究发现,大肠杆菌感染显著抑制肝组织SCAP mRNA的相对表达量。而SCAP表达降低可使肝组织中胆固醇合成减少[37],这表明LPS对胆固醇合成的影响可能存在种属和组织之间的差异。提示可能是由于大肠杆菌感染致使内源性胆固醇合成不足,造成肉鸡肝组织发生一定的炎性细胞浸润。胆固醇是细胞膜的重要组成部分,添加苦参苍术颗粒后,SCAP、SREBP2和HMGCR mRNA相对表达量显著增加,促进了肝中胆固醇合成增加,一方面有利于缓解大肠杆菌所致细胞膜的通透性增加[38],保持细胞膜结构的完整性。另一方面苦参苍术颗粒促进肝中胆固醇合成增加的同时上调HDL-C和LDL-C的表达,促使机体内的胆固醇水平处于更加平衡的状态。以上这些结果表明,苦参苍术颗粒在由大肠杆菌导致胆固醇合成异常方面具有一定的调节作用。
4 结论本试验结果表明,苦参苍术颗粒可降低血液中TG含量,改善肉鸡体重;通过增加肝组织中HDL和LDL水平,促进肝中胆固醇转运、合成、分解来调控肝组织胆固醇水平,从而缓解大肠杆菌所致的肉鸡肝组织胆固醇合成异常。
| [1] |
王亚芳, 崔小七, 贾召锋, 等. 鸡大肠杆菌病的模型建立与中兽医辨证论治研究进展[J]. 中国畜牧兽医, 2014, 41(9): 269-272. WANG Y F, CUI X Q, JIA Z F, et al. Research advance on disease model and Chinese traditional veterinary diagnosis and treatment of chicken Escherichia coli disease[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(9): 269-272. (in Chinese) |
| [2] |
DA ROSA G, ALBA D F, SILVA A D, et al. Impact of Escherichia coli infection in broiler breeder chicks: The effect of oxidative stress on weight gain[J]. Microb Pathog, 2020, 139: 103861. DOI:10.1016/j.micpath.2019.103861 |
| [3] |
ZHAO P F, PIAO X S, PAN L, et al. Forsythia suspensa extract attenuates lipopolysaccharide-induced inflammatory liver injury in rats via promoting antioxidant defense mechanisms[J]. Anim Sci J, 2017, 88(6): 873-881. DOI:10.1111/asj.12717 |
| [4] |
SONG H T, ZUO Z C, YANG Z Z, et al. Hepatic histopathology and apoptosis in diet-induced-obese mice under Escherichia coli pneumonia[J]. Aging (Albany NY), 2019, 11(9): 2836-2851. |
| [5] |
CARPINO G, DEL BEN M, PASTORI D, et al. Increased liver localization of lipopolysaccharides in human and experimental NAFLD[J]. Hepatology, 2020, 72(2): 470-485. DOI:10.1002/hep.31056 |
| [6] |
彭梦玲. 胚胎期肉鸡脂肪代谢的蛋白质组学和代谢组学分析及(-)-羟基柠檬酸调控机制研究[D]. 南京: 南京农业大学, 2018. PENG M L. Proteomics and Metabolomics Analyze the Lipids Metabolism during Embryonic Chicken and the Mechanisms of Lipids Metabolism-regulation of (-)-Hydroxylcitrate[D]. Nanjing: Nanjing Agricultural University, 2018. (in Chinese) |
| [7] |
HOPKINS E G D, ROUMELIOTIS T I, MULLINEAUX-SANDERS C, et al. Intestinal epithelial cells and the microbiome undergo swift reprogramming at the inception of colonic Citrobacter rodentium infection[J]. mBio, 2019, 10(2): e00062-19. |
| [8] |
ZHANG C J, ZHU N, LIU Z, et al. Wnt5a/Ror2 pathway contributes to the regulation of cholesterol homeostasis and inflammatory response in atherosclerosis[J]. Biochim Biophys Acta (BBA)-Mol Cell Biol Lipids, 2020, 1865(2): 158547. |
| [9] |
苏丽丽. 苦参的化学成分及药理作用研究进展[J]. 化学工程师, 2021, 35(3): 58-61. SU L L. Advances in the study of chemical constituents and pharmacological effects of Sophora flavescens Ait.[J]. Chemical Engineer, 2021, 35(3): 58-61. DOI:10.16247/j.cnki.23-1171/tq.20210358 (in Chinese) |
| [10] |
KIM H Y, JEONG D M, JUNG H J, et al. Hypolipidemic effects of Sophora flavescens and its constituents in poloxamer 407-induced hyperlipidemic and cholesterol-fed rats[J]. Biol Pharm Bull, 2008, 31(1): 73-78. DOI:10.1248/bpb.31.73 |
| [11] |
唐彬, 艾正琳, 姚树坤. 苦参碱对高脂-脂肪肝模型大鼠肝脏COX-2、iNOS表达的影响[J]. 中华临床医师杂志: 电子版, 2013, 7(5): 2011-2015. TANG B, AI Z L, YAO S K. Effects of matrine on the expression of COX-2 and iNOS in rats with non-alcoholic fatty liver disease[J]. Chinese Journal of Clinicians: Electronic Edition, 2013, 7(5): 2011-2015. (in Chinese) |
| [12] |
张明发, 沈雅琴. 苍术及其有效成分对心血管和代谢系统药理作用的研究进展[J]. 抗感染药学, 2017, 14(2): 244-249. ZHANG M F, SHEN Y Q. Research advances in pharmacologic actions of Atractylodis rhizoma and its effective components on cardiovascular and metabolic systems[J]. Anti-Infection Pharmacy, 2017, 14(2): 244-249. DOI:10.13493/j.issn.1672-7878.2017.02-002 (in Chinese) |
| [13] |
KIM C K, KIM M, OH S D, et al. Effects of Atractylodes macrocephala koidzumi rhizome on 3T3-L1 adipogenesis and an animal model of obesity[J]. J Ethnopharmacol, 2011, 137(1): 396-402. DOI:10.1016/j.jep.2011.05.036 |
| [14] |
SONG M Y, LIM S K, WANG J H, et al. The Root of Atractylodes macrocephala koidzumi prevents obesity and glucose intolerance and increases energy metabolism in mice[J]. Int J Mol Sci, 2018, 19(1): 278. DOI:10.3390/ijms19010278 |
| [15] |
高艳艳, 张志伟, 康慧. 苦参苍术口服液的抗炎与止泻作用研究[J]. 中国兽药杂志, 2013, 47(4): 26-28. GAO Y Y, ZHANG Z W, KANG H. Study on the anti-inflammatory and anti-diarrhea effects of Kushencangzhu oral liquid in mice[J]. Chinese Journal of Veterinary Drug, 2013, 47(4): 26-28. (in Chinese) |
| [16] |
周德刚, 高艳艳, 张晓会. 苦参苍术口服液对鸡耐药大肠杆菌的疗效试验[J]. 中国动物保健, 2012, 14(12): 25-27. ZHOU D G, GAO Y Y, ZHANG X H. Effect of Sophora flavescens and Atractylodes lancea oral liquid on drug-resistant Escherichia coli in chickens[J]. China Animal Health, 2012, 14(12): 25-27. DOI:10.3969/j.issn.1008-4754.2012.12.010 (in Chinese) |
| [17] |
丛日华. 品种和母猪日粮蛋白水平对仔猪肝脏胆固醇代谢的影响及其机制[D]. 南京: 南京农业大学, 2011. CONG R H. Effect of breed and maternal dietary protein level on hepatic cholesterol metabolism in piglets and mechanisms involved[D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese) |
| [18] |
程林, 谌俊, 韩景河, 等. 母猪妊娠和哺乳饲粮中硒源和维生素E水平对后代仔猪器官指数和血清激素水平的影响[J]. 动物营养学报, 2018, 30(3): 918-928. CHENG L, CHEN J, HAN J H, et al. Effects of dietary selenium sources and vitamin E levels during sows' gestation and lactation on organ indices and serum hormone levels of their progeny[J]. Chinese Journal of Animal Nutrition, 2018, 30(3): 918-928. DOI:10.3969/j.issn.1006-267x.2018.03.015 (in Chinese) |
| [19] |
YAN C Y, OUYANG S H, WANG X, et al. Celastrol ameliorates Propionibacterium acnes/LPS-induced liver damage and MSU-induced gouty arthritis via inhibiting K63 deubiquitination of NLRP3[J]. Phytomedicine, 2021, 80: 153398. DOI:10.1016/j.phymed.2020.153398 |
| [20] |
POHLMANN S, SCHEU S, ZIEGLER V, et al. Hepatic rac1 GTPase contributes to liver-mediated basal immune homeostasis and LPS-induced endotoxemia[J]. Biochim Biophys Acta (BBA)-Mol Cell Res, 2018, 1865(9): 1277-1292. DOI:10.1016/j.bbamcr.2018.06.007 |
| [21] |
张志翔, 曹颖光, 徐恋祎. 大肠杆菌脂多糖对小鼠骨髓间充质干细胞炎症因子分泌的影响[J]. 临床口腔医学杂志, 2020, 36(12): 707-711. ZHANG Z X, CAO Y G, XU L Y. Effects of Escherichia coli lipopolysaccharide on the secretion of inflammatory factors in mouse bone marrow mesenchymal stem cells[J]. Journal of Clinical Stomatology, 2020, 36(12): 707-711. DOI:10.3969/j.issn.1003-1634.2020.12.002 (in Chinese) |
| [22] |
ZHANG Z J, TIAN L, JIANG K. Propofol attenuates inflammatory response and apoptosis to protect d-galactosamine/lipopolysaccharide induced acute liver injury via regulating TLR4/NF-κB/NLRP3 pathway[J]. Int Immunopharmacol, 2019, 77: 105974. DOI:10.1016/j.intimp.2019.105974 |
| [23] |
ANDERS L C, LANG A L, ANWAR-MOHAMED A, et al. Vinyl chloride metabolites potentiate inflammatory liver Injury caused by LPS in mice[J]. Toxicol Sci, 2016, 151(2): 312-323. DOI:10.1093/toxsci/kfw045 |
| [24] |
HUNG Y L, FANG S H, WANG S C, et al. Corylin protects LPS-induced sepsis and attenuates LPS-induced inflammatory response[J]. Sci Rep, 2017, 7(1): 46299. DOI:10.1038/srep46299 |
| [25] |
HUYNH D T N, BAEK N, SIM S, et al. Minor ginsenoside Rg2 and Rh1 attenuates LPS-Induced acute liver and kidney damages via downregulating activation of TLR4-STAT1 and inflammatory cytokine production in macrophages[J]. Int J Mol Sci, 2020, 21(18): 6656. DOI:10.3390/ijms21186656 |
| [26] |
XU Q M, XU J, ZHANG K F, et al. Study on the protective effect and mechanism of Dicliptera chinensis (L.) Juss (Acanthaceae) polysaccharide on immune liver injury induced by LPS[J]. Biomed Pharmacother, 2021, 134: 111159. DOI:10.1016/j.biopha.2020.111159 |
| [27] |
张明发, 沈雅琴. 氧化苦参碱抗慢性肝损伤的药理作用及其机制研究进展[J]. 药物评价研究, 2019, 42(7): 1466-1473. ZHANG M F, SHEN Y Q. Research advances on effects of oxymatrine against chronic liver injuries[J]. Drug Evaluation Research, 2019, 42(7): 1466-1473. (in Chinese) |
| [28] |
沙多依, 杭永付, 宋菲, 等. 北苍术炮制前后挥发油部位保肝作用比较研究[J]. 现代中药研究与实践, 2010, 24(4): 41-43. SHA D Y, HANG Y F, SONG F, et al. Study on the protecting-liver effect of volatile oil of pre and post processing Cangzhu[J]. Research and Practice on Chinese Medicines, 2010, 24(4): 41-43. (in Chinese) |
| [29] |
GONG Z W, TAS E, YAKAR S, et al. Hepatic lipid metabolism and non-alcoholic fatty liver disease in aging[J]. Mol Cell Endocrinol, 2017, 455: 115-130. DOI:10.1016/j.mce.2016.12.022 |
| [30] |
于茹, 赵立岭, 李娥娥, 等. 细菌中Ⅰ型毒素蛋白-细胞膜作用机制的研究进展[J/OL]. 生物化学与生物物理进展, 2022: 1-16. (2022-02-23). http://kns.cnki.net/kcms/detail/11.2161.Q.20220222.1805.004.html. YU R, ZHAO L L, LI E E, et al. Research Progress on mechanisms of Type Ⅰ toxin protein- membrane in bacteria[J/OL]. Progress in Biochemistry and Biophysics, 2022: 1-16. (2022-02-23). http://kns.cnki.net/kcms/detail/11.2161.Q.20220222.1805.004.html. (in Chinese) |
| [31] |
SONG Y O, KIM M, WOO M, et al. Chondroitin sulfate-rich extract of skate cartilage attenuates lipopolysaccharide-induced liver damage in mice[J]. Mar Drugs, 2017, 15(6): 178. DOI:10.3390/md15060178 |
| [32] |
路筱涛, 祝晨蔯. 苦参碱降血脂作用的实验研究[J]. 广东药学, 2003, 13(6): 32-34. LU X T, ZHU C C. Experimental research on antilipidic effect of matrine[J]. Guangdong Pharmaceutical Journal, 2003, 13(6): 32-34. (in Chinese) |
| [33] |
ZHOU Y F, MAO S G, ZHOU M X. Effect of the flavonoid baicalein as a feed additive on the growth performance, immunity, and antioxidant capacity of broiler chickens[J]. J Poult Sci, 2019, 98(7): 2790-2799. |
| [34] |
LI L C, VARGHESE Z, MOORHEAD J F, et al. Cross-talk between TLR4-MyD88-NF-κB and SCAP-SREBP2 pathways mediates macrophage foam cell formation[J]. Amer J Physiol Heart Circ Physiol, 2013, 304(6): H874-H884. |
| [35] |
HE M Y, ZHANG W H, DONG Y Y, et al. Pro-inflammation NF-κB signaling triggers a positive feedback via enhancing cholesterol accumulation in liver cancer cells[J]. J Exp Clin Cancer Res, 2017, 36(1): 15. |
| [36] |
NA S F, DUAN X J, WANG R Y, et al. Chronic neuroinflammation induced by lipopolysaccharide injection into the third ventricle induces behavioral changes[J]. J Mol Neurosci, 2021, 71(6): 1306-1319. |
| [37] |
MOTAMED M, ZHANG Y X, WANG M L, et al. Identification of luminal Loop 1 of SCAP protein as the sterol sensor that maintains cholesterol homeostasis[J]. J Biol Chem, 2011, 286(20): 18002-18012. |
| [38] |
林莹, 杨军红, 司萍, 等. 米油对内毒素导致大鼠急性肝损伤的保护作用[J]. 营养学报, 2019, 41(1): 102-104. LIN Y, YANG J H, SI P, et al. Protective effect of rice oil on endotoxin-induced liver injury in rats[J]. Acta Nutrimenta Sinica, 2019, 41(1): 102-104. (in Chinese) |
(编辑 范子娟)



