2. 南京农业大学动物医学院, 南京 210014
2. College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是一种单股正链RNA病毒,基因变异率高,严重危害世界养猪业健康发展[1]。目前商品化猪繁殖与呼吸综合征疫苗免疫保护效力有限,给我国养猪业带来了巨大损失[2-3]。近20多年来,国内外学者对该病毒致病和免疫机制做了广泛研究,揭示了多种宿主拮抗蛋白分子,但PRRSV感染和致病机制尚不十分清楚,临床上尚无有效治疗药物。N蛋白是PRRSV编码的核衣壳蛋白,在病毒的致病和免疫机制中发挥重要作用,但其与宿主蛋白的相互作用机制也不十分全面[4-5]。深入研究PRRSV N蛋白与宿主细胞蛋白相互作用机制,对揭示该病毒致病机制、预防和控制该病毒感染具有重要理论意义和应用前景。
酵母双杂交系统(yeast two-hybrid system,Y2H)是研究蛋白质相互作用的一种重要技术手段[6-7]。本研究构建PRRSV天然靶器官——猪肺酵母双杂交cDNA文库,继而以PRRSV N蛋白为诱饵蛋白,利用Y2H方法筛选猪肺酵母双杂交cDNA文库,研究核糖体蛋白S20 (ribosomal protein S20,RPS20)与N蛋白的相互作用,确定RPS20对PRRSV复制的影响,为N蛋白在PRRSV感染中的功能及宿主蛋白RPS20在PRRSV复制中发挥的作用提供理论依据。
1 材料与方法 1.1 材料1.1.1 细胞、病毒和肺组织 本试验选用MARC-145细胞(非洲绿猴肾上皮细胞)及高致病性PRRSV毒株BB0907(由南京农业大学姜平教授馈赠)。仔猪肺组织和PAMs(猪肺泡巨噬细胞)采自4周龄健康仔猪,其PRRSV、PCV2、PRV和CSFV病毒核酸和抗体均为阴性。
1.1.2 主要试剂 RNA提取试剂TRIzol Reagent购自Invitrogen公司;cDNA文库构建试剂盒Make Your Own “mate & plate” Library System kit、酵母感受态制备及转化试剂盒YeastmakerTM Yeast Transformation System 2、LD-PCR试剂盒Advantage 2 Polymerase Mix、文库质粒插入片段检测试剂Matchmaker Insert Check PCR Mix 2、酵母菌株Y2HGold和Y187、酵母表达质粒pGBKT7、pGADT7、pGADT7-T、pGBKT7-p53(阳性对照质粒,p53蛋白与T蛋白互作)和pGBKT7-Lam(阴性对照质粒,Lam蛋白不与T蛋白互作)以及各种酵母培养基均购自Clontech公司。Flag单抗购自Abmart公司;HA单抗购自巴傲德公司;IRDye 800CW的山羊抗小鼠/兔IgG(H-L)购自LI-COR公司。
本试验所用的三对siRNA是根据NCBI中猪源RPS20基因序列(DQ629171.1)基因设计,由吉玛基因公司合成,具体序列如表 1。
|
|
表 1 干扰RPS20序列 Table 1 siRNA sequence |
1.2.1 猪肺酵母双杂交cDNA文库的构建 采取4周龄健康仔猪(PRRSV、PCV2、PRV和CSFV核酸和抗体均为阴性)肺组织,提取总RNA,以SMART技术合成第一条cDNA链,通过LD-PCR技术扩增成双链DNA,并将纯化后的双链DNA和线性化的酵母表达载体pGADT7载体一起转化入酵母Y187菌株,利用酵母细胞内的同源重组酶活性,完成二者的连接重组。最终收集转化外源基因的酵母菌。对文库的插入片段和文库库容量进行检测。
1.2.2 重组质粒的构建与鉴定 根据GenBank中公布的猪源RPS20基因序列(DQ629171.1)和PRRSV BB0907 ORF7(HQ315835.1)的基因序列设计引物。利用TRIzol抽提猪肺泡巨噬细胞和PRRSV接种细胞的总RNA,反转录成cDNA后,利用RT-PCR方法分别扩增RPS20基因和ORF7基因,并将其分别克隆至pcDNA3.1(+)中。
将ORF7基因构建入酵母表达质粒pGBKT7中。获得重组质粒经序列比对鉴定正确后命名为pcDNA3.1-RPS20-HA、pcDNA3.1-N-Flag和pGBKT7-N。所有得到的重组质粒均经测序验证。所用引物见表 2。
|
|
表 2 重组质粒引物 Table 2 Primers for recombinant plasmid |
1.2.3 文库筛选 将pGBKT7-N质粒转化至酵母Y2HGold中,涂布于SD/-Trp琼脂培养基平板上,挑取形态规则的单菌落接种至50 mL SD/-Trp液体培养基,过夜,培养液离心去上清,将酵母沉淀用SD/-Trp液体培养基重悬,加入猪肺酵母双杂交cDNA文库进行杂交,显微镜下观察到三叶草形状酵母菌(酵母菌杂交)时,将杂交产物涂布在QDO(SD/-His/-Trp/-Leu)培养基上,将QDO培养基上生长出的粉白色菌落,挑取于QDO/X/A(SD/-Leu/-Trp/X-α-Gal/AbA)平板划线培养,对生长状态良好的蓝色单菌落进行提取质粒并测序,经NCBI的BLAST数据库比对分析所得到的基因序列,以确定捕获的宿主蛋白。
1.2.4 免疫共沉淀 将MARC-145细胞铺于24孔板中,37 ℃,5% CO2恒温培养箱中培养至细胞汇合度达80%,共转染0. 5 μg pcDNA3.1(+)-RPS20-HA和0.5 μg pcDNA3.1(+)-N-Flag,24 h后收集蛋白样品,加入1 μg鼠抗HA单克隆抗体,4 ℃摇床中孵育8 h。加入50 μL的Protein A+G琼脂糖珠,4 ℃摇床中继续缓慢摇动孵育3 h。2 500 r·min-1离心5 min,PBST洗涤,重复该过程4次。加入5×Loading Buffer,沸水煮10 min,进行Western blot。
为确定内源PRRSV N蛋白与RPS20蛋白的互作。待生长在24孔细胞板中的MARC-145细胞的汇合度达到80%,转染0.5 μg的RPS20-HA真核表达质粒,12 h后接种0.1 MOI PRRSV,接毒24 h后用鼠抗HA单克隆抗体进行Co-IP试验。
1.2.5 激光共聚焦试验 将MARC-145细胞接种在细胞爬片上,待汇合度达到60%时,转染1 μg pcDNA3.1(+)-N-Flag,24 h后用4%多聚甲醛固定15 min;0.1% Triton X-100对细胞进行透膜30 min;加入特异性抗体鼠抗Flag(1∶1 000稀释)和兔抗RPS20(1∶500),孵育1 h;经PBST充分洗涤后加入对应荧光二抗,37 ℃孵育45 min;弃二抗充分洗涤后,加入终浓度为1 mmol·L-1 DAPI/PBS孵育10 min,用中性树脂封片后至共聚焦显微镜下观察结果。
1.2.6 过表达RPS20对PRRSV增殖影响的测定 将MARC-145细胞以每孔105个·500 mL-1铺于24孔板中,37 ℃ 5% CO2培养箱中培养,待细胞长至70%~80%时依据LipofectamineⓇ 3000说明书进行转染。37 ℃温箱培养36 h后可收取细胞及上清,分别通过病毒滴度测定、荧光定量PCR或Western blot进行检测。
1.2.7 siRNA转染及筛选 参照LipofectamineⓇ 2000说明书转染48 pmol·L-1干扰片段至MARC-145细胞中,于24和36 h收集细胞进行实时荧光定量PCR测定RPS20的表达水平,筛选效果最好的沉默基因进行Western blot,验证其对内源性RPS20蛋白的干扰效果。
1.2.8 相对荧光定量PCR 每孔MARC-145细胞加入200 μL TRIzol收集细胞,按照总RNA提取试剂盒提取细胞中的总RNA,依据HiScript Ⅱ 1st Strand cDNA Synthesis进行RNA反转录,以得到的cDNA为模板,依据qPCR SYBE Green Master Mix说明书配制反应体系及设置反应程序。设定阴性对照,获得Ct值。目的基因的mRNA的相对表达采用2-ΔΔCt法分析[8]。所有处理组均重复检测3次。所用引物见表 3。
|
|
表 3 重组质粒引物 Table 3 Primers for quantitative fluorescence |
本研究中Western blot所得蛋白条带使用Image J软件对灰度值进行三次扫描,进行统计分析。使用GraphPad prism 8.0软件(One-way ANOVA test)进行统计学分析绘图,所有数据都被表示为平均值±标准差(x±s),P < 0.05(*)表示差异显著,P < 0.01(**)和P < 0.001(***)表示差异极显著。
2 结果 2.1 猪肺酵母双杂交cDNA文库的构建及筛选为了筛选与PRRSV N蛋白互作的宿主蛋白,本试验通过采取4周龄健康仔猪(PRRSV、PCV2、PRV和CSFV核酸和抗体均为阴性)肺组织构建cDNA文库。将所构建文库稀释涂布于SD/-Leu平板(图 1A),经两次稀释涂板计算得到文库滴度为5 × 106 CFU·mL-1,cDNA文库容量为7.5×107 CFU,符合酵母双杂交筛选要求。进一步挑取15个单菌落进行PCR鉴定,结果显示:扩增产物长度大小主要集中在300~2 000 bp(图 1B),平均长度约为500 bp,且同源重组率达到87%。上述结果表明,cDNA文库质量合格,可用于后续酵母双杂交试验。

|
A.酵母双杂交文库总容量数的测定;B. 随机挑选15个菌落PCR产物的琼脂糖凝胶电泳分析结果(1~15. 随机挑取的15个菌落的PCR产物;M1. DS2000 DNA相对分子质量标准;M2. DL10000 DNA相对分子质量标准);C. 电子显微镜观察下的三叶草结构;D. 在QDO和QDO/X/A平板上酵母双杂交结果电子显微镜观察结果 A. Determination of the total volume number of yeast two-hybrid libraries; B. Agarose gel electrophoresis of PCR products from 15 colonies randomly selected(1-15. Normalized effect of 15 PCR products randomly selected; M1. DS2000 DNA marker; M2. DL10000 DNA marker); C. The structure of a cloverleaf under electron microscopic observation; D. Results of yeast two-hybridization on QDO and QDO/X/A plates 图 1 猪肺酵母双杂交cDNA文库构建及筛选 Fig. 1 Construction and screening of porcine lung yeast two hybrid cDNA library |
以PRRSV N蛋白作为诱饵,与猪肺cDNA酵母文库进行杂交,在显微镜下观察到三叶草型二倍体酵母菌,表明诱饵酵母Y2HGold与文库酵母Y187发生了杂交融合(图 1C)。将Y2HGold [pGBKT7-p53]和Y187[pGADT7-T]的混合菌液分别涂布于QDO(SD/-His/-Trp/-Leu)及QDO/X/A(SD/-Leu/-Trp/X-α-Gal/AbA)培养基,并将Y2HGold[pGBKT7-Lam]和Y187[pGADT7-T]的混合菌株设为阴性对照。结果显示,试验组及阴性对照组在QDO培养基上生长均呈现粉白色,试验组在QDO/X/A培养基中生长呈现蓝色而阴性对照组在QDO/X/A培养基上无菌落生长,证明本杂交系统成立。将试验组在QDO平板上生长出的粉白色菌落进一步接种于QDO/X/A平板上,生长出三个蓝色菌落并将其扩大培养,提取酵母质粒进行测序,其中两个菌落内质粒包含片段与40S核糖体蛋白S20(RPS20)的第87—357位氨基酸序列相似性达到100%(图 1D)。初步判定PRRSV N蛋白能够与RPS20第87—357位氨基酸在酵母细胞内发生互作关系。
2.2 确定N蛋白与RPS20互作关系为进一步验证N蛋白与RPS20蛋白之间的相互作用,构建真核表达质粒pcDNA3.1-RPS20-HA和pcDNA3.1-N-Flag,共转染至MARC-145细胞,进行免疫共沉淀试验。结果显示N蛋白与RPS20蛋白在细胞内存在互作(图 2A)。同时将pcDNA3.1-RPS20-HA转染至MARC-145细胞,感染0.1 MOI PRRSV,24 h后收集蛋白样品进行免疫共沉淀,结果显示RPS20蛋白可以与病毒感染后的细胞内的N蛋白相互结合(图 2B)。

|
A. RPS20与PRRSV N蛋白互作的鉴定;B. RPS20与内源性PRRSV N蛋白互作的鉴定;C. 激光共聚焦试验检测过表达的N和细胞内源RPS20亚细胞定位 A. Identification of the interaction between RPS20 and N; B. Identification of interaction between RPS20 and endogenous PRRSV N protein; C. Detection of the subcellular localization of exogenous RPS20 and N protein 图 2 RPS20与PRRSV N蛋白互作的验证 Fig. 2 The interaction between RPS20 and PRRSV N protein was identified |
采用激光共聚焦检测N蛋白与RPS20蛋白在MARC-145细胞内的亚细胞定位。在转染了pcDNA3.1-N-Flag细胞中,N蛋白主要定位于细胞质中;RPS20定位在细胞核与细胞质中,N与内源性RPS20共定位于细胞质中(图 2C)。
2.3 过表达RPS20对PRRSV在MARC-145中复制的影响为验证RPS20蛋白对PRRSV复制的影响,首先将不同剂量pcDNA3.1-RPS20-HA转染MARC-145细胞,24 h后检测细胞活力,结果显示质粒转染量≤1 μg时对MARC-145细胞并无细胞毒性(图 3A)。转染pcDNA3.1-RPS20-HA和pcDNA3.1-HA空载后24 h感染PRRSV(0.1 MOI),分别于感染后24和36 h收集细胞和上清,分别测定病毒滴度和ORF7 mRNA表达水平。结果显示,转染pcDNA3.1-RPS20-HA的细胞组病毒滴度低于空载组(图 3B),ORF7 mRNA表达量低于空载组(图 3C)。进而将0、0.5、1.0 μg pcDNA3.1-RPS20-HA转染MARC-145细胞,24 h后感染0.1 MOI PRRSV,通过荧光定量PCR、Western blot、TCID50方法检测RPS20蛋白对PRRSV复制的影响。结果显示,随着pcDNA3.1-RPS20-HA转染量的增加,病毒滴度(图 3D)、PRRSV ORF7 mRNA表达量(图 3E)和N蛋白表达水平(图 3F)均显著降低,表明过表达RPS20降低PRRSV在MARC-145中的复制水平,且呈剂量依赖性。
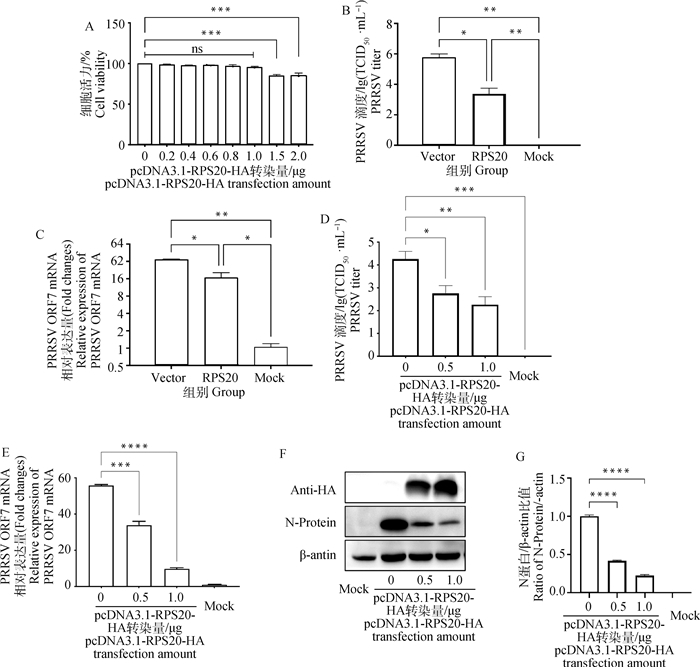
|
A. CCK-8法测定质粒对细胞的毒力影响;B. TCID50法测定RPS20对PRRSV毒力的影响;C. qPCR法测定RPS20对PRRSV复制的影响;D. 不同剂量RPS20对PRRSV滴度的影响;E. qPCR法测定不同剂量RPS20对PRRSV复制的影响;F、G. Western blot法及蛋白灰度值统计测定不同剂量RPS20对PRRSV复制的影响。*.P < 0.05;**.P < 0.01;***.P < 0.001;****.P < 0.000 1 A. The effect of RPS20 on cell viability was detected by CCK-8 method; B. The effect of RPS20 on PRRSV virulence was detected by TCID50 method; C. The effect of RPS20 on PRRSV replication was detected by qPCR method; D. The effect of different doses of RPS20 on PRRSV virulence; E. The effect of different doses of RPS20 on PRRSV replication was detected by qPCR method; F, G. The effect of different doses of RPS20 on PRRSV replication determined was detected by Western blot method and statistics of protein band gray value. *.P < 0.05; **. P < 0.01; ***. P < 0.001; ****. P < 0.000 1 图 3 过表达RPS20对PRRSV在MARC-145中复制的影响 Fig. 3 Effect of overexpression of RPS20 on replication of PRRSV in MARC-145 |
将48 pmol·L-1的siRPS20和无关对照NC转染至MARC-145细胞中,分别在24和36 h收集细胞,通过qPCR测定细胞中的RPS20 mRNA表达量。图 4A结果显示,siRNA-129在24和36 h均能降低RPS20 mRNA表达量。转染siRPS20-129后36 h收集细胞蛋白,结果显示siRNA-129可有效降低细胞内RPS20蛋白表达量(图 4B、C)。

|
A. 通过荧光定量PCR筛选出有效的siRPS20;B、C. 使用siRNA-129后RPS20的蛋白质表达及蛋白灰度值统计图;D.通过qPCR检测siRNA-129对PRRSV复制的影响;E.通过TCID50试验检测siRNA-129对PRRSV的影响;F~H.通过Western blot及蛋白灰度值统计检测siRNA-129对PRRSV复制的影响。*.P < 0.05;**.P < 0.01;***.P < 0.001;****.P < 0.000 1 A. Screening of the effective siRPS20 by fluorescence quantitative PCR; B, C. Protein expression of RPS20 after using siRNA-129 and statistical diagram of protein band gray value; D. The effect of siRNA-129 on PRRSV replication was detected by qPCR; E. The effect of siRNA-129 on PRRSV was detected by TCID50assay; F-H. The effect of siRNA-129 on PRRSV replication was detected by Western blot and statistics of protein band gray value. *.P < 0.05; **. P < 0.01; ***. P < 0.001; ****. P < 0.000 1 图 4 干扰RPS20对PRRSV在MARC-145中复制的影响 Fig. 4 Effect of siRPS20 on PRRSV replication in MRAC-145 |
为了验证干扰RPS20蛋白对PRRSV复制的影响,将siRNA-129转染MARC-145细胞,同时转染siRNA-NC为对照组;24 h后感染0.1 MOI PRRSV,36 h后分别收取核酸及蛋白样品。通过荧光定量PCR、病毒滴度测定和Western blot检测病毒的复制水平。结果显示,转染siRNA-129可以显著增多PRRSV感染细胞内ORF7的mRNA拷贝数(图 4D)、病毒蛋白的表达量(图 4F~H),并增高病毒的滴度(图 4E)。以上结果说明干扰细胞内RPS20蛋白的表达,可以促进PRRSV在MARC-145中的复制。
2.5 RPS20对PRRSV在PAMs中复制的影响猪是PRRSV的天然宿主,PAMs是其天然靶细胞,通过对NCBI公布的猪源(NP_001123426.1)与猴源(XP_007998872.1)RPS20蛋白的氨基酸序列进行序列比对,RPS20蛋白在猪与非洲绿猴的相似性高达99.16%。提示在PAMs内RPS20可能对PRRSV复制发挥作用。首先探究PRRSV增殖是否影响PAMs内RPS20蛋白的表达,试验采用0.01MOI、0.1MOI和1MOI PRRSV感染PAMs,24 h后收集细胞蛋白,通过Western blot方法及灰度值统计分析测定RPS20的蛋白表达量。结果显示PAMs中不同剂量PRRSV感染并不改变细胞内RPS20的蛋白表达(图 5A~C)。
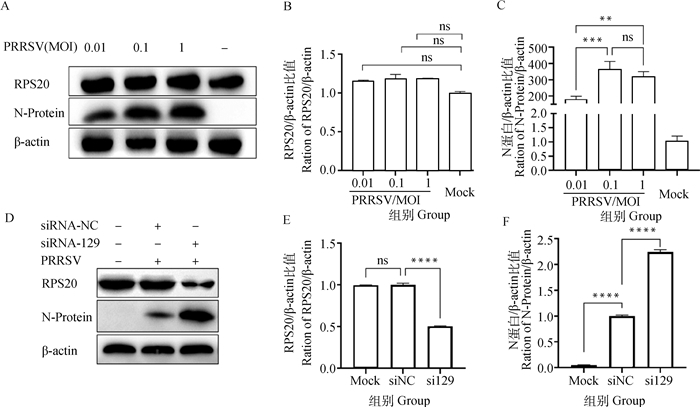
|
A.通过Western blot方法测定不同感染剂量PRRSV对PAMs内RPS20蛋白表达的影响;B、C.图A蛋白条带灰度值统计图;D.通过Western blot检测siRNA-129对PRRSV复制的影响; E、F.图D蛋白条带灰度值统计图。*.P < 0.05;**.P < 0.01;***.P < 0.001;****.P < 0.000 1 A. The effect of different infection doses of PRRSV on the expression of RPS20 protein in PAMs was determined by Western blot; B, C. statistical diagram of protein band gray value in Figure A; D. The effect of siRNA-129 on PRRSV replication was detected by Western blot; E, F. statistical diagram of protein band gray value in Figure D. *.P < 0.05; **. P < 0.01; ***. P < 0.001; ****. P < 0.000 1 图 5 RPS20对PRRSV在PAMs中复制的影响 Fig. 5 Effect of RPS20 on PRRSV replication in PAMs |
为了进一步验证RPS20蛋白对PRRSV在PAMs中复制的影响,将siRNA-129转染PAMs,同时转染siRNA-NC为对照组;24 h后感染0.1 MOI PRRSV,24 h后收取蛋白样品。通过Western blot方法及灰度值统计分析测定PRRSV N蛋白和RPS20蛋白表达量。结果显示,干扰RPS20会增强PRRSV在PAMs的复制(图 5D~F)。以上结果说明干扰细胞内RPS20蛋白的表达,可以促进PRRSV在PAMs中的复制。
3 讨论PRRSV在病毒的传播和进化过程中易发生变异,传统的疫苗保护效果不佳,迫切需要新的研究思路来降低该病毒对养殖行业的影响[2, 9]。以宿主蛋白为靶向的抗病毒药物能够避免病毒耐药性的发生,因此针对PRRSV复制的互作宿主蛋白的筛选至关重要。PRRSV核衣壳蛋白N的基本功能是形成病毒衣壳,并封装病毒基因组,其在动物体内具有高度的免疫原性,是病毒感染后产生水平最高且最久的蛋白[10]。它与多种宿主细胞蛋白相互作用,如原纤维蛋白[11]、PARP-1[12]、S100A9[13]、TRIM25[14]和TSG101[15],通过与以上细胞因子互作能够调节PRRSV感染。继续筛选与N蛋白互作的宿主蛋白,将为PRRSV的感染机制及宿主靶向的PRRSV药物提供新的理论基础。
Y2H是一种蛋白互作的研究方法,在建立宿主细胞或组织酵母cDNA文库的基础上,构建表达目的蛋白诱饵质粒,使其与文库杂交,通过在选择培养基上的不断筛选,筛选出能够与目的蛋白在酵母细胞内互作的宿主蛋白[16]。PRRSV感染后,首先入侵肺泡巨噬细胞,经胞吞作用进入细胞后,激活炎症因子的释放,并在巨噬细胞内迅速增殖繁衍,最终导致其破裂、溶解[17]。感染猪呈现出典型的间质性肺炎,肺是猪最重要的靶器官[18]。因此选择仔猪肺组织构建酵母cDNA文库更容易筛选到与病毒蛋白互作且与病毒致病性相关的宿主蛋白。本研究筛选PRRSV、PCV2、PRV和CSFV核酸和抗体均为阴性的4周龄健康仔猪,无菌采取其肺组织,使用Make Your Own “Mate & PlateTM” Library System cDNA文库构建系统,利用SMART技术和同源重组技术,构建了猪肺酵母cDNA文库,所构建文库插入片段和文库库容量均符合SMART建库要求。
本试验通过Y2H系统筛选出在酵母细胞中与N蛋白相互作用的宿主蛋白——RPS20,并通过免疫共沉淀证明RPS20蛋白与PRRSV感染细胞内的N蛋白存在互作。通过激光共聚焦证实N蛋白与内源RPS20蛋白存在亚细胞共定位。RPS20在PRRSV复制过程中的作用尚未明确,故本试验采用荧光定量PCR、Western blot、TCID50等方法检测干扰或过表达RPS20对ORF7 mRNA、N蛋白和病毒滴度的影响。结果发现过表达RPS20能够降低PRRSV的复制水平,反之,干扰RPS20后病毒的复制水平提高,说明RPS20对PRRSV的复制过程存在一定的影响。
核糖体蛋白(ribosomal protein,RP)是核糖体的重要组成部分,对蛋白质的合成、细胞的分裂、增殖、分化和凋亡具有重要调节作用[19]。核糖体蛋白被病毒“策反”会导致功能异常,因此核糖体蛋白已经成为许多疾病治疗中的潜在宿主靶点[18]。RPS20属于核糖体蛋白S10P家族,是细胞核糖体蛋白的重要组成部分。研究表明RPS20与猪脑心肌炎病毒VP1蛋白存在互作[20],与草鱼呼肠孤病毒VP7蛋白相互作用[21];RPS20可以减少早期的细胞凋亡,其在乙型流感病毒的复制过程中起到重要的作用[22]。另有研究者发现在缺乏干扰素应答的细胞系中RPS20参与痘病毒的复制和特异性蛋白的合成[23]。在本研究中,RPS20不仅能够与PRRSV N蛋白相互作用,还影响PRRSV的天然靶细胞内的PRRSV的增殖。可见RPS20在PRRSV复制过程中起着重要作用。另外在激光共聚焦试验中,在转染了pcDNA3.1-N-Flag的细胞中,N蛋白主要定位于细胞质中;RPS20定位在细胞核与细胞质中,N蛋白与内源性RPS20共定位于细胞质中,推测RPS20对PRRSV增殖的影响可能与其蛋白质的合成有关,具体机制还需进一步探究。RPS20能够参与细胞的增殖并与细胞凋亡有关[24]。而在PRRSV体外感染的PAM细胞中,前期PRRSV趋向于抗凋亡,后期趋向于促进凋亡[25]。PRRSV感染仔猪的肺组织和胸腺中也能够检测到细胞凋亡[26]。因此,RPS20是否参与到PRRSV对猪体的凋亡调控,也有待进一步研究。
综上,本研究通过构建猪肺酵母cDNA文库,采用酵母双杂交、免疫共沉淀、激光共聚焦、过表达试验和干扰试验等手段,证实PRRSV N蛋白与宿主蛋白RPS20蛋白相互作用,且RPS20对PRRSV的复制存在明显影响。提示RPS20可作为潜在宿主靶点进行深入研究,为PRRSV抗病毒研究提供新思路和新方向。
4 结论本研究通过酵母双杂交发现了与PRRSV N蛋白互作的宿主蛋白RPS20,并确定RPS20对PRRSV的增殖具有抑制作用。
| [1] |
DONE S, PATON D. Porcine reproductive and respiratory syndrome: clinical disease, pathology and immunosuppression[J]. Vet Rec, 1995, 136(2): 32-35. DOI:10.1136/vr.136.2.32 |
| [2] |
SCORTTI M, PRIETO C, ALVAREZ E, et al. Failure of an inactivated vaccine against porcine reproductive and respiratory syndrome to protect gilts against a heterologous challenge with PRRSV[J]. Vet Rec, 2007, 161(24): 809-813. |
| [3] |
HOLTKAMP D J, KLIEBENSTEIN J B, NEUMANN E J, et al. Assessment of the economic impact of porcine reproductive and respiratory syndrome virus on United States pork producers[J]. J Swine Health Prod, 2013, 21(2): 72-84. |
| [4] |
WOOTTON S K, YOO D. Homo-oligomerization of the porcine reproductive and respiratory syndrome virus nucleocapsid protein and the role of disulfide linkages[J]. J Virol, 2003, 77(8): 4546-4557. DOI:10.1128/JVI.77.8.4546-4557.2003 |
| [5] |
DOKLAND T. The structural biology of PRRSV[J]. Virus Res, 2010, 154(1-2): 86-97. DOI:10.1016/j.virusres.2010.07.029 |
| [6] |
LIN J S, LAI E M. Protein-protein interactions: yeast two-hybrid system[M]//JOURNET L, CASCALES E. Bacterial Protein Secretion Systems. New York: Humana Press, 2017: 177-187.
|
| [7] |
PAIANO A, MARGIOTTA A, DE LUCA M, et al. Yeast two-hybrid assay to identify interacting proteins[J]. Curr Protoc Protein Sci, 2019, 95(1): e70. DOI:10.1002/cpps.70 |
| [8] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [9] |
ROSE N, RENSON P, ANDRAUD M, et al. Porcine reproductive and respiratory syndrome virus (PRRSv) modified-live vaccine reduces virus transmission in experimental conditions[J]. Vaccine, 2015, 33(21): 2493-2499. DOI:10.1016/j.vaccine.2015.03.040 |
| [10] |
MUSIC N, GAGNON C A. The role of porcine reproductive and respiratory syndrome (PRRS) virus structural and non-structural proteins in virus pathogenesis[J]. Anim Health Res Rev, 2010, 11(2): 135-163. DOI:10.1017/S1466252310000034 |
| [11] |
YOO D, WOOTTON S K, LI G, et al. Colocalization and interaction of the porcine arterivirus nucleocapsid protein with the small nucleolar RNA-associated protein fibrillarin[J]. J Virol, 2003, 77(22): 12173-12183. DOI:10.1128/JVI.77.22.12173-12183.2003 |
| [12] |
LIU L, LEAR Z, HUGHES D J, et al. Resolution of the cellular proteome of the nucleocapsid protein from a highly pathogenic isolate of porcine reproductive and respiratory syndrome virus identifies PARP-1 as a cellular target whose interaction is critical for virus biology[J]. Vet Microbiol, 2015, 176(1-2): 109-119. DOI:10.1016/j.vetmic.2014.11.023 |
| [13] |
SONG Z B, BAI J, LIU X W, et al. S100A9 regulates porcine reproductive and respiratory syndrome virus replication by interacting with the viral nucleocapsid protein[J]. Vet Microbiol, 2019, 239: 108498. DOI:10.1016/j.vetmic.2019.108498 |
| [14] |
ZHAO K, LI L W, JIANG Y F, et al. Nucleocapsid protein of porcine reproductive and respiratory syndrome virus antagonizes the antiviral activity of TRIM25 by interfering with TRIM25-mediated RIG-I ubiquitination[J]. Vet Microbiol, 2019, 233: 140-146. DOI:10.1016/j.vetmic.2019.05.003 |
| [15] |
ZHANG L X, LI R, GENG R, et al. Tumor susceptibility gene 101 (TSG101) contributes to virion formation of porcine reproductive and respiratory syndrome virus via interaction with the nucleocapsid (N) protein along with the early secretory pathway[J]. J Virol, 2022, 96(6): e0000522. DOI:10.1128/jvi.00005-22 |
| [16] |
王玉娥, 杨汉春. 酵母双杂交技术在病毒学研究中的应用[J]. 中国兽医学报, 2004, 24(3): 307-309. WANG Y E, YANG H C. Applicating yeast two hybrid system in research of virology[J]. Chinese Journal of Veterinary Science, 2004, 24(3): 307-309. DOI:10.3969/j.issn.1005-4545.2004.03.033 (in Chinese) |
| [17] |
CHANG C C, YOON K J, ZIMMERMAN J J, et al. Evolution of porcine reproductive and respiratory syndrome virus during sequential passages in pigs[J]. J Virol, 2002, 76(10): 4750-4763. DOI:10.1128/JVI.76.10.4750-4763.2002 |
| [18] |
BEYER J, FICHTNER D, SCHIRRMEIER H, et al. Porcine reproductive and respiratory syndrome virus (PRRSV): kinetics of infection in lymphatic organs and lung[J]. J Vet Med B Infect Dis Vet Public Health, 2010, 47(1): 9-25. |
| [19] |
LAI M D, XU J. Ribosomal proteins and colorectal cancer[J]. Curr Genomics, 2007, 8(1): 43-49. DOI:10.2174/138920207780076938 |
| [20] |
张元峰, 张昆丽, 薛娟, 等. 猪脑心肌炎病毒VP1蛋白与宿主RPS20蛋白相互作用研究[J]. 中国预防兽医学报, 2018, 40(8): 715-719. ZHANG Y F, ZHANG K L, XUE J, et al. Encephalomyocarditis virus VP1 interacts with ribosomal protein 20[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(8): 715-719. (in Chinese) |
| [21] |
YAN X Y, XIE J G, LI J, et al. Screening and analysis on the protein interaction of the protein VP7 in grass carp reovirus[J]. Virus Genes, 2015, 50(3): 425-433. DOI:10.1007/s11262-015-1193-x |
| [22] |
喻宏, 姚立红, 陈爱君, 等. 应用酵母双杂交系统筛选与乙型流感病毒BM2相互作用的蛋白质[J]. 中华实验和临床病毒学杂志, 2005, 19(2): 182-184. YU H, YAO L H, CHEN A J, et al. Screening for new binding proteins which interact with BM2 of influenza B virus with yeast two-hybrid system[J]. Chinese Journal of Experimental and Clinical Virology, 2005, 19(2): 182-184. DOI:10.3760/cma.j.issn.1003-9279.2005.02.024 (in Chinese) |
| [23] |
DIGIUSEPPE S, ROLLINS M G, BARTOM E T, et al. ZNF598 plays distinct roles in interferon-stimulated gene expression and poxvirus protein synthesis[J]. Cell Rep, 2018, 23(5): 1249-1258. DOI:10.1016/j.celrep.2018.03.132 |
| [24] |
KRISHNAN R, BODDAPATI N, MAHALINGAM S. Interplay between human nucleolar GNL1 and RPS20 is critical to modulate cell proliferation[J]. Sci Rep, 2018, 8(1): 11421. DOI:10.1038/s41598-018-29802-y |
| [25] |
COSTERS S, LEFEBVRE D J, DELPUTTE P L, et al. Porcine reproductive and respiratory syndrome virus modulates apoptosis during replication in alveolar macrophages[J]. Arch Virol, 2008, 153(8): 1453-1465. DOI:10.1007/s00705-008-0135-5 |
| [26] |
LABARQUE G, VAN GUCHT S, NAUWYNCK H, et al. Apoptosis in the lungs of pigs infected with porcine reproductive and respiratory syndrome virus and associations with the production of apoptogenic cytokines[J]. Vet Res, 2003, 34(3): 249-260. DOI:10.1051/vetres:2003001 |
(编辑 白永平)



