2. 南京农业大学 江苏省家畜胚胎工程实验室, 南京 210095
2. Jiangsu Livestock Engineering Laboratory, Nanjing Agricultural University, Nanjing 210095, China
湖羊是我国浙江嘉兴和太湖流域一带的优良绵羊品种,是我国一级保护地方畜禽品种,具有性成熟早、多胎高产、生长发育快、肉质鲜嫩等优良特性[1],受到畜牧工作者的广泛重视。随着养羊业被重视程度的提高,开展良种繁育,尤其是提高雌性绵羊繁殖力已成为养羊业持续发展的一个重要决定因素。决定母羊繁殖力的两个重要因素是排卵率和子宫容受性。子宫是胚胎着床和发育的场所,直接决定着胚胎的命运,因此子宫的发育情况与繁殖力的提升直接相关。已有研究表明,Hippo通路参与卵泡发育,但是其在子宫容受性中的作用尚未见报道。
Hippo通路的核心是一个激酶级联反应,即Mst1/2激酶和SAV1形成复合体发生磷酸化,进而激活LATS1/2,LATS1/2和MOB1形成复合体发生磷酸化并使YAP1发生磷酸化[2],研究发现Hippo信号通路参与调控雌性动物的生殖系统发育[3-4]。Hippo通路可通过调控细胞增殖、凋亡及干细胞自我更新来控制器官大小[5-7]。磷酸化的YAP1与细胞质中的蛋白结合并滞留在细胞质中,随后被泛素化降解,由此抑制YAP1的促生长、抗凋亡等功能。有研究表明,YAP1的激活能够诱导细胞增殖,并建立一个免疫抑制的局部环境,允许胎儿着床到子宫上皮,保证牛早期妊娠的正常进行[8]。建立良好的子宫容受性有利于早期妊娠的正常进行。但是,YAP1对于湖羊子宫容受性建立的影响未见报道。
子宫内膜基质细胞是子宫组织中含量最多的一种细胞,其分布于子宫腺之间,主要参与蜕膜化过程[9]。子宫内膜基质细胞蜕膜化是一个受多基因调控的子宫内膜基质细胞增殖与分化过程,对胚胎着床、胎盘功能的维持及胎儿的生长发育具有重要作用[10]。线粒体作为细胞内能量供应的重要细胞器,在细胞分化、增殖和凋亡等过程中起着重要作用。但是,YAP1基因对子宫内膜细胞增殖和线粒体功能的影响尚不清楚。
综上所述,YAP1参与调控机体内多种生理过程的研究已广泛开展,其能够参与机体内多项生物学活动,但国内外却鲜有YAP1对于家畜生殖器官发育影响的研究。因此,本试验以高、低繁殖力湖羊为研究对象,研究Hippo通路核心因子在不同繁殖力湖羊子宫中的表达差异以及效应基因YAP1对子宫容受性的影响及可能存在的调控机制,阐明Hippo通路在不同繁殖力湖羊子宫中的表达模式及YAP1调控子宫容受性可能存在的分子机制,为高繁殖力母羊的分子培育提供新的思路和途径。
1 材料与方法 1.1 试验动物及采样本试验所用湖羊来源于江苏省泰州市海伦羊业有限公司。根据系谱档案在体况相近、健康的经产母羊中筛选出高繁湖羊群体(连续3胎产3羔)和低繁湖羊群体(连续3胎产1羔)。依据BMPR-1B基因多态性分析将候选湖羊分为3组:FecBBB基因型的高繁和低繁湖羊组(HBB/LBB, n=3),FecBB+基因型低繁湖羊组(LB+,n=3)。3组湖羊采取单栏饲养,所有动物都被安置在相同的条件下,自由获得饲料和水。阴道内海绵同步发情周期11 d。利用试情公羊检测发情行为并记录,在第二次自然发情时屠宰,并收集子宫内膜、下丘脑、垂体、卵巢、输卵管、松果体、心、肝、脾、肺、肾、肌肉等12个组织,在液氮中迅速冷冻后转移至-80 ℃超低温冰箱冻存。
1.2 YAP1基因的氨基酸和系统进化树分析利用NCBI网站获取并下载山羊、牛、猪、人、鸡、大鼠和小鼠的YAP1氨基酸序列,利用DNAMAN 6.0软件进行氨基酸序列比对,用MEGA 7.0软件进行系统进化树分析。
1.3 细胞培养与转染本试验中子宫内膜基质细胞的分离及鉴定参照文献[11]。在添加15% FBS的DMEM/F12培养基中培养ESC。用1 mL 0.25%胰蛋白酶消化1 min后制成细胞悬液接种于6孔细胞培养板中,在光学显微镜下观察到细胞密度达到70%左右时,按照LipofectamineⓇ3000试剂盒说明书将si-NC、si-YAP1转染至细胞内。si-NC和si-YAP1序列由上海吉玛公司设计与合成,其具体序列见表 1。所有细胞均置于37 ℃、5% CO2培养箱中培养,并进行各项指标检测。
|
|
表 1 YAP1基因干扰序列 Table 1 Sequences of YAP1 gene interference |
用Trizol试剂盒(Invitrogen)提取子宫组织及转染si-NC和si-YAP1的ESC内总RNA,分光光度计检测其纯度和浓度(1.8 < OD260 nm/OD280 nm < 2.0) 后,反转录获得cDNA。按照以下反应体系进行RT-qPCR:SYBR MIX 10.0 μL,上、下游引物各0.6 μL,cDNA 1.0 μL,加入ddH2O补充体系至20 μL。反应条件:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。样本基因的表达强度用其对应的ACTB基因的表达强度进行校正,即ΔCT=CT(目的基因)-CT(ACTB基因),基因相对表达量采用2-ΔΔCt法计算。所有的引物具体信息见表 2。
|
|
表 2 基因引物序列 Table 2 Primer sequences of genes |
细胞转染72 h后,向6孔板中加入含苯甲基磺酰氟(PMSF)的裂解液,冰上裂解30 min。用细胞刮收集细胞,12 000 r·min-1离心15 min,收集上清液,用BCA试剂盒检测蛋白浓度。蛋白变性后取10 μg蛋白采用SDS-PAGE电泳分离处理,结束后用半干转法转印硝酸纤维膜,5%脱脂奶粉室温封闭1 h,加一抗(YAP1抗体,1∶1 000稀释;Bax抗体,1∶5 000稀释;Bcl-2抗体,1∶1 000稀释;ACTB抗体,1∶5 000稀释),4 ℃过夜孵育。次日加入二抗(HRP标记的山羊抗兔/鼠IgG,1∶5 000稀释),室温孵育1 h,用化学发光法显色,用ImageJ软件进行灰度分析。以ACTB作为内参,分析目的蛋白的表达。
1.6 细胞凋亡检测利用Annexin-V FITC/PI双染法检测细胞凋亡,即细胞转染24 h后,弃培养液,DPBS洗3次,用细胞消化液处理并收集细胞;收集到的细胞再用PBS洗两次,随后加入500 μL的Binding Buffer重悬浮细胞,之后加入Annexin V-FITC与PI染液,室温避光反应5~15 min;最后,用流式细胞术进行检测。
1.7 统计学分析本研究所涉及试验均重复至少3次,试验数据以“平均值±标准差(mean±SD)”表示。试验数据先用Excel 2019处理,用GraphPad Prism 8.0软件分析数据并作图,两组间比较采用独立样本t检验,3组及以上比较采用单因素方差分析,并且选择LSD法进行多重比较。P < 0.05表示差异有统计学意义。
2 结果 2.1 高繁(HBB)和低繁(LBB/LB+)湖羊组织中Hippo通路核心基因表达差异如图 1所示,Hippo通路中的LATS1和MST1基因在高繁湖羊(HBB)子宫内膜组织中的表达量显著低于低繁(LBB/LB+)湖羊(P < 0.05)。MST2基因表达量在高繁(HBB)湖羊和低繁(LBB/LB+)湖羊组织差异不显著。只有YAP1基因在高繁湖羊(HBB)组织中的表达量显著高于低繁(LBB/LB+)湖羊(P < 0.05)。因此,接下来YAP1基因将作为目的基因进行进一步的探究。
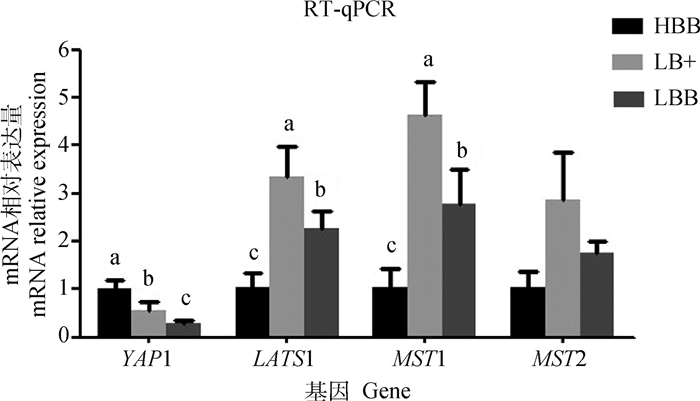
|
图中数据为3次生物学重复的“平均值±标准差”。柱上不同小写字母表示基因表达量在不同繁殖力湖羊间差异显著(P < 0.05,单因素方差分析) Data in the figure are "means±SD" of three biological replicates. Different small letters above bars indicate that the gene expression levels were significantly different in Hu sheep with different fertility (P < 0.05, one-way ANOVA) 图 1 高繁(HBB)和低繁(LBB/LB+)湖羊子宫组织中Hippo通路核心基因表达量 Fig. 1 Relative expression levels of genes in Hippo pathway in uterus of Hu sheep with high or low fertility |
氨基酸序列同源性分析结果(图 2A)显示,YAP1氨基酸序列与山羊和牛的同源性最高,分别为95.94%和95.04%。系统进化树分析结果(图 2B)表明,绵羊YAP1蛋白与山羊和牛聚为一组,亲缘关系最近。

|
A. DNAMAN软件分析绵羊、山羊、牛、猪、人、鸡、大鼠和小鼠YAP1的氨基酸序列相似性;B. 绵羊、山羊、牛、猪、人、鸡、大鼠和小鼠YAP1的蛋白同源性分析 A. The similarity of YAP1 amino acid sequences of sheep, goat, cattle, pig, human, chicken, rat and mouse was analyzed using DNAMAN software; B. Homology analysis of YAP1 protein in sheep, goat, cattle, pig, human, chicken, rat and mouse 图 2 湖羊与其他物种YAP1氨基酸序列比较 Fig. 2 Comparison of amino acid sequences of YAP1 in different species |
通过RT-qPCR检测了YAP1基因在湖羊子宫、心、肝、肾、下丘脑、肌肉等12种组织中的表达情况(图 3):YAP1基因在被检测的12种组织中均有表达,在肌肉中表达量最高,在心中表达量最低。在下丘脑-垂体-生殖轴中,YAP1在子宫中表达仅次于松果体和输卵管。

|
图中数据为3次生物学重复的“平均值±标准差”。柱上不同小写字母表示基因表达量在不同组织间差异显著(P < 0.05,单因素方差分析) Data in the figure are "means±SD" of three biological replicates. Different small letters above bars indicate that the gene expression levels were significantly different in different tissues (P < 0.05, one-way ANOVA) 图 3 湖羊YAP1基因组织表达分析 Fig. 3 Expression analysis of YAP1 gene in various tissues of Hu sheep |
RT-qPCR结果(图 4A)显示,较si-NC组,si-YAP1组中YAP1 mRNA表达量显著降低(P < 0.05)。Western blot检测结果(图 4B)显示,转染si-YAP1后,YAP1蛋白表达水平显著降低(P < 0.05)。以上结果显示si-YAP1能够有效地抑制YAP1的表达,可用于后续试验。
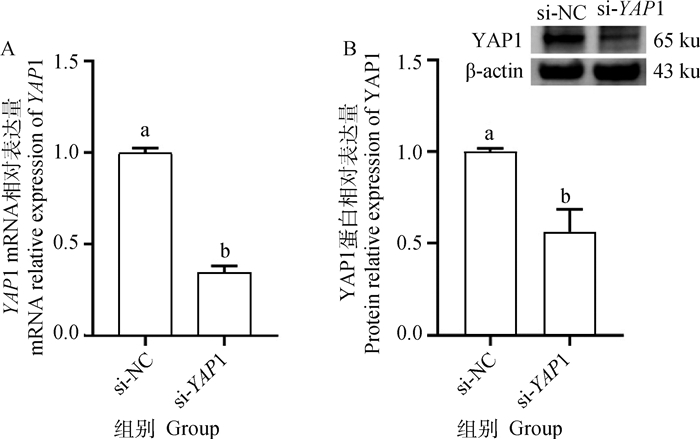
|
图中数据为3次生物学重复的“平均值±标准差”。柱上不同小写字母表示基因及蛋白表达量在试验组和对照组间差异显著(P < 0.05,独立样本t检验)。下同 Data in the figure are "means±SD" of three biological replicates. Different small letters above bars indicate that the gene and protein expression levels were significantly different between test group and control group (P < 0.05, independent-samples t test). The same as below 图 4 YAP1基因的siRNA干扰效率检测 Fig. 4 Detection of siRNA interference efficiency of YAP1 gene |
如图 5所示,干扰YAP1基因能够显著下调FOXO1、PRL、VEGF和OPN mRNA的表达水平(P < 0.05),显著上调COX-2 mRNA的表达水平(P < 0.05)。
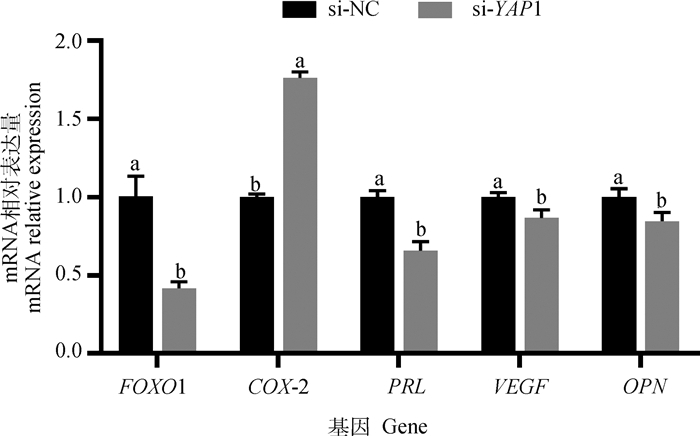
|
图 5 干扰YAP1对子宫内膜基质细胞容受性相关基因表达的影响 Fig. 5 Effects of YAP1 interference on receptivity related genes expression in endometrial stromal cells |
如图 6所示,干扰YAP1后,子宫内膜基质细胞的凋亡率显著上升(图 6A)。RT-qPCR结果(图 6B)显示,干扰YAP1显著上调了子宫内膜基质细胞中Bax、BIM、p53、caspase3、caspase8、caspase9的mRNA表达水平(P < 0.05),显著降低了Bcl-2的mRNA表达水平(P < 0.05),且Bax/Bcl-2的比值显著升高。Western blot结果(图 6C)显示,干扰YAP1后Bax的蛋白表达量显著升高(P < 0.05),Bcl-2的蛋白表达量显著下降(P < 0.05),Bax/Bcl-2的比值也显著升高(P < 0.05)。
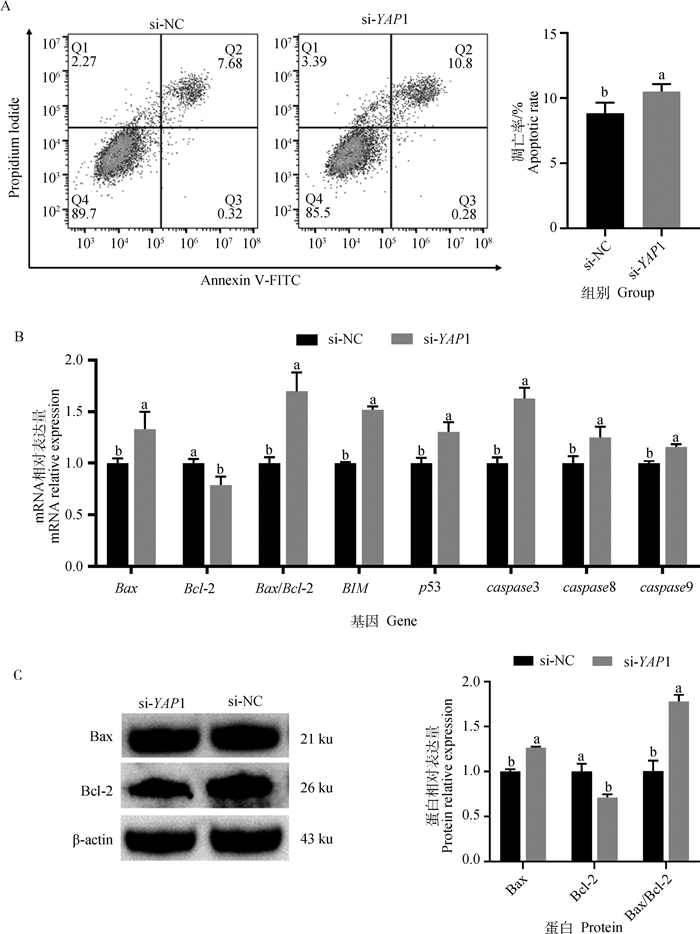
|
A.流式细胞术分析干扰YAP1对子宫内膜基质细胞凋亡的影响;B.干扰YAP1对子宫内膜基质细胞凋亡相关基因表达的影响;C.干扰YAP1后Bax和Bcl-2蛋白表达情况变化。数据结果以“平均数±标准差”表示且以si-NC为对照 A. Endometrial stromal cell apoptosis was detected after interfering YAP1 gene by flow cytometer; B. Effects of YAP1 interference on mRNA relative expression of apoptosis-related genes in endometrial stromal cells; C. Effects of YAP1 interference on Bax and Bcl-2 proteins expression in endometrial stromal cells. The results are expressed relative to the si-NC group as "mean±SD" 图 6 干扰YAP1对湖羊子宫内膜基质细胞凋亡的影响 Fig. 6 Effects of YAP1 interference on the apoptosis of Hu sheep endometrial stromal cells |
如图 7所示,干扰YAP1后FIS1、DNM1L的mRNA表达水平显著升高(P < 0.05),MFN2、PPARGC1A、OPA1的mRNA表达量显著降低(P < 0.05),MFN1的mRNA表达水平无显著变化。
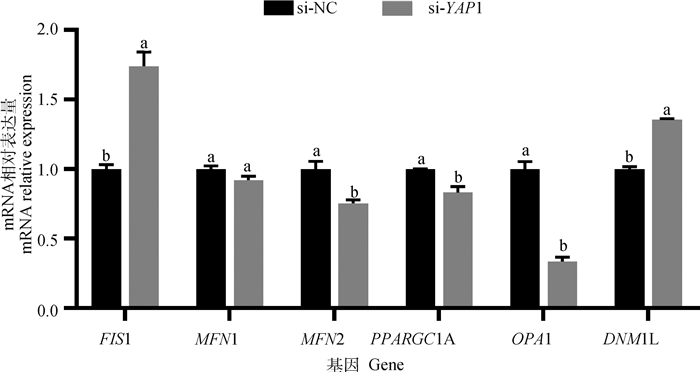
|
图 7 干扰YAP1对子宫内膜基质细胞线粒体功能相关基因表达的影响 Fig. 7 Effects of YAP1 interference on mRNA relative expression of mitochondrial function related genes in endometrial stromal cells |
近年来,YAP1参与调控机体内多种生理过程的研究已广泛开展,但YAP1在子宫容受性中的研究尚未见报道。本试验首先通过对不同繁殖力湖羊子宫组织中Hippo通路的关键基因进行定量,筛选出在高繁殖力湖羊子宫组织中显著高表达的效应基因YAP1;接下来对YAP1的序列特征进行分析;最后通过功能缺失试验探究YAP1基因影响子宫容受性潜在的分子机制。本试验发现,YAP1能够抑制子宫内膜基质细胞的凋亡从而有利于子宫容受性的建立。
Hippo通路是一个高度保守的信号传导通路,能够调控细胞的增殖、分化和死亡,进而调控器官的发育。有研究表明,Hippo通路与子宫内膜重构和子宫内膜微环境调节等有关,YAP1的活化提供早期妊娠所需环境,对雌性动物生殖力的维持至关重要;且对于奶牛子宫损伤后修复有重要作用[12]。在本试验中,检测Hippo通路核心因子MST1、MST2、LATS1及主要效应因子YAP1在高繁和低繁湖羊组织中的表达量,发现仅有YAP1的表达量在高繁湖羊中高于低繁湖羊,因此推测,在Hippo通路中,YAP1是影响湖羊子宫发育及容受性,进而导致繁殖力差异的主要因子。
子宫内膜容受性是指子宫内膜对胚胎的接受能力,是完成妊娠的必要条件之一[13]。胚胎植入过程中最显著的现象是胚泡植入部位血管通透性显著增加,一般认为,这是胚胎植入早期必备条件之一[14]。而新血管的形成是成功维持妊娠的基础[15],VEGF作为一种有效的血管生成因子发挥着核心作用,通过调控血管生成促进胚胎的成功植入。已证实,FOXO1通过MST1-FOXO1级联建立内皮细胞极性,在血管生成中起关键作用[16]。FOXO1作为血管生成的重要调节因子,可直接调节其他组织中VEGF的表达[17]。近期有研究表明,YAP已经被确定为将VEGF/VEGFR2信号转导到特定转录程序中的主要调节剂,这对血管形成至关重要[18]。在VEGF诱导的血管生成中,VEGFR-2可以与整合素αvβ3相互作用[19]。整合素αvβ3是胚胎植入过程中的重要黏附分子,糖蛋白骨桥蛋白(OPN)是其配体糖蛋白,胚胎整合素αvβ3与子宫内膜OPN的相互作用被认为参与了胚胎与子宫内膜腔上皮的黏附[20]。COX-2是胚囊着床时唯一可以在子宫内膜上皮和基质细胞中表达的环氧化酶,其可以促进着床部位的内膜血管再生以及血管通透性增加,有利于胚胎植入与妊娠的建立[21]。此外,在小鼠中,敲除COX-2后,野生型囊胚未能植入,且正常的蜕膜化反应受损,这表明COX-2在植入过程中发挥了重要作用[22]。在妊娠各期,前列腺素都可以促进子宫平滑肌收缩,COX-2的过度表达可能会导致前列腺素表达上升,降低子宫内膜容受性。分泌性子宫内膜通过黄体酮的直接作用合成PRL,在黄体晚期达到最大产量,诱导孕酮介导的基质细胞蜕膜。同时,在蜕膜过程中,子宫内膜基质细胞产生的PRL对造血细胞有显著的促增殖和抗凋亡作用[23]。本研究中,沉默YAP1后FOXO1、VEGF、PRL和OPN mRNA水平明显降低,而COX-2 mRNA水平明显升高,说明YAP1可能有增加子宫内膜血管通透性、增加子宫与胚胎黏附性,减少前列腺素分泌,抑制子宫收缩,促进PRL分泌,促进子宫蜕膜化,从而维持妊娠的作用。
细胞的凋亡受到细胞内凋亡蛋白的调控,是一个极其复杂的生理过程。caspase是一组促使细胞凋亡的蛋白酶,在细胞凋亡机制网络中处于核心地位。caspase3是caspase级联反应下游中的一个关键凋亡蛋白酶,可被caspase8、caspase9等活化,能够激活外源性细胞凋亡途径和由线粒体调节的内源性凋亡途径[24]。在细胞凋亡进程中,Bcl-2家族也发挥重要作用,有研究者提出Bax/Bcl-2可以体现细胞在受凋亡刺激后的存活比例[25],比值降低,能减少细胞凋亡数量,相反则增加细胞凋亡数量。BIM是Bcl-2家族中的促凋亡蛋白成员之一[26],能结合并转位凋亡蛋白Bax到线粒体上,促进细胞凋亡。p53也是重要的细胞凋亡调节因子,通过调节Bax和Bcl-2诱导细胞凋亡[27]。Bax蛋白是组成线粒体膜上离子通道的部分,能够帮助细胞色素C穿过线粒体膜,激活Caspase级联反应,促进细胞凋亡。而Bcl-2作为凋亡抑制基因,能够阻止上述过程,抑制细胞凋亡[28-29]。研究发现,抑制YAP1能够加快人宫颈癌Hela细胞的凋亡,这可能与激活p53及Fra-1基因相关[30]。通过靶向抑制剂CA3抑制肝癌HepG2细胞中YAP1的转录活性后发现,Bcl-2表达降低,Bax、caspase3表达升高,HepG2细胞增殖受到抑制、凋亡率增加[31]。本试验中,干扰YAP1基因后细胞凋亡率明显升高,RT-qPCR检测发现p53、caspase3、caspase8、Bax的mRNA表达水平明显升高,Bcl-2的mRNA水平明显降低,Bax/Bcl-2比值明显上升。以上结果与前人在其他不同细胞类型上的研究结果相似,说明YAP1的表达会对细胞凋亡过程产生抑制作用。干扰YAP1后线粒体的融合可能受到阻碍,从而导致线粒体紊乱,触发凋亡级联反应。细胞凋亡的两种主要途径是内在的线粒体途径和外在的死亡受体途径,内在和外在途径都会受到p53的调控且这两种途径最终都会导致caspase蛋白酶家族的激活,YAP1的表达可在一定程度上抑制这两种途径的激活。
线粒体是细胞的“能量工厂”,通过不断分裂和融合,能够调节膜电位,间接决定着组织细胞的功能甚至存亡[32]。其中,FIS1是线粒体分裂的重要调节因子,介导线粒体分裂复合物的组装,参与线粒体分裂,是线粒体融合分裂过程中重要的蛋白质。DNM1L也是线粒体分裂体系的重要组成成分,其可与不同物种的多种分子之间相互作用组装成高级结构,并定位于线粒体中,引起线粒体膜的融合和分裂[33]。线粒体融合过程包括外膜融合和内膜融合两步,外膜融合主要依靠线粒体外膜中的GTPase蛋白MFN1和MFN2来完成,内膜融合则是由OPA1来完成[34]。研究表明,YAP1通过过氧化物酶体增殖物激活受体γ共激活因子1α(PPARGC1A)调节小鼠血管生成[35],PPARGC1A是介导线粒体功能的主要参与者,在线粒体增殖和呼吸等生化途径中起着十分重要的作用[36]。本研究中,MFN2、OPA1和PPARGC1A mRNA水平明显下调,DNM1L和FIS1 mRNA水平明显上调,表明YAP1可能通过提高子宫内膜基质细胞内线粒体的活性调节线粒体的生物合成,进而促进子宫的生长发育和容受性。
本研究发现,YAP1基因在高繁湖羊组织中的表达量显著高于低繁湖羊。在下丘脑-垂体-生殖轴中,YAP1在子宫中的表达仅次于松果体和输卵管。干扰YAP1基因能够显著下调FOXO1、PRL、VEGF、OPN、Bcl-2、MFN2、PPARGC1A、OPA1 mRNA的表达水平,显著上调COX-2、Bax、BIM、p53、caspase3、caspase8、caspase9、FIS1、DNM1L mRNA的表达水平。所以,沉默YAP1基因后细胞凋亡率升高,促凋亡基因和蛋白的表达增加,抗凋亡基因和蛋白的表达降低。同时,促线粒体融合基因表达降低,促线粒体分裂基因表达升高,不利于线粒体正常功能的发挥。因此,干扰YAP1可能会对胚胎着床和妊娠维持产生不利影响。
4 结论本研究结果表明,沉默YAP1基因后细胞凋亡率升高,增加了促凋亡基因和蛋白的表达,降低了抗凋亡基因和蛋白的表达。同时,促线粒体融合基因表达降低,促线粒体分裂基因表达升高,不利于线粒体正常功能的发挥。因此,干扰YAP1可能会对胚胎着床和妊娠维持产生不利影响,提示YAP1可以从影响子宫内膜血管生成及通透性、细胞凋亡和线粒体融合这3个途径调控湖羊子宫的发育及容受性。抑制Hippo通路,提高YAP1基因表达量可能提高子宫容受性,有利于子宫发育,从而有利于湖羊高繁殖性能的发挥。
| [1] |
张吉顺, 刘念, 谈姣嫣, 等. 湖羊消化道各段T1R1、T1R3及PepT1基因表达水平的分析[J]. 畜牧与兽医, 2017, 49(2): 51-56. ZHANG J S, LIU N, TAN J Y, et al. Expression levels of T1R1/T1R3 and PepT1 genes in the gastrointestinal tract of Hu Sheep[J]. Animal Husbandry & Veterinary Medicine, 2017, 49(2): 51-56. (in Chinese) |
| [2] |
OUYANG T H, MENG W, LI M H, et al. Recent advances of the Hippo/YAP signaling pathway in brain development and glioma[J]. Cell Mol Neurobiol, 2020, 40(4): 495-510. DOI:10.1007/s10571-019-00762-9 |
| [3] |
李佳, 周芳月, 黄健, 等. Hippo信号通路在雌性生殖系统中的研究进展[J]. 中国细胞生物学学报, 2014, 36(12): 1689-1694. LI J, ZHOU F Y, HUANG J, et al. Research progress on Hippo signaling pathway in female reproductive system[J]. Chinese Journal of Cell Biology, 2014, 36(12): 1689-1694. (in Chinese) |
| [4] |
AN S Y, GAO X X, WANG Z B, et al. Estradiol-17β regulates proliferation and apoptosis of sheep endometrial epithelial cells by regulating the relative abundance of YAP1[J]. Anim Reprod Sci, 2020, 215: 106328. DOI:10.1016/j.anireprosci.2020.106328 |
| [5] |
CHEN H X, SONG Y, YANG S Y, et al. YAP mediates human decidualization of the uterine endometrial stromal cells[J]. Placenta, 2017, 53: 30-35. DOI:10.1016/j.placenta.2017.03.013 |
| [6] |
吉新彦, 钟国轩, 赵斌. 哺乳动物Hippo信号通路分子机制研究进展[J]. 遗传, 2017, 39(7): 546-567. JI X Y, ZHONG G X, ZHAO B. Molecular mechanisms of the mammalian Hippo signaling pathway[J]. Hereditas (Beijing), 2017, 39(7): 546-567. DOI:10.16288/j.yczz.17-094 (in Chinese) |
| [7] |
PICCOLO S, DUPONT S, CORDENONSI M. The biology of YAP/TAZ: Hippo signaling and beyond[J]. Physiol Rev, 2014, 94(4): 1287-1312. DOI:10.1152/physrev.00005.2014 |
| [8] |
ZHANG T, GUO S, ZHOU H, et al. Endometrial extracellular matrix rigidity and IFNτ ensure the establishment of early pregnancy through activation of YAP[J]. Cell Prolif, 2021, 54(2): e12976. |
| [9] |
许祺欣, 苏仁伟. 胚胎着床的过程与机制研究进展[J]. 生理学报, 2020, 72(1): 91-104. XU Q X, SU R W. Research progress in process and mechanisms of embryo implantation[J]. Acta Physiologica Sinica, 2020, 72(1): 91-104. DOI:10.13294/j.aps.2020.0004 (in Chinese) |
| [10] |
OCHOA-BERNAL M A, FAZLEABAS A T. Physiologic events of embryo implantation and decidualization in human and non-human primates[J]. Int J Mol Sci, 2020, 21(6): 1973. DOI:10.3390/ijms21061973 |
| [11] |
LI X D, YAO X L, XIE H Q, et al. PPP2R2A affects embryonic implantation by regulating the proliferation and apoptosis of Hu sheep endometrial stromal cells[J]. Theriogenology, 2021, 176: 149-162. DOI:10.1016/j.theriogenology.2021.09.026 |
| [12] |
张涛. IFN-τ和生物力激活YAP维持奶牛生殖能力的作用及机制研究[D]. 武汉: 华中农业大学, 2021. ZHANG T. Study on the function and mechanism of IFN-τ and biomechanical activating YAP to maintain reproductive ability of dairy cows[D]. Wuhan: Huazhong Agricultural University, 2021. (in Chinese) |
| [13] |
陈万方. OPN N-糖基化修饰对子宫内膜容受性建立的调控机制研究[D]. 大连: 大连医科大学, 2019. CHEN W F. Mutation of N-linked glycosylation in osteopontin affected the establishment of endometrial receptivity[D]. Dalian: Dalian Medical University, 2019. (in Chinese) |
| [14] |
SHEKIBI M, HENG S, NIE G Y. MicroRNAs in the regulation of endometrial receptivity for embryo implantation[J]. Int J Mol Sci, 2022, 23(11): 6210. DOI:10.3390/ijms23116210 |
| [15] |
CHA J, SUN X F, DEY S K. Mechanisms of implantation: strategies for successful pregnancy[J]. Nat Med, 2012, 18(12): 1754-1767. |
| [16] |
KIM Y H, CHOI J, YANG M J, et al. A MST1-FOXO1 cascade establishes endothelial tip cell polarity and facilitates sprouting angiogenesis[J]. Nat Commun, 2019, 10(1): 838. DOI:10.1038/s41467-019-08773-2 |
| [17] |
REN B. FoxO1 transcriptional activities in VEGF expression and beyond: a key regulator in functional angiogenesis?[J]. J Pathol, 2018, 245(3): 255-257. DOI:10.1002/path.5088 |
| [18] |
WANG X H, VALLS A F, SCHERMANN G, et al. YAP/TAZ orchestrate VEGF signaling during developmental angiogenesis[J]. Dev Cell, 2017, 42(5): 462-478.E7. |
| [19] |
SOLDI R, MITOLA S, STRASLY M, et al. Role of αvβ3 integrin in the activation of vascular endothelial growth factor receptor-2[J]. EMBO J, 1999, 18(4): 882-892. |
| [20] |
GUO X, YI H, LI T C, et al. Role of vascular endothelial growth factor (VEGF) in human embryo implantation: clinical implications[J]. Biomolecules, 2021, 11(2): 253. |
| [21] |
MENTER D G, SCHILSKY R L, DUBOIS R N. Cyclooxygenase-2 and cancer treatment: understanding the risk should be worth the reward[J]. Clin Cancer Res, 2010, 16(5): 1384-1390. |
| [22] |
SIERRA J C, HOBBS S, CHATURVEDI R, et al. Induction of COX-2 expression by helicobacter pylori is mediated by activation of epidermal growth factor receptor in gastric epithelial cells[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305(2): G196-G203. |
| [23] |
AURIEMMA R S, DEL VECCHIO G, SCAIRATI R, et al. The interplay between prolactin and reproductive system: focus on uterine pathophysiology[J]. Front Endocrinol, 2020, 11: 594370. |
| [24] |
MAN S M, KANNEGANTI T D. Converging roles of caspases in inflammasome activation, cell death and innate immunity[J]. Nat Rev Immunol, 2016, 16(1): 7-21. |
| [25] |
XIE Z L, KOYAMA T, SUZUKI J, et al. Coronary reperfusion following ischemia - Different expression of bcl-2 and bax proteins, and cardiomyocyte apoptosis[J]. Jpn Heart J, 2001, 42(6): 759-770. |
| [26] |
姚云峰, 王宝成, 王俊. 促凋亡蛋白Bim在肿瘤治疗中的研究进展[J]. 肿瘤学杂志, 2019, 25(3): 247-251. YAO Y F, WANG B C, WANG J. Research progress on pro-apoptotic protein Bim in tumor therapy[J]. Journal of Chinese Oncology, 2019, 25(3): 247-251. (in Chinese) |
| [27] |
KIM Y S, LI X F, KANG K H, et al. Stigmasterol isolated from marine microalgae navicula incerta induces apoptosis in human hepatoma HepG2 cells[J]. BMB Rep, 2014, 47(8): 433-438. |
| [28] |
ESKES R, DESAGHER S, ANTONSSON B, et al. Bid induces the oligomerization and insertion of Bax into the outer mitochondrial membrane[J]. Mol Cell Biol, 2000, 20(3): 929-935. |
| [29] |
CHI X K, NGUYEN D, PEMBERTON J M, et al. The carboxyl-terminal sequence of bim enables bax activation and killing of unprimed cells[J]. Elife, 2020, 9: e44525. |
| [30] |
李书萍, 李波, 张阳. 抑制YAP对宫颈癌细胞增殖、凋亡、迁移及p53、Fra-1表达的影响[J]. 遵义医科大学学报, 2022, 45(1): 31-36. LI S P, LI B, ZHANG Y. Inhibition of YAP on proliferation, apoptosis, migration and expression of p53 and FRA-1 in cervical cancer cells[J]. Journal of Zunyi Medical University, 2022, 45(1): 31-36. (in Chinese) |
| [31] |
张舒文. CA3靶向抑制YAP1诱导肝癌HepG2细胞凋亡及机制研究[D]. 锦州: 锦州医科大学, 2020. ZHANG S W. Targeted inhibition of YAP1-induced apoptosis of hepatocelular carcinoma hepG2 cells by CA3 and its mechanism[D]. Jinzhou: Jinzhou Medical University, 2020. (in Chinese) |
| [32] |
YU R, LENDAHL U, NISTÉR M, et al. Regulation of mammalian mitochondrial dynamics: opportunities and challenges[J]. Front Endocrinol (Lausanne),, 2020, 11: 374. |
| [33] |
肖成, 胡进, 纪红军, 等. 小鼠子宫内膜基质细胞中HOXA10调控DNM1L表达机制的研究[J]. 南京农业大学学报, 2016, 39(6): 1023-1029. XIAO C, HU J, JI H J, et al. The regulation mechanism of HOXA10 on DNM1L expression in mouse endometrial stromal cells[J]. Journal of Nanjing Agricultural University, 2016, 39(6): 1023-1029. (in Chinese) |
| [34] |
HOPPINS S, LACKNER L, NUNNARI J. The machines that divide and fuse mitochondria[J]. Annu Rev Biochem, 2007, 76: 751-780. |
| [35] |
MAMMOTO A, MUYLEART M, KADLEC A, et al. YAP1-TEAD1 signaling controls angiogenesis and mitochondrial biogenesis through PGC1α[J]. Microvasc Res, 2018, 119: 73-83. |
| [36] |
安世钰, 张国敏, 尤佩华, 等. PPARGC1A/NRF1/TFAM通路核心基因在湖羊睾丸发育过程中的表达变化[J]. 南京农业大学学报, 2019, 42(2): 345-351. AN S Y, ZHANG G M, YOU P H, et al. Research on the change of PPARGC1A/NRF1/TFAM pathway genes expression in the development of Hu sheep testis[J]. Journal of Nanjing Agricultural University, 2019, 42(2): 345-351. (in Chinese) |
(编辑 郭云雁)



