2. 江苏省农业科学院畜牧研究所, 南京 210014
2. Institute of Animal Science, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
毛囊的形态发生和生长发育受到多种信号通路的共调控,并在多种细胞的调控下,经历生长期(anagen)、退行期(catagen)和休止期(telogen)[1]。在此过程中,角蛋白(keratin,KRT)在毛囊生长发育中扮演重要角色。角蛋白属于中间丝蛋白,是上皮细胞重要组成部分,对上皮细胞具有重要保护作用[2]。除了保护作用,角蛋白家族还参与调节细胞内多种信号传导途径及生物反应,如细胞生长、迁移、凋亡、增殖等[3]。其中,KRT17能够调节TNFα信号,从而影响毛囊生长周期[4];而KRT81、KRT83、KRT85、KRT86和KRT2-25的缺失导致SD大鼠出现无毛表型,这体现了角蛋白基因对毛发生长的重要性[5]。此外,KRT1和KRT4基因突变会引起皮毛颜色变化,表明角蛋白还能调节皮肤色素沉着[6-8]。
角蛋白16(keratin 16,KRT16)属于一大类酸性Ⅰ型角蛋白,已有研究表明,KRT16是皮肤的重要保护屏障,与一些皮肤疾病有着紧密联系[9]。如银屑病、先天性厚甲症和掌跖脚皮症。在银屑病的研究中,过表达KRT16后,角质形成细胞过度增殖,从而导致银屑病的发生[10]。另外,KRT16表达的沉默能够抑制VEGF分泌,而VEGF通过影响血液生成进而影响毛囊循环和生长[11]。本研究克隆得到兔KRT16基因的编码序列,对KRT16编码序列(CDS)的生物学特性初步进行生物信息学分析。在毛乳头细胞(dermal papilla cell,DPC)中过表达和敲低KRT16,探究KRT16对毛囊生长发育相关基因的调控作用,以及对DPC细胞增殖的影响。该研究有助于我们进一步了解KRT16在兔毛囊生长发育中的作用。
1 材料与方法 1.1 材料1.1.1 试验动物 皖系长毛兔由安徽省农业科学院提供,共12只。饲养在相同环境下,给予充足的水和饲料。耳缘静脉注射Zoteil-50麻醉,采集毛囊不同时期的长毛兔背部皮肤,每组一式三份,对伤口进行碘伏消毒[12]。
1.1.2 试验试剂 Zoteil-50购自法国维克宠物保健公司;HiScript Ⅱ Q Select RT SuperMix for qPCR、ChamQTM SYBRⓇ qPCR、ClonExpressⓇ Ⅱ One Step Cloning Kit、HiScript Ⅲ 1 st Strand cDNA Synthesis Kit (+gDNA wiper)和CCK-8 Cell Counting Kit购自南京诺维赞;Trizol试剂和无内毒素质粒大量提取试剂盒购于天根;限制性内切酶Hind Ⅲ和EcoR Ⅰ、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit胶回收试剂盒、DH5α感受态细胞购自TaKaRa; PBS购于HyClone;MSCM培养基购于Sciencell;LipofecctamineTM3000购自赛默飞。
1.2 长毛兔皮肤组织总RNA的提取与反转录Trizol法提取兔皮肤组织总RNA,并用NanoDrop 2000检测RNA浓度和纯度,再经1%琼脂糖凝胶电泳检测其完整性。通过HiScript Ⅲ 1 st Strand cDNA Synthesis Kit (+gDNA wiper)合成第一链cDNA。
1.3 引物设计根据GenBank数据库提供的KRT16基因的CDS序列(XM_002719157.3),使用Primer 5.0设计扩增引物,同时设计实时荧光定量PCR(qRT-PCR)引物,并送至擎科生物公司进行合成(表 1)。
|
|
表 1 引物信息 Table 1 Primers information |
提取兔背部皮肤总RNA,进行长链第一链cDNA合成,根据NCBI数据库中编码序列(XM_002719157.3)设计KRT16 CDS引物,构建pcDNA3.1(+)过表达载体,引物序列如表 1所示。pcDNA3.1载体经Hind Ⅲ和EcoR I双酶切后,切胶回收,利用ClonExpressⓇ Ⅱ One Step Cloning Kit进行一步克隆试验,将连接产物转化至感受态细胞,培养过夜后挑选阳性克隆进行鉴定。小干扰RNA(small interference RNA, siRNA)和siRNA-NC购自上海吉玛制药有限公司,siRNA序列见表 2。
|
|
表 2 siRNA序列信息 Table 2 Sequences of the siRNAs |
DPC在MSCM培养基中生长,并在37 ℃含有5% CO2细胞培养箱中培养。转染前,将DPC接种于24孔板中,待细胞的汇合度达80%时,使用LipofecctamineTM3000转染试剂转染,具体操作根据试剂盒说明书进行。
1.6 细胞增殖试验细胞计数后,将定量的细胞接种于96孔板中,每孔总体积100 μL,培养24 h后,在每个测定时间向每孔中加入10 μL CCK8 Solution,避光孵育3 h,酶标仪检测450 nm处吸光值。
1.7 生物信息学分析通过MegAlign软件(https://en.freedownloadmanager.org/Mac-OS/MegAlign.html)进行多序列比对[13];使用ExPASy在线软件(http://au.expasy.org/)预测KRT16的理化性质[14];使用SPOMA(https://npsa-prabi.ibcp.fr/)和SWISS-MODEL软件(http://www.swissmodel.expasy.org)预测蛋白质二级和三级结构[15]。使用UniProt在线软件(https://www.uniprot.org/)预测KRT16的亚细胞定位,并通过ProtoScale在线软件(http://expasy.org/tools/protscale.html)分析蛋白质疏水性[16-17]。使用NetPhos 3.1 (http://www.cbs.dtu.dk/services/NetPhos/)、NetOGlyc 4.0 (https://services.healthtech.dtu.dk/service.php?NetOGlyc-4.0)和NetNGlyc 1.0 (http://www.cbs.dtu.dk/services/NetNGlyc/)预测磷酸化位点和糖基化位点[12, 18-19]。使用SignalP-4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)和TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白质信号肽和跨膜区预测[19]。STRING数据库(https://string-db.org/cgi/input.pl)对蛋白进行交联分析[20];使用MEGA X软件进行进化树分析[21]。
1.8 实时荧光定量PCR(qRT-PCR)收集转染后的DPC,用Trizol法提取总RNA,并通过HiScript Ⅱ Q Select RT SuperMix for qPCR合成cDNA第一链,cDNA反转录产物用于qRT-PCR试验,使用ChamQTM SYBRⓇ qPCR Master Mix配置PCR体系,由QuantStudioⓇ5上机操作,引物序列见表 1。
1.9 统计分析使用Excel 2019整理数据,2-ΔΔCt法计算基因相对表达量。利用SPSS 25.0进行差异分析,P < 0.05为差异显著,P < 0.01为差异极显著,试验中至少设计3个生物学重复,结果使用“平均值±SD”表示。
2 结果 2.1 KRT16的克隆和生物信息学分析由试验结果可知,KRT16基因CDS为1 431 bp,共编码476个氨基酸,其分子式为C2207H3544N652O749S18,分子量为51.77 ku,理论等电位为5.08。不稳定系数为63.48,表明该蛋白为不稳定蛋白。利用ProtoScal在线软件对蛋白进行亲/疏水性分析,结果见图 1A。由图 1A可知,第93位的苯丙氨酸疏水性最强,第150位的谷氨酰胺亲水性最强,亲水系数均值为-0.545,说明KRT16为亲水蛋白。UniProt预测KRT16蛋白主要定位于细胞骨架。NetPhos 3.1 Server预测结果如图 1B所示,KRT16蛋白存在69个磷酸化位点:52个丝氨酸(Ser),12个苏氨酸(Thr),5个酪氨酸(Tyr)。NetOGlyc 4.0预测KRT16蛋白O-糖基化位点有21个。NetNGlyc 1.0 Server预测KRT16蛋白不存在N-糖基化位点(图 1C)。SignalP 4.0和TMHMM 2.0预测,KRT16蛋白不包含跨膜区(图 1D)和信号肽(图 1E)。
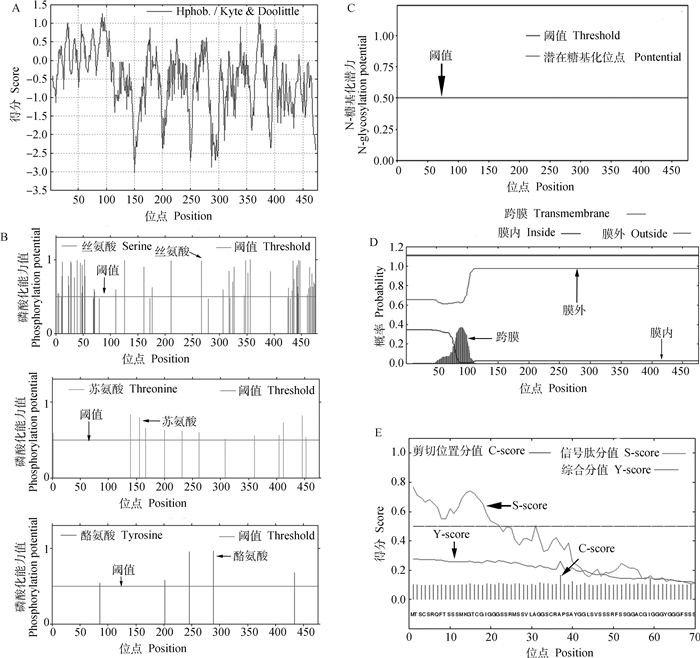
|
A. KRT16蛋白的亲水性预测;B. KRT16蛋白的磷酸化位点预测;C. KRT16蛋白的N-糖基化位点预测;D. KRT16蛋白的跨膜结构域预测;E.KRT16蛋白的信号肽预测 A. Prediction of hydrophilicity of KRT16 protein; B. Prediction of phosphorylation sites of KRT16 protein; C. Prediction of N-glycosylation sites of KRT16 protein; D. Transmembrane domain prediction of KRT16 protein; E. Signal peptide prediction of KRT16 protein 图 1 KRT16蛋白的生物信息学分析 Fig. 1 Bioinformatics analysis of KRT16 protein |
KRT16的二级结构预测表明,α-螺旋占61.76%,延伸链占7.77%,β转角占3.15%,无规则卷曲占27.31%(图 2A)。KRT16三级结构预测为一条螺旋链(图 2B)。KRT16蛋白的交联作用利用STRING数据库进行分析(图 2C),结果表明KRT16与KRT1、KRT5、KRT17、DSG1蛋白等存在互作关系。
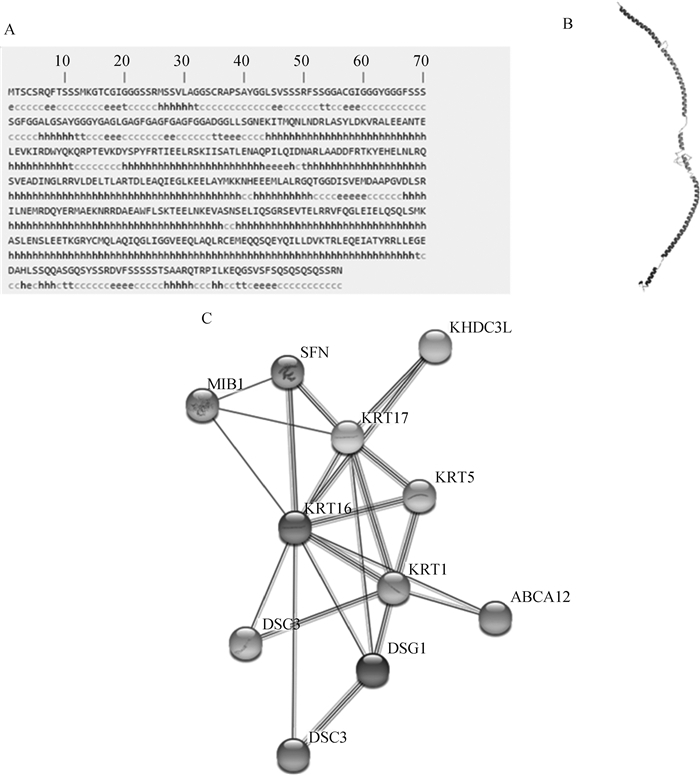
|
A. KRT16蛋白的二级结构预测;B. KRT16蛋白的三级结构预测;C. KRT16及其相关蛋白的相互作用网络 A. Secondary structure prediction of the KRT16 protein; B. Tertiary structure prediction of KRT16 protein; C. Interaction network of KRT16 and its related proteins 图 2 KRT16蛋白的结构预测及互作蛋白 Fig. 2 KRT16 structural prediction and PPI network |
利用MEGA X软件,将家兔KRT16基因序列与中国仓鼠(Cricetulus griseus)、小鼠(Mus musculus)、河狸(Castor canadensis)、北美鼠兔(Ochotona princeps)、人(Homo sapiens)、家猫(Felis catus)、狗(Canis lupus familiaris)及水牛(Bubalus bubalis)的KRT16基因序列进行系统发育树的构建(图 3)。结果显示,兔和北美鼠兔形成一个分支,同源性达到76%。

|
图 3 不同物种间KRT16基因的系统进化树 Fig. 3 Phylogenetic tree of KRT16 and other homologous sequences |
qRT-PCR结果显示(图 4),KRT16在毛囊周期同期化后的生长期表达量最高,显著高于退行期(P < 0.05),极显著高于休止期(P < 0.01),由此说明KRT16在毛囊生长期高表达。KRT16的表达水平随时间变化而变化,提示其参与毛囊周期性发育。
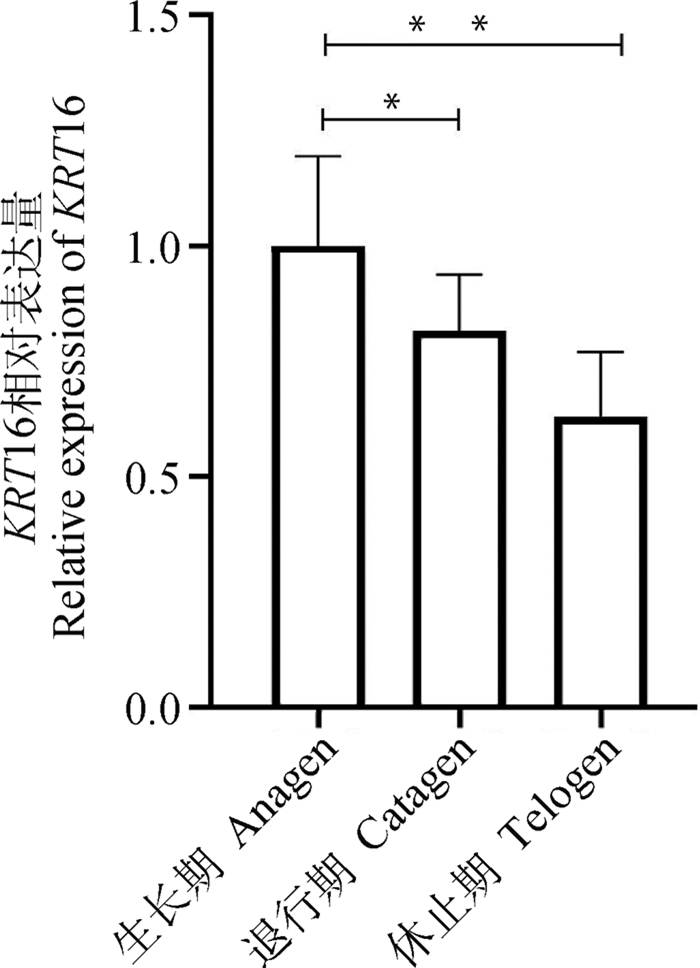
|
*.表示差异显著(P < 0.05),**.表示差异极显著(P < 0.01),下同 *.indicates the significant difference (P < 0.05), **. indicates the extremely significant difference (P < 0.01), the same as below 图 4 KRT16在长毛兔不同毛囊发育周期中的表达量变化 Fig. 4 The expression level of KRT16 mRNA during the hair follicle cycle and skin development in Angora rabbits |
将pcDNA3.1-KRT16过表达载体和siRNA-KRT16转染至DPC中,qRT-PCR结果表明pcDNA3.1-KRT16能够极显著上调KRT16基因的表达量(P < 0.01,图 5A),siRNA-KRT16能够极显著下调KRT16基因的表达量(P < 0.01,图 5C),提示过表达载体和siRNA转染成功。同时发现(图 5B、5D),过表达KRT16后,SFRP2和TGFβ1基因的mRNA表达量极显著下降(P < 0.01),BCL2、CCND1、EGF、LEF1和CTNNB1基因的mRNA表达量极显著提高(P < 0.01);而敲减KRT16后,SFRP2和TGFβ1基因的表达量极显著提高(P < 0.01),BCL2、CCND1、EGF、LEF1和CTNNB1基因的表达量极显著下降(P < 0.01)。由此可知,KRT16基因能够调控毛囊生长发育相关基因表达。
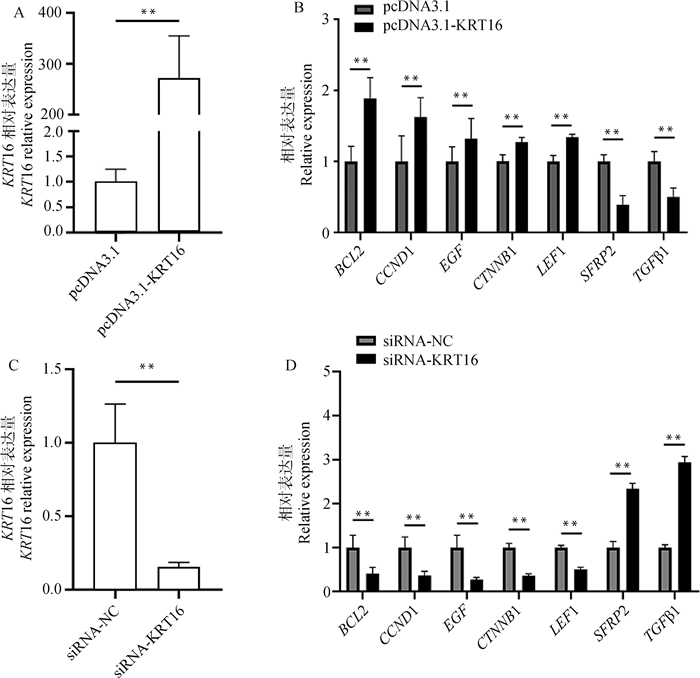
|
A. pcDNA3.1-KRT16极显著上调DPC中KRT16 mRNA表达水平;B. pcDNA3.1-KRT16对毛囊发育相关基因的影响;C. siRNA-KRT16极显著下调DPC中KRT16 mRNA表达水平;D siRNA-KRT16对毛囊发育相关基因的影响 A. pcDNA3.1-KRT16 significantly increased the expression of the KRT16 mRNA level in DPC; B. Effects of pcDNA3.1-KRT16 on the expression levels of hair follicle development related genes; C. siRNA-KRT16 significantly reduced the expression of the KRT16 mRNA level in DPC; D. Effects of siRNA-KRT16 on the expression levels of hair follicle development related genes 图 5 KRT16对毛囊发育相关基因表达的影响 Fig. 5 Effects of KRT16 on the expression levels of hair follicle development related genes |
DPC中过表达和敲减KRT16,通过CCK8法检测细胞增殖情况。结果表明,在细胞处理后的0和24 h,细胞增殖无明显差异。转染48 h后,与对照组相比,过表达KRT16极显著促进DPC增殖(P < 0.01),而敲低KRT16显著抑制DPC的增殖(P < 0.05)(图 6)。
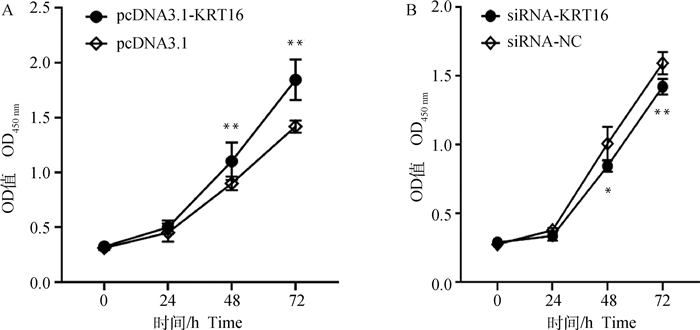
|
A. pcDNA3.1-KRT16对DPC细胞增殖的影响;B. siRNA-KRT16对DPC细胞增殖的影响 A. Effects of pcDNA3.1-KRT16 on DPC proliferation; B. Effects of siRNA-KRT16 on DPC proliferation 图 6 KRT16对DPC增殖的影响 Fig. 6 Effects of KRT16 on DPC proliferation |
角蛋白作为上皮细胞骨架的主要成分,最初仅被认为参与维持细胞的结构,而随着对角蛋白研究的深入,越来越多的研究表明角蛋白参与细胞增殖、迁移、凋亡等多种生命活动[22]。KRT16在疾病中的研究较为广泛,与银屑病、先天性厚甲症和掌跖角化症有着密切联系[23-24]。已有研究表明,KRT16受到miR-31的靶向调控,调节皮肤和毛囊基因的表达与毛囊周期变化[25];EGF可以通过转录因子Sp1和c-Jun诱导KRT16表达,而EGF可以促进DPC增殖,并通过调控细胞信号途径改变细胞周期,进而影响毛发的生长[26];Hox13与KRT16互相作用,有研究表明Hoxc13通过调节角蛋白分化影响毛囊生长[27]。
本研究中,KRT16的表达量在生长期最高,由此说明KRT16在生长期处于高表达水平。获取完整的兔KRT16 CDS后,对其进行生物信息学分析显示,KRT16 CDS包含一个1 431 bp的ORF,编码476个氨基酸。KRT16是一种亲水蛋白,主要存在于细胞骨架中,且由α螺旋结构构成。通过预测发现,KRT16蛋白磷酸化和糖基化位点丰富,说明KRT16可能参与细胞增殖,细胞凋亡,化学信号传导等重要过程。此外,系统发育树分析表明,兔KRT16在进化树上最接近于北美鼠兔。另外,KRT16与KRT17、KRT1和KRT5等蛋白存在互作关系。已有研究表明,KRT1和KRT5在毛囊生长期表达量最高,可能促进毛囊生长发育[28]。KRT17同样对毛囊生长有着重要作用,在小鼠中敲除KRT17出现脱毛现象[29]。在本研究中,过表达KRT16能够显著上调BCL2、CCND1、CTNNB1、LEF1、和EGF表达,敲减KRT16能够显著下调它们表达;过表达KRT16显著下调TGFβ1和SFRP2表达,敲减KRT16显著上调它们的表达。其中,SFRP2作为Wnt调节剂,在毛囊发育中有着重要作用,并且可以通过抑制Wnt活性来抑制角质形成细胞的增殖[30]。TGFβ1是一种多功能因子,对大多数细胞的生长起到抑制作用,并且已有研究发现TGFβ1在毛囊退行期高表达[31-32]。Wnt/CTNNB1信号通路是经典的信号通路,主要参与毛囊生长调节,CTNNB1还是细胞膜标志蛋白质,可以调节细胞生长和细胞间黏附[33]。LEF1被认为是毛囊正常发育以及促进毛母质细胞分化所必需的转录因子[33-34]。EGF因子大量分布在表皮、真皮与表皮结合处,是一种外源性调节因子,具有调控毛囊生长的作用,促进上皮细胞繁殖,并且有研究表明EGF可以诱导KRT16表达[34-35]。CCND1是细胞周期调节因子,同时也是抑凋亡基因,对细胞增殖起到促进作用。BCL2也同样是抑凋亡基因,有研究表明BCL2能够在毛囊各个时期皆有表达,并能调节毛囊细胞的凋亡[36-40]。KRT16能够上调CCND1与BCL2的表达,提示KRT16能够促进细胞增殖。另外,KRT16的敲低能够降低肺腺癌癌胞的体外迁移、侵袭和增殖能力,并能降低角质形成细胞的存活率[41]。本研究中,KRT16能够促进DPC增殖,说明KRT16能够调控DPC的细胞活动,从而影响毛囊周期性再生。
4 结论本试验成功克隆得到了兔KRT16基因,KRT16基因的编码序列全长1 431 bp,可编码476个氨基酸,预测KRT16蛋白为亲水蛋白,存在69个磷酸位点和21个O-糖基化位点。在毛囊发育周期中,KRT16在毛囊生长期高表达,并能调控毛囊生长发育相关基因,促进毛乳头细胞增殖。本研究通过对KRT16基因功能的初步研究,为毛囊发育的基础研究提供参考,同时为长毛兔毛囊发育相关基因的功能研究提供依据。
| [1] |
ZHAO B H, LI J L, LIU M, et al. DNA methylation mediates lncRNA2919 regulation of hair follicle regeneration[J]. Int J Mol Sci, 2022, 23(16): 9481. DOI:10.3390/ijms23169481 |
| [2] |
SARMA A. Biological importance and pharmaceutical significance of keratin: a review[J]. Int J Biol Macromol, 2022, 219: 395-413. DOI:10.1016/j.ijbiomac.2022.08.002 |
| [3] |
GU L H, COULOMBE P A. Keratin function in skin epithelia: a broadening palette with surprising shades[J]. Curr Opin Cell Biol, 2007, 19(1): 13-23. DOI:10.1016/j.ceb.2006.12.007 |
| [4] |
CHEN Y, BAO Z Y, LIU M, et al. Promoter methylation changes in KRT17:a novel epigenetic marker for wool production in angora rabbit[J]. Int J Mol Sci, 2022, 23(11): 6077. DOI:10.3390/ijms23116077 |
| [5] |
张静. 角蛋白24在脱毛中的作用研究[D]. 杭州: 浙江大学, 2020. ZHANG J. The role of keratin 24 in hair loss[D]. Hangzhou: Zhejiang University, 2020. (in Chinese) |
| [6] |
FITCH K R, MCGOWAN K A, VAN RAAMSDONK C D, et al. Genetics of dark skin in mice[J]. Genes Dev, 2003, 17(2): 214-228. DOI:10.1101/gad.1023703 |
| [7] |
MCGOWAN K A, ARADHYA S, FUCHS H, et al. A mouse Keratin 1 mutation causes dark skin and epidermolytic hyperkeratosis[J]. J Invest Dermatol, 2006, 126(5): 1013-1016. DOI:10.1038/sj.jid.5700241 |
| [8] |
MCGOWAN K A, FUCHS H, DE ANGELIS M H, et al. Identification of a Keratin 4 mutation in a chemically induced mouse mutant that models white sponge nevus[J]. J Invest Dermatol, 2007, 127(1): 60-64. DOI:10.1038/sj.jid.5700498 |
| [9] |
LESSARD J C, COULOMBE P A. Keratin 16-null mice develop palmoplantar keratoderma, a hallmark feature of pachyonychia congenita and related disorders[J]. J Invest Dermatol, 2012, 132(5): 1384-1391. DOI:10.1038/jid.2012.6 |
| [10] |
ZHANG X W, YIN M M, ZHANG L J. Keratin 6, 16 and 17-critical barrier Alarmin molecules in skin wounds and psoriasis[J]. Cells, 2019, 8(8): 807. DOI:10.3390/cells8080807 |
| [11] |
CHEN J G, FAN H Y, WANG T, et al. Silencing KRT16 inhibits keratinocyte proliferation and VEGF secretion in psoriasis via inhibition of ERK signaling pathway[J]. Kaohsiung J Med Sci, 2019, 35(5): 284-296. DOI:10.1002/kjm2.12034 |
| [12] |
ZHAO B H, CHEN Y, HU S S, et al. Characterization of HTATIP2 and its role during hair follicle cycles in Angora rabbit[J]. Genome, 2020, 63(3): 179-187. DOI:10.1139/gen-2019-0132 |
| [13] |
赵采芹, 王燕碧, 朱杰, 等. 鸡TRAF6和TIFA蛋白的序列分析与相互作用验证[J]. 畜牧兽医学报, 2021, 52(6): 1511-1522. ZHAO C Q, WANG Y B, ZHU J, et al. Sequence analysis and interaction verification of chicken TRAF6 and TIFA proteins[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(6): 1511-1522. (in Chinese) |
| [14] |
ZHOU T, CHEN Y, ZHAO B H, et al. Characterization and functional analysis of SIAH1 during skin and hair follicle development in the angora rabbit (Oryctolagus cuniculus)[J]. Hereditas, 2020, 157(1): 10. DOI:10.1186/s41065-020-00126-0 |
| [15] |
白少成, 周娟, 靳荣帅, 等. 新西兰白兔CYP11A1基因的克隆、生物信息学分析及其对繁殖相关基因的影响[J]. 中国畜牧兽医, 2022, 49(7): 2484-2496. BAI S C, ZHOU J, JIN R S, et al. Cloning and bioinformatics analysis of CYP11A1 gene in New Zealand white rabbits and its effects on reproduction-related genes[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(7): 2484-2496. (in Chinese) |
| [16] |
BAO Z Y, ZHAO B H, HU S S, et al. Characterization and functional analysis of SMAD2 regulation in hair follicle cycle in Angora rabbits[J]. Gene, 2021, 770: 145339. DOI:10.1016/j.gene.2020.145339 |
| [17] |
张晖, 潘阳阳, 王靖雷, 等. 牦牛RBM3的基因克隆及其在不同繁殖时期卵巢、输卵管、子宫中的表达定位[J]. 畜牧兽医学报, 2022, 53(7): 2202-2214. ZHANG H, PAN Y Y, WANG J L, et al. RBM3 gene cloning and its expression, localization in ovary, fallopian tube and uterus at different reproductive stages of yak (Bos grunniens)[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7): 2202-2214. (in Chinese) |
| [18] |
黄正洋, 王钱保, 李春苗, 等. 鸡Smad4基因克隆生物信息学及组织表达分析[J]. 中国畜牧兽医, 2021, 48(10): 3522-3532. HUANG Z Y, WANG Q B, LI C M, et al. Cloning, bioinformatics and tissue expression analysis of Smad4 gene in chicken (Gallus gallus)[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(10): 3522-3532. (in Chinese) |
| [19] |
陈红梅, 程龙飞, 傅光华, 等. 6种血清型鸭疫里默氏菌SSPA基因的克隆及序列分析[J]. 福建农业学报, 2015, 30(9): 831-835. CHEN H M, CHENG L F, FU G H, et al. Cloning and sequence analysis of SSPA genes of Riemerella anatipestifer with different serotypes[J]. Fujian Journal of Agricultural Sciences, 2015, 30(9): 831-835. DOI:10.3969/j.issn.1008-0384.2015.09.001 (in Chinese) |
| [20] |
闵星宇, 杨丽雪, 于海玲, 等. 犏牛PPP1R11基因的克隆及在睾丸中的表达规律研究[J]. 畜牧兽医学报, 2022, 53(2): 481-492. MIN X Y, YANG L X, YU H L, et al. Cloning and expression analysis of cattle-yak PPP1R11 gene in testis[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2): 481-492. (in Chinese) |
| [21] |
KUMAR S, STECHER G, LI M, et al. MEGA X: molecular evolutionary genetics analysis across computing platforms[J]. Mol Biol Evol, 2018, 35(6): 1547-1549. DOI:10.1093/molbev/msy096 |
| [22] |
KIM S, COULOMBE P A. Intermediate filament scaffolds fulfill mechanical, organizational, and signaling functions in the cytoplasm[J]. Genes Dev, 2007, 21(13): 1581-1597. DOI:10.1101/gad.1552107 |
| [23] |
GONG L, GUO S P, WANG D T, et al. A KRT6A and a novel KRT16 gene mutations in Chinese patients with pachyonychia congenita[J]. Int J Gen Med, 2021, 14: 903-907. DOI:10.2147/IJGM.S280160 |
| [24] |
LESSARD J C, PIÑA-PAZ S, ROTTY J D, et al. Keratin 16 regulates innate immunity in response to epidermal barrier breach[J]. Proc Natl Acad Sci U S A, 2013, 110(48): 19537-19542. DOI:10.1073/pnas.1309576110 |
| [25] |
MARDARYEV A N, AHMED M I, VLAHOV N V, et al. Micro-RNA-31 controls hair cycle-associated changes in gene expression programs of the skin and hair follicle[J]. FASEB J, 2010, 24(10): 3869-3881. DOI:10.1096/fj.10-160663 |
| [26] |
WANG Y N, CHANG W C. Induction of disease-associated Keratin 16 gene expression by epidermal growth factor is regulated through cooperation of transcription factors Sp1 and c-Jun[J]. J Biol Chem, 2003, 278(46): 45848-45857. DOI:10.1074/jbc.M302630200 |
| [27] |
WU J H, ZHANG W G, LI J Q, et al. Hoxc13 expression pattern in cashmere goat skin during hair follicle development[J]. Agric Sci China, 2009, 8(4): 491-496. DOI:10.1016/S1671-2927(08)60237-0 |
| [28] |
高丽霞, 张燕军, 张文广, 等. 内蒙古白绒山羊毛囊发育周期蛋白质表达谱分析[J]. 农业生物技术学报, 2014, 22(6): 727-735. GAO L X, ZHANG Y J, ZHANG W G, et al. Analysis of protein expression profile of hair follicle cycle of inner Mongolia cashmere goat (Capra cashmere)[J]. Journal of Agricultural Biotechnology, 2014, 22(6): 727-735. DOI:10.3969/j.issn.1674-7968.2014.06.008 (in Chinese) |
| [29] |
TONG X M, COULOMBE P A. Keratin 17 modulates hair follicle cycling in a TNFα-dependent fashion[J]. Genes Dev, 2006, 20(10): 1353-1364. DOI:10.1101/gad.1387406 |
| [30] |
KIM B K, YOON S K. Expression of Sfrp2 is increased in Catagen of hair follicles and inhibits keratinocyte proliferation[J]. Ann Dermatol, 2014, 26(1): 79-87. DOI:10.5021/ad.2014.26.1.79 |
| [31] |
FOITZIK K, LINDNER G, MUELLER-ROEVER S, et al. Control of murine hair follicle regression (catagen) by TGF-β1 in vivo[J]. FASEB J, 2000, 14(5): 752-760. DOI:10.1096/fasebj.14.5.752 |
| [32] |
吴振宇. 生长獭兔毛囊发育规律及蛋氨酸调控机制研究[D]. 泰安: 山东农业大学, 2016. WU Z Y. The hair follicle development regularity and the mechanism research of Met in growing Rex rabbit[D]. Tai'an: Shandong Agricultural University, 2016. (in Chinese) |
| [33] |
SUN Y, ZHOU Y X, MSUTHWANA P, et al. The role of CTNNB1 and LEF1 in feather follicles development of Anser cygnoides and Anser anser[J]. Genes Genomics, 2020, 42(7): 761-771. DOI:10.1007/s13258-020-00950-8 |
| [34] |
陈秋燃. IGF-1与EGF因子联合使用对毛兔毛囊生长的影响[D]. 扬州: 扬州大学, 2020. CHEN Q R. The effect of IGF-1 combined with EGF on the hair follicle growth of Angora rabbit[D]. Yangzhou: Yangzhou University, 2020. (in Chinese) |
| [35] |
NANASHIMA N, AKITA M, YAMADA T, et al. The hairless phenotype of the Hirosaki hairless rat is due to the deletion of an 80-kb genomic DNA containing five basic keratin genes[J]. J Biol Chem, 2008, 283(24): 16868-16875. DOI:10.1074/jbc.M802539200 |
| [36] |
CAI C K, ZHAO G Y, TIAN L Y, et al. miR-15a and miR-16-1 downregulate CCND1 and induce apoptosis and cell cycle arrest in osteosarcoma[J]. Oncol Rep, 2012, 28(5): 1764-1770. DOI:10.3892/or.2012.1995 |
| [37] |
XU X W, LYLE S, LIU Y P, et al. Differential expression of Cyclin D1 in the human hair follicle[J]. Am J Pathol, 2003, 163(3): 969-978. DOI:10.1016/S0002-9440(10)63456-6 |
| [38] |
MVLLER-RÖVER S, ROSSITER H, LINDNER G, et al. Hair follicle apoptosis and Bcl-2[J]. J Investig Dermatol Symp Proc, 1999, 4(3): 272-277. DOI:10.1038/sj.jidsp.5640228 |
| [39] |
STENN K S, LAWRENCE L, VEIS D, et al. Expression of the bcl-2 protooncogene in the cycling adult mouse hair follicle[J]. J Invest Dermatol, 1994, 103(1): 107-111. DOI:10.1111/1523-1747.ep12391844 |
| [40] |
BOTCHKAREVA N V, AHLUWALIA G, SHANDER D. Apoptosis in the hair follicle[J]. J Invest Dermatol, 2006, 126(2): 258-264. DOI:10.1038/sj.jid.5700007 |
| [41] |
LIU Y H, QIAN P D, ZHU W, et al. TFAP2A induced KRT16 as an oncogene in lung adenocarcinoma via EMT[J]. Int J Biol Sci, 2019, 15(7): 1419-1428. DOI:10.7150/ijbs.34076 |
(编辑 郭云雁)



