生物体内在自然状态下形成的,能够与其正义链RNA互补的转录产物叫做自然反义链转录本(NATs)。以往对NATs的研究结果表明,NATs大多分布在其正义链基因的启动子区域与外显子区域,既包含了具有编码功能的mRNA,也包含了非编码RNA(如lncRNA),根据转录的方向不同,又可以分为cis-NATs和trans-NATs[1]。
早期有研究者认为NATs属于一种转录异常副产物,因而其本身没有调控任何基因表达的功能[2],近年来的研究则推翻了这一观点。研究发现,NATs能通过与其正义链转录本序列以重叠或互补配对,以此而实现可以在包括转录或者转录后等多个水平参与到对正义链转录本基因的表达调控[2-3]。已逐步证实NATs广泛的存在于人类[4-5]、小鼠[6]、猪[7]、鸡[8]等多个常见物种的转录组中,暗示着它们可能在参与这些物种的基因表达以及在调控功能等方面具有重要的作用。而与人类和小鼠NATs的研究相比,在家禽中相关的研究相对滞后。
鸡的VGLL2基因(vestigial like family member 2, VGLL2)位于3号染色体,在GenBank数据库中,鸡VGLL2 mRNA有4个外显子,而X1、X2和X3均因内含子3的部分滞留而多形成一个外显子。在分析的所有脊椎动物物种中,VGLL2表达主要定位在早期胚胎及以后的骨骼肌的体细胞分裂中,这与在C2C12成肌细胞的肌肉分化期间观察到VGLL2表达的上调相一致[9-10]。这些数据表明,VGLL2在骨骼肌生长发育过程中可能发挥着非常重要的作用,但VGLL2在家禽中的表达和调控还尚不清楚。
本课题组基于前期对6周龄地方鸡(固始鸡)和商业肉鸡(AA鸡)肌肉组织的转录组测序(RNA-Seq)鉴定出一个在鸡肌肉组织中特异性表达,由VGLL2基因序列逆向转录而来的lncRNA,命名为VGLL2-AS(GenBank登录号: KY126094),猜测VGLL2-AS可能在鸡的肌肉发育中发挥重要作用,但具体机制尚不清楚[11]。为此,本研究对VGLL2-AS的生物学功能展开进一步的探索,以期为NATs调控家禽骨骼肌生长提供理论基础。
1 材料与方法 1.1 试验材料本试验所用动物均来自于河南农业大学家禽种质资源场,包括11胚龄固始鸡胚蛋若干枚、1日龄(1 d)、6周龄(6 W)、16周龄(16 W)、22周龄(22 W)、30周龄(30 W)固始鸡各6只。
本试验所用的核酸染料(DNA Green)以及2×Taq PCR Master Mix分别购自TIANDZ公司和CWBIO公司;试验用到的DNA Marker,包括Ladder 100和D2000,分别购自上海莱枫以及北京中科瑞泰生物科技有限公司;琼脂糖凝胶回收试剂盒、Trizol、RNA反转录试剂盒、SYBR Premix和DH5α感受态细胞均购自日本TaKaRa公司;试验中用到的有机溶剂包括无水乙醇、三氯甲烷等均购自天津市富宇精细化工有限公司;PBS、PRMI-1640细胞培养基和质粒小提试剂盒购自Promega公司;细胞培养试验中用到的细胞消化液(0.25% EDTA)、青链霉素混合液和胎牛血清(FBS)购自于Gibco公司;放线菌素D和PARISTM Kit分别购自于Sigma和Invitrogen公司。
1.2 引物设计根据NCBI在线网站所提供的基因序列,利用NCBI在线设计引物网站(https://www.ncbi.nlm.nih.gov/)和Sangon Biotech公司分别设计和合成表 1所示的引物序列。
|
|
表 1 本研究所使用的引物 Table 1 The primers used in this study |
利用组织(细胞)裂解液Trizol来提取不同时期固始鸡不同组织样品(包括肺、心、肾、肝、皮脂、腹脂、腿肌、胸肌和下丘脑)或者细胞样品的RNA,按照反转录试剂盒使用说明书对质量合格的RNA进行反转录,以反转录而来的cDNA为模板进行实时荧光定量PCR(real-time quantitative PCR, RT-qPCR),具体操作及分析参考任团辉[11]的方法。
1.4 RT-PCR验证VGLL2-AS与VGLL2基因的双向转录分别以VGLL2的正义链第3个外显子设计引物GF1和GR1,以VGLL2-AS的反义链第1个外显子设计引物DL-F和DL-R,GAPDH作为内参基因。引物序列见表 1。
用于特异基因逆转录cDNA的合成步骤如下:以固始鸡胸肌总RNA(1 μg)为模板,去除模板中的基因组DNA污染后,于反转录反应中分别以DL-R和GAPDH-R或GR1和GAPDH-R特异引物进行反转录,得到的链特异cDNA为接下来Touchdown PCR扩增的模板。反应体系为:cDNA 1 μL,上、下游引物(10 μmol·L-1)各0.5 μL、ddH2O 3 μL,2×SYBR Green Mix 5 μL。反应程序为:95 ℃ 4 min;95 ℃ 30 s,退火65 ℃~50 ℃(-1 ℃/cycle) 30 s,72 ℃ 40 s;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,分别为15和26个循环。扩增所得产物于核酸染料预染的1.5%琼脂糖凝胶中进行电泳(120 V,110 mA,30 min),最后在凝胶成像系统下成像。
1.5 细胞培养鸡原代成肌细胞的分离和培养详见戴巍等[12]的研究。
1.6 核酸酶保护试验向固始鸡胸肌总RNA(1 μg)中加入2 μL DNase Ⅰ和1 μL RNase A以消除基因组的DNA及单链RNA,用反转录试剂盒将消化产物反转录,反转录产物作为模板进行下一步的PCR检测。反应体系为:cDNA 1 μL,上、下游引物(10 μmol·L-1) 各0.5 μL、ddH2O 3 μL,2×Taq PCR Master Mix 5 μL,反应条件同RT-qPCR。
1.7 放线菌素D添加试验分析VGLL2-AS与VGLL2半衰期将鸡原代成肌细胞接种至12孔板中,待其细胞汇合度达到70%左右时,收取3个孔的细胞培养品,设置为0 h样品;将最终浓度为2 μg·mL-1的放线菌素D加入细胞中,之后每1 h收集3个孔细胞样品,提取细胞RNA后检测靶基因的表达。
1.8 鸡原代成肌细胞VGLL2和VGLL2-AS亚细胞定位鸡成肌细胞细胞核与细胞质的分离使用PARISTM Kit试剂盒进行,细胞质和细胞核的内参基因分别为GAPDH和U6基因,通过RT-qPCR方法检测成肌细胞中VGLL2-AS和VGLL2基因的表达,进而确定两者的细胞定位。
1.9 统计分析与作图本试验采用相对定量2-ΔΔCt计算方法对所得qRT-PCR的原始数据进行分析,以2-ΔΔCt值来代表不同基因在不同样品中的相对表达水平。2-ΔΔCt方法具体计算过程如下:
ΔCt= Ct(目的基因)-Ct(内参基因);
ΔΔCt=ΔCt-ΔCt(对照组均值);
目的基因在某一样品中的相对表达量=2-ΔΔCt。
本研究所有的定量数据均是通过罗氏实时荧光定量软件LightCycler 96进行收集,再经Excel等软件进行整理;用SPSS 20.0对整理后的数据进行显著性分析,采用单因素方差分析进行显著性检验,多重比较采用新复极差法(SSR),设置显著性水平为0.05。最后用作图软件GraphPad Prism 6进行制图,数据表示的形式为“平均值±标准差”[10]。
2 结果 2.1 鸡肌肉组织中VGLL2-AS的验证为了验证VGLL2-AS是否真实存在,在VGLL2-AS的特异区(与VGLL2相比,VGLL2-AS缺少第3外显子,故选取VGLL2-AS跨第2外显子与第4外显子区域作为VGLL2-AS特异区)设计引物F1/R1并进行PCR扩增和测序检测。结果如图 1所示,特异区PCR产物测序结果与目的基因VGLL2-AS序列完全一致,证明VGLL2-AS在鸡的转录组中真实存在。
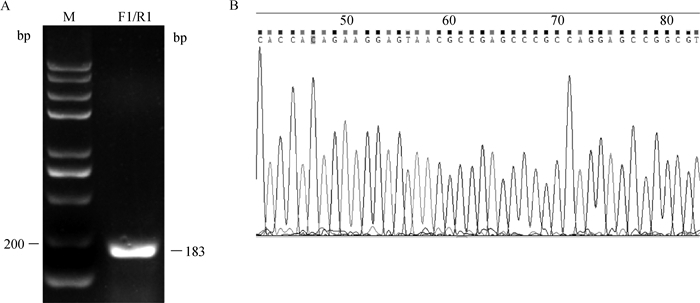
|
A. VGLL2-AS的琼脂糖凝胶电泳图;B. VGLL2-AS的测序图 A. Agarose gel electrophoresis of VGLL2-AS; B. DNA sequencing map of VGLL2-AS 图 1 VGLL2-AS的验证 Fig. 1 Verification of VGLL2-AS |
为了验证VGLL2与VGLL2-AS是否在肌肉中高表达,qRT-PCR检测VGLL2与VGLL2-AS在固始鸡不同时期的肺、心、肾、肝、皮脂、腹脂、腿肌、胸肌和下丘脑组织之间的表达差异。结果如图 2所示,可以看出VGLL2与VGLL2-AS表达趋势一致,即均在肌肉组织中特异高表达,而在其余组织中几乎不表达。且在6 w和16 w肌肉组织中的表达量与1 d相比,表达量均显著降低(P < 0.05),说明VGLL2和VGLL2-AS参与了鸡的肌肉发育进程。
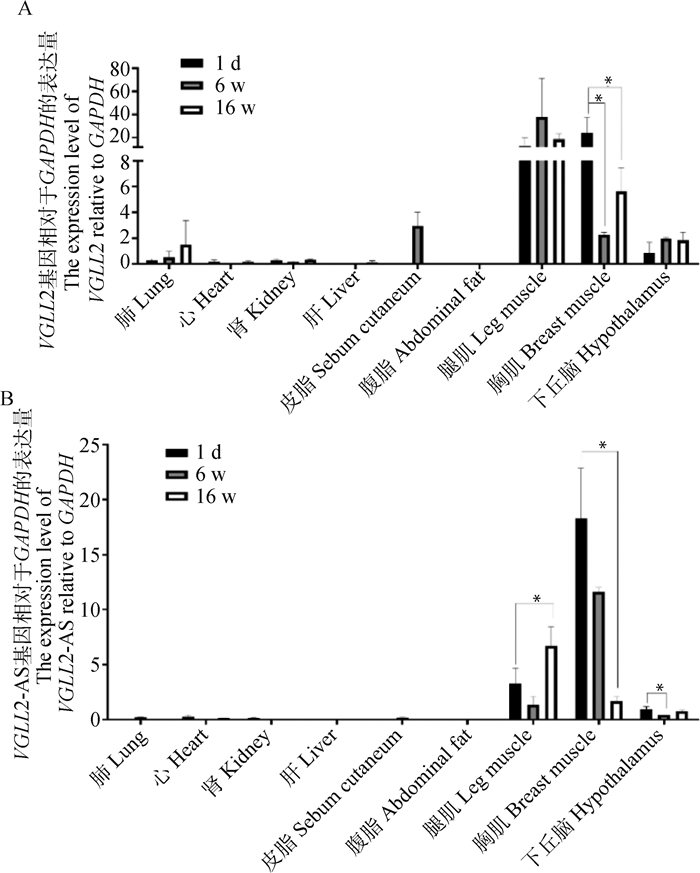
|
A. VGLL2时空表达谱;B. VGLL2-AS的时空表达谱。经单因素方差分析检验,*表示差异显著(P < 0.05) A. The spatio-temporal expression pattern of VGLL2; B. The spatio-temporal expression pattern of VGLL2-AS. Tested by one-way analysis of variance, * means significant difference(P < 0.05) 图 2 VGLL2与VGLL2-AS的表达规律 Fig. 2 Expression patterns of VGLL2 and VGLL2-AS |
为了验证VGLL2-AS与VGLL2是否可以进行双向转录,通过设计特异引物,以胸肌cDNA进行Touchdown PCR检测。结果如图 3所示,VGLL2和VGLL2-AS都可以扩增出目的条带,表明VGLL2-AS与VGLL2均可以进行双向转录。
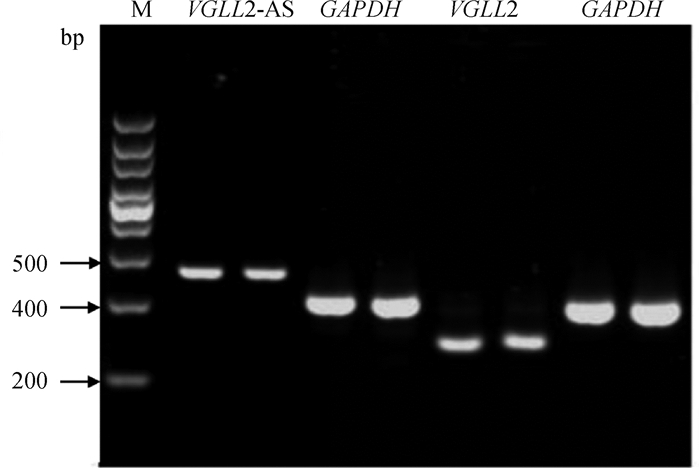
|
图 3 链特异引物鉴定鸡VGLL2-AS与VGLL2双向转录 Fig. 3 Identification of bidirectional transcription of chicken VGLL2-AS and VGLL2 by strand specific primers |
为了探究VGLL2-AS的作用机制,利用核酸酶保护试验在VGLL2-AS与VGLL2的重叠区(第二外显子)设计了引物F2/R2(图 4A),之后扩增重叠区的目的片段以检测VGLL2-AS与VGLL2之间是否形成了RNA二聚体。如图 4B所示,可以看到在F2与R2之间可以扩增到大小132 bp的目的片段,证明VGLL2-AS与VGLL2间形成了RNA二聚体。
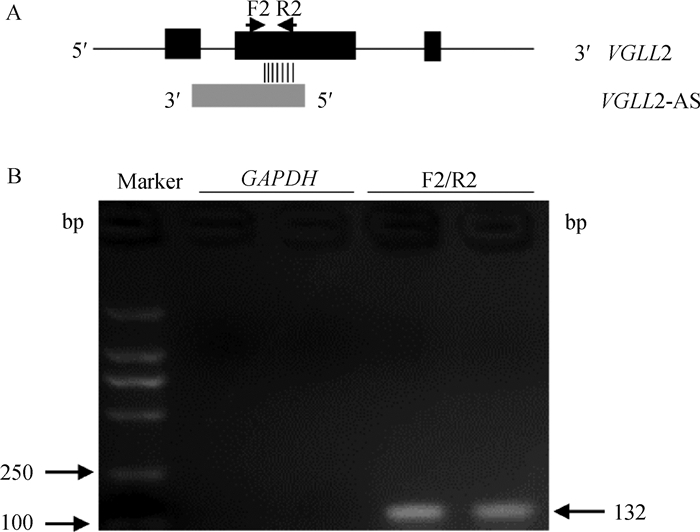
|
A. VGLL2和VGLL2-AS之间重叠和非重叠区域的引物示意图;B. 消化产物扩增的琼脂糖凝胶电泳 A. Schematic illustration of primers in overlapping and non-overlapping region between VGLL2 and VGLL2-AS; B. Agarose gel electrophoresis of amplification of digestion products 图 4 核酸酶保护试验 Fig. 4 Ribonuclease protection assay |
既然VGLL2-AS与VGLL2可以形成RNA双链,而两者之间形成的双链是否可以增加其在鸡原代成肌细胞增殖过程中的稳定性还不可知。为此,本研究进行了放线菌素D处理成肌细胞试验。结果如图 5所示,与VGLL2的2 h左右的半衰期相比较,VGLL2-AS的半衰期可以达到5 h左右,表明VGLL2-AS半衰期较VGLL2长,证明其稳定性高于VGLL2基因。
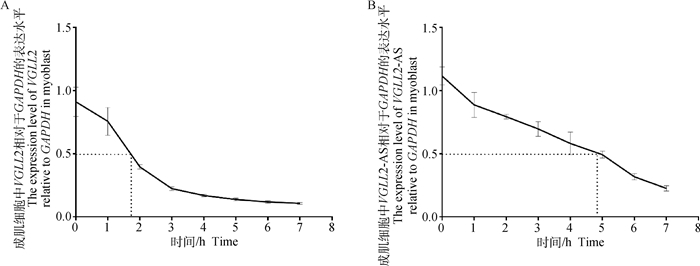
|
A. VGLL2半衰期检测; B. VGLL2-AS半衰期检测 A. The stability assay of VGLL2; B. The stability assay of VGLL2-AS 图 5 VGLL2和VGLL2-AS的半衰期检测 Fig. 5 The stability assay of VGLL2 and VGLL2-AS |
为了更进一步探究VGLL2-AS的作用机制,对VGLL2-AS和VGLL2进行亚细胞定位。分离的RNA产物用GAPDH(细胞质内参基因)和U6(细胞核内参基因)进行RT-qPCR检测,确定核质分离是否成功。如图 6所示,VGLL2-AS和VGLL2基因都主要表达于细胞质中,说明在成肌细胞中,VGLL2-AS和VGLL2主要定位于鸡成肌细胞的细胞质中。
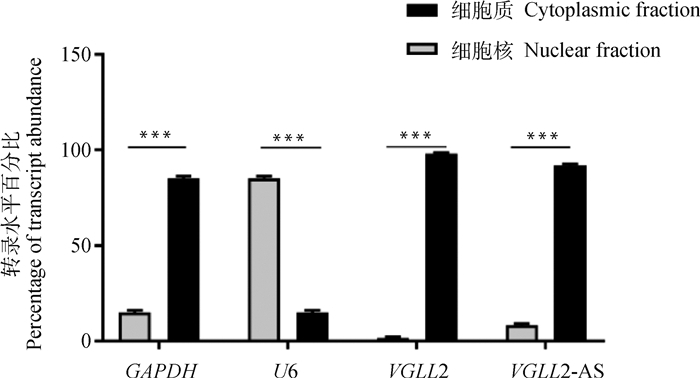
|
GAPDH和U6分别为细胞质和细胞核内参基因。经单因素方差分析检验,***表示差异极显著(P < 0.001) GAPDH and U6 are cytoplasmic and nuclear reference genes, respectively. Tested by one-way analysis of variance, *** means extremely significant difference (P < 0.001) 图 6 鸡原代成肌细胞中VGLL2-AS与VGLL2亚细胞定位 Fig. 6 Subcellular localization of hepatic VGLL2-AS and VGLL2 |
利用NCBI在线网站查询VGLL2基因发现,VGLL2具有4个转录本,分别为:VGLL2-mRNA、VGLL2-X1、VGLL2-X2和VGLL2-X3。为了阐明VGLL2-AS与VGLL2各转录本的异同,首先利用PCR扩增及单克隆测序对VGLL2的转录本进行验证。如图 7所示,利用VGLL2各转录本的共有引物VBF和VBR进行扩增后发现胸肌组织中VGLL2实际不存在VGLL2-X1转录本,只存在VGLL2-mRNA、VGLL2-X2和VGLL2-X3转录本。
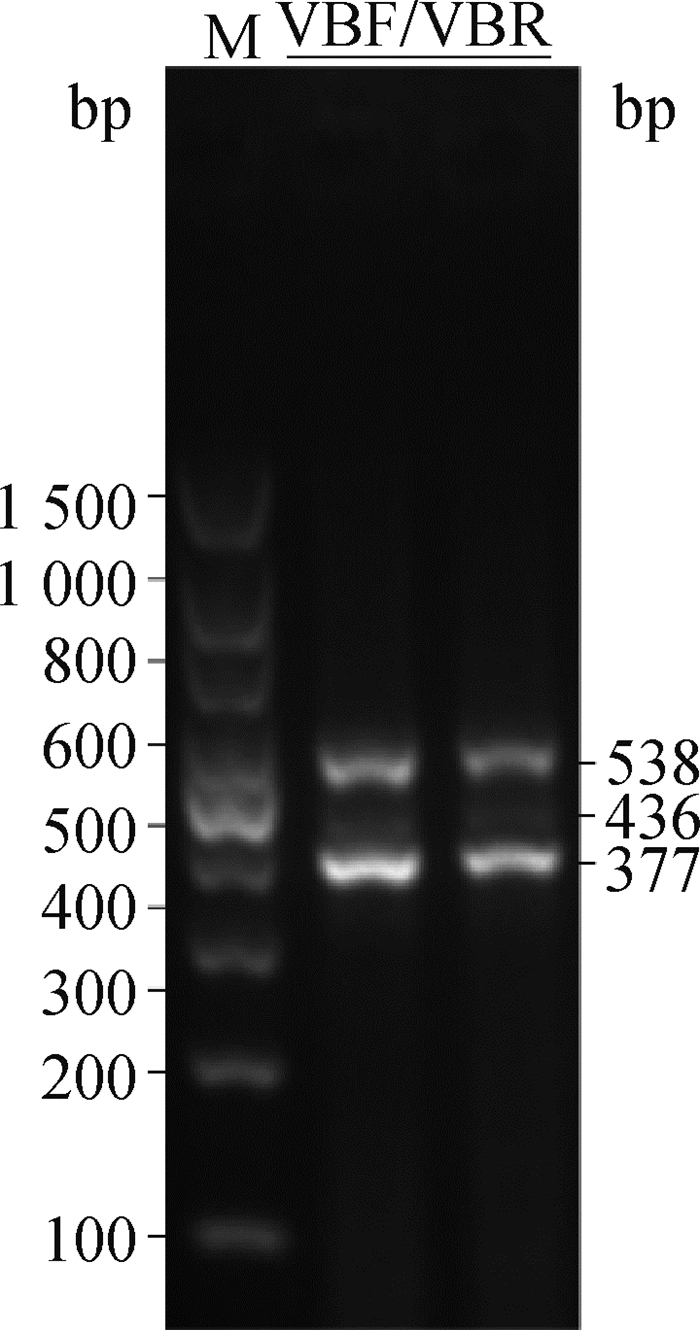
|
图 7 VGLL2不同转录本的凝胶电泳 Fig. 7 The agarose gel electrophoresis of VGLL2 transcripts |
通过NCBI和USCS(http://genome.ucsc.edu/)数据库以及验证得到的各转录本序列信息,对VGLL2各转录本序列进行分析。结果如图 8所示,VGLL2-X2和VGLL2-X3均含有5个外显子,而VGLL2-mRNA和VGLL2-AS分别含有4个和3个外显子;观察各个转录本之间的序列信息发现,与VGLL2的3种形式转录本相比,VGLL2-AS缺少外显子E3;此外,相比于VGLL2-X2和VGLL2-X3转录本,VGLL2-AS缺少VGLL2-X2的外显子I3a和VGLL2-X3的外显子I3b。
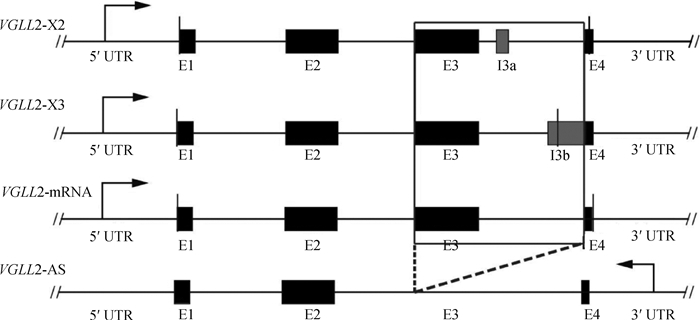
|
双斜线代表起始和终止密码子 The double diagonal represents the initial and terminal codons 图 8 VGLL2-AS与VGLL2各剪切体结构分析 Fig. 8 Schematic comparison of transcripts of the VGLL2-AS and VGLL2 genes |
前面的试验证明VGLL2-AS与VGLL2都在肌肉组织中高表达,但两者之间的相关性尚不清楚。为此,本研究利用RT-qPCR检测了它们在固始鸡胸肌组织中的时空表达规律(由于VGLL2-X2的表达量在各个组织中均较低且在其序列中没有找到合适的引物进行检测,因此本试验中只对VGLL2-mRNA和VGLL2-X3进行了检测)。结果如图 9所示,VGLL2-mRNA和VGLL2-X3与VGLL2-AS表达趋势一致,且VGLL2-mRNA、VGLL2-X3和VGLL2-AS的表达呈现极强的正相关(r分别为0.943和0.935),且差异极显著(P < 0.01)。
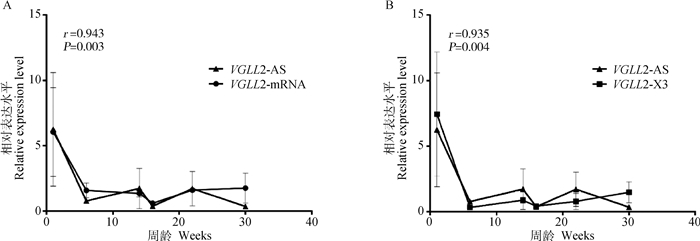
|
图 9 VGLL2-AS和VGLL2-mRNA (A)、VGLL2-X3 (B)在胸肌中的表达 Fig. 9 Expression patterns of VGLL2-AS, VGLL2-mRNA (A) and VGLL2-X3 (B) in breast muscle |
NATs可以直接与其正义链转录本相互作用,通过转录和表观遗传学水平来调节正义链基因表达,从而参与到各种生物学过程,对生物体的生长发育具有重要意义[13-16]。目前,在哺乳动物中关于NATs与其正义链转录本之间的研究较多,如DHRS4-AS[17]、p15AS [18],而在家禽中的相关研究较少,如bFGF[19]、IGF-Ⅱ[20]、Collagen[21]和Pdcd2[22]。因此,对NATs在家禽肌肉发育过程中的调控作用进行解析,既能补充lncRNAs在动物肌肉中的调控作用理论,又能为鸡肌肉发育和开发家禽的分子标记提供理论基础。
研究报道,半衰期可以衡量NATs的稳定性[23-24]。此外,与正义链转录本相比,大部分NATs的半衰期更长,这也意味着大多数NATs的稳定性更高,表明NATs有可能比其正义链转录本承担着更多的生物学功能[25-26],而VGLL2-AS半衰期较VGLL2长,证明其稳定性高于VGLL2基因。同时,lncRNAs的功能与所处的细胞定位相关,而不同细胞定位的lncRNAs发挥的调节机制也不一样。根据细胞定位,lncRNAs又可分类为细胞质lncRNAs以及细胞核lncRNAs[27-30]。研究发现,大多数存在于细胞质中的lncRNAs可以通过与双链RNA之间的相互作用,进而参与到对mRNA稳定性和表达的调节。例如,主要存在于细胞质中的lncRNA MD1可以通过ceRNA的调控机制从而参与骨骼肌的分化进程[31]。而位于细胞核内的lncRNAs可能通过与靶基因的结合从而激活或者抑制靶基因表达,除此之外,还可能通过参与表观调控作用介导基因表达的调节[11, 32-34]。此外,已有研究表明,位于细胞核内的lncRNAs比细胞质中的lncRNAs的稳定性弱[35]。VGLL2-AS主要表达于鸡原代成肌细胞的细胞质中,暗示VGLL2-AS可能通过转录水平以及转录后水平来调控VGLL2。
基因的可变剪切能够改变转录本的结构和其编码的蛋白,同时也可以使基因产生多种结构不同的mRNA以及多肽序列,是基因表达多样性的一种重要的表现形式[36-39]。反义lncRNAs可以通过与其正义链转录本形成双链RNA以覆盖其顺式元件,从而直接调节前体mRNA的可变剪切。例如,NATs Zeb2补充了其正义链转录本的剪接位点,并导致其内含子的滞留,最终促进Zeb2的表达以及翻译[40]。内含子滞留是基因形成不同剪切体的方式之一,而分析VGLL2不同的剪切体信息,推测可能是VGLL2-AS与VGLL2通过碱基互补配对形成双链RNA,造成了VGLL2的内含子滞留,使之产生了3种剪切体,但VGLL2-AS是否影响VGLL2基因的可变剪切,仍待进一步的研究。
转录起始点之间的距离在1 kb碱基范围内的相邻的两个转录方向相反的基因被称为双向转录基因对,原核生物和真核生物的基因组中都存在双向转录基因,它们的表达大多是正相关的,并且在进化上保守[41-42]。VGLL2-AS和VGLL2-mRNA、VGLL2-X3在不同时期的胸肌组织中的表达具有很强的正相关,这与前期证明VGLL2-AS与VGLL2可以双向转录的结果一致。而VGLL2-AS的表达水平随着胸肌的发育而下调,这个基因是否负向调控肌肉发育,或者只在肌肉发育前期起作用有待进一步解析。
4 结论综上所述,VGLL2-AS作为VGLL2反义链编码的lncRNA定位于细胞质中,可能通过与VGLL2形成的双链RNA之间的相互作用,然后参与调节VGLL2的表达并维持其稳定性,最终在鸡的早期肌肉发育中发挥重要作用。本研究的结果扩展了鸡中关于NATs的研究,并为鸡VGLL2基因与其天然反义链转录本VGLL2-AS在鸡骨骼肌发育中的生物学功能奠定了基础,对于提高禽类的生长性能具有一定的意义。
| [1] |
CHEN J J, SUN M, KENT W J, et al. Over 20% of human transcripts might form sense-antisense pairs[J]. Nucleic Acids Res, 2004, 32(16): 4812-4820. DOI:10.1093/nar/gkh818 |
| [2] |
CABILI M N, TRAPNELL C, GOFF L, et al. Integrative annotation of human large intergenic noncoding RNAs reveals global properties and specific subclasses[J]. Genes Dev, 2011, 25(18): 1915-1927. DOI:10.1101/gad.17446611 |
| [3] |
MIHOLA O, FOREJT J, TRACHTULEC Z. Conserved alternative and antisense transcripts at the programmed cell death 2 locus[J]. BMC Genomics, 2007, 8: 20. DOI:10.1186/1471-2164-8-20 |
| [4] |
FENG Y, ZHANG Q, WANG J, et al. Increased lncRNA AFAP1-AS1 expression predicts poor prognosis and promotes malignant phenotypes in gastric cancer[J]. Eur Rev Med Pharmacol Sci, 2017, 21(17): 3842-3849. |
| [5] |
ZHANG C L, ZHU K P, MA X L. Antisense lncRNA FOXC2-AS1 promotes doxorubicin resistance in osteosarcoma by increasing the expression of FOXC2[J]. Cancer Lett, 2017, 396: 66-75. DOI:10.1016/j.canlet.2017.03.018 |
| [6] |
WATANABE T, TOTOKI Y, TOYODA A, et al. Endogenous siRNAs from naturally formed dsRNAs regulate transcripts in mouse oocytes[J]. Nature, 2008, 453(7194): 539-543. DOI:10.1038/nature06908 |
| [7] |
WANG Y Y, XUE S Y, LIU X R, et al. Analyses of long non-coding RNA and mRNA profiling using RNA sequencing during the pre-implantation phases in pig endometrium[J]. Sci Rep, 2016, 6(1): 20238. DOI:10.1038/srep20238 |
| [8] |
WANG Z, XU H D, LI T, et al. Chicken GHR antisense transcript regulates its sense transcript in hepatocytes[J]. Gene, 2019, 682: 101-110. DOI:10.1016/j.gene.2018.10.001 |
| [9] |
MAEDA T, CHAPMAN D L, STEWART A F R. Mammalian Vestigial-like 2, a cofactor of TEF-1 and MEF2 transcription factors that promotes skeletal muscle differentiation[J]. J Biol Chem, 2002, 277(50): 48889-48898. DOI:10.1074/jbc.M206858200 |
| [10] |
MIELCAREK M, GVNTHER S, KRVGER M, et al. VITO-1, a novel vestigial related protein is predominantly expressed in the skeletal muscle lineage[J]. Mech Dev, 2002, 119(Suppl 1): S269-S274. |
| [11] |
任团辉. 天然反义转录本VGLL2-AS在鸡肌肉发育中的作用解析[D]. 郑州: 河南农业大学, 2018. REN T H. Effect analysis of natural antisense transcript VGLL2-AS during chicken muscle development[D]. Zhengzhou: Henan Agricultural University, 2018. (in Chinese) |
| [12] |
戴巍, 宋瑞龙, 张远浩, 等. 鸡骨骼肌卫星细胞的分离培养与鉴定[J]. 畜牧兽医学报, 2021, 52(3): 676-682. DAI W, SONG R L, ZHANG Y H, et al. Isolation, culture and identification of muscle satellite cells of chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(3): 676-682. (in Chinese) |
| [13] |
YU W Q, GIUS D, ONYANGO P, et al. Epigenetic silencing of tumour suppressor gene p15 by its antisense RNA[J]. Nature, 2008, 451(7175): 202-206. DOI:10.1038/nature06468 |
| [14] |
MAO Y, XU J, WANG Q, et al. A natural antisense transcript acts as a negative regulator for the maize drought stress response gene ZmNAC48[J]. J Exp Bot, 2021, 72(7): 2790-2806. DOI:10.1093/jxb/erab023 |
| [15] |
CHENG H, ZHANG E S, SHI X, et al. A novel ATM antisense transcript ATM-AS positively regulates ATM expression in normal and breast cancer cells[J]. Curr Med Sci, 2022, 42(4): 681-691. DOI:10.1007/s11596-022-2585-5 |
| [16] |
PARNIGONI A, CAON I, TEO W X, et al. The natural antisense transcript HAS2-AS1 regulates breast cancer cells aggressiveness independently from hyaluronan metabolism[J]. Matrix Biol, 2022, 109: 140-161. DOI:10.1016/j.matbio.2022.03.009 |
| [17] |
YANG Y Y, SU Z J, SONG X H, et al. Enhancer RNA-driven looping enhances the transcription of the long noncoding RNA DHRS4-AS1, a controller of the DHRS4 gene cluster[J]. Sci Rep, 2016, 6(1): 20961. DOI:10.1038/srep20961 |
| [18] |
YU W Q, GIUS D, ONYANGO P, et al. Epigenetic silencing of tumour suppressor gene p15 by its antisense RNA[J]. Nature, 2008, 451(7175): 202-206. DOI:10.1038/nature06468 |
| [19] |
ZÚÑIGA A, BORJA M, MEIJERS C, et al. Expression of alternatively spliced bFGF first coding exons and antisense mRNAs during chicken embryogenesis[J]. Dev Biol, 1993, 157(1): 110-118. DOI:10.1006/dbio.1993.1116 |
| [20] |
TAYLOR E R, SELEIRO E A P, BRICKELL P M. Identification of antisense transcripts of the chicken insulin-like growth factor-Ⅱ gene[J]. J Mol Endocrinol, 1991, 7(2): 145-154. DOI:10.1677/jme.0.0070145 |
| [21] |
FARRELL C M, LUKENS L N. Naturally occurring antisense transcripts are present in chick embryo chondrocytes simultaneously with the down-regulation of the α1(Ⅰ) collagen gene[J]. J Biol Chem, 1995, 270(7): 3400-3408. DOI:10.1074/jbc.270.7.3400 |
| [22] |
MIHOLA O, FOREJT J, TRACHTULEC Z. Conserved alternative and antisense transcripts at the programmed cell death 2 locus[J]. BMC Genomics, 2007, 8: 20. DOI:10.1186/1471-2164-8-20 |
| [23] |
SARODAYA N, TYAGI A, KIM H J, et al. Deubiquitinase USP19 enhances phenylalanine hydroxylase protein stability and its enzymatic activity[J]. Cell Biol Toxicol, 2022. DOI:10.1007/s10565-022-09719-z |
| [24] |
VAN DIJK E L, CHEN C L, D'AUBENTON-CARAFA Y, et al. XUTs are a class of Xrn1-sensitive antisense regulatory non-coding RNA in yeast[J]. Nature, 2011, 475(7354): 114-117. DOI:10.1038/nature10118 |
| [25] |
CLARK M B, JOHNSTON R L, INOSTROZA-PONTA M, et al. Genome-wide analysis of long noncoding RNA stability[J]. Genome Res, 2012, 22(5): 885-898. DOI:10.1101/gr.131037.111 |
| [26] |
王章. 鸡GHR-AS与Let-7b在肝细胞中调控GHR-S的机制研究[D]. 湛江: 广东海洋大学, 2018. WANG Z. Chicken GHR-AS and Let-7b Regulate the GHR-S in hepatocytes[D]. Zhanjiang: Guangdong Ocean University, 2018. (in Chinese) |
| [27] |
CHEN L L. Linking long noncoding RNA localization and function[J]. Trends Biochem Sci, 2016, 41(9): 761-772. DOI:10.1016/j.tibs.2016.07.003 |
| [28] |
孟珊, 杨阳, 李睿霄, 等. lncRNA-6617调控猪肌内前体脂肪细胞分化的筛选与功能研究[J]. 畜牧兽医学报, 2022, 53(6): 1712-1722. MENG S, YANG Y, LI R X, et al. Screening and functional study of lncRNA-6617 regulating porcine intramuscular preadipocytes differentiation[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(6): 1712-1722. (in Chinese) |
| [29] |
赵学亮, 刘海金, 萧飒, 等. 长链非编码RNA——病毒与宿主相互作用中的新型调控因子[J]. 畜牧兽医学报, 2020, 51(9): 2059-2067. ZHAO X L, LIU H J, XIAO S, et al. Long Non-coding RNAs: novel regulators of virus-host interactions[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(9): 2059-2067. (in Chinese) |
| [30] |
李倩倩, 李龙, 黄子莹, 等. 猪lncRNA TCONS_00791383对骨骼肌卫星细胞增殖分化的影响[J]. 畜牧兽医学报, 2020, 51(6): 1177-1186. LI Q Q, LI L, HUANG Z Y, et al. Effect of Pig lncRNA TCONS_00791383 on the proliferation and differentiation of skeletal muscle satellite cells[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(6): 1177-1186. (in Chinese) |
| [31] |
CESANA M, CACCHIARELLI D, LEGNINI I, et al. A long noncoding RNA controls muscle differentiation by functioning as a competing endogenous RNA[J]. Cell, 2011, 147(2): 358-369. DOI:10.1016/j.cell.2011.09.028 |
| [32] |
PENNY G D, KAY G F, SHEARDOWN S A, et al. Requirement for Xist in X chromosome inactivation[J]. Nature, 1996, 379(6561): 131-137. DOI:10.1038/379131a0 |
| [33] |
PELECHANO V, STEINMETZ L M. Gene regulation by antisense transcription[J]. Nat Rev Genet, 2013, 14(12): 880-893. DOI:10.1038/nrg3594 |
| [34] |
FAGHIHI M A, ZHANG M, HUANG J, et al. Evidence for natural antisense transcript-mediated inhibition of microRNA function[J]. Genome Biol, 2010, 11(5): R56. DOI:10.1186/gb-2010-11-5-r56 |
| [35] |
QUINN J J, CHANG H Y. Unique features of long non-coding RNA biogenesis and function[J]. Nat Rev Genet, 2016, 17(1): 47-62. DOI:10.1038/nrg.2015.10 |
| [36] |
STAMM S, BEN-ARI S, RAFALSKA I, et al. Function of alternative splicing[J]. Gene, 2005, 344: 1-20. DOI:10.1016/j.gene.2004.10.022 |
| [37] |
王晶晶, 张培培, 郝海生, 等. 牛体内囊胚全转录组模式解析[J]. 畜牧兽医学报, 2020, 51(6): 1271-1280. WANG J J, ZHANG P P, HAO H S, et al. Analysis of whole transcriptome pattern of bovine in vivo blastocyst[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(6): 1271-1280. (in Chinese) |
| [38] |
田威龙, 兰干球, 张龙超, 等. 北京黑猪DKK3和CCR1基因多态性检测及其与背膘厚的关联分析[J]. 畜牧兽医学报, 2022, 53(7): 2083-2093. TIAN W L, LAN G Q, ZHANG L C, et al. Detection of DKK3 and CCR1 genes polymorphisms and their association with backfat thickness in Beijing black pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7): 2083-2093. (in Chinese) |
| [39] |
崔迎迎, 芒来, 李蓓, 等. MEI1基因可变剪切事件对蒙古马精子生成的调控作用[J]. 畜牧兽医学报, 2022, 53(4): 1096-1108. CUI Y Y, MANG L, LI B, et al. Regulatory role of MEI1 with alternative splicing event on spermatogenesis in mongolian horse[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(4): 1096-1108. (in Chinese) |
| [40] |
BELTRAN M, PUIG I, PEÑA C, et al. A natural antisense transcript regulates Zeb2/Sip1 gene expression during Snail1-induced epithelial-mesenchymal transition[J]. Genes Dev, 2008, 22(6): 756-769. DOI:10.1101/gad.455708 |
| [41] |
TRINKLEIN N D, ALDRED S F, HARTMAN S J, et al. An abundance of bidirectional promoters in the human genome[J]. Genome Res, 2004, 14(1): 62-66. DOI:10.1101/gr.1982804 |
| [42] |
CHEN Y Q, LI H, LI Y Y, et al. Pan-cancer analysis of head-to-head gene pairs in terms of transcriptional activity, Co-expression and regulation[J]. Front Genet, 2021, 11: 560997. DOI:10.3389/fgene.2020.560997 |
(编辑 郭云雁)



