肌肉色泽不仅能影响消费者的购买决策,同时还反映了动物的健康及营养代谢状况[1]。肌肉色泽与肉中肌红蛋白(myoglobin,Mb)含量及其氧化还原状态有关,Mb的氧化产物高铁肌红蛋白(metmyoglobin,MMb)会使肉呈现暗褐色,因此抑制肉中Mb氧化并降低MMb比例是保持色泽的关键。
植物多酚作为一类天然的抗氧化剂,具有很强的供氢与螯合金属的能力,可抑制自由基形成,中断氧化链式反应,能作为一种有效的护色方式添加到动物日粮中[2]。肌细胞线粒体中氧化磷酸化过程及线粒体代谢与MMb的还原有密切的联系,已有研究显示,线粒体中电子传递链的还原酶直接参与MMb的还原[3]。肌纤维类型也是影响肉色的重要因素,其类型不同,所含的线粒体和Mb含量也不同[4]。在日粮中添加植物多酚作为膳食补充剂,可以提高动物肌肉的抗氧化能力,调控肌纤维类型,增强线粒体功能,抑制肌红蛋白与脂质的过度氧化,从而提高肉色稳定性。本文概括了植物多酚提高肌肉抗氧化能力、促进肌纤维类型转化的研究进展并探寻了植物多酚调控肉色改变的分子机制,为今后动物饲料添加植物多酚改善肉色提供理论依据。
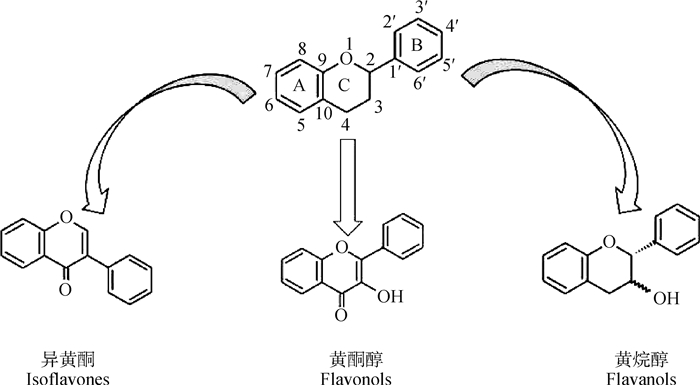
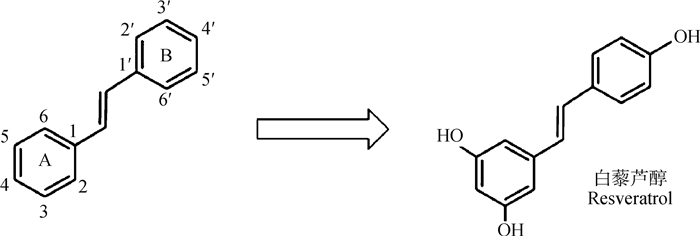
1 植物多酚概述 1.1 植物多酚的种类与化学结构植物多酚是一类苯环上连有一个或多个羟基的次生代谢物,化学结构独特,可以清除多种自由基,有较强的抗氧化功效。植物多酚广泛分布于植物的根、叶、皮和果中。目前,从植物中鉴定出的多酚化合物有8 000余种。在自然界中,酚类化合物通常与糖和有机酸结合,根据芳香环的数量及位置分为黄酮类和非黄酮类两大类[5]。黄酮类由两个芳香环(环A和环B)通过三碳氧化杂环(环C)连接而成,根据杂环的氧化程度,黄酮类可分为花青素、异黄酮、黄烷酮、黄酮醇、黄酮和黄烷醇等6个亚族(图 1)[6]。黄酮类物质含有邻二酚基团、羰基共轭双键及酚羟基等结构元素,能与氧自由基反应,中断链式氧化反应,发挥抗氧化作用[7]。而黄酮醇中的槲皮素能集合黄酮的所有结构元素,发挥的抗氧化功效最强[8]。非黄酮类物质种类多样,既有简单酚酸类(C6-C1)又有复杂芪类(C6-C2-C6)。在芪类物质中(图 2),芳香环通过带双键的碳桥连接而成,白藜芦醇是芪类物质的母体,存在多个酚羟基并发挥生物活性[9]。
1.2 植物多酚的作用1.2.1 植物多酚的抗氧化作用 植物多酚的抗氧化能力取决于化学结构中酚羟基的数量与位置,并随羟基化程度逐渐增强[10]。Xiao等[11]研究了4种黄酮醇的羟基数目,发现羟基数目与抗氧化能力排序一致,依次为杨梅素>槲皮素>山奈酚>高良姜素;羟基的取代位置也会影响植物多酚的抗氧化作用,邻位和对位二酚的抗氧化能力较强。Brown和Kelly[12]发现,植物多酚中矢车菊素和原儿茶酸抗氧化活性最强,其所含羟基多为邻位取代;没食子酸羟基数最多,但活性反而降低。
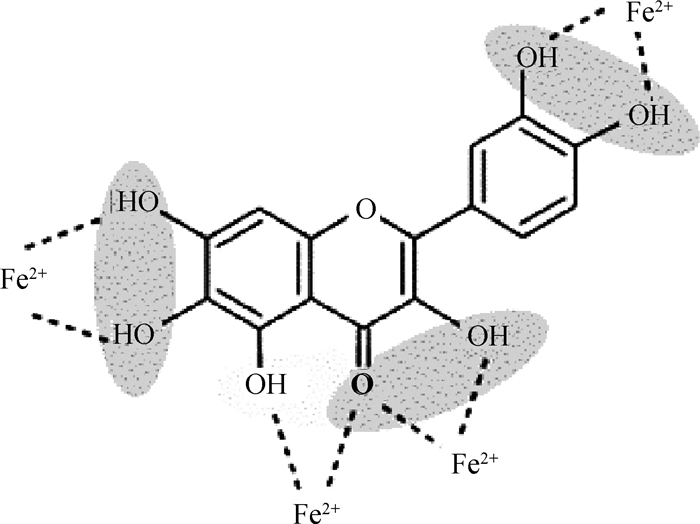
机体中的脂质氧化属于自由基链式反应[13]。铁、铜等金属离子是脂质氧化的启动剂,能催化H2O2的分解并产生羟基自由基,植物多酚可螯合金属离子形成稳定络合物,减少羟基自由基的产生,并阻断脂质过氧化反应[2]。螯合反应的作用位点来源于植物多酚的邻位酚羟基及羟基与羰基的组合部分。目前,黄酮与铁螯合作用的研究较为完善(图 3),普遍存在“铁螯合位点”为3-羟基-4-羰基、4-羰基-5-O羟基和3’-4’-羟基部位,也有研究发现,黄芩素的6-7号位羟基也是铁的螯合位点[14-15]。这些螯合位点能直接作用于活性氧,维持机体的内源性防御系统。
|
灰色和虚线区域是铁螯合位点 The gray and dashed areas are iron chelation sites 图 3 黄酮类抗氧化的结构特征[6] Fig. 3 Structural characteristics of flavonoid antioxidants[6] |
1.2.2 植物多酚抗氧化作用在动物中的作用 植物多酚可以提高动物的抗氧化潜力,降低动物屠宰后肌肉氧化损伤的风险,对肉的色泽、风味等会产生积极影响[13]。在母猪日粮中添加白藜芦醇,可降低胸长肌丙二醛水平,提高SOD酶活性[16]。Andrés等[17]发现,在羔羊饲料中添加槲皮素可降低肉中不饱和脂肪酸和脂质氧化的比例。在育成猪饲料中添加鳄梨废料(类黄酮),猪肉在贮藏期间具有较低的脂质和蛋白氧化速率[18]。因此,日粮中添加多酚类物质是一种通过抑制脂质和蛋白质氧化来改善动物肉质的新策略。
2 日粮添加植物多酚对肉色稳定性的影响在畜禽营养领域,植物多酚作为一种天然的饲料添加剂,在猪、鸡、羊、牛上都得到了广泛应用。通过添加不同种类的植物多酚,可对肉色产生积极影响(表 1)。影响肉色稳定性的因素包括蛋白和脂质的氧化状态、骨骼肌的纤维类型及机体内源的抗氧化能力等,当动物摄入植物多酚后,在胃肠道菌群的作用下实现部分吸收利用,不仅能调控肌纤维类型、影响机体内的氧化状态,还能沉积于动物肌肉组织并提升抗氧化能力,最终达到改善肉色稳定性的目的。
|
|
表 1 日粮中添加植物多酚对畜禽肌肉肉色的调控 Table 1 Regulation of muscle colour in livestock by dietary addition of plant polyphenols |
肌肉组织中肌红蛋白的主要作用是输送和储存氧气,以脱氧肌红蛋白(deomyoglobin,DMb)、氧合肌红蛋白(oxymyoglobin,OMb)和高铁肌红蛋白3种形式存在,它们之间可按照以下顺序进行可逆转化:DMb↔OMb↔MMb[26]。肌肉组织中肌红蛋白易氧化为无生理活性的MMb,而MMb积累可引起肉色的劣变,因此,阻止MMb的产生以及提高其还原能力是控制肉色变化的关键[27]。线粒体可通过酶促和非酶促途径实现MMb还原。线粒体内存在着完整的高铁肌红蛋白还原酶系统,依赖NADH通过酶促途径介导MMb的还原[28]。NADH作为电子供体,将电子传递至细胞色素b5还原酶,后者将电子转移给细胞色素b5,还原态的细胞色素b5再将电子传递到MMb的血红素辅基中,从而使正3价铁离子还原为正2价,实现MMb的还原[29-30]。非酶促途径也能实现MMb的还原,在氧化呼吸链中,线粒体膜中的复合物Ⅰ、复合物Ⅱ分别催化NADH和琥珀酸脱氢,并将脱下的H+传递给辅酶Q,后者将H+释放到介质中,电子进一步经复合体Ⅲ、细胞色素c和复合体Ⅳ传递给MMb,最终实现MMb的还原[31-32]。
植物多酚可在肠道消化后转化为可吸收的苷元等,进一步沉积于肌肉组织中,这对动物肉色产生积极影响[33]。这些物质不仅能提高机体的抗氧化性能,还会激活线粒体呼吸链,增强MMb还原酶系的活力。Luciano等[22]在饲料中添加单宁后,发现肌肉中酚类化合物提高,减缓了肌细胞内线粒体的氧化进程,有效保护了线粒体膜的完整性及其活性;酚类物质还延缓了MMb生成速率,提高了肉色稳定性。刘策[21]研究发现,苜蓿皂苷能增强绵羊肌肉中高铁肌红蛋白还原酶(MetMbase)、琥珀酸脱氢酶(SDH)及细胞色素c氧化酶(COX)的活力,推断苜蓿皂苷激活并促进了线粒体呼吸链的电子传递速率,使MMb发生还原反应,有效改善了肉色。因此,植物多酚可通过改变肌红蛋白的氧化还原状态达到调控肉色的目的。
2.2 植物多酚对脂质氧化程度的影响动物肌肉中脂肪十分丰富,其中不饱和脂肪酸(UFA)极易发生脂质氧化产生自由基(L·、LOO·、O2-等)和氧化代谢产物,包括丙二醛(malondialdehyde,MDA)、4-羟基-2-壬烯醛(4-hydroxy-2-nonenal,HNE),会对肉色产生不利影响[34]。动物宰后,肌细胞膜的完整性被破坏会增加脂质氧化的风险,而Mb更容易与UFA接触并催化脂质氧化,脂质氧化终产物的积累也会加剧Mb的氧化。自由基能夺取肌红蛋白中Fe2+的电子,使其氧化为Fe3+;脂质氧化产物既能氧化OMb,又能影响MMb的还原能力,最终导致脂质氧化与肌红蛋白氧化耦合发生[30, 35]。
植物多酚是天然氧化抑制剂,可通过清除自由基、螯合金属离子等途径来抑制脂肪氧化。Natalello等[23]在羔羊饲料中添加石榴副产物,发现羔羊肌肉中的脂质氧化受到了抑制,推测是植物多酚阻断了链式反应的进行,及时清除了脂质氧化产生的自由基,减少MMb的积累。Emami等[36]发现,膳食中补充植物多酚可使山羊肌肉组织中TBARS值线性下降,这与石榴中含有鞣花酸等酚类物质有关,鞣花酸含有酚羟基,能结合脂质氧化产物并阻断后续链式反应。植物多酚除了能提供氢自由基来阻断脂质氧化进程外,还能螯合过渡金属形成惰性络合物,从源头阻止脂质氧化的发生。Morel等[37]建立了铁诱导的细胞脂质氧化模型,在铁处理的肝细胞培养物中加入杨梅素,发现细胞中丙二醛和脂质氧化初级代谢物的生成速率明显降低。同时,Cimmino等[38]在日粮中添加植物多酚发现,羔羊血浆中铁浓度及MDA生成量降低,说明植物多酚能螯合金属铁,抑制芬顿反应的发生,降低脂质氧化水平。Maggiolino等[24]研究发现,饲料中添加木质素可发挥抗氧化作用,降低牛肉脂质氧化程度并提高肉色稳定性。
2.3 植物多酚对肌纤维类型的影响骨骼肌的基本组成单位是肌纤维,通常排列成束,周围环绕着结缔组织。肌纤维可划分为慢速收缩氧化型(Ⅰ型)、快速收缩氧化型(Ⅱa型)、中间型(Ⅱx型)和快速收缩酵解型(Ⅱb型)4种类型[39]。Ⅰ型和Ⅱa型肌纤维主要进行有氧代谢,需要大量的肌红蛋白和线粒体来携氧供能,因而肌肉中氧化型肌纤维比例越高,肉色越好;相反,Ⅱb型肌纤维的能量代谢以糖酵解为主,肌红蛋白含量较少,肌肉显得苍白,因此,肌纤维类型组成与动物肉色密切相关。动物出生后肌纤维数量基本固定,但类型会受环境、年龄及营养等因素的影响发生Ⅰ↔Ⅱa↔Ⅱx↔Ⅱb的表型转化[40]。Gagaoua等[41]试验证明,饲养方式可能是肉色和肌肉纤维之间关联的根源。Dunne等[42]早期研究发现,放牧饲养的动物中氧化型肌纤维比例较高,肌红蛋白含量丰富,这也为后续通过改变饲养方式进而改善肉色奠定了研究基础。
动物饲粮中添加植物多酚,可提高过氧化物酶受体增殖激活受体辅助激活因子-1α(peroxisome proliferator-activated receptor gamma co-activator 1 alpha,PGC-1α)的表达,实现肌纤维类型的转化,进而改善动物的肉色[43]。Zhang等[20]研究表明,在饲料中添加白藜芦醇可提高猪背最长肌的a*值和Mb含量,究其原因是白藜芦醇提高了肌球蛋白重链MyHC Ⅱa以及PPARs基因表达水平,增强了线粒体功能,提高了氧化型肌纤维的比例。越来越多的研究致力于阐明植物多酚影响肌纤维类型转化的机理。有研究表明,PGC-1α与Ⅰ型肌纤维的形成关系密切,敲除小鼠PGC-1α基因,会诱导小鼠骨骼肌从氧化型向酵解型转化[44]。Mizunoya等[45]研究发现,在小鼠饲料中添加5%苹果植物多酚,可通过上调PPAR-γ从而激活PGC-1α相关途径,增加Ⅰ型肌纤维的比例。
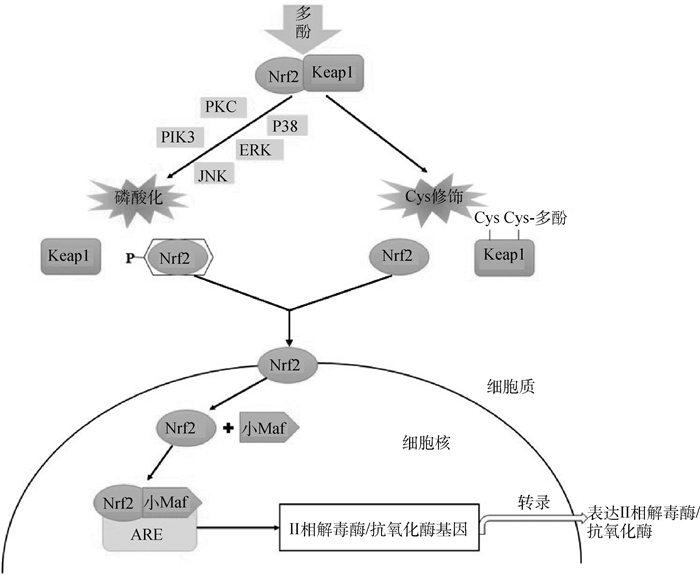
3 植物多酚介导的肉色稳定性作用机制 3.1 Nrf2/Keap1-ARE信号途径Nrf2/Keap1-ARE信号通路是增强机体抗氧化功能的保护性信号途径[46]。如图 4所示,在Nrf2/Keap1-ARE信号通路中,核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)活性受Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein-1,Keap1)调控[47]。机体正常状态下,细胞中的Nrf2与Keap1结合,处于非活性状态[48];而氧化应激会导致Keap1构象发生改变并与Nrf2分离,Nrf2进入细胞核,识别核内小Maf蛋白并结合抗氧化反应元件(antioxidant response element,ARE)从而启动Ⅱ相脱毒酶和抗氧化酶相关基因的表达和蛋白的合成,从而提升细胞的抗氧化能力[49]。
|
图 4 植物多酚影响抗氧化能力的信号通路[45-46] Fig. 4 Signaling pathways of plant polyphenols affecting antioxidant capacity[45-46] |
植物多酚能通过促进不同途径激活上述信号通路,增强内源性抗氧化能力,降低肌肉组织中脂质过氧化并抑制肌红蛋白氧化,具有保护肉色及其稳定性的作用[46, 50]。细胞中负责活化Nrf2的蛋白激酶系包括蛋白激酶C(protein kinase C,PKC)、磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase,PIK3)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)及p38等[50]。植物多酚能通过激活Nrf2酶系来诱导Nrf2磷酸化参与对转录活性的调节,促使Nrf2/Keap1复合物中释放出Nrf2,并进一步结合到ARE上调节抗氧化蛋白和Ⅱ相解毒酶的表达从而提高细胞抗氧化能力。Chen等[51]发现,在细胞中添加PIK3和MEK1/2的抑制因子LY294002和U0126后,下游的Akt和ERK1/2失活,这减弱了白藜芦醇诱导细胞HO-1表达的能力,由此证明白藜芦醇是通过磷酸化ERK和Akt来激活PC12细胞中的Nrf2。Tsai等[52]用鼠尾草酸(迷迭香酚)处理细胞,发现鼠尾草酸可激活MAPKs中p38的活性,并随剂量的增加,Nrf2、ARE和醌氧化还原酶1(quinone oxidoreductase 1,NQO1)活性也随之增加。李黎云[53]研究发现,饲粮中添加0.01%阿魏酸能有效提高猪背最长肌中抗氧化酶基因的表达水平,推断阿魏酸可能是通过蛋白激酶PI3K和ERK途径致使Nrf2磷酸化,激活Nrf2/Keap1-ARE信号通路。Sun等[54]在1日龄肉鸡饲料中添加槲皮素,发现可促进Nrf2从细胞质到细胞核的易位,这激活了Nrf2信号通路,增加了Nrf2下游基因水平的表达;此外,槲皮素还削弱了脂多糖对ERK、JNK和p38磷酸化的抑制作用,说明槲皮素对脂多糖诱导的肉鸡肠道氧化应激具有的潜在保护作用。
Keap1包含5个不同的功能区,其中插入区(intervening region,ⅣR)富含半胱氨酸残基,是整个蛋白的功能调节区。植物多酚可以通过修饰Keap1中ⅣR区的半胱氨酸(Cys)位点,使Keap1蛋白的构象发生改变而与Nrf2解偶联,激活Nrf2/Keap1-ARE通路[55]。Tanigawa等[56]发现,槲皮素会使HepG2细胞中Keap1半胱氨酸残基被修饰引起构象变化,这降低了Keap1蛋白水平,提高了Nrf2/Keap1比例。有研究发现,在氧化应激条件下,茶多酚的B环会被氧化成半醌自由基,醌类物质可与ⅣR区的半胱氨酸的巯基反应形成2’-半胱氨酸茶多酚,破坏Keap1结构;同时,茶多酚自身氧化产生的活性氧(reactive oxygen species,ROS)可以氧化Keap1的半胱氨酸硫醇,导致Nrf2对Keap1的亲和力下降[46]。Shin等[57]发现,小鼠表皮细胞转染突变体Keap1蛋白(其中Cys151被丝氨酸取代)后,姜黄素诱导HO-1及Nrf2的能力降低,质谱分析表明,姜黄素可作用于Keap1且与Cys151位点结合,说明Cys是姜黄素修饰Keap1的关键靶点。
植物多酚还可通过调控其他转录因子和核蛋白表达来介导Nrf2/Keap1-ARE通路。Liu等[58]研究发现,核因子-κB(NF-κB)在转录水平抑制Nrf2信号通路。周莎莎等[59]通过肾损伤小鼠模型发现芹菜素能激活NF-κB相关通路,上调Nrf2表达,使小鼠机体抗氧化性能增强。也有研究发现,膳食中的白藜芦醇能增加沉默信息调节因子1(SIRT1)表达,SIRT1过表达会促进Nrf2的核积累,调节Nrf2介导的Ⅱ相解毒酶来提高细胞的抗氧化能力[60]。综上,植物多酚可通过多种途径调节Nrf2/Keap1-ARE通路,增强抗氧化相关基因表达,进一步调控肌红蛋白的氧化状态及脂质氧化进程来提高肉色稳定性。
3.2 PGC-1α信号途径PGC-1α是核受体辅助激活因子,相关通路是肌纤维类型转化的关键信号途径。PGC-1α作为肌纤维类型转化信号网络的中心枢纽,由细胞信号级联系统控制其激活、表达及信号传递,其上游调控因子主要包括脂联素(adiponectin,AdipoQ)、沉默信息调节因子1(silent information regulator 1,SIRT1)及腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)等;下游效应物为过氧化物酶受体增殖激活受体(peroxisome proliferator-activated receptors,PPARs)、肌细胞特异性增强结合因子2(myocyte-specific enhancer-binding factor 2,MEF2)及雌激素相关受体γ/β(estrogen-related receptor γ/β,EERγ /β)等[61]。机体受到氧化刺激时,细胞内与PGC-1α相关的通路激活后可诱导肌纤维类型的转化(图 5)。
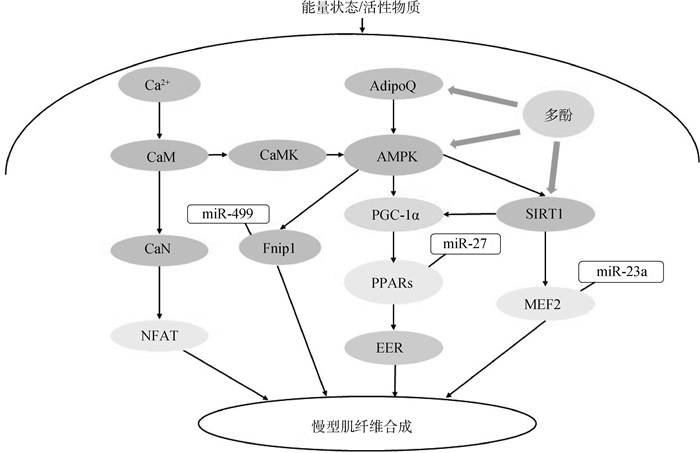
|
图 5 植物多酚影响骨骼肌纤维类型转化的信号通路[39, 62-64] Fig. 5 Signaling pathways of plant polyphenols affecting skeletal muscle fiber type conversion[39, 62-64] |
植物多酚可作用于PGC-1α信号途径上游调控因子,包括AdipoQ、AMPK及SIRT1等,激活下游效应物,参与调节骨骼纤维类型的转换。AdipoQ是脂肪组织分泌的一种活性物质,不仅可调节脂肪沉积,还与肌纤维的类型密切相关。Chen等[62]为探究饮食补充槲皮素诱导小鼠肌纤维类型转化的分子机制,以C2C12细胞体外模型为研究对象,敲除C2C12细胞肌管中AdipoQ受体,结果发现氧化型肌纤维显著降低,这表明槲皮素介导的骨骼肌纤维转化依赖于AdipoQ信号通路。AMPK是细胞的能量感受器,除对肌肉能量代谢起关键调节作用外,还参与调控肌纤维类型转化[65]。Chen等[66]发现,在小鼠饲料中添加阿魏酸可提高AMPK磷酸化水平,AMPK经磷酸化激活后会调控其下游通路PGC-1α,从而上调PPARs等下游靶基因的表达,进而影响MyHC基因表达,促进骨骼肌慢肌纤维形成。除AMPK之外,SIRT1是另一能量感受器,在骨骼肌组织的能量代谢中发挥重要作用。当SIRT1活性增强,会导致其下游靶点(PGC-1α)的去乙酰化,促进红肌纤维的形成[67]。Ljubicic等[68]给6周龄小鼠喂食白藜芦醇可诱导骨骼肌向红肌纤维转化,并确定此过程与AMPK-SIRT1-PGC-1α信号通路密切相关。Price等[64]发现,白藜芦醇可显著降低PGC-1α乙酰化水平,诱导红肌纤维的生成,但在缺乏SIRT1的条件下,这种影响消失,说明白藜芦醇可能是通过SIRT1来间接调控PGC-1α表达的。Akashi等[69]给小鼠饲喂橙皮素5周后,观察到小鼠骨骼肌中PGC-1α蛋白水平、线粒体含量及氧化型肌纤维比例增高,表明橙皮素可介导PGC-1α诱导线粒体生物发生及红肌纤维的形成。此外,研究还发现,随着橙皮素的增加,SIRT3和AMPK的表达增强,暗示橙皮素可能刺激了SIRT3、AMPK和PGC-1α相关信号通路。
miRNAs是一类保守性极高的非编码RNA,此前已有研究证实miRNA在控制骨骼肌发育、肌球蛋白表达和肌纤维表型等方面有重要作用[70]。多种miRNAs作用于PGC-1α信号通路调控因子上,发挥调控肌纤转化的作用。每种miRNA调控肌纤维转化的作用机制不同,其与肌源性调控因子的互作复杂交错,且存在负反馈回路。Fnip1是负反馈AMPK的关联蛋白,miR-499靶向抑制Fnip1后,经过AMPK-PGC-1α通路来诱导肌纤维类型转化。miR-23a可直接靶向MEF2C,miR-143则通过HDAC4-MEF2通路来调控慢型肌纤维基因的表达[70-72]。余亲平[73]发现,复方中草药的活性成分6-姜酚可通过调控miR-27b/PPAR比例,影响猪慢肌纤维基因和蛋白的表达水平,改变肌纤维类型。植物多酚会激活胞内与肌纤维转化相关的PGC-1α信号通路,通路中各调控因子互相影响,共同完成酵解型向氧化型肌纤维的转化,改善动物肉色及其稳定性。
4 小结与展望肉色及其稳定性与肌红蛋白氧化状态、脂质氧化程度和骨骼肌纤维类型密切相关。植物多酚能够通过激活Nrf2/Keap1-ARE途径上调内源性抗氧化能力,调控肌红蛋白与脂质的氧化状态;还可以诱导与辅助活化因子PGC-1α相关的信号通路,调节肌纤维类型的转化,为改善肉色提供新的途径。
植物多酚在体内的活性及效用取决于多种因素,包括多酚的多样性、肠道微生物体系的复杂性及宿主的健康和免疫状态。植物多酚的代谢与吸收离不开肠道菌群的参与,其代谢产物能够发挥出对肠道微生物群和机体更有益的作用。肠道微生物体系和多酚代谢物之间存在着紧密的相互依赖关系,两者在维持宿主肠道内环境平衡方面起着关键作用。但是,完全阐明肠道微生物体系、多酚以及与肠-脑功能之间的相互作用是一项还未解决的难题。因此,进一步的研究应该集中在机体摄入多酚后的代谢途径上,因为具体的作用途径是揭开背后机制的关键。此外,通过使用组学方法,可以获得关于肠道微生物组成、多酚及其结肠发酵产物和其他微生物体系代谢物更准确的信息,更好地了解它们在宿主中的作用效应[74-76]。
| [1] |
刘策, 罗海玲. 羊肉色泽的影响因素及调控方式研究[Z]. 2015中国羊业进展, 2015. LIU C, LUO H L. Study on the influencing factors and regulation methods of mutton color[Z]. Progress of China's Sheep Industry in 2015, 2015. (in Chinese) |
| [2] |
YUN S J, HE X S, ZHANG W F, et al. Alleviation effect of grape seed proanthocyanidins on neuronal apoptosis in rats with iron overload[J]. Biol Trace Elem Res, 2020, 194(1): 210-220. DOI:10.1007/s12011-019-01766-8 |
| [3] |
MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Sci, 2005, 71(1): 100-121. DOI:10.1016/j.meatsci.2005.03.003 |
| [4] |
白艳苹, 侯艳茹, 苏琳, 等. 乳酸菌诱导线粒体生物发生对绵羊肌纤维特性和肉品质的影响[J]. 农业工程学报, 2021, 37(10): 269-276. BAI Y P, HOU Y R, SU L, et al. Effects of lactobacillus induced mitochondrial biogenesis on muscle fiber properties and meat quality of sheep[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(10): 269-276. DOI:10.11975/j.issn.1002-6819.2021.10.032 (in Chinese) |
| [5] |
LIPIŃSKI K, MAZUR M, ANTOSZKIEWICZ Z, et al. Polyphenols in monogastric nutrition-a review[J]. Ann Anim Sci, 2017, 17(1): 41-58. DOI:10.1515/aoas-2016-0042 |
| [6] |
FRAGA C G, GALLEANO M, VERSTRAETEN S V, et al. Basic biochemical mechanisms behind the health benefits of polyphenols[J]. Mol Aspects Med, 2010, 31(6): 435-445. DOI:10.1016/j.mam.2010.09.006 |
| [7] |
类红梅, 罗欣, 毛衍伟, 等. 天然抗氧化剂的功能及其在肉与肉制品中的应用研究进展[J]. 食品科学, 2020, 41(21): 267-277. LEI H M, LUO X, MAO Y W, et al. A review of the functions and application of natural antioxidants in meat and meat products[J]. Food Science, 2020, 41(21): 267-277. DOI:10.7506/spkx1002-6630-20191025-286 (in Chinese) |
| [8] |
ZARAGOZÁ C, MONSERRAT J, MANTECÓN C, et al. Binding and antiplatelet activity of quercetin, rutin, diosmetin, and diosmin flavonoids[J]. Biomed Pharmacother, 2021, 141: 111867. DOI:10.1016/j.biopha.2021.111867 |
| [9] |
RAFIEI F, KHAJALI F. Flavonoid antioxidants in chicken meat production: potential application and future trends[J]. World's Poult Sci J, 2021, 77(2): 347-361. DOI:10.1080/00439339.2021.1891401 |
| [10] |
BREWER M S. Natural antioxidants: sources, compounds, mechanisms of action, and potential applications[J]. Compr Rev Food Sci Food Saf, 2011, 10(4): 221-247. DOI:10.1111/j.1541-4337.2011.00156.x |
| [11] |
XIAO J B, SUZUKI M, JIANG X Y, et al. Influence of B-ring hydroxylation on interactions of flavonols with bovine serum albumin[J]. J Agric Food Chem, 2008, 56(7): 2350-2356. DOI:10.1021/jf7037295 |
| [12] |
BROWN J E, KELLY M F. Inhibition of lipid peroxidation by anthocyanins, anthocyanidins and their phenolic degradation products[J]. Eur J Lipid Sci Technol, 2007, 109(1): 66-71. DOI:10.1002/ejlt.200600166 |
| [13] |
黄欢, 靳烨, 郭月英, 等. 植物多酚对动物脂质代谢影响的研究进展[J]. 动物营养学报, 2020, 32(8): 3533-3542. HUANG H, JIN Y, GUO Y Y, et al. Research progress on effects of plant polyphenols on lipid metabolism in animals[J]. Chinese Journal of Animal Nutrition, 2020, 32(8): 3533-3542. DOI:10.3969/j.issn.1006-267x.2020.08.011 (in Chinese) |
| [14] |
REN J, MENG S, LEKKA C E, et al. Complexation of flavonoids with iron: structure and optical signatures[J]. J Phys Chem B, 2008, 112(6): 1845-1850. DOI:10.1021/jp076881e |
| [15] |
PEREZ C A, WEI Y B, GUO M L. Iron-binding and anti-Fenton properties of baicalein and baicalin[J]. J Inorg Biochem, 2009, 103(3): 326-332. DOI:10.1016/j.jinorgbio.2008.11.003 |
| [16] |
MENG Q W, SUN S S, BAI Y S, et al. Effects of dietary resveratrol supplementation in sows on antioxidative status, myofiber characteristic and meat quality of offspring[J]. Meat Sci, 2020, 167: 108176. DOI:10.1016/j.meatsci.2020.108176 |
| [17] |
ANDRÉS S, MORÁN L, ALDAI N, et al. Effects of linseed and quercetin added to the diet of fattening lambs on the fatty acid profile and lipid antioxidant status of meat samples[J]. Meat Sci, 2014, 97(2): 156-163. DOI:10.1016/j.meatsci.2014.02.001 |
| [18] |
HERNÁNDEZ-LÓPEZ S H, RODRÍGUEZ-CARPENA J G, LEMUS-FLORES C, et al. Avocado waste for finishing pigs: impact on muscle composition and oxidative stability during chilled storage[J]. Meat Sci, 2016, 116: 186-192. DOI:10.1016/j.meatsci.2016.02.018 |
| [19] |
XU X J, CHEN X L, CHEN D W, et al. Effects of dietary apple polyphenol supplementation on carcass traits, meat quality, muscle amino acid and fatty acid composition in finishing pigs[J]. Food Funct, 2019, 10(11): 7426-7434. DOI:10.1039/C9FO01304K |
| [20] |
ZHANG C, LUO J Q, YU B, et al. Dietary resveratrol supplementation improves meat quality of finishing pigs through changing muscle fiber characteristics and antioxidative status[J]. Meat Sci, 2015, 102: 15-21. DOI:10.1016/j.meatsci.2014.11.014 |
| [21] |
刘策. 苜蓿皂苷对绵羊肌肉色泽的影响及其机理[D]. 北京: 中国农业大学, 2018. LIU C. Effect of afalfa saponins on the meat color and its mechanism of sheep[D]. Beijing: China Agricultural University, 2018. (in Chinese) |
| [22] |
LUCIANO G, VASTA V, MONAHAN F J, et al. Antioxidant status, colour stability and myoglobin resistance to oxidation of longissimus dorsi muscle from lambs fed a tannin-containing diet[J]. Food Chem, 2011, 124(3): 1036-1042. DOI:10.1016/j.foodchem.2010.07.070 |
| [23] |
NATALELLO A, PRIOLO A, VALENTI B, et al. Dietary pomegranate by-product improves oxidative stability of lamb meat[J]. Meat Sci, 2020, 162: 108037. DOI:10.1016/j.meatsci.2019.108037 |
| [24] |
MAGGIOLINO A, LORENZO J M, SALZANO A, et al. Effects of aging and dietary supplementation with polyphenols from Pinus taeda hydrolysed lignin on quality parameters, fatty acid profile and oxidative stability of beef[J]. Anim Prod Sci, 2020, 60(5): 713-724. DOI:10.1071/AN19215 |
| [25] |
LI W, ZHANG X Y, DU J, et al. RNA-seq-based quanitative transcriptome analysis of meat color and taste from chickens administered by eucalyptus leaf polyphenols extract[J]. J Food Sci, 2020, 85(4): 1319-1327. DOI:10.1111/1750-3841.15082 |
| [26] |
郜娜, 葛玲, 薛洋洋, 等. 线粒体介导高铁肌红蛋白还原活性与肉色变化关联性研究进展[J]. 肉类研究, 2021, 35(3): 60-65. GAO N, GE L, XUE Y Y, et al. Progress in understanding the relationship between mitochondria-mediated metmyoglobin reduction and changes in meat color[J]. Meat Research, 2021, 35(3): 60-65. (in Chinese) |
| [27] |
辛建增, 李铮, 李欣, 等. 甘油醛-3-磷酸对羊肉色泽稳定性和高铁肌红蛋白还原的影响[J]. 食品科学, 2018, 39(16): 112-117. XIN J Z, LI Z, LI X, et al. Effect of glyceraldehyde-3-phosphate on color stability and metmyoglobin reduction of mutton[J]. Food Science, 2018, 39(16): 112-117. DOI:10.7506/spkx1002-6630-201816017 (in Chinese) |
| [28] |
MANCINI R A, BELSKIE K, SUMAN S P, et al. Muscle-specific mitochondrial functionality and its influence on fresh beef color stability[J]. J Food Sci, 2018, 83(8): 2077-2082. DOI:10.1111/1750-3841.14219 |
| [29] |
ARIHARA K, CASSENS R G, GREASER M L, et al. Localization of metmyoglobin-reducing enzyme (NADH-cytochrome b5 reductase) system components in bovine skeletal muscle[J]. Meat Sci, 1995, 39(2): 205-213. DOI:10.1016/0309-1740(94)P1821-C |
| [30] |
陈骋. 脂质氧化和抗氧化因子对牦牛肉肌红蛋白稳定性及高铁肌红蛋白还原能力的影响[D]. 兰州: 甘肃农业大学, 2016. CHEN C. Effects of lipid oxidation and antioxidant factors on color stability and metmyoglobin reducing ability of yak muscle[D]. Lanzhou: Gansu Agricultural University, 2016. (in Chinese) |
| [31] |
GENOVA M L, LENAZ G. Functional role of mitochondrial respiratory supercomplexes[J]. Biochim Biophys Acta, 2014, 1837(4): 427-443. DOI:10.1016/j.bbabio.2013.11.002 |
| [32] |
TANG J L, FAUSTMAN C, MANCINI R A, et al. Mitochondrial reduction of metmyoglobin: dependence on the electron transport chain[J]. J Agric Food Chem, 2005, 53(13): 5449-5455. DOI:10.1021/jf050092h |
| [33] |
李文婷. 六种豆类中不同结合态多酚组成、胃肠道生物可接受率及其抗氧化活性研究[D]. 南昌: 南昌大学, 2018. LI W T. The composition of free, conjugated and bound phenolics in six legumes, and their bioacessibility of gastrointestinal tract and antioxidant activity[D]. Nanchang: Nanchang University, 2018. (in Chinese) |
| [34] |
张蒙蒙, 罗欣, 张一敏, 等. 钙盐对肉与肉制品肉色的影响及其机理研究进展[J]. 食品科学, 2019, 40(23): 327-333. ZHANG M M, LUO X, ZHANG Y M, et al. A review of recent research on the effect and underlying mechanism of calcium salts on meat color[J]. Food Science, 2019, 40(23): 327-333. DOI:10.7506/spkx1002-6630-20181210-122 (in Chinese) |
| [35] |
刘文轩, 罗欣, 杨啸吟, 等. 脂质氧化对肉色影响的研究进展[J]. 食品科学, 2020, 41(21): 238-247. LIU W X, LUO X, YANG X Y, et al. Recent progress in research on the effect of lipid oxidation on meat color[J]. Food Science, 2020, 41(21): 238-247. DOI:10.7506/spkx1002-6630-20190916-201 (in Chinese) |
| [36] |
EMAMI A, FATHI NASRI M H, GANJKHANLOU M, et al. Dietary pomegranate seed pulp increases conjugated-linoleic and -linolenic acids in muscle and adipose tissues of kid[J]. Anim Feed Sci Technol, 2015, 209: 79-89. DOI:10.1016/j.anifeedsci.2015.08.009 |
| [37] |
MOREL I, ABALÉA V, SERGENT O, et al. Involvement of phenoxyl radical intermediates in lipid antioxidant action of myricetin in iron-treated rat hepatocyte culture[J]. Biochem Pharmacol, 1998, 55(9): 1399-1404. DOI:10.1016/S0006-2952(97)00648-5 |
| [38] |
CIMMINO R, BARONE C M A, CLAPS S, et al. Effects of dietary supplementation with polyphenols on meat quality in Saanen goat kids[J]. BMC Vet Res, 2018, 14(1): 181. DOI:10.1186/s12917-018-1513-1 |
| [39] |
XUE Y H, HUANG Z Q, CHEN X L, et al. Naringin induces skeletal muscle fiber type transformation via AMPK/PGC-1α signaling pathway in mice and C2C12 myotubes[J]. Nutr Res, 2021, 92: 99-108. DOI:10.1016/j.nutres.2021.06.003 |
| [40] |
侯艳茹, 苏琳, 侯普馨, 等. 饲养方式对苏尼特羊肌纤维组成和肉品质的影响及其调控机理[J]. 食品科学, 2021, 42(7): 83-89. HOU Y R, SU L, HOU P X, et al. Effect of feeding regimens on muscle fiber type composition and meat quality of Sunit sheep and underlying regulatory mechanism[J]. Food Science, 2021, 42(7): 83-89. (in Chinese) |
| [41] |
GAGAOUA M, MONTEILS V, COUVREUR S, et al. Identification of biomarkers associated with the rearing practices, carcass characteristics, and beef quality: an integrative approach[J]. J Agric Food Chem, 2017, 65(37): 8264-8278. DOI:10.1021/acs.jafc.7b03239 |
| [42] |
DUNNE P G, MONAHAN F J, MOLONEY A P. Current perspectives on the darker beef often reported from extensively-managed cattle: does physical activity play a significant role?[J]. Livest Sci, 2011, 142(1-3): 1-22. DOI:10.1016/j.livsci.2011.06.018 |
| [43] |
梁婷玉, 吴建平, 刘婷, 等. 肌纤维类型分类及转化机理研究进展[J]. 肉类研究, 2018, 32(9): 55-61. LIANG T Y, WU J P, LIU T, et al. Recent progress in classification and transformation mechanism of muscle fiber types[J]. Meat Research, 2018, 32(9): 55-61. (in Chinese) |
| [44] |
HANDSCHIN C, CHIN S, LI P, et al. Skeletal muscle fiber-type switching, exercise intolerance, and myopathy in PGC-1α Muscle-specific knock-out animals[J]. J Biol Chem, 2007, 282(41): 30014-30021. DOI:10.1074/jbc.M704817200 |
| [45] |
MIZUNOYA W, MIYAHARA H, OKAMOTO S, et al. Improvement of endurance based on muscle fiber-type composition by treatment with dietary apple polyphenols in rats[J]. PLoS One, 2015, 10(7): e0134303. DOI:10.1371/journal.pone.0134303 |
| [46] |
NA H K, SURH Y J. Modulation of Nrf2-mediated antioxidant and detoxifying enzyme induction by the green tea polyphenol EGCG[J]. Food Chem Toxicol, 2008, 46(4): 1271-1278. DOI:10.1016/j.fct.2007.10.006 |
| [47] |
钟佳, 刘进辉, 张珊珊, 等. Keap1-Nrf2-ARE动物氧化应激反应信号通路与天然抗氧化产品开发[J]. 中国畜牧杂志, 2016, 52(5): 79-83. ZHONG J, LIU J H, ZHANG S S, et al. Keap1-Nrf2-ARE oxidative stress response signaling pathway in animals and the development of natural antioxidant products[J]. Chinese Journal of Animal Science, 2016, 52(5): 79-83. DOI:10.3969/j.issn.0258-7033.2016.05.017 (in Chinese) |
| [48] |
赖灯妮, 覃思, 赵玲艳, 等. 果蔬中多酚类化合物双向调控Nrf2/Keap1信号通路的研究进展[J]. 食品科学, 2018, 39(5): 311-320. LAI D N, QIN S, ZHAO L Y, et al. A review of the dual role of dietary polyphenols from fruits and vegetables on regulation of Nrf2/Keap1 signaling[J]. Food Science, 2018, 39(5): 311-320. (in Chinese) |
| [49] |
廖霞, 郑少杰, 卢可可, 等. 植物多酚通过Nrf2/ARE信号通路抗氧化作用研究进展[J]. 食品科学, 2016, 37(7): 227-232. LIAO X, ZHENG S J, LU K K, et al. Plant polyphenols exert antioxidant activity of by Nrf2/ARE signaling pathway: a review[J]. Food Science, 2016, 37(7): 227-232. (in Chinese) |
| [50] |
QIN S, HOU D X. The biofunctions of phytochemicals and their applications in farm animals: the Nrf2/Keap1 system as a target[J]. Engineering, 2017, 3(5): 738-752. DOI:10.1016/J.ENG.2017.03.011 |
| [51] |
CHEN C Y, JANG J H, LI M H, et al. Resveratrol upregulates heme oxygenase-1 expression via activation of NF-E2-related factor 2 in PC12 cells[J]. Biochem Biophys Res Commun, 2005, 331(4): 993-1000. DOI:10.1016/j.bbrc.2005.03.237 |
| [52] |
TSAI C W, LIN C Y, WANG Y J. Carnosic acid induces the NAD(P)H: quinone oxidoreductase 1 expression in rat clone 9 cells through the p38/nuclear factor erythroid-2 related factor 2 pathway[J]. J Nutr, 2011, 141(12): 2119-2125. DOI:10.3945/jn.111.146779 |
| [53] |
李黎云. 日粮添加阿魏酸与维生素E对育肥猪肉品质和抗氧化性能的影响[D]. 南京: 南京农业大学, 2013. LI L Y. Effects of dietary supplementation of ferulic acid and vitamin e on meat quality and antioxidative capacity of finishing pigs[D]. Nanjing: Nanjing Agricultural University, 2013. |
| [54] |
SUN L, XU G Q, DONG Y Y Y, et al. Quercetin protects against lipopolysaccharide-induced intestinal oxidative stress in broiler chickens through activation of Nrf2 pathway[J]. Molecules, 2020, 25(5): 1053. DOI:10.3390/molecules25051053 |
| [55] |
HONG F, FREEMAN M L, LIEBLER D C. Identification of sensor cysteines in human keap1 modified by the cancer chemopreventive agent sulforaphane[J]. Chem Res Toxicol, 2005, 18(12): 1917-1926. DOI:10.1021/tx0502138 |
| [56] |
TANIGAWA S, FUJⅡ M, HOU D X. Action of Nrf2 and Keap1 in ARE-mediated NQO1 expression by quercetin[J]. Free Radical Biol Med, 2007, 42(11): 1690-1703. DOI:10.1016/j.freeradbiomed.2007.02.017 |
| [57] |
SHIN J W, CHUN K S, KIM D H, et al. Curcumin induces stabilization of Nrf2 protein through Keap1 cysteine modification[J]. Biochem Pharmacol, 2020, 173: 113820. DOI:10.1016/j.bcp.2020.113820 |
| [58] |
LIU G H, QU J, SHEN X. NF-κB/p65 antagonizes Nrf2-ARE pathway by depriving CBP from Nrf2 and facilitating recruitment of HDAC3 to MafK[J]. Biochim Biophys Acta, 2008, 1783(5): 713-727. DOI:10.1016/j.bbamcr.2008.01.002 |
| [59] |
周莎莎, 郭志远, 杨智勇, 等. 芹菜素对顺铂化疗所致肾损伤及Nrf2/HO-1通路的影响[J]. 肿瘤药学, 2021, 11(5): 554-560. ZHOU S S, GUO Z Y, YANG Z Y, et al. Effects of apigenin on cisplatin chemotherapy-induced renal injury and Nrf2/HO-1 pathway[J]. Anti-Tumor Pharmacy, 2021, 11(5): 554-560. DOI:10.3969/j.issn.2095-1264.2021.05.07 (in Chinese) |
| [60] |
MENG Q W, GUO T, LI G Q, et al. Dietary resveratrol improves antioxidant status of sows and piglets and regulates antioxidant gene expression in placenta by Keap1-Nrf2 pathway and Sirt1[J]. J Anim Sci Biotechnol, 2018, 9: 34. DOI:10.1186/s40104-018-0248-y |
| [61] |
孙冰, 侯艳茹, 苏琳, 等. 过氧化物酶体增殖物激活受体β(δ)对肌纤维类型转化和肉品质的影响及其调控因素研究进展[J]. 动物营养学报, 2021, 33(8): 4304-4314. SUN B, HOU Y R, SU L, et al. Research progress on effects of peroxisome proliferator-activated receptor β (δ) on muscle fiber type transformation and meat quality and its regulatory factors[J]. Chinese Journal of Animal Nutrition, 2021, 33(8): 4304-4314. DOI:10.3969/j.issn.1006-267x.2021.08.011 (in Chinese) |
| [62] |
CHEN X L, LIANG D H, HUANG Z Q, et al. Quercetin regulates skeletal muscle fiber type switching via adiponectin signaling[J]. Food Funct, 2021, 12(6): 2693-2702. DOI:10.1039/D1FO00031D |
| [63] |
HANDSCHIN C. Regulation of skeletal muscle cell plasticity by the peroxisome proliferator-activated receptor γ coactivator 1α[J]. J Recept Sig Transd, 2010, 30(6): 376-384. DOI:10.3109/10799891003641074 |
| [64] |
PRICE N L, GOMES A P, LING A J Y, et al. SIRT1 is required for AMPK activation and the beneficial effects of resveratrol on mitochondrial function[J]. Cell Metab, 2012, 15(5): 675-690. DOI:10.1016/j.cmet.2012.04.003 |
| [65] |
IWABU M, YAMAUCHI T, OKADA-IWABU M, et al. Adiponectin and AdipoR1 regulate PGC-1α and mitochondria by Ca2+and AMPK/SIRT1[J]. Nature, 2010, 464(7293): 1313-1319. DOI:10.1038/nature08991 |
| [66] |
CHEN X L, GUO Y F, JIA G, et al. Ferulic acid regulates muscle fiber type formation through the Sirt1/AMPK signaling pathway[J]. Food Funct, 2019, 10(1): 259-265. DOI:10.1039/C8FO01902A |
| [67] |
VACCA R A, VALENTI D, CACCAMESE S, et al. Plant polyphenols as natural drugs for the management of Down syndrome and related disorders[J]. Neurosci Biobehav Rev, 2016, 71: 865-877. DOI:10.1016/j.neubiorev.2016.10.023 |
| [68] |
LJUBICIC V, BURT M, LUNDE J A, et al. Resveratrol induces expression of the slow, oxidative phenotype in mdx mouse muscle together with enhanced activity of the SIRT1-PGC-1α axis[J]. Am J Physiol Cell Physiol, 2014, 307(1): C66-C82. DOI:10.1152/ajpcell.00357.2013 |
| [69] |
AKASHI S, MORITA A, MOCHIZUKI Y, et al. Citrus hassaku extract powder increases mitochondrial content and oxidative muscle fibers by upregulation of PGC-1α in skeletal muscle[J]. Nutrients, 2021, 13(2): 497. DOI:10.3390/nu13020497 |
| [70] |
WU L T, RAN L, LANG H D, et al. Myricetin improves endurance capacity by inducing muscle fiber type conversion via miR-499[J]. Nutr Metab, 2019, 16: 27. DOI:10.1186/s12986-019-0353-8 |
| [71] |
ZUO J J, WU F, LIU Y H, et al. MicroRNA transcriptome profile analysis in porcine muscle and the effect of miR-143 on the MYH7 gene and protein[J]. PLoS One, 2015, 10(4): e0124873. DOI:10.1371/journal.pone.0124873 |
| [72] |
SHEN L Y, CHEN L, ZHANG S H, et al. MicroRNA-23a reduces slow myosin heavy chain isoforms composition through myocyte enhancer factor 2C (MEF2C) and potentially influences meat quality[J]. Meat Sci, 2016, 116: 201-206. DOI:10.1016/j.meatsci.2016.02.023 |
| [73] |
余亲平. 复方中草药基于干预肌纤维类型转化调控猪肉品质的机制研究[D]. 广州: 华南农业大学, 2017. YU Q P. Traditional Chinese medicine formula intervenes on muscle fiber type transformation and regulates meat quality of pork[D]. Guangzhou: South China Agricultural University, 2017. (in Chinese) |
| [74] |
WAN M L Y, CO V A, EL-NEZAMI H. Dietary polyphenol impact on gut health and microbiota[J]. Crit Rev Food Sci Nutr, 2021, 61(4): 690-711. DOI:10.1080/10408398.2020.1744512 |
| [75] |
WANG Z Y, ZENG M M, WANG Z J, et al. Dietary polyphenols to combat nonalcoholic fatty liver disease via the gut-brain-liver axis: a review of possible mechanisms[J]. J Agric Food Chem, 2021, 69(12): 3585-3600. DOI:10.1021/acs.jafc.1c00751 |
| [76] |
MITHUL ARAVIND S, WICHIENCHOT S, TSAO R, et al. Role of dietary polyphenols on gut microbiota, their metabolites and health benefits[J]. Food Res Int, 2021, 142: 110189. DOI:10.1016/j.foodres.2021.110189 |
(编辑 范子娟)