2. 中国农业科学院北京畜牧兽医研究所,北京 100193;
3. 北京黑六牧业科技有限公司,北京 102211
2. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
3. Beijing Black Six Animal Husbandry Technology Company Limited, Beijing 102211, China
猪肉是世界上最广泛消费的肉类,尤其是在中国。以2020年国家统计年鉴数据为例,猪肉消费量占年肉类消费总量的75.46%[1]。在过去的几十年里,猪的选择主要集中在生长性状和瘦肉率上。现代猪品种选择性育种的目标导致脂肪生成潜力强烈降低,然而近些年由于对生物多样性的重要性和集约化生产系统的负面影响的认识,导致了对培育地方猪种的兴趣增加。肌内脂肪的差异导致烹饪后产生芳香化合物的不同,最终香气特征也会不同[2],这为肌内脂肪含量是肉品质特性及其消费者可接受性的重要决定因素提供支撑。而目前的商品猪在肌肉中沉积的脂肪比本地猪种少[3]。中国地方猪种,通常被称为脂肪型猪,比外来猪种有更丰富的脂肪。降低背膘厚(BFT)和增加IMF含量是现代猪育种计划的目标,也满足了消费者保持健康的需求[4]。地方猪种对其特定环境条件和饲养资源的适应性更强,因此是一种宝贵的遗传资源。与现代品种相比,它们能够沉积更多的脂肪,具有独特的生脂能力,以及更好的脂肪酸组成[5-6]。保持了高的脂质沉积能力,这反映在皮下脂肪组织和IMF含量的增加[5]。北京黑猪是我国著名的培育品种,有着肌内脂肪高,肉味浓郁的特点,因其肉质优良,风味独特非常受消费者欢迎。作为可持续的地方猪肉链的基础,在北京当地经济中发挥着重要作用[7]。
大理石花纹是肌肉纤维之间或肌肉束之间的脂肪堆积,这种脂肪被称为肌内脂肪(IMF)。结缔组织在肌纤维之间或肌束之间的空间中发育,IMF沿结缔组织积聚[8]。IMF是一种重要的猪肉感官品质,它影响消费者的偏好和猪肉的溢价[9]。IMF是肌肉纤维中与瘦肉混合的可见脂肪条纹,决定猪肉的感官品质,如风味、嫩度和多汁性,其已被证明是影响感官肉质的主要决定因素。事实上一些研究表明,在IMF和猪肉的多汁性和嫩度之间存在有利的关系,IMF的最低阈值水平是使猪肉嫩度最大化所必需的[10]。当IMF含量高于2.5%时,猪肉的风味和多汁性增强[11]。猪的脂肪代谢和IMF发育受饮食营养、基因及其代谢途径的控制。猪肉风味性状在很大程度上取决于产生和沉积脂质的代谢过程。因此,为了提高肉质风味性状,需要更好的了解猪肌肉组织中脂质的构成,以此找到影响IMF的目标脂质并有目的的改善肉品质。肌内脂肪由磷脂、甘油三酯和胆固醇组成。甘油三酯的合成、降解和摄取之间的平衡反映在IMF含量中。北京黑猪、东北民猪、五指山猪的饱和脂肪酸总量低于DLY猪,而不饱和脂肪酸总量高于杂交猪[12]。脂肪生成被定义为葡萄糖转化为甘油三酯[13],它提供了猪体内至少80%的沉积脂肪酸[14]。脂肪酸决定了肉类脂肪的熔点和品质,与肉类的食用品质密切相关[15]。脂质在通过自氧化或热氧化形成生肉气味和熟肉风味方面发挥着关键作用[16-17]。脂质的热氧化能力取决于脂肪酸的种类,以及单个脂质分子和脂质类别的结合位点[18]。据报道,低IMF减少了来自美拉德反应的挥发性化合物和熟腌猪肉火腿令人愉悦的香气属性[19]。有研究表明,不同风味的鸡肉可以用脂质组很明显的区分[20]。但到目前为止,利用脂质组学方法鉴别猪肉不同肌肉或鉴别猪肉品种的研究还很少。
为了研究北京黑猪背最长肌肌内脂肪含量与脂质的关系,本试验就北京黑猪肌内脂肪高低两组进行了非靶向脂质组学的检测,并利用每一类脂质脂肪酸链的信号值进行多元化分析。本研究旨在获得中国地方猪肉脂肪组成的更全面信息,并进一步揭示贡献较大的潜在化学标记。当前的数据集将有助于更好地了解所研究北京黑猪肉的营养价值,并可以扩展到更大的样本量以进行脂质标记验证。
1 材料与方法 1.1 样品来源400头210日龄北京黑猪均在相同环境下饲养,样品采自北京黑六牧业科技有限公司,于屠宰后2 h内采集完毕,取背最长肌第6、7肋处样品于2 mL冻存管置于液氮中保存。
1.2 试验方法1.2.1 肌内脂肪含量的测定 本实验室使用SOXTEC脂肪测定仪,采用索氏提取法提取脂肪[21]。首先除尽外周筋膜,将肉块切成糜状待测。秤取100 g左右肉末置于培养皿中,65 ℃烘箱脱水至恒重(约24 h)。分别秤取2份10 g左右碎肉样置于水分皿中,打开称量瓶盖1/2,瓶盖斜支于瓶边,65 ℃烘箱脱水(约24 h),取出后置于干燥器中冷却至室温,称重一次,直至恒重,计算新鲜肉样风干水分含量。将风干肉末置于105 ℃烘箱烘2 h称重一次,直至绝干恒重,计算绝干含水量。将恒温脱水的样品取出,用打碎机瞬时磨为粉状,称取3.5 g左右粉状风干样,用滤纸包好后加入SOXTEC脂肪测定仪测定杯中,每个测定杯中加入100 mL石油醚,设定抽提温度为135 ℃,经过2 h的抽提,最后烘箱105 ℃烘1 h,称量得到脂肪重量(具体的SOXTEC脂肪测定仪操作方法见仪器使用说明书)。
肌内脂肪含量计算公式:
| $ \text { 肌内脂肪含量 }(\%)=\frac{{抽提得到油脂重量}}{{风干样重 \times(1-风干到绝干含水量 ) /(1- 新鲜样水分 )}} \times 100 , 结果保留两位小数。$ |
1.2.2 非靶向脂质组学测定 取(60±3) mg左右组织于2 mL组织研磨管中,按比例加入C2HCl2∶MeOH(2∶1),如60 mg加入600 μL有机相,加入的有机溶剂体积按照组织重量等比例加入即可。全程在冰上操作,用组织研磨仪(北京赫德GRINDER)研磨,参数设置,55 Hz,10 s, 3次,-20 ℃。按水相与有机相1∶4的比例,加入水相进行分层,涡旋,静置,如此反复3次,充分抽提后离心15 min,12 000 r·min-1,取出下层有机相360 μL于新的离心管中。按水相与有机相1∶4的比例,加入水相,对有机层进行二次萃取,洗掉多余蛋白质,涡旋,静置,重复3次,充分抽提后离心15 min,12 000 r·min-1,取出下层有机相150 μL于新的离心管中,在氮气的保护下吹干有机溶剂至透明薄膜状,吹干过程氮气流不要过大,不能加热。将吹干的样品保存在-80 ℃冰箱。将处理好的样品送至清华大学代谢组平台进行LC-MS检测。
按Tang等[22]的方法使用Cortecs C18柱(2.1* 100 mm,2.7 μm,Waters)选择反相色谱法进行LC分离。流动相A通过将400 mL含有0.77 g乙酸铵的HPLC级水与600 mL HPLC级乙腈混合来制备。流动相B含有10%乙腈和90%异丙醇。以0.25 mL·min-1的流速进行梯度洗脱,柱温箱温度设置为40 ℃。梯度如下:0 min,30% B;3.0 min,30% B;4.5 min,33% B;7.0 min,45% B;8.0 min,52% B;11.0 min,58% B;14.0 min,66% B;17.0 min,70% B;21.0 min,75% B;23.0 min,98% B;30.0 min,98% B;30.5 min,30% B;35.0 min,30% B。脂质分析在Q Exactive HF orbitrap质谱仪(Thermo,CA)和UHPLC系统Ultimate 3000 (Thermo,CA)上进行。详细的质谱仪参数如下:喷雾电压,正3.2 kV,负2.8 kV;毛细管温度,320 ℃;鞘气流量(arb),35;辅助气体流量(arb),10;质量范围(m·z-1),240~2 000为正,200~2 000为负。全MS分辨率,60 000;MS/MS分辨率,15 000;top N,10;使用Lipidsearch 4.2 (Thermo Fisher,USA)对脂质进行鉴定和定量。
1.3 统计方法用R中的stats包做T检验,使用Metaboanalyst 5.0进行主成分分析(PCA)和偏最小二乘判别分析(PLS-DA),GraphPad Prism 9.0软件用于可视化统计结果。
2 结果 2.1 北京黑猪肌内脂肪含量高、低组差异分析从采集的400个北京黑猪的样品中按肌内脂肪含量的高低选取11个样品和19个样品分别为高肌内脂肪含量组和低肌内脂肪含量组。高组中肌内脂肪含量最大值为5.00%,最小值为3.09%;低组中肌内脂肪含量最大值为1.03%,最小值为0.07%:两组间T检验得到的P值为7.95×10-16,差异极显著(表 1)。
|
|
表 1 北京黑猪高、低肌内脂肪含量组 Table 1 Intramuscular fat content of Beijing black pig in high and low groups |
在阳离子模式下测定的脂质有酰基肉碱(AcCa)、甘油二酯(DG)、甘油三酯(TG) 3类,在阴离子模式下测定的脂质有心磷脂(CL)、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰甘油(PG)、磷脂酰肌醇(PI)、磷脂酰丝氨酸(PS) 6类,能确定的组成每一类脂质的脂肪酸共104种。主要脂质种类为PE(29,27.88%)、TG(23,22.12%)、PC(21,20.19%)(图 1A、1B)。
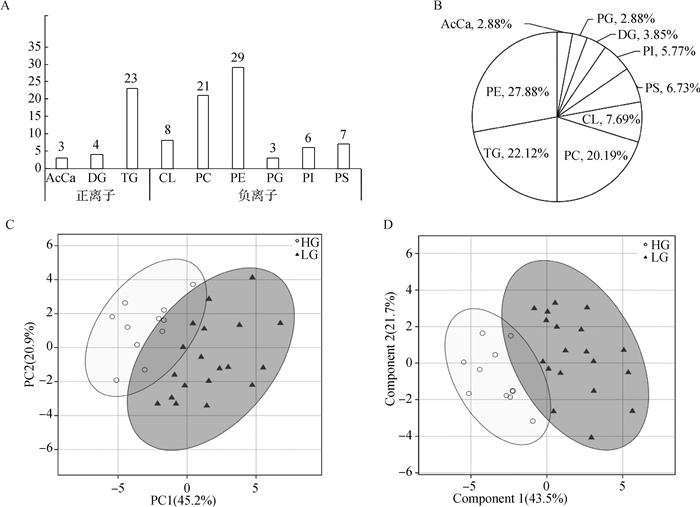
|
A. 分别在正离子和负离子模式下检测出的脂质种类及数目;B. 各脂质种类分别占全部的比例;C. 高、低组间PCA结果展示;D. 高、低组间PLS-DA结果展示 A. The types and numbers of lipids were detected in positive and negative ion modes, respectively; B. All kinds of lipids account for the total proportion, respectively; C. PCA results display between high and low groups; D. PLS-DA results display between high and low groups 图 1 脂质谱分布图与多元分析比分图 Fig. 1 Lipid distribution chart and multivariate analysis score chart |
为了区分北京黑猪高、低肌内脂肪含量组的完整脂质组学特征,使用多变量统计分析脂质组学数据。对组成每一类脂质的脂肪酸进行了主成分分析(PCA)和偏最小二乘回归分析法(PLS-DA)分析。PCA是通过几个主成分来体现脂质组学多维数据下的特征,因此通过PCA图可以观察到两组间的差异。在PCA图中,高、低肌内脂肪含量组明显分离(图 1C),其中第一主成分(PCA1)可以解释原始数据集的45.2%的特征,这表明在高、低肌内脂肪含量组间样品中代谢物有明显的不同。
偏最小二乘判别分析(PLS-DA)是一种用于判别分析的多变量统计分析方法,通过投影分别将预测变量和观测变量投影到一个新空间,来寻找一个线性回归模型。PLS-DA分析根据观察或测量到的若干变量值,来判断研究对象如何分类。PLS-DA评分图表明,北京黑猪高、低肌内脂肪含量组清晰的分为两类,高组样品可以与低组样品明显区分开来(图 1D)。这些结果表明,两组之间的脂质组成存在差异。
2.3 北京黑猪高、低肌内脂肪含量组差异脂肪酸筛选对北京黑猪高、低肌内脂肪含量组间进行了T检验,有差异的脂肪酸有33种,其中TG有23个,AcCa有2个,DG有4个,PE有4个(图 2A、2B)。可以初步判定这些脂质与肌内脂肪之间有显著的联系。
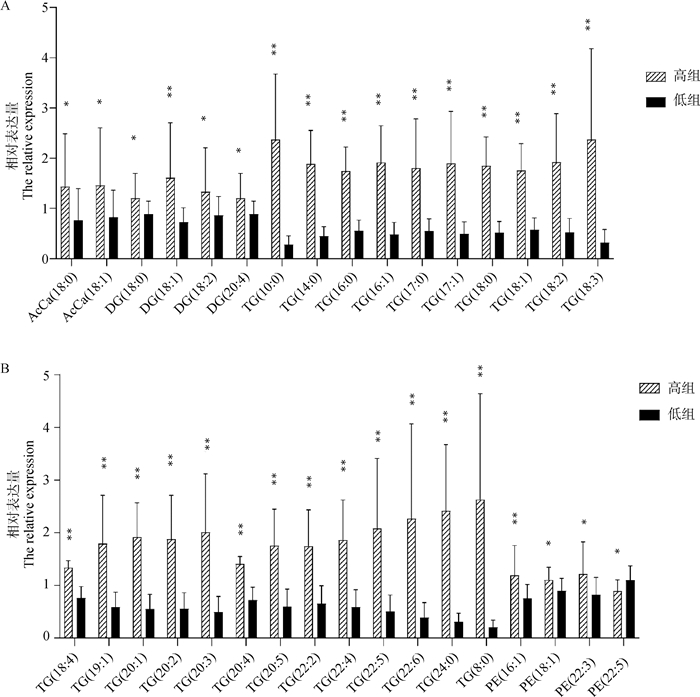
|
A、B. T检验差异代谢物信息。横坐标是脂质名称,纵坐标是归一化后的脂质相对表达量。*. P < 0.05;**. P < 0.01 A, B. T-test differential metabolites information. The abscissa is lipid name; The ordinate is the normalized relative expression of lipid. *. P < 0.05; **. P < 0.01 图 2 差异脂肪酸T检验柱状图 Fig. 2 T-test histogram of differential fatty acids |
根据构建的PLS-DA模型计算VIP值;以VIP>1为标准筛选的脂肪酸有23个,其中TG有22个,DG有1个。根据高组与低组间的差异倍数FC进行筛选,发现FC>2即上调的脂肪酸有22种,均为TG,FC < 0.5即下调的脂肪酸为0。综合3种筛选方法(P < 0.05,VIP>1,FC>2或FC < 0.5)取交集,最终筛选到满足3个条件的脂肪酸有22个(图 3A),其中TG有21个,DG有1个(图 3B)。具体104个物质的3个指标及其上下调情况见表 2。
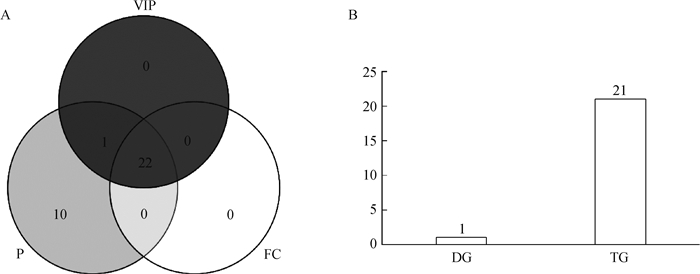
|
A. 3种筛选方法结果对比;B.综合P值、VIP值、FC值,共同筛选出的22个物质的类别及数量 A. Comparison of results of three screening methods; B. The category and quantity of 22 substances selected together by P value, VIP value, FC value 图 3 3种筛选指标对比韦恩图与筛选物质分布图 Fig. 3 Comparison of 3 screening indexes with Venn diagram and distribution diagram of screened substances |
|
|
表 2 肌内脂肪高、低组间组成各脂质的脂肪酸差异指标 Table 2 Fatty acid difference index of each lipid between high and low groups of IMF |
本研究的脂质组学分析结果得出,北京黑猪肌内脂肪含量高、低组猪肉样品的脂质谱是不同的,初步差异分析筛选出的物质主要为AcCa、DG、TG和PE。Lísa等[23]通过进行RP-LC/MS将猪脑提取物分级成非极性脂质、己糖神经酰胺(Hex1Cer)、磷酸乙醇胺(PE)、磷酸胆碱(PC)、鞘磷脂(SM)和溶血磷酸胆碱(LPC)类。背最长肌主要由中性脂质组成,主要是甘油三酯(TG)和胆固醇酯(CE),它们为能量产生、膜成分和信号脂质提供底物[24]。Kaabia等[25]发现了不同物种间的脂质差异,但是只有猪的通常脂质分布与人重叠,其通过查询260个分子种类的脂质库,从4 899个变量中清晰准确地鉴定出106个,包括神经酰胺(Cer)、鞘脂(SM)、溶血磷脂酰胆碱(LPC)、溶血磷脂酰乙醇胺(LPE)、磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)、甘油二酯(DG)和甘油三酯(TG)。Wu和Wang[18]使用MMSE-气相色谱-质谱联用仪,从PE标准品中鉴定出己醛、辛醛、壬醛、癸醛、1-己醇和1-辛烯-3-醇等香味物质。说明PE对肉类风味有贡献,本研究进行差异分析筛选出的PE(16:1)、PE(18:1)、PE(22:3)、PE(22:5)或许是重要的风味前体物质。Li等[26]通过研究阉割对湖羊脂质种类及含量的影响,发现阉割后大多数脂质种类增加,尤其是TG、DG和PE,与本研究的分组结果相似的是,阉割后的湖羊肌内脂肪是显著升高的。Tonazzi等[27]报道,肉碱棕榈酰转移酶Ⅱ催化酰基从肉碱向线粒体CoA的酯交换,并释放AcCa,从而为脂肪酸β-氧化提供酰基CoA底物,也进一步说明AcCa与脂肪沉积相关,与本研究结果一致。
本研究进一步筛选后,发现其主要区别在于甘油三酯含量的不同,并且其差异极显著。先前的研究表明,多不饱和脂肪酸(PUFA)的一个重要来源是甘油三酯,它是脂肪酸(FAs)的主要载体[28-29]。Zhang等[30]认为,IMF含量的增加主要是由于TG含量增加。Fernandez等[31]进行了两个试验来评估IMF水平对脂质部分的组成和对背最长肌的感官品质的影响,这两个试验均证明了肌肉中甘油三酯含量的增加几乎完全反映了IMF含量的增加。甘油三酯是哺乳动物脂肪组织中能量储存的主要形式,当动物表现出高日采食量时,出现高TG水平, 高TG水平与高脂肪沉积相关[32-33]。Ren等[34]通过研究发现,金华猪血清甘油三酯(TG)和总胆固醇(TCHO)浓度高于长白猪。Sirt1是Sirtuins家族中研究最多的,已被确定可影响哺乳动物的糖异生和脂肪酸氧化[35]。同时先前的研究发现,在皮下脂肪组织中,Sirt1基因的表达在中国地方脂肪品种猪(金华猪)中低于瘦肉型猪(长白猪)[36]。这与北京黑猪高肌内脂肪组比低肌内脂肪组中TG含量高结果相一致。肌内脂肪(IMF)主要是储存在肌内脂肪细胞中的三酰基甘油酯(TAG)[37-38]。BHLB猪肉比DLY猪肉含有更多的甘油三酯,这归因于BHLB猪肉含有更多的IMF[39]。这些结果表明,肌内脂肪高组中甘油三酯的含量显著高于肌内脂肪低的猪肉,这可能会影响烹饪过程中挥发性物质的浓度及释放。Zhao等[40]发现,与瘦版纳小型猪相比,肥胖版纳小型猪通过上调固醇调节元件结合蛋白-1c、二酰基甘油酰基转移酶和心脏脂肪酸结合蛋白,增加了脂肪酸和甘油三酯的合成。
4 结论在本研究中,对选定的北京黑猪肌内脂肪高低组进行了全面的比较和脂质组分析。通过化学和物理计量学的方法,找到了鉴别肌内脂肪高低猪肉的潜在脂类标记。发现构成肌内脂肪高低猪肉样品的脂质组差异物质主要集中在TG和DG两类物质上。
| [1] |
零丽斯. "猪"事变化如何影响农业产业?[J]. 中国农村科技, 2022(3): 49-51. LING L S. How does the change of "pig" affect the agricultural industry?[J]. China Rural Science & Technology, 2022(3): 49-51. (in Chinese) |
| [2] |
LI J, YANG Y Y, TANG C H, et al. Changes in lipids and aroma compounds in intramuscular fat from Hu sheep[J]. Food Chem, 2022, 383: 132611. DOI:10.1016/j.foodchem.2022.132611 |
| [3] |
PUGLIESE C, SIRTORI F. Quality of meat and meat products produced from southern European pig breeds[J]. Meat Sci, 2012, 90(3): 511-518. DOI:10.1016/j.meatsci.2011.09.019 |
| [4] |
LIU H C, WEI W, LIN W M, et al. miR-32-5p regulates lipid accumulation in intramuscular fat of erhualian pigs by suppressing KLF3[J]. Lipids, 2021, 56(3): 279-287. DOI:10.1002/lipd.12294 |
| [5] |
POKLUKAR K, ČANDEK-POTOKAR M, LUKAČ N B, et al. Lipid deposition and metabolism in local and modern pig breeds: A review[J]. Animals (Basel), 2020, 10(3): 424. |
| [6] |
BAREA R, ISABEL B, NIETO R, et al. Evolution of the fatty acid profile of subcutaneous back-fat adipose tissue in growing Iberian and Landrace×Large White pigs[J]. Animal, 2013, 7(4): 688-698. DOI:10.1017/S175173111200184X |
| [7] |
CABALLERO B, FINGLAS P M, TOLDRÁ F. Encyclopedia of food and health[M]. Amsterdam: Elsevier Science, 2016: 307-310.
|
| [8] |
KATSUMATA M. Promotion of intramuscular fat accumulation in porcine muscle by nutritional regulation[J]. Anim Sci J, 2011, 82(1): 17-25. DOI:10.1111/j.1740-0929.2010.00844.x |
| [9] |
MALGWI I H, HALAS V, GRVNVALD P, et al. Genes related to fat metabolism in pigs and intramuscular fat content of pork: A focus on nutrigenetics and nutrigenomics[J]. Animals (Basel), 2022, 12(2): 150. |
| [10] |
CASTELL A G, CLIPLEF R L, POSTE-FLYNN L M, et al. Performance, carcass and pork characteristics of castrates and gilts self-fed diets differing in protein content and lysine: Energy ratio[J]. Can J Anim Sci, 1994, 74(3): 519-528. DOI:10.4141/cjas94-073 |
| [11] |
FERNANDEZ X, MONIN G, TALMANT A, et al. Influence of intramuscular fat content on the quality of pig meat-2. Consumer acceptability of m. Longissimus lumborum[J]. Meat Sci, 1999, 53(1): 67-72. DOI:10.1016/S0309-1740(99)00038-8 |
| [12] |
TU T, WU W D, TANG X Y, et al. Screening out important substances for distinguishing Chinese indigenous pork and hybrid pork and identifying different pork muscles by analyzing the fatty acid and nucleotide contents[J]. Food Chem, 2021, 350: 129219. DOI:10.1016/j.foodchem.2021.129219 |
| [13] |
HILLGARTNER F B, SALATI L M, GOODRIDGE A G. Physiological and molecular mechanisms involved in nutritional regulation of fatty acid synthesis[J]. Physiol Rev, 1995, 75(1): 47-76. DOI:10.1152/physrev.1995.75.1.47 |
| [14] |
KLOAREG M, NOBLET J, VAN MILGEN J. Deposition of dietary fatty acids, de novo synthesis and anatomical partitioning of fatty acids in finishing pigs[J]. Br J Nutr, 2007, 97(1): 35-44. DOI:10.1017/S0007114507205793 |
| [15] |
ZHANG Y F, ZHANG J J, GONG H F, et al. Genetic correlation of fatty acid composition with growth, carcass, fat deposition and meat quality traits based on GWAS data in six pig populations[J]. Meat Sci, 2019, 150: 47-55. DOI:10.1016/j.meatsci.2018.12.008 |
| [16] |
RESCONI V C, BUENO M, ESCUDERO A, et al. Ageing and retail display time in raw beef odour according to the degree of lipid oxidation[J]. Food Chem, 2018, 242: 288-300. DOI:10.1016/j.foodchem.2017.09.036 |
| [17] |
POLIDORI P, SANTINI G, KLIMANOVA Y, et al. Effects of ageing on donkey meat chemical composition, fatty acid profile and volatile compounds[J]. Foods, 2022, 11(6): 821. DOI:10.3390/foods11060821 |
| [18] |
WU N, WANG X C. Identification of important odorants derived from phosphatidylethanolamine species in steamed male Eriocheir sinensis hepatopancreas in model systems[J]. Food Chem, 2019, 286: 491-499. DOI:10.1016/j.foodchem.2019.01.201 |
| [19] |
BENET I, GUÀRDIA M D, IBAÑEZ C, et al. Low intramuscular fat (but high in PUFA) content in cooked cured pork ham decreased Maillard reaction volatiles and pleasing aroma attributes[J]. Food Chem, 2016, 196: 76-82. DOI:10.1016/j.foodchem.2015.09.026 |
| [20] |
MI S, SHANG K, JIA W, et al. Characterization and discrimination of Taihe black-boned silky fowl (Gallus gallus domesticus Brisson) muscles using LC/MS-based lipidomics[J]. Food Res Int, 2018, 109: 187-195. DOI:10.1016/j.foodres.2018.04.038 |
| [21] |
ENGLMAIEROVÁ M, SKŘIVAN M, TAUBNER T, et al. Performance and meat quality of dual-purpose cockerels of dominant genotype reared on pasture[J]. Animals (Basel), 2020, 10(3): 387. |
| [22] |
TANG H P, WANG X Y, XU L N, et al. Establishment of local searching methods for orbitrap-based high throughput metabolomics analysis[J]. Talanta, 2016, 156-157: 163-171. DOI:10.1016/j.talanta.2016.04.051 |
| [23] |
LÍSA M, ŘEHULKOVÁ H, HANČOVÁ E, et al. Lipidomic analysis using hydrophilic interaction liquid chromatography microgradient fractionation of total lipid extracts[J]. J Chromatogr A, 2021, 1653: 462380. DOI:10.1016/j.chroma.2021.462380 |
| [24] |
WELTE M A. Expanding roles for lipid droplets[J]. Curr Biol, 2015, 25(11): R470-R481. DOI:10.1016/j.cub.2015.04.004 |
| [25] |
KAABIA Z, POIRIER J, MOUGHAIZEL M, et al. Plasma lipidomic analysis reveals strong similarities between lipid fingerprints in human, hamster and mouse compared to other animal species[J]. Sci Rep, 2018, 8(1): 15893. DOI:10.1038/s41598-018-34329-3 |
| [26] |
LI J, TANG C H, ZHAO Q Y, et al. Integrated lipidomics and targeted metabolomics analyses reveal changes in flavor precursors in psoas major muscle of castrated lambs[J]. Food Chem, 2020, 333(4): 127451. |
| [27] |
TONAZZI A, GIANGREGORIO N, CONSOLE L, et al. The mitochondrial carnitine acyl-carnitine carrier (SLC25A20): molecular mechanisms of transport, role in redox sensing and interaction with drugs[J]. Biomolecules, 2021, 11(4): 521. DOI:10.3390/biom11040521 |
| [28] |
ZHOU L, ZHAO M J, BINDLER F, et al. Comparison of the volatiles formed by oxidation of phosphatidylcholine to triglyceride in model systems[J]. J Agric Food Chem, 2014, 62(33): 8295-8301. DOI:10.1021/jf501934w |
| [29] |
WANG B, ZHAO X G, ZHANG B Y, et al. Assessment of components related to flavor and taste in Tan-lamb meat under different silage-feeding regimens using integrative metabolomics[J]. Food Chem: X, 2022, 14: 100269. DOI:10.1016/j.fochx.2022.100269 |
| [30] |
ZHANG C, LUO J Q, ZHENG P, et al. Differential expression of lipid metabolism-related genes and myosin heavy chain isoform genes in pig muscle tissue leading to different meat quality[J]. Animal, 2015, 9(6): 1073-1080. DOI:10.1017/S1751731115000324 |
| [31] |
FERNANDEZ X, MONIN G, TALMANT A, et al. Influence of intramuscular fat content on the quality of pig meat - 1.Composition of the lipid fraction and sensory characteristics of m.Longissimus lumborum[J]. Meat Sci, 1999, 53(1): 59-65. DOI:10.1016/S0309-1740(99)00037-6 |
| [32] |
BRESSAN M C, BELO A T, AMARAL A, et al. The impact of genetic groups (Alentejano and F1 Landrace x Large White pigs) and body weight (90, 120 and 160 kg) on blood metabolites[J]. Livest Sci, 2022, 255: 104810. DOI:10.1016/j.livsci.2021.104810 |
| [33] |
CHEN J Y, CHEN F M, LIN X, et al. Effect of excessive or restrictive energy on growth performance, meat quality, and intramuscular fat deposition in finishing Ningxiang pigs[J]. Animals (Basel), 2021, 11(1): 27. |
| [34] |
REN Y, HUANG J, YU X F, et al. Breed difference of porcine Sirtuin 1, adipose triglyceride lipase (ATGL) and hormone sensitive lipase (HSL)[J]. Livest Sci, 2013, 158(1-3): 199-205. DOI:10.1016/j.livsci.2013.09.018 |
| [35] |
FENG B, HUANG B, JING Y L, et al. Silymarin ameliorates the disordered glucose metabolism of mice with diet-induced obesity by activating the hepatic SIRT1 pathway[J]. Cell Signal, 2021, 84: 110023. DOI:10.1016/j.cellsig.2021.110023 |
| [36] |
SHAN T, REN Y, LIU Y, et al. Breed difference and regulation of the porcine Sirtuin 1 by insulin[J]. J Anim Sci, 2010, 88(12): 3909-3917. DOI:10.2527/jas.2010-2880 |
| [37] |
DALRYMPLE B P, GUO B. TRIENNIAL GROWTH AND DEVELOPMENT SYMPOSIUM: intramuscular fat deposition in ruminants and pigs: A transcriptomics perspective[J]. J Anim Sci, 2017, 95(5): 2272-2283. |
| [38] |
HUANG Y Z, ZHOU L S, ZHANG J J, et al. A large-scale comparison of meat quality and intramuscular fatty acid composition among three Chinese indigenous pig breeds[J]. Meat Sci, 2020, 168: 108182. |
| [39] |
LI J, ZHANG J Q, YANG Y Y, et al. Comparative characterization of lipids and volatile compounds of Beijing Heiliu and Laiwu Chinese black pork as markers[J]. Food Res Int, 2021, 146: 110433. DOI:10.1016/j.foodres.2021.110433 |
| [40] |
ZHAO S M, LI W Z, PAN H B, et al. Expression levels of candidate genes for intramuscular fat deposition in two Banna mini-pig inbred lines divergently selected for fatness traits[J]. Genet Mol Biol, 2012, 35(4): 783-789. |
(编辑 郭云雁)



