硒是动物必需的营养元素,也是植物有益的营养元素[1-2],具有抗氧化、抗癌、增强免疫功能等生物学作用[3-5]。当动物摄取硒不足时可引起多种疾病,如癌症、克山骨病、心血管疾病等[6-7],对动物的身体健康造成危害的同时,也对养殖业造成巨大的经济损失。硒不能由机体自主合成,只能从体外摄取,因此在畜牧生产中,常常会把亚硒酸钠作为添加剂,用来补充动物机体需要的微量元素硒[8-12],再通过氧化还原反应或复杂的生物酶反应等使其被机体吸收并利用。有研究发现,硒对T、B细胞的免疫功能和巨噬细胞的抗氧化功能具有调节作用,同时可抑制肺癌细胞增殖和迁移[13-15]。树突状细胞(dendritic cells, DCs)和巨噬细胞是参与调节免疫刺激和耐受的重要抗原提呈细胞,在免疫系统中起着重要的作用[16-18]。然而,硒对DCs和巨噬细胞免疫功能的影响报道少见,因此,本试验以髓源性树突状细胞(bone marrow derived dendritic cells, BMDCs)和腹腔巨噬细胞为靶细胞,探究硒对树突状细胞和巨噬细胞的调控作用。
1 材料与方法 1.1 试验材料亚硒酸钠购自上海凌峰化学试剂有限公司(批号:W5070);RPMI1640培养液购自Gibco(批号:8120038);小牛血清购自四季青有限公司(批号:20060502)青链霉素购自Biological Industries(批号:1950172);噻唑蓝(MTT),购自Solarbio公司(批号:CM27191620);二甲基亚砜(DMSO)购自Coolaber科技有限公司(批号:CD281315200);Phagocytosis Assay Kit购自Thermo公司(批号:2160425);rmGM-CSF(批号:BJ2418061)和rmIL-4(批号:BC1918101)购自RD Systems公司;小鼠脾淋巴细胞分离试剂盒购自天津颢洋生物制品有限公司;Purified Rat Anti-Mouse CD16/CD32(批号:0160289)、PE-CyTM7 Hamster Anti-Mouse CD11c(批号:9345738)、488 Rat Anti-Mouse I-A/I-E(批号:1004521)、PE Mouse Anti-Rat CD86(批号:9338081)、BV421 Hamster Anti-Mouse CD80(批号:0009143)、APC Rat anti-Mouse CD40(批号:9128909)和7-AAD(批号:0017296-A)购自BD Pharmingen;IL-10、IL-12、IL-6、IL-1β、TNF-α、IFN-γ和NO的ELISA试剂盒购自酶免公司(批号:212104)。
1.2 主要仪器酶联免疫检测仪购自Thermo公司;L420离心机购自上海生物科技有限公司;CytoFLEX流式细胞仪购自Beckman公司;DMi 1倒置显微镜购自LEICA公司。
1.3 硒对小鼠未成熟BMDCs的影响1.3.1 小鼠未成熟BMDCs的制备 未成熟BMDCs取自4~6周龄KM小鼠胫骨和股骨的骨髓,重悬于含有10%小牛血清和1%青链霉素的RPMI-1640完全培养液中,未成熟BMDCs制备完成。
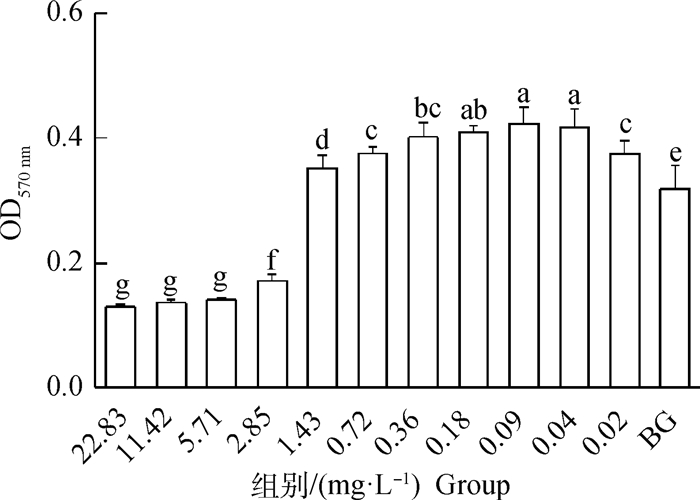
1.3.2 硒对小鼠未成熟BMDCs安全浓度的测定 将制备的未成熟BMDCs细胞浓度调整为2.5× 106个·mL-1,加入至96孔板(100 μL·孔-1),分别加入不同质量浓度的硒,硒以亚硒酸钠的形式添加(将硒用细胞培养液分别从45.66 mg·L-1倍比稀释至0.02 mg·L-1,共11个浓度梯度,加入细胞孔后的终浓度依次为22.83、11.42、5.71、2.85、1.43、0.72、0.36、0.18、0.09、0.04、0.02 mg·L-1),每个浓度组100 μL·孔-1,并重复6个孔,另设空白组(blank group, BG),只加入RPMI-1640完全培养液。在37 ℃、50 mL·L-1 CO2条件下培养48 h。培养结束前4 h,每孔加入30 μL MTT(5 g·L-1)。培养结束后,弃去上清液,每孔加入100 μL DMSO,轻晃10 min,用酶联免疫仪检测570 nm处的吸光值。当硒最大质量浓度在570 nm处的吸光值不显著低于空白组(BG)时,作为硒对未成熟BMDCs最大安全质量浓度。测得硒的最大安全质量浓度为1.43 mg·L-1,选择最大安全质量浓度倍比稀释5个质量浓度,进行以下相关试验,因此硒的质量浓度选取范围是1.43~0.09 mg·L-1。
1.3.3 硒对小鼠未成熟BMDCs吞噬活性测定 将制备的未成熟BMDCs浓度调整为每毫升2.5×106个细胞,加入到12孔板中(1 mL·孔-1)。贴壁15 h后,弃去非贴壁细胞,在每个细胞孔中分别加入1 mL的硒(1.43、0.72、0.36、0.18、0.09 mg·L-1)、LPS和PHA(5和10 mg·L-1),另设空白组(BG),只加入RPMI-1640完全培养液,每个浓度组重复3个孔。在37 ℃、50 mL·L-1 CO2条件下培养46 h,收集细胞,分别加入200 μL FITC标记的大肠杆菌,避光孵育2 h后, 2 000 r·min-1离心5 min,PBS洗涤2次,在流式细胞仪中检测各组细胞荧光强度。
1.4 硒对小鼠成熟BMDCs的影响1.4.1 小鼠成熟BMDCs的制备 将制备的未成熟BMDCs细胞浓度调整为1.6×106个·mL-1,加入至6孔板中(2 mL·孔-1),在37 ℃、CO2浓度为50 mL·L-1条件下培养15 h后,弃去非贴壁细胞,加入等量的RPMI-1640培养液(含有10% 胎牛血清、1% 青链霉素、25 mg·L-1 rmGM-CSF和25 mg·L-1 rmIL-4),然后隔天半量更换培养液,7 d后成熟BMDCs制备完成。
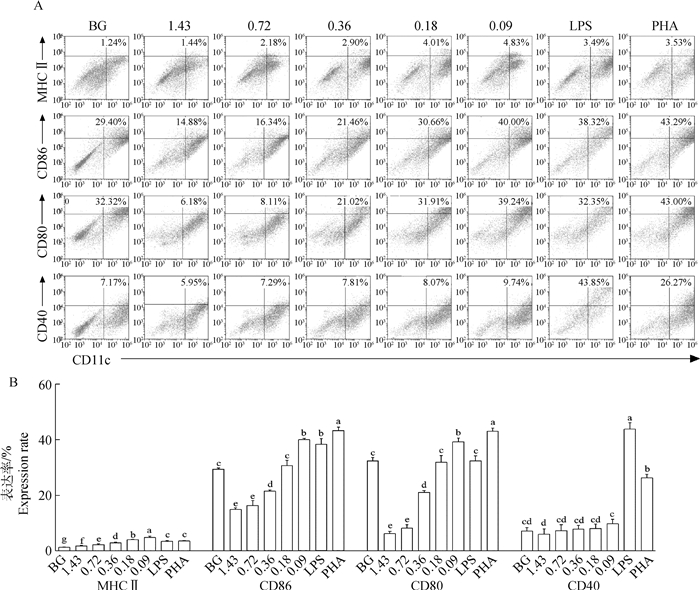
1.4.2 硒对成熟BMDCs表型测定 将硒(1.43、0.72、0.36、0.18、0.09 mg·L-1)、LPS和PHA(5和10 mg·L-1)分别加入到培养至第7天的成熟BMDCs,另设空白组(BG),只加入RPMI-1640完全培养液,每个浓度组重复3个孔。在37 ℃、50 mL·L-1CO2条件下培养48 h后收集成熟BMDCs,先与CD16/32共孵育10 min,再与5种荧光素偶联抗体(PE-Cy CD11c、488 I-A/I-E、PE CD86、BV421 CD80和APC CD40)混合液在4 ℃避光条件下孵育染色30 min后,加入7-AAD标记死亡细胞,在流式细胞仪中检测各组细胞荧光强度。
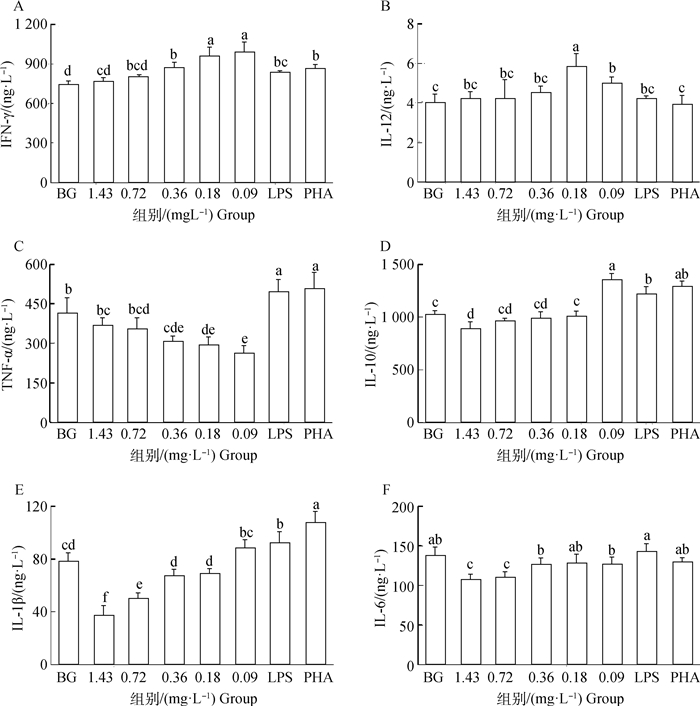
1.4.3 硒对成熟BMDCs上清液中细胞因子含量的测定 如“1.4.1”制备小鼠成熟BMDCs,按“1.4.2”进行分组处理,收集经硒(1.43、0.72、0.36、0.18、0.09 mg·L-1)、LPS和PHA(5和10 mg·L-1)处理后的细胞,每个浓度组重复5个孔,离心收取各组成熟BMDCs上清液,并根据ELISA试剂盒按说明书检测IL-10、IL-12、IL-6、IL-1β、TNF-α和IFN-γ的含量水平。
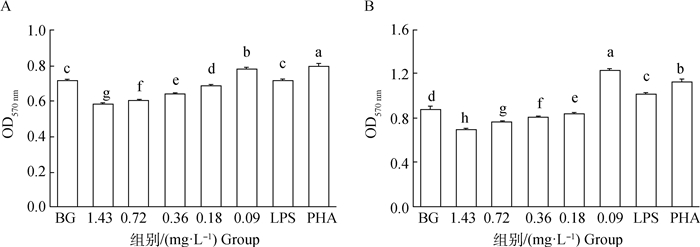
1.4.4 硒对成熟BMDCs刺激同种异体淋巴细胞增殖能力的测定 取无菌KM小鼠脾,研磨成匀浆,用小鼠脾淋巴细胞分离液试剂盒提取脾淋巴细胞,调整脾细胞浓度至2.5×106个·mL-1。如“1.4.1”制备小鼠成熟BMDCs,按“1.4.2”进行分组处理,将制备好的脾淋巴细胞加入到经硒(1.43、0.72、0.36、0.18、0.09 mg·L-1)、LPS和PHA (5和10 mg·L-1)处理后的细胞孔中(1 mL·孔-1),在37 ℃、50 mL·L-1CO2条件下共同培养44 h后, 添加600 μL MTT, 继续培养4 h,小心弃去孔内液体,加入2 mL DMSO,吹打均匀后,吸100 μL至96孔板中,每个浓度组重复6个孔,在570 nm波长处测量其吸光度值。
1.4.5 硒对成熟BMDCs抗原呈递能力的测定 KM小鼠每20 g体重皮下接种100 μg OVA,2周后收集脾淋巴细胞,调整细胞浓度至2.5×106个·mL-1。如“1.4.1”制备小鼠成熟BMDCs,按“1.4.2”进行分组处理,将制备好的脾淋巴细胞加入到经硒(1.43、0.72、0.36、0.18、0.09 mg·L-1)、LPS和PHA(5和10 mg·L-1) 处理后的细胞孔中(1 mL·孔-1),在37 ℃、50 mL·L-1CO2条件下共同培养44 h后, 加入600 μL MTT,继续培养4 h,小心弃去孔内液体,加入2 mL DMSO,吹打均匀后,吸100 μL至96孔板中,每个浓度组重复6个孔,在570 nm波长处测量其吸光度值。
1.5 硒对腹腔巨噬细胞的影响1.5.1 硒对腹腔巨噬细胞的吞噬活性的测定 小鼠每20 g体重腹腔内注射1 mL 6%淀粉溶液,48 h后收集小鼠腹腔巨噬细胞,调节细胞浓度为2.5×106个·mL-1, 接种于12孔板(1 mL·孔-1), 15 h后弃去非贴壁细胞,在每个细胞孔中分别加入1 mL的硒(1.43、0.72、0.36、0.18、0.09 mg·L-1)、LPS和PHA(终浓度分别为5和10 mg·L-1),另设空白组(BG),只加入RPMI-1640完全培养液,每个浓度组重复3个孔。在37 ℃、50 mL·L-1CO2的条件下培养46 h,收集细胞,分别加入200 μL FITC标记的大肠杆菌,继避避光孵育2 h后, 2 000 r·min-1离心5 min,PBS洗涤2次,在流式细胞仪中检测各组细胞荧光强度。
1.5.2 硒对腹腔巨噬细胞上清液中细胞因子含量的测定 同“1.5.1”制备并处理腹腔巨噬细胞,每个浓度组重复5个孔,于37 ℃、50 mL·L-1CO2的条件下培养48 h,收集细胞,离心收取各组小鼠腹腔巨噬细胞上清液,并根据ELISA试剂盒按说明书检测IL-6、IL-10、NO、TNF-α和IFN-γ的含量。
1.6 数据处理试验数据用SPSS 22.0中的One-way ANOVA程序进行单因素方差分析,Dunkan氏法进行多重比较,试验结果以“平均值±标准差”表示,用P < 0.05作为差异显著性判断标准。
2 结果 2.1 硒对小鼠未成熟BMDCs安全浓度的分析当硒最大质量浓度在570 nm处的吸光值不显著低于空白组(BG)时,作为硒对未成熟BMDCs最大安全质量浓度。由图 1可知,当硒的质量浓度在1.43 mg·L-1时,吸光值显著高于空白组(P<0.05),因此对于未成熟BMDCs,硒最大安全质量浓度为1.43 mg·L-1。在以下的试验中,硒选择的质量浓度为1.43、0.72、0.36、0.18和0.09 mg·L-1。
|
所标字母相异表示差异显著(P < 0.05),所标字母相同表示差异不显著(P>0.05),下表同 Different letters mean significant difference among treatments(P < 0.05), same letter means no significant difference among treatments(P>0.05). The same as below 图 1 硒对未成熟BMDCs的安全浓度(n=6) Fig. 1 The safe concentration of selenium on immature BMDCs(n=6) |
由图 2B可知,当硒的质量浓度为0.36~0.09 mg·L-1时,未成熟BMDCs吞噬活性显著高于空白组、LPS和PHA组,且当质量浓度0.18 mg· L-1时,吞噬活性最强,显著高于其他各组(P < 0.05),达到61.19%。

|
A.未成熟BMDCs的吞噬活性流式图;B.未成熟BMDCs的吞噬活性统计图 A.Flow chart of phagocytic activity of immature BMDCs; B.Statistical chart of phagocytic activity of immature BMDCs 图 2 硒对未成熟BMDCs吞噬活性的影响(n=3) Fig. 2 Effect of selenium on phagocytic activity of immature BMDCs (n=3) |
由图 3可知,成熟BMDCs的MHCⅡ、CD86和CD80的表达量随硒质量浓度的递减呈现递增趋势,且当硒的质量浓度为0.09 mg·L-1时,均显著高于空白组(P < 0.05),而当硒的质量浓度为0.09 mg·L-1时,MHCⅡ的表达量还显著高于LPS和PHA组(P < 0.05),而CD40的表达量在不同硒处理组中虽然与空白组没有显著差异(P>0.05),但有明显上升的趋势。
|
A.成熟BMDCs的表型流式图;B.成熟BMDCs的表型统计图 A.Flow chart of phenotype of mature BMDCs; B.Statistical chart of phenotype of mature BMDCs 图 3 硒对成熟BMDCs表型的影响(n=3) Fig. 3 Effect of selenium on phenotype of mature BMDCs(n=3) |
由图 4可知,随着硒质量浓度的递减,IFN-γ的含量呈递增趋势,当质量浓度为0.36~0.09 mg·L-1时,IFN-γ的含量显著高于空白组,且质量浓度在0.18~0.09 mg·L-1时,显著高于LPS、PHA组及其他各组(P<0.05);当硒的质量浓度为0.18~0.09 mg·L-1时,IL-12的含量显著高于空白组,当浓度为0.18 mg·L-1时,IL-12的含量最高且显著高于其他各组(P<0.05);随着硒质量浓度的递减,TNF-α的含量呈递减趋势,且当硒的质量浓度为0.36~0.09 mg·L-1时,TNF-α的含量显著低于空白组、LPS和PHA组(P<0.05);IL-10在硒的质量浓度为0.09 mg·L-1时,其含量最高且显著高于除PHA组外的其他各组(P<0.05);当硒的质量浓度为1.43~0.72 mg·L-1时,IL-6和IL-1β的含量显著低于其他各组(P<0.05),硒的质量浓度为0.36~0.09 mg·L-1时,IL-6和IL-1β的含量虽然明显升高,但与空白组无显著性差异(P>0.05)。
|
A.IFN-γ的含量;B.IL-12的含量;C.TNF-α的含量;D.IL-10的含量;E.IL-1β的含量;F.IL-6的含量 A.IFN-γ content; B.IL-12 content; C.TNF-α content; D.IL-10 content; E.IL-1β content; F.IL-6 content 图 4 硒对成熟BMDCs上清液中细胞因子含量的影响(n=5) Fig. 4 Effect of selenium on cytokine content in supernatant of mature BMDCs(n=5) |
由图 5A可知,硒对成熟BMDCs刺激同种异体淋巴细胞增殖能力随硒质量浓度的递减,呈现递增趋势。当硒质量浓度为0.09 mg·L-1时,成熟BMDCs刺激同种异体淋巴细胞增殖能力显著高于除PHA组之外的其他各组(P < 0.05)。
|
A.同种异体淋巴细胞的增殖;B.抗原呈递能力 A. Proliferation of allogeneic lymphocytes; B. Ability of antigen presenting 图 5 硒对成熟BMDCs刺激同种异体淋巴细胞增殖和抗原呈递能力的影响(n=6) Fig. 5 Effects of selenium stimulated on proliferation of allogeneic lymphocytes and ability of antigen presentation by mature BMDCs(n=6) |
由图 5B可知,随硒质量浓度的递减,硒对成熟BMDCs抗原呈递的能力呈现递增趋势。当硒质量浓度为0.09 mg·L-1时,成熟BMDCs抗原递呈能力最高,且显著高于其他各组(P < 0.05)。
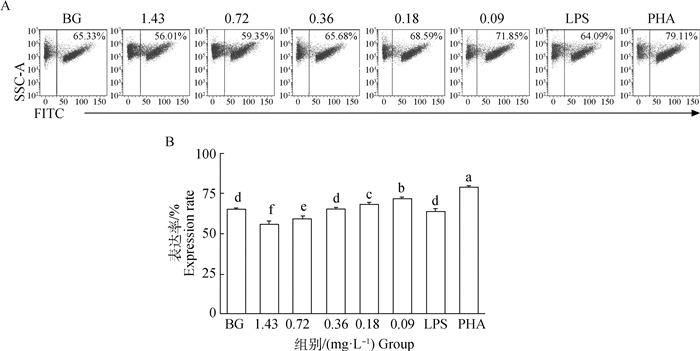
2.7 硒对腹腔巨噬细胞吞噬活性的分析当硒的质量浓度为0.18~0.09 mg·L-1时,腹腔巨噬细胞吞噬活性显著高于空白组和LPS组(P < 0.05),且当质量浓度为0.09 mg·L-1时,吞噬活性显著强于除PHA组之外的其他各组,达到71.85%(图 6)。
|
A.腹腔巨噬细胞的吞噬活性流式图;B.腹腔巨噬细胞的吞噬活性统计图 A. Flow chart of phagocytic activity of peritoneal macrophage; B. Statistical chart of phagocytic activity of peritoneal macrophage 图 6 硒对腹腔巨噬细胞吞噬活性的影响(n=3) Fig. 6 Effect of selenium on phagocytic activity of peritoneal macrophage(n=3) |
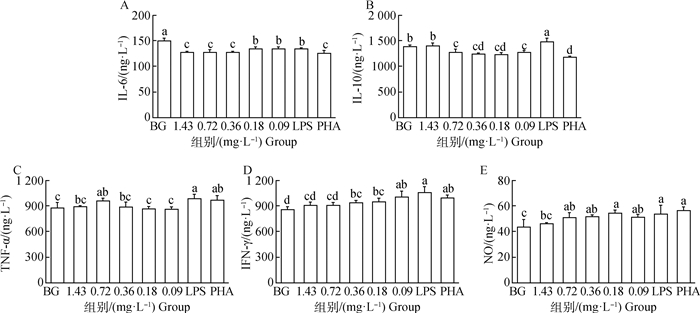
由图 7可知,硒的各组质量浓度组中IL-6的含量显著低于空白组(BG)(P<0.05);当硒的质量浓度为0.72~0.09 mg·L-1时,IL-10的含量显著低于空白组(BG)和LPS组(P<0.05);当硒的质量浓度为0.72 mg·L-1时,TNF-α的含量显著高于空白组(BG)(P<0.05);当硒的质量浓度为0.36~0.09 mg·L-1时,IFN-γ的含量显著高于空白组(BG)(P<0.05);当硒的质量浓度为0.72~0.09 mg·L-1时,NO的含量显著高于空白组(BG)(P<0.05),且在质量浓度为0.18 mg·L-1时含量最高。
|
A. IL-6的含量;B. IL-10的含量;C. TNF-α的含量;D. IFN-γ的含量;E. NO的含量 A. IL-6 content; B.IL-10 content; C.TNF-α content; D. IFN-γ content; E. NO content 图 7 硒对腹腔巨噬细胞上清液中细胞因子含量的影响(n=5) Fig. 7 Effect of selenium on cytokine content in supernatant of peritoneal macrophages(n=5) |
树突状细胞(DCs)发现于1973年,是机体最强大的抗原提呈细胞,在适应性免疫应答的启动中起主要作用,参与一系列微生物病原体的防御[19]。根据表型和功能成熟水平, 树突状细胞分为未成熟和成熟DCs。在不成熟状态下,树突状细胞可以不断地吸收各种自身抗原和外源抗原,具有较强的吞噬活性[20-21]。在摄取抗原或受到某些因素刺激时会分化为成熟DCs,成熟DCs不仅可以启动抗原特异性免疫,还可以诱导并维持对自身组织抗原的特异性耐受。机体的特异性免疫反应是由抗原提呈细胞摄取抗原并在细胞内进行处理,然后将抗原信息呈递给T和B淋巴细胞,刺激T和B细胞增殖,进而诱导机体产生各种抗原特异性抗体,在细胞免疫和体液免疫调节中发挥重要作用[22-23],并且高表达抗原递呈分子MHCⅡ和共刺激因子CD86、CD80和CD40。
吞噬是生物最古老、最基本的防御机制之一,是单细胞生物最基本的营养过程。当DCs分化成熟后,吞噬能力降低,但由于MHCⅡ类分子的高表达,其抗原捕获和呈递能力就有相应的增强,同时CD86、CD80和CD40作为DCs的共刺激因子,表达量上调可诱导T细胞的活化[24]。本研究表明,在硒的安全质量浓度范围内,随着硒质量浓度的降低,未成熟的BMDCs吞噬活性和腹腔巨噬细胞的吞噬活性显著增强,吞噬活性最高分别能达到61.19%和71.85%。当未成熟BMDCs分化成熟后,表面分子MHCⅡ和共刺激分子CD86和CD80表达量显著高于空白组,CD40的表达量也明显增高。当硒质量浓度为0.09 mg·L-1时,BMDCs刺激同种异体淋巴细胞增殖能力和抗原呈递能力显著增强。
细胞因子是由多种组织细胞合成分泌的小分子多肽或糖蛋白,具有多种生物学功能,可以直接表征细胞功能[25]。辅助T细胞(TH)为免疫系统的其他细胞提供辅助功能,在免疫应答中起重要作用,而1型辅助性T细胞(Th1)、2型辅助性T细胞(Th2)和17型辅助性T细胞(Th17)是TH的效应细胞亚群,一般认为Th细胞前体在抗原的刺激下,Th0细胞选择性分化为Th1、Th2或TH17细胞。当DCs和巨噬细胞受到刺激时,会分泌各种细胞因子,其中IFN-γ、IL-12和TNF-a是Th1 CD4+和CD8+ T细胞分化的标志,IL-10、IL-6和IL-1β可诱导Th2和Th17分化,主要作为防御细胞内外病原体的免疫防线[26-29]。巨噬细胞被激活时可产生大量NO[30],具有细胞毒性作用,可杀死细胞内的细菌、寄生虫和肿瘤细胞等,因此,NO分泌的增加可以直接反应巨噬细胞的生理功能。本试验结果显示,一定质量浓度范围内的硒作用于BMDCs和腹腔巨噬细胞,在其上清液中IFN-γ的含量均随硒质量浓度的递减而增多;在成熟BMDCs上清液中,IL-12的含量在硒的质量浓度为0.18 mg·L-1时含量最高,IL-10随硒质量浓度的递减而增多,TNF-α的含量随硒质量浓度递减而降低,IL-6和IL-1β虽然也随硒质量浓度的递减而增多,但从硒的质量浓度0.36 mg·L-1时与空白组没有显著差异;在腹腔巨噬细胞上清液中,NO的含量在硒的质量浓度为0.18 mg·L-1时含量最高,IL-10的含量随硒质量浓度递减而降低,IL-6的含量随硒质量浓度递减而增高,TNF-α的含量在硒的质量浓度为0.72 mg·L-1时含量最高。分析细胞因子含量结果表明,在硒的作用下,DCs和巨噬细胞对TH1型和TH2型免疫应答均有促进作用,并且对TH1型免疫应答的促进作用更加明显。
4 结论综上所述,一定质量浓度的硒可以增强对树突状细胞和巨噬细胞的调控作用,且以浓度为0.18~0.09 mg·L-1时,效果更加显著,因此值得进一步探究硒对机体免疫功能的影响。
| [1] |
REN G X, RAN X L, ZENG R Y, et al. Effects of sodium selenite spray on apple production, quality, and sucrose metabolism-related enzyme activity[J]. Food Chem, 2021, 339: 127883. DOI:10.1016/j.foodchem.2020.127883 |
| [2] |
NEWMAN R, WATERLAND N, MOON Y, T, et al. Selenium biofortification of agricultural crops and effects on plant nutrients and bioactive compounds important for human health and disease prevention - a review[J]. Plant Foods Hum Nutr, 2019, 74(4): 449-460. DOI:10.1007/s11130-019-00769-z |
| [3] |
李晓丽, 何万领, 文凤云, 等. 酵母硒对蛋鸡血清酶活性及抗氧化能力的影响[J]. 中国兽医学报, 2017, 37(2): 318-321. LI X L, HE W L, WEN F Y, et al. Effects of yeast-Se on serum enzyme activity and antioxidant capacity of laying hens[J]. Chinese Journal of Veterinary Science, 2017, 37(2): 318-321. DOI:10.16303/j.cnki.1005-4545.2017.02.23 (in Chinese) |
| [4] |
齐志国, 张铁鹰, 付瑶, 等. 不同高硒饲粮对北京油鸡蛋鸡生产性能、蛋品质、蛋硒含量和抗氧化能力的影响[J]. 动物营养学报, 2019, 31(10): 4537-4544. QI Z G, ZHANG T Y, FU Y, et al. Effects of different high-selenium diets on performance, egg quality, egg selenium content and antioxidant capacity of Beijing-You laying hens[J]. Chinese Journal of Animal Nutrition, 2019, 31(10): 4537-4544. (in Chinese) |
| [5] |
SELENIUS M, RUNDL? F A K, OLM E, et al. Selenium and the selenoprotein thioredoxin reductase in the prevention, treatment and diagnostics of cancer[J]. Antioxid Redox Signal, 2010, 12(7): 867-880. DOI:10.1089/ars.2009.2884 |
| [6] |
TSAI C F, OU B R, LIANG Y C, et al. Growth inhibition and antioxidative status induced by selenium-enriched broccoli extract and selenocompounds in DNA mismatch repair-deficient human colon cancer cells[J]. Food Chem, 2013, 139(1-4): 267-273. DOI:10.1016/j.foodchem.2013.02.001 |
| [7] |
GAĆ P, CZERWIŃSKA K, MACEK P, et al. The importance of selenium and zinc deficiency in cardiovascular disorders[J]. Environ Toxicol Pharmacol, 2021, 82: 103553. DOI:10.1016/j.etap.2020.103553 |
| [8] |
DELEZIE E, ROVERS M, VAN DER AA A, et al. Comparing responses to different selenium sources and dosages in laying hens[J]. Poult Sci, 2014, 93(12): 3083-3090. DOI:10.3382/ps.2014-04301 |
| [9] |
LI B X, LIU Y, LI W Y, et al. Effect of selenium on ion profiles and antioxidant defense in mice livers[J]. Biol Trace Elem Res, 2018, 184(1): 127-135. DOI:10.1007/s12011-017-1178-9 |
| [10] |
RAO S V R, PRAKASH B, RAJU M V L N, et al. Effect of supplementing organic selenium on performance, carcass traits, oxidative parameters and immune responses in commercial broiler chickens[J]. Asian-Australas J Anim Sci, 2013, 26(2): 247-252. DOI:10.5713/ajas.2012.12299 |
| [11] |
洪作鹏, 章亦武, 周雯婷, 等. 微量元素硒在畜禽养殖中的研究进展[J]. 饲料研究, 2021, 44(14): 135-138. HONG Z P, ZHANG Y W, ZHOU W T, et al. Research progress of trace element selenium in livestock and poultry breeding[J]. Feed Research, 2021, 44(14): 135-138. (in Chinese) |
| [12] |
李世印. 不同硒源对断奶小鼠和育肥猪生长性能和抗氧化的影响[D]. 泰安: 山东农业大学, 2021. LI S Y. Effects of different selenium sources on growth performance and antioxidant capacity of weaned mice and finishing pigs[D]. Tai'an: Shandong Agricultural University, 2021. (in Chinese) |
| [13] |
陈昌豪. 亚硒酸钠对DON致GPX1过表达型猪脾脏淋巴细胞氧化损伤的保护作用[D]. 雅安: 四川农业大学, 2019. CHEN C H. Protective effect of sodium selenite on DON induced GPX1 overexpressing spleen lymphocytes in pigs[D]. Ya'an: Sichuan Agricultural University, 2019. (in Chinese) |
| [14] |
臧浩哲. 硒对金黄色葡萄球菌感染的巨噬细胞自噬和氧化损伤的影响研究[D]. 扬州: 扬州大学, 2019. ZANG H Z. Effects of selenium on autophagy and oxidative damage of macrophages infected by Staphylococcus aureus[D]. Yangzhou: Yangzhou University, 2019. (in Chinese) |
| [15] |
许晓, 李明, 范理宏. 亚硒酸钠对肺癌细胞生物学行为的影响及其相关机制研究[J]. 安徽医科大学学报, 2021, 56(7): 1117-1122. XU X, LI M, FAN L H. Effect of sodium selenite on biological behaviors of lung cancer cells and its molecular mechanism[J]. Acta Universitatis Medicinalis Anhui, 2021, 56(7): 1117-1122. DOI:10.19405/j.cnki.issn1000-1492.2021.07.021 (in Chinese) |
| [16] |
SHEN K Y, LIU H Y, YAN W L, et al. Liposomal TLR9 agonist combined with TLR2 agonist-fused antigen can modulate tumor microenvironment through dendritic cells[J]. Cancers, 2020, 12(4): 810. DOI:10.3390/cancers12040810 |
| [17] |
WYLIE B, MACRI C, MINTERN J D, et al. Dendritic cells and cancer: from biology to therapeutic intervention[J]. Cancers, 2019, 11(4): 521. DOI:10.3390/cancers11040521 |
| [18] |
黄文竹, 胡文慧, 曾柱. Ⅰ型鼠尾胶原三维培养模型对树突状细胞形态及分泌能力的影响[J]. 贵州医科大学学报, 2017, 42(9): 993-997, 1002. HUANG W Z, HU W H, ZENG Z. The effects of t-dimensional rat tail collagen I cultivation model on morphology and cytokine secretion capacity of dendritic cells[J]. Journal of Guizhou Medical University, 2017, 42(9): 993-997, 1002. (in Chinese) |
| [19] |
BIEBER K, AUTENRIETH S E. Insights how monocytes and dendritic cells contribute and regulate immune defense against microbial pathogens[J]. Immunobiology, 2015, 220(2): 215-226. DOI:10.1016/j.imbio.2014.10.025 |
| [20] |
MERAD M, SATHE P, HELFT J, et al. The dendritic cell lineage: ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting[J]. Annu Rev Immunol, 2013, 31: 563-604. DOI:10.1146/annurev-immunol-020711-074950 |
| [21] |
XIE Q, SUN Y T, CAO L L, et al. Antifatigue and antihypoxia activities of oligosaccharides and polysaccharides from Codonopsis pilosula in mice[J]. Food Funct, 2020, 11(7): 6352-6362. DOI:10.1039/D0FO00468E |
| [22] |
SUZUKI H, TSUJI R, SUGAMATA M, et al. Administration of plasmacytoid dendritic cell-stimulative lactic acid bacteria is effective against dengue virus infection in mice[J]. Int J Mol Med, 2019, 43(1): 426-434. |
| [23] |
HEESTERS B A, CARROLL M C. The role of dendritic cells in S. pneumoniae transport to follicular dendritic cells[J]. Cell Rep, 2016, 16(12): 3130-3137. DOI:10.1016/j.celrep.2016.08.049 |
| [24] |
INABA K, INABA M. Antigen recognition and presentation by dendritic cells[J]. Int J Hematol, 2005, 81(3): 181-187. |
| [25] |
ZHANG S S, NIE S P, HUANG D F, et al. Immunomodulatory effect of Ganoderma atrum polysaccharide on CT26 tumor-bearing mice[J]. Food Chem, 2013, 136(3-4): 1213-1219. |
| [26] |
SOLEYMANI S, HADI A, ASGARI F, et al. Combination of mechanical and chemical methods improves gene delivery in cell-based HIV vaccines[J]. Curr Drug Delivery, 2019, 16(9): 818-828. |
| [27] |
GARRIS C S, ARLAUCKAS S P, KOHLER R H, et al. Successful anti-PD-1 cancer immunotherapy requires T cell-dendritic cell crosstalk involving the cytokines IFN-γ and IL-12[J]. Immunity, 2018, 49(6): 1148-1161. |
| [28] |
BROWN C C, GUDJONSON H, PRITYKIN Y, et al. Transcriptional basis of mouse and human dendritic cell heterogeneity[J]. Cell, 2019, 179(4): 846-863. |
| [29] |
LIU K F, TAO Y H, WANG L Y, et al. A novel multifunctional vaccine platform with dendritic cell-targeting and pH-responsive for cancer immunotherapy: antigen-directed biomimetic fabrication of a cabbage-like mannatide-zinc-antigen hybrid microparticles[J]. Chem Eng J, 2021, 426: 130867. |
| [30] |
LIU Q, XIAO X H, HU L B, et al. Anhuienoside c ameliorates collagen-induced arthritis through inhibition of MAPK and NF-κB signaling pathways[J]. Front Pharmacol, 2017, 8: 299. |
(编辑 范子娟)



