危害养鸡业的细菌性疾病主要是大肠杆菌病与沙门菌病,在育雏期通过适当途径给予抗革兰阴性菌的抗菌药物防治此类疾病已成为养鸡业的惯例。氟喹诺酮类药物是世界上最有价值、使用最广泛的一类抗菌药,恩诺沙星为第三代氟喹诺酮类抗菌药,对革兰阴性菌具有良好的抗菌活性,在兽医临床广泛用于防控大肠杆菌、沙门菌和支原体等引起的家禽肠道和呼吸道感染[1-2]。相比于欧美等发达国家,我国目前大肠杆菌(Escherichia coli)和沙门菌(Salmonella)等革兰阴性菌临床分离株对氟喹诺酮类耐药水平较高,山西省部分地区分离的20株致病性鸡源大肠杆菌耐药性检测结果显示,试验菌对恩诺沙星耐药率为85%[3]。秦春芝等[4]于山东省分离的93株致病性大肠杆菌,对恩诺沙星耐药率为88.63%。高强等[5]于甘肃省肉仔鸡中分离得到的大肠杆菌、沙门菌均对恩诺沙星耐药。氟喹诺酮类抗菌药使用情况与细菌耐药有一定相关性,Guo等[6]报道983株从河北省1日龄雏鸡分离的大肠杆菌对恩诺沙星的平均耐药率高达75%,随着恩诺沙星的使用,耐药率逐渐提高至100%;而徐耀辉等[7]报道的从河南省三黄种鸡场死胚中分离的173株沙门菌对恩诺沙星、环丙沙星均敏感。在未批准使用氟喹诺酮类药物的美国,大肠杆菌对氟喹诺酮类药物的耐药率低于5%,而在氟喹诺酮类药物使用合法化的巴西、中国和欧盟,大肠杆菌的平均耐药率超过40%[8]。我国大肠杆菌和沙门菌临床分离株的高耐药率是否与养禽业长期使用此类药物较低浓度混饮或混饲给药有关?目前,尚无这方面的研究。中国是世界上最大的抗菌药生产和使用国,动物占总消费量的一半以上[9-10],《2020年中国兽用抗菌药使用情况报告》中指出,2020年,中国境内使用的全部兽用抗菌药总量约为3.2万t,较2019年增长6.06%[11]。临床批准使用的抗菌药物耐药性增加对这些药物在未来的使用构成重大威胁[12],动物生产在很大程度上仍然依赖于抗菌药的广泛使用,立即彻底禁止食品动物使用抗菌素将对动物健康、生产力和福利以及食品价格造成严重后果[13]。在全球细菌耐药性增加的同时新型抗菌药物的发现率显著下降[14-15],PK/PD模型提供了防止细菌耐药的策略和方法,最佳的治疗方案既能达到最佳杀菌效果,又能最大限度抑制耐药菌株的出现[16-17]。Drusano等[18-19]建立了将PK/PD研究与Monte Carlo模拟(Monte Carlo simulation,MCS)结合以确定最佳给药方案的方法,MCS是一种计算机建模过程,它结合了药代动力学参数的可变性和细菌种群内的自然MIC分布,该技术可用于建立细菌的PK/PD折点[20],此方法已被FDA、EMEA等多个新药审批机构提倡和鼓励,并广泛应用于新药研发中,同时在国内外也广泛应用于抗菌药物的临床研究中[21-22]。本研究利用恩诺沙星在1、7和14日龄雏鸡混饮给药的药动学特征与美国临床和实验室标准协会(CLSI)关于禽大肠杆菌对恩诺沙星的敏感性折点值(0.25 μg·mL-1)[23]构建PK/PD模型,结合MCS综合评价恩诺沙星可溶性粉在鸡给药方案的合理性,不仅能为监管部门对这类制剂上市后再评价提供参考依据,且对延长抗菌药使用寿命、指导育雏期间合理用药具有实际意义。
1 材料与方法 1.1 材料1.1.1 药品与试剂 恩诺沙星与盐酸环丙沙星对照品(纯度≥99.8%),批号分别为H0081505、H0101310,购自中国兽医药品监察所;恩诺沙星可溶性粉,规格:10%(以恩诺沙星计),批号:E9K191202,购自河北远征禾木药业有限公司;乙腈、甲醇、色谱纯购自美国TEDIA公司;85%浓磷酸分析纯购自德国CNW公司;氢氧化钠、三乙胺、分析纯购自国药集团化学试剂有限公司。
1.1.2 仪器与设备 高效液相色谱仪(Waters2695,配Waters2475荧光检测器)购自美国Waters公司;电子分析天平(BSI24S)购自德国赛多利斯天平公司;高速冷冻离心机(5180R)、微量移液器购自德国Eppendorf公司;纯水仪(UPH-11-20T)购自四川优普超纯科技有限公司;水浴氮吹仪(N-EVAP)购自美国Organomation公司;微型旋涡混合仪(WH-3)购自上海沪西分析仪器厂有限公司;KS-250D超声仪购自宁波科生仪器厂;有机针式滤器(0.22 μm)购自上海安谱科技有限公司。
1.1.3 试验动物 健康白羽肉鸡,购自江苏八达畜禽公司;1日龄雏鸡给药第0天平均体重为(42.0± 2.5)g;给药第4天为(109.0±1.6)g。7日龄雏鸡给药第0天平均体重为(163.0±2.1)g;给药第4天为(300.0±1.8)g。14日龄雏鸡给药第0天平均体重为(402.0±2.2)g;给药第4天为(524.0±2.6)g。饲料为雏鸡全价饲料,由扬州旺旺饲料厂提供。试验期间,雏鸡饲养环境温度1日龄为34~37 ℃;7日龄为31~36 ℃;14日龄为28~32 ℃。饲养环境湿度为42%~68%。
1.2 方法1.2.1 动物分组与给药 600只1日龄雏鸡随机分为3组,每组200只。第1组处理组于1日龄时即混饮给药,第2组处理组饲养至7日龄时始混饮给药,第3组处理组饲养至14日龄时开始混饮给药。3个处理组给药方案均为恩诺沙星可溶性粉临床推荐剂量的最高限量即75 mg·L-1(以恩诺沙星计)混饮,连用5 d(第1日记为给药第0天,第5日记为给药第4天)。另设一平行对照组,根据其日饮水量和雏鸡体重换算为24 h药物摄入量。
混饮药液现配现用,每日第一次给药时间均为上午08:00,根据雏鸡的饮水量及时补充或更换。
1.2.2 给药后血样采集及血浆中恩诺沙星及其代谢物环丙沙星含量测定 在混饮给药的第0天开始采集血样,时间点分别为0 (给药前)、0.5、1、2、3、4、6、8、12 h;第1、2天混饮给药期间每日采集血样时间点分别为0(给药前)、3、6、8和12 h;第3天采集血样时间点分别为0(给药前)、0.5、1、2、4、6、8和12 h;第4天采集血样时间点分别为0(给药前)、0.5、1、2、4、6、8、12和24 h。各时间点随机取5只雏鸡,通过颈静脉采集血样,每只鸡一次性采血1~2 mL,置于含有肝素钠的离心管中,4 000 r·min-1离心10 min分离血浆,于-20 ℃冰箱中冻存待用。
血浆中恩诺沙星及其代谢物环丙沙星的含量采用经验证的HPLC方法检测。色谱参考条件:色谱柱为Agilent HP-C18(4.6 mm×250 mm,5 μm);流动相为0.05 mol·L-1磷酸/三乙胺(pH=3.0),乙腈(820 mL·L-1);流速:0.8 mL·min-1;柱温:35 ℃;进样量:10 μL;荧光检测器,激发波长278 nm,发射波长450 nm。准确度和精密度通过空白血浆样品添加标准工作液的回收率和变异系数进行评价,测定结果带入当日随行标准曲线,计算血浆中恩诺沙星和环丙沙星的含量。
1.2.3 Monte Carlo模拟 使用Crystal ball 11.1软件进行MCS,置信区间为95%,模拟恩诺沙星对大肠杆菌的AUC0-24/MIC估值,模拟10 000次。模拟过程中AUC0-24选择1、7和14日龄雏鸡给药第4天实测值,遵循对数正态分布;MIC遵循自定义分布,大肠杆菌MIC分布来源于文献[24];以AUC0-24/MIC≥100的估值作为靶值,达标率(target attainment rate, TAR)≥90%表明当前给药方案预期可获得满意疗效,并防止细菌产生耐药性。
1.2.4 数据处理及分析 使用Phoenix WinNonlin 8.1软件处理平均血药浓度-时间数据,采用非房室模型分析方法计算相关药动学参数;使用SPSS 26.0软件进行差异显著性分析。
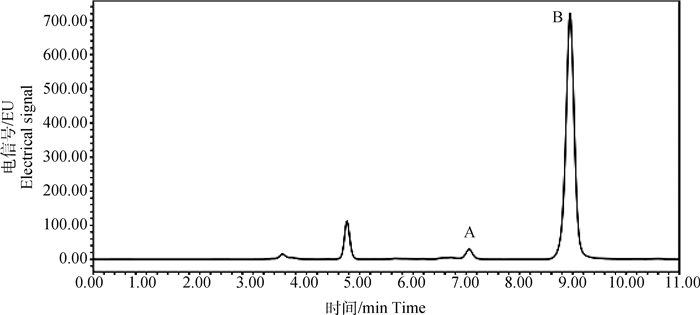
2 结果 2.1 鸡血浆中恩诺沙星和环丙沙星含量测定的HPLC方法验证空白基质、空白基质添加标准品及1日龄雏鸡给药第4天实测色谱图分别见图 1~3。在本试验所建立的色谱条件下,恩诺沙星的出峰时间在8.9 min左右,环丙沙星的出峰时间在7.0 min左右,待测组分能够与溶剂峰及基质组分完全分开,且峰形良好。在0.02~2.5 μg·mL-1浓度,恩诺沙星和环丙沙星药物浓度与峰面积呈良好的线性关系(R2≥0.999),检测限(LOD)和定量限(LOQ)分别为0.01和0.02 μg·mL-1。在定量限(0.02 μg·mL-1)和低、中、高3个添加浓度(0.05、0.5、2.5 μg· mL-1)恩诺沙星的平均回收率为95.16%~105.02%,批内变异系数 < 5.65%,批间变异系数 < 5.84%;环丙沙星的平均回收率为88.42%~100.8%,批内变异系数 < 5.16%,批间变异系数 < 6.58%。
|
A.环丙沙星色谱峰;B.恩诺沙星色谱峰 A. The chromatographic peak of ciprofloxacin; B. The chromatographic peak of enrofloxacin 图 1 空白血浆色谱图 Fig. 1 Blank plasma chromatogram |

|
图 2 空白血浆添加混合标准液色谱图(0.02 μg·mL-1) Fig. 2 Blank plasma added with mixed standard solution chromatogram (0.02 μg·mL-1) |
|
A.环丙沙星色谱峰;B.恩诺沙星色谱峰 A. The chromatographic peak of ciprofloxacin; B. The chromatographic peak of enrofloxacin 图 3 1日龄雏鸡给药第4天血浆色谱图 Fig. 3 Plasma chromatogram of one day old chicks on the 4th day after administration |
1、7和14日龄雏鸡处理组在给药第0~4天平均血药浓度分别为0.458~0.629、0.435~0.714和0.391~0.561 μg·mL-1,给药第0和第4天的恩诺沙星平均血药浓度-时间曲线分别见图 4、5,整个给药期间的恩诺沙星平均血药浓度-时间曲线见图 6。除1和7日龄雏鸡处理组在给药第1天以及1和14日龄雏鸡处理组在给药第4天的平均血药浓度有显著差异外(P < 0.05),给药期间其他时间段不同日龄雏鸡恩诺沙星平均血药浓度均无显著差异(P≥0.05)。

|
图 4 1、7和14日龄雏鸡处理组在给药第0天的恩诺沙星平均血药浓度-时间曲线 Fig. 4 The mean plasma drug concentration-time curve of 1, 7 and 14 day olds chicks on day 0 of administration |

|
图 5 1、7和14日龄雏鸡处理组在给药第4天的恩诺沙星平均血药浓度-时间曲线 Fig. 5 The mean plasma drug concentration-time curves of 1, 7 and 14 day-olds chicks in treatment groups on the 4th day of administration |

|
图 6 1、7和14日龄雏鸡处理组在整个给药期间的恩诺沙星平均血药浓度-时间曲线 Fig. 6 Mean plasma concentration-time curves of 1, 7 and 14 day-olds chicks in treatment groups during the whole administration period |
对1、7和14日龄雏鸡处理组第0和4天平均血药浓度-时间数据处理获得相关药动学参数,见表 1。鉴于环丙沙星在雏鸡血浆浓度过低,选择恩诺沙星作为PK计算标志物。
|
|
表 1 1、7和14日龄雏鸡处理组在给药第0和4天的药动学参数 Table 1 Pharmacokinetic parameters of 1, 7 and 14 day-olds chicks on day 0 and day 4 of administration |
将本试验所得药动学参数与恩诺沙星对禽大肠杆菌敏感性折点值(0.25 μg·mL-1)进行比值计算,1、7和14日龄雏鸡处理组给药第4天的Cmax/MIC分别为2.40、2.20和1.95,Cavg/MIC分别为2.05、1.97和1.73,AUC0-24/MIC分别为49.24、47.28和41.48。
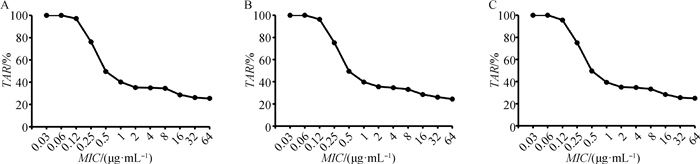
2.4 Monte Carlo模拟结果不同日龄雏鸡恩诺沙星可溶性粉混饮给药第4天在大肠杆菌临床分离株不同MIC范围内的TAR见图 7。恩诺沙星对MIC≤0.25 μg·mL-1的大肠杆菌临床分离株,给药第4天TAR分别为76.11%、75.21%和75.01%,AUC0-24敏感度为27%~30%;在MIC≤0.12 μg·mL-1的菌株TAR≥90%。
|
A. 1日龄雏鸡给药第4天;B. 7日龄雏鸡给药第4天;C. 14日龄雏鸡给药第4天 A. Day 4 of administration for 1 day-old chicks; B. Day 4 of administration for 7 day-old chicks; C. Day 4 of administration for 14 day-old chicks 图 7 恩诺沙星可溶性粉75 mg·L-1混饮给药对大肠杆菌临床分离株在不同MIC范围内的TAR Fig. 7 The TAR of enrofloxacin at 75 mg·L-1 mixed drinks within different MIC ranges of Escherichia coli clinical isolates |
恩诺沙星可溶性粉在1、7和14日龄雏鸡连续混饮5 d,在给药第0天药物摄入量分别为42.86、54.86和36.24 mg·kg-1,在给药第4天药物摄入量分别为54.52、38.07和35.43 mg·kg-1。与Kang等[2]报道恩诺沙星10 mg·kg-1在肉鸡口服给药(Tmax为0.65 h;Cmax为3.82 μg·mL-1)相比,药物摄入量更多,同时1、7和14日龄雏鸡给药第0天的Tmax与其相比更晚,且Cmax更低。1、7和14日龄雏鸡首次给药后,分别于12、24和12 h检测出环丙沙星,整个试验期间所有雏鸡体内环丙沙星的血药浓度均未超过0.1 μg·mL-1。3个日龄处理组雏鸡在首次给药24 h和之后各时间点的血药浓度均相对接近;除1日龄和7日龄雏鸡处理组在给药第1天以及1和14日龄雏鸡处理组在给药第4天的平均血药浓度有显著性差异外,其他时间段不同日龄雏鸡处理组的平均血药浓度均无显著性差异。结果表明,恩诺沙星可溶性粉在健康雏鸡混饮给药,雏鸡日龄对恩诺沙星血药浓度无明显影响;按推荐给药方案混饮给药12 h后才能在雏鸡体内检测出代谢物环丙沙星,且检出量很低。
3.2 PK/PD参数与TAR对临床用药的指导意义氟喹诺酮类药物属于浓度依赖型抗菌药,评估此类药物的主要PK/PD参数为AUC0-24/MIC和Cmax/MIC[24]。氟喹诺酮类药物的PK/PD参数与疗效密切相关,一般认为Cmax/MIC>8或AUC0-24/MIC>100时,抗菌效果良好。同时,Cmax/MIC和AUC0-24/MIC也可用于预测治疗过程中耐药性出现的可能性,在Blaser等[25]的研究中,只有Cmax/MIC>8时,细菌才不易产生耐药性;Tomas等[26]研究表明,当AUC/MIC < 100时,无论使用何种抗菌疗法,大约50%的分离微生物在开始治疗的4 d内获得耐药性,且在治疗的最初24 h内,必须达到较高的AUC/MIC,才能有效杀灭病原体。Toutain等[27]指出,应选择达到稳态时的AUC0-24构建抗菌药物PK/PD模型,因此使用1、7和14日龄雏鸡在给药第4天的药动学参数计算。CLSI给出的恩诺沙星对禽大肠杆菌敏感性折点值为0.25 μg·mL-1,以Cmax和AUC0-24与折点值的比值分别评价恩诺沙星混饮给药方案对敏感菌的杀灭效果及诱导耐药性的作用。依据本试验获得的PK参数值,得出1、7和14日龄雏鸡处理组给药第4天Cmax/MIC及Cavg/MIC均接近或大于2,理论上对所有敏感性大肠杆菌均具有抑制或杀灭效果,但未达最佳比值,无法发挥最佳治疗效果。给药期间,AUC0-24/MIC为41.48~49.24,亦未达最佳PK/PD比值,对部分恩诺沙星敏感性大肠杆菌易诱导耐药性。将1、7和14日龄雏鸡给药第4天Cmax和AUC0-24值代入上述不等式计算MIC范围,显示当前给药方案对MIC≤0.06 μg·mL-1的大肠杆菌具有最佳杀灭作用;可限制MIC≤0.10 μg·mL-1的菌株产生耐药性;对MIC≤0.06 μg·mL-1的菌株发挥最佳杀菌效果的同时可避免诱导耐药。
PK/PD模型对评价抗菌药物给药方案具有重要意义,将禽大肠杆菌对恩诺沙星敏感性折点值作为PK参数,能够直接反映当前给药方案对全部敏感菌的作用。同时,MCS将PK/PD模型与细菌自然分布结合,预测抗菌药物对临床感染菌株的疗效,是科学评价给药方案必不可少的环节。Booker等[28]发现,氟喹诺酮类药物的AUC0-24/MIC能更好地反映PK与PD之间的关系,因此选用AUC0-24/MIC作为PK/PD参数进行MCS。根据国内外的相关报道,选择AUC0-24/MIC≥100作为PK/PD靶值[20, 29-31]。某种细菌在某一特定MIC下,TAR≥90%时,提示该给药方案对不高于该MIC的感染菌株达到预期治疗效果,且能防止耐药性产生[20]。欧洲药敏委员会(EUCAST)MIC数据库(https://mic.eucast.org/)中检索得到恩诺沙星对3 039株大肠杆菌的MIC分布中91%分布在0.06 μg·mL-1及以下,与中国大肠杆菌临床分离株的MIC分布有一定区别,选择中国大肠杆菌临床分离株的MIC分布对指导临床用药更具实际意义。本研究选择Sang等[24]2016年于中国5个省份肉鸡中分离得到的929株大肠杆菌临床分离株MIC分布,其中,310株大肠杆菌的MIC≤0.25 μg·mL-1,230株≤0.06 μg·mL-1。结果显示,恩诺沙星对大肠杆菌临床分离株的MIC≤0.25 μg·mL-1时,1、7和14日龄雏鸡给药期间TAR在75.01%~76.11%,未达90%,即恩诺沙星可溶性粉按当前给药方案给药,无法对恩诺沙星敏感性大肠杆菌发挥最大杀菌作用,且易诱导产生耐药性,仅能在MIC≤0.12 μg·mL-1的大肠杆菌获得预期疗效。MCS结果中的敏感度指模拟过程中各变量的敏感程度,AUC0-24敏感度为27%~30%,表明当前给药方案对模型存在一定影响。
4 结论本研究在不同日龄雏鸡开展恩诺沙星可溶性粉混饮给药的药动学研究,获得药动学参数,采用PK/PD与MCS相结合的方法,评价恩诺沙星可溶性粉在雏鸡混饮给药方案对大肠杆菌的有效性。结果提示,恩诺沙星可溶性粉当前推荐给药方案在雏鸡对大肠杆菌杀菌效果有限,且易诱导部分敏感菌产生耐药性,长期在育雏期使用当前给药方案,将导致我国鸡源大肠杆菌对氟喹诺酮类药物的高水平耐药加剧。给药途径的改变、新剂型的研发以及合理使用抗菌药的科普等对延长恩诺沙星使用寿命、减少细菌耐药性产生具有重要意义。
| [1] |
MAJALEKAR P P, SHIROTE P J. Fluoroquinolones: blessings or curses[J]. Curr Drug Targets, 2020, 21(13): 1354-1370. DOI:10.2174/1389450121666200621193355 |
| [2] |
KANG J, HOSSAIN M A, PARK H C, et al. Pharmacokinetic and pharmacodynamic integration of enrofloxacin against Salmonella Enteritidis after administering to broiler chicken by per-oral and intravenous routes[J]. J Vet Sci, 2019, 20(2): e15. DOI:10.4142/jvs.2019.20.e15 |
| [3] |
宁官保, 牛艺儒, 张鼎, 等. 鸡源大肠杆菌耐药性分析及中药对大肠杆菌耐药性消除作用的研究[J]. 畜牧兽医学报, 2015, 46(6): 1018-1025. NING G B, NIU Y R, ZHANG D, et al. Studies on the drug resistance of chicken isolated Escherichia coli and role of traditional Chinese medicines in the drug resistance elimination[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(6): 1018-1025. (in Chinese) |
| [4] |
秦春芝, 徐怀英, 黄迪海, 等. 山东省禽源致病性大肠杆菌流行病学监测及耐药模式分析[J]. 中国动物检疫, 2021, 38(8): 16-21, 62. QIN C Z, XU H Y, HUANG D H, et al. Epidemiological surveillance of avian pathogenic Escherichia coli in Shandong province and it's antimicrobial resistance analysis[J]. China Animal Health Inspection, 2021, 38(8): 16-21, 62. (in Chinese) |
| [5] |
高强, 薛瑞林, 李守湖, 等. 鸡源大肠杆菌和沙门氏菌的分离鉴定及耐药分析[J]. 中国兽药杂志, 2020, 54(11): 14-21. GAO Q, XUE R L, LI S H, et al. Study on the antibacterial effect of compound Chinese herbal medicine on E. coli and Salmonella from chicken[J]. Chinese Journal of Veterinary Drug, 2020, 54(11): 14-21. (in Chinese) |
| [6] |
GUO K X, ZHAO Y, CUI L Q, et al. Longitudinal surveillance and risk assessment of resistance in Escherichia coli to enrofloxacin from a large-scale chicken farm in Hebei, China[J]. Antibiotics, 2021, 10(10): 1222. DOI:10.3390/antibiotics10101222 |
| [7] |
徐耀辉, 邓同炜, 齐亚如, 等. 三黄种鸡场孵化死胚中沙门菌的分离鉴定与耐药性分析[J]. 畜牧兽医学报, 2018, 49(5): 1081-1088. XU Y H, DENG T W, QI Y R, et al. Isolation, identification and antimicrobial resistance of Salmonella from dead chicken embryos in Sanhuang breeder farms[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 1081-1088. (in Chinese) |
| [8] |
ROTH N, KÄSBOHRER A, MAYRHOFER S, et al. The application of antibiotics in broiler production and the resulting antibiotic resistance in Escherichia coli: a global overview[J]. Poul Sci, 2019, 98(4): 1791-1804. DOI:10.3382/ps/pey539 |
| [9] |
KRISHNASAMY V, OTTE J, SILBERGELD E. Antimicrobial use in Chinese swine and broiler poultry production[J]. Antimicrob Resist Infect Control, 2015, 4(1): 17. DOI:10.1186/s13756-015-0050-y |
| [10] |
HVISTENDAHL M. China takes aim at rampant antibiotic resistance[J]. Science, 2012, 336(6083): 795. DOI:10.1126/science.336.6083.795 |
| [11] |
中华人民共和国农业农村部. 2020年中国兽用抗菌药使用情况报告[J/OL]. 兽医公报, 2021, 23(9): 33-36. [2022-06-23]. http://www.moa.gov.cn/gk/sygb/202111/P020211104353940540082.pdf Ministry of Agriculture and Rural Affairs of the People's Republic of China. 2020 Annual report on the use of veterinary antibiotics in China[J/OL]. Official Veterinary Bulletin, 2021, 23(9): 33-36. [2022-06-23]. http://www.moa.gov.cn/gk/sygb/202111/P020211104353940540082.pdf (in Chinese) |
| [12] |
PRIVALSKY T M, SOOHOO A M, WANG J H, et al. Prospects for antibacterial discovery and development[J]. J Am Chem Soc, 2021, 143(50): 21127-21142. DOI:10.1021/jacs.1c10200 |
| [13] |
WOOLHOUSE M, WARD M, VAN BUNNIK B, et al. Antimicrobial resistance in humans, livestock and the wider environment[J]. Philos Trans R Soc B: Biol Sci, 2015, 370(1670): 20140083. DOI:10.1098/rstb.2014.0083 |
| [14] |
BROWN E D, WRIGHT G D. Antibacterial drug discovery in the resistance era[J]. Nature, 2016, 529(7586): 336-343. DOI:10.1038/nature17042 |
| [15] |
VIVAS R, BARBOSA A A T, DOLABELA S S, et al. Multidrug-resistant bacteria and alternative methods to control them: an overview[J]. Microb Drug Resist, 2019, 25(6): 890-908. DOI:10.1089/mdr.2018.0319 |
| [16] |
TOUTAIN P L, LEES P. Integration and modelling of pharmacokinetic and pharmacodynamic data to optimize dosage regimens in veterinary medicine[J]. J Vet Pharmacol Ther, 2004, 27(6): 467-477. DOI:10.1111/j.1365-2885.2004.00613.x |
| [17] |
BELEW S, KIM J Y, HOSSAIN A, et al. Pharmacokinetics of marbofloxacin after intravenous and intramuscular administration in Hanwoo, Korean native cattle[J]. J Vet Med Sci, 2015, 77(3): 327-329. DOI:10.1292/jvms.14-0221 |
| [18] |
DRUSANO G L, LOUIE A. Breakpoint determination when multiple organisms are tested for effect targets[J]. Eur J Pharm Sci, 2019, 130: 196-199. |
| [19] |
DRUSANO G L, PRESTON S L, HARDALO C, et al. Use of preclinical data for selection of a phase II/III dose for evernimicin and identification of a preclinical MIC breakpoint[J]. Antimicrob Agents Chemother, 2001, 45(1): 13-22. DOI:10.1128/AAC.45.1.13-22.2001 |
| [20] |
FREI C R, WIEDERHOLD N P, BURGESS D S. Antimicrobial breakpoints for Gram-negative aerobic bacteria based on pharmacokinetic–pharmacodynamic models with Monte Carlo simulation[J]. J Antimicrob Chemother, 2008, 61(3): 621-628. |
| [21] |
MOUTON J W, DUDLEY M N, CARS O, et al. Standardization of pharmacokinetic/pharmacodynamic (PK/PD) terminology for anti-infective drugs: an update[J]. J Antimicrob Chemother, 2005, 55(5): 601-607. |
| [22] |
AMBROSE P G, GRASELA D M. The use of Monte Carlo simulation to examine pharmacodynamic variance of drugs: fluoroquinolone pharmacodynamics against Streptococcus pneumoniae[J]. Diagn Microbiol Infect Dis, 2000, 38(3): 151-157. |
| [23] |
CLSI. Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals. 5th ed. CLSI supplement VET01S[M/OL]. Clinical and Laboratory Standards Institute, 2020. [2022-06-23]. http://clsivet.org/Dashboard.aspx.
|
| [24] |
SANG K N, HAO H H, HUANG L L, et al. Pharmacokinetic-pharmacodynamic modeling of enrofloxacin against Escherichia coli in broilers[J]. Front Vet Sci, 2016, 2: 80. |
| [25] |
BLASER J, STONE B B, GRONER M C, et al. Comparative study with enoxacin and netilmicin in a pharmacodynamic model to determine importance of ratio of antibiotic peak concentration to MIC for bactericidal activity and emergence of resistance[J]. Antimicrob Agents Chemother, 1987, 31(7): 1054-1060. |
| [26] |
THOMAS J K, FORREST A, BHAVNANI S M, et al. Pharmacodynamic evaluation of factors associated with the development of bacterial resistance in acutely ill patients during therapy[J]. Antimicrob Agents Chemother, 1998, 42(3): 521-527. |
| [27] |
TOUTAIN P L, BOUSQUET-MÉLOU A, MARTINEZ M. AUC/MIC: a PK/PD index for antibiotics with a time dimension or simply a dimensionless scoring factor?[J]. J Antimicrob Chemother, 2007, 60(6): 1185-1188. |
| [28] |
BOOKER B M, SMITH P F, FORREST A, et al. Application of an in vitro infection model and simulation for reevaluation of fluoroquinolone breakpoints for Salmonella enterica serotype Typhi[J]. Antimicrob Agents Chemother, 2005, 49(5): 1775-1781. |
| [29] |
AMBROSE P G, BHAVNANI S M, RUBINO C M, et al. Pharmacokinetics-pharmacodynamics of antimicrobial therapy: it's not just for mice anymore[J]. Clin Infect Dis, 2007, 44(1): 79-86. |
| [30] |
CRAIG W A. Pharmacodynamics of antimicrobials: general concepts and applications[M]//NIGHTINGALE C H, MURAKAWA T, AMBROSE P G. Antimicrobial Pharmacodynamics in Theory and Clinical Practice. 2nd ed. Boca Raton: CRC Press, 2007: 1-20.
|
| [31] |
ANDES D, CRAIG W A. Animal model pharmacokinetics and pharmacodynamics: a critical review[J]. Int J Antimicrob Agents, 2002, 19(4): 261-268. |
(编辑 白永平)



