2. 河南农业大学农业农村部动物生化与营养重点实验室,郑州 450002;
3. 河南省动物性食品安全重点实验室,郑州 450002
2. Key Laboratory of Animal Biochemistry and Nutrition of Ministry of Agriculture and Rural Affairs, Henan Agricultural University, Zhengzhou 450002, China;
3. Henan Province Key Laboratory of Animal Food Safety, Zhengzhou 450002, China
冠状病毒(Coronavirus)属于套式病毒目(Nidovirales),冠状病毒科(Coronaviridae),冠状病毒亚科(Coronavirinae)的成员,是一种具有囊膜的单股正链RNA病毒,病毒粒子呈不规则形状,直径60~220 nm,根据基因组结构及分子系统发育树,冠状病毒可分为α、β、γ和δ 4个属。迄今为止,已确定能感染猪的冠状病毒有6种:α冠状病毒,包括猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)、传染性胃肠炎病毒(transmissible gastroenteritis virus, TGEV)、猪肠道甲型冠状病毒(swine enteric alphacoronavirus, SeACoV)和猪呼吸道冠状病毒;β冠状病毒,包括猪血凝性脑脊髓炎病毒;以及猪δ冠状病毒(porcine deltacoronavirus, PDCoV,也称猪丁型冠状病毒)。其中,TGEV、PEDV、PDCoV和SeACoV临床症状极其相似,均能引起猪腹泻病,给养猪业带来重大经济损失。
PDCoV是近年新发现的一种猪肠道致病性冠状病毒,在全球范围内持续传播,给经济和公共卫生带来了压力。2012年,PDCoV首次在中国香港猪粪便中检测到,2014年, 在美国首次暴发[9],随后, 在世界其他国家和地区也检测到PDCoV,PDCoV会导致仔猪严重腹泻、呕吐和脱水,死亡率为40%~50%。
2021年,在海地三名儿童的血浆样本中检测到了突变后的PDCoV,提示PDCoV可能存在感染人的风险[13]。目前,仍无抗PDCoV的疫苗或药物。因此,有必要筛选出有效对抗PDCoV感染的药物。
苯基吡啶酮衍生物JIB-04是一种体内、外Jumonji去甲基化酶抑制剂,而且不影响其他α-酮戊二酸依赖性羟化酶或组蛋白修饰酶。JIB-04会抑制癌细胞的生长,但不会影响正常细胞的生长。已证实,JIB-04对包括结肠癌、前列腺癌、肝癌细胞在内的多种癌细胞的增殖均有抑制作用,但抑制机制尚不清楚。此外,在患有严重扩张型心肌病的小鼠模型中,JIB-04通过抑制Jumonji去甲基化酶活性,导致心脏中的组蛋白去甲基化酶功能降低和组蛋白甲基化水平升高,从而延长小鼠生存期。目前,关于JIB-04的研究多集中在抗肿瘤领域,对于JIB-04的抗病毒报道并不多见。本研究证实了JIB-04抑制PDCoV复制的生物学功能,为抗冠状病毒药物的研发提供依据和新思路。
1 材料与方法 1.1 材料和仪器JIB-04由河南农业大学农业农村部动物生物化学与营养重点实验室根据之前文献报道的方法合成,并利用核磁共振对化合物进行表征分析,无杂峰,纯度> 95%;高糖DMEM培养液购自北京索莱宝公司;MEM培养液、青霉素-链霉素混合液(100×)、HEPES、NEAA、0.05%胰蛋白酶、胎牛血清、细胞CO2培养箱、-80 ℃超低温冰箱购自美国Thermo公司;猪源PDCoV多克隆一抗由河南省动物性食品安全重点实验室保存;anti-GAPDH、羊抗兔和羊抗猪IgG二抗均购自Proteintech公司;ECL化学发光试剂盒、CCK-8试剂盒购自碧云天生物公司;Amersham ImageQuant 800生物分子成像仪购自美国GE Amersham生物公司;Trizol、反转录试剂盒、qPCR SYBR Green Master Mix购自南京诺唯赞生物科技有限公司;无水乙醇、氯仿、异丙醇等分子试剂购自北京化工公司;荧光定量RT-PCR仪购自美国Bio-Rad公司。
1.2 病毒和细胞培养LLC-PK细胞(猪肾细胞)为本实验室保存;本研究所使用的PDCoV为HNZK-02(GenBank登录号:MH708123.1),为本实验室分离自河南周口某暴发PDCoV感染猪场的腹泻病料样品,经LLC-PK细胞连续传代,本研究所用PDCoV为第33代病毒。LLC-PK细胞用0.05%胰蛋白酶进行消化传代,用含有5%胎牛血清、1%双抗、1% HEPES、1% NEAA的MEM培养基,在37 ℃、5% CO2培养箱中培养。
1.3 细胞活力检测按照每孔约5×103个细胞接种96孔板,细胞融合度达到80%左右时,用PBS洗2遍,随后换成含不同浓度JIB-04(0、5、10、20、40、80、160、320、640 μmol·L-1)的无血清培养基,设置只含不同浓度JIB-04的无细胞空白对照组,24 h后,移除培养基,换成含10% CCK-8试剂的培养基(每孔100 μL)培养2 h,读取450 nm的吸光度,计算细胞活力和半数毒性浓度(CC50)。
半数有效浓度(EC50)的测定,分别用含不同浓度JIB-04(0、0.1、0.2、0.4、0.8、1.6、3.2、6.4、8、9.6、12.8、16 μmol·L-1)的无血清培养基作用细胞2 h,PBS洗2遍,用含不同浓度JIB-04的无血清培养基稀释病毒并接种细胞,接毒量为MOI=0.1,37 ℃孵育2 h,用PBS洗2遍,加入含不同浓度JIB-04的无血清培养基,22 h后移除培养基,换成含10% CCK-8试剂的培养基(每孔100 μL) 培养2 h,读取450 nm的吸光度,计算细胞活力、半数有效浓度(EC50)和药物选择性指数(SI=CC50/ EC50)。
1.4 JIB-04的抗病毒作用按照每孔约4×104个细胞接种12孔板,细胞融合度达到90%左右时用PBS洗2遍,按以下方式处理。JIB-04对病毒感染的预防作用:每孔加入含不同浓度JIB-04(0、5、10、20 μmol·L-1)的无血清培养基,37 ℃培养2 h,用PBS洗2遍,随后接种病毒,接毒量为MOI=0.1,37 ℃孵育2 h,用PBS洗2遍,每孔加入1 mL含胰酶的培养基,37 ℃培养22 h,收取细胞混合液。JIB-04对病毒感染的治疗作用:用含不同浓度JIB-04(0、5、10、20 μmol·L-1)的无血清培养基稀释病毒并接种细胞,接毒量为MOI=0.1,37 ℃孵育2 h,用PBS洗2遍,每孔加入1 mL含不同浓度JIB-04和胰酶的培养基,37 ℃培养22 h,收取细胞混合液。将上述细胞混合液放置-80 ℃,反复冻融3次,用于TCID50试验。
1.5 JIB-04对病毒吸附细胞的影响为了检测JIB-04对病毒吸附的影响,根据之前的研究方法,进行试验:按每孔约4×104个细胞接种12孔板,细胞融合度达到90%左右时用PBS洗2遍,加入含JIB-04(10 μmol·L-1)的无血清培养基,对照组为不含JIB-04的无血清培养基,37 ℃处理2 h,用PBS洗2遍,随后接种10 MOI的PDCoV,4 ℃孵育2 h,用PBS洗2遍,每孔加500 μL培养基,收取细胞混合液。将上述细胞混合液放置-80 ℃,反复冻融3次,用于TCID50试验。
1.6 JIB-04对病毒入侵宿主细胞的影响为了检测JIB-04对病毒入侵细胞的影响,根据之前的研究方法进行试验:按照每孔约4×104个细胞接种12孔板,细胞融合度达到90%左右时,置于4 ℃预冷1 h,用PBS洗2遍,随后接种病毒(MOI=10),4 ℃孵育2 h,用PBS洗2遍,加入含JIB-04(10 μmol·L-1)的无血清培养基,对照组为不含JIB-04的无血清培养基,37 ℃培养1 h,用PBS洗2遍,随后用柠檬酸盐缓冲液(pH 3.0)处理1 min以去除吸附在细胞表面但未入侵的病毒粒子,每孔加500 μL培养基,收取细胞混合液。将上述细胞混合液放置-80 ℃,反复冻融3次,用于TCID50试验。
1.7 JIB-04对病毒复制的影响为了检测JIB-04对病毒复制的影响,根据之前的研究方法进行试验:按照每孔约4×104个细胞接种12孔板,细胞融合度达到90%左右时用PBS洗2遍,加入含JIB-04(10 μmol·L-1)的无血清培养基,对照组为不含JIB-04的无血清培养基,培养2 h,用PBS洗2遍,随后接种病毒(MOI= 0.1),接毒后将细胞板置于37 ℃孵育2 h,用PBS洗2遍,每孔加入1 mL含胰酶的培养基,37 ℃培养4、10、22 h,收取细胞混合液。将上述细胞混合液放置-80 ℃,反复冻融3次,用于绝对荧光定量RT-PCR试验和TCID50试验。
1.8 TCID50的测定按照每孔约5×103个细胞接种96孔板,细胞融合度达到90%左右时进行TCID50试验。利用含胰酶的培养基依次将上述收取的病毒进行倍比稀释(10-1~10-10),每个稀释度设置8个重复孔,每孔加入100 μL稀释的病毒液,同时设不含病毒的阴性对照(无血清培养基)。37 ℃孵育2 h,用PBS洗2遍,每孔加入200 μL含胰酶的培养基。接种第3天后用Reed-Muench法计算TCID50。
1.9 荧光定量RT-PCR使用Trizol法提取病毒RNA,然后根据诺唯赞反转录试剂盒说明书将RNA反转录为cDNA。应用荧光定量试剂盒和特异性引物进行荧光定量RT-PCR,反应体系:2.0 μL cDNA,10.0 μL qPCR SYBR Green Master Mix,7 μL H2O,0.5 μL上、下游引物各0.5 μL。使用荧光定量RT-PCR仪进行PCR反应,反应程序为95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 15 s,40个循环。应用本实验室建立的绝对荧光定量RT-PCR方法计算细胞混合液中PDCoV RNA拷贝数。PDCoV S引物由尚亚生物公司合成,引物序列(5′→3′):PDCoV S F:CGTTAACCTCTTCTCACCACTT,PDCoV S R:GCTGAGAGTCTGGTTGGTTATT。
1.10 Western blot将含蛋白酶抑制剂的NP40裂解液加到细胞孔中,4 ℃裂解10 min,12 000 g离心5 min,取上清液用蛋白定量试剂盒定量,加入loading buffer,沸水煮8 min,-40 ℃保存。SAD-PAGE电泳后转移到硝酸纤维素(NC)膜上,5%脱脂奶粉封闭后,用一抗(PDCoV多克隆一抗或GAPDH一抗)4 ℃孵育过夜,再用HRP标记二抗(羊抗兔和羊抗猪IgG二抗)4 ℃孵育1 h,使用ECL显色液进行曝光。
1.11 统计分析以上试验均至少进行3次独立重复,使用Graphpad Prism 7软件进行数据统计分析,结果以“平均值(x)±标准差(s)”的形式表示,统计学分析采用t test和one-way ANOVA。*.P < 0.05表示差异显著;**.P < 0.01,***.P < 0.001,****.P < 0.000 1表示差异极显著。
2 结果 2.1 JIB-04的细胞毒性JIB-04的化学结构式如图 1a所示。不同浓度JIB-04处理LLC-PK细胞24 h后,细胞活力变化如图 1b所示,JIB-04在所有受试浓度下均没有改变LLC-PK细胞的活力。经Graphpad Prism 7软件对不同浓度JIB-04处理后的细胞活力进行曲线拟合并绘制药物剂量反应曲线图,如图 1c所示,JIB-04在LLC-PK细胞上CC50>640 μmol·L-1。Graphpad Prism 7软件对在病毒感染条件下不同浓度JIB-04处理后的细胞活力进行曲线拟合并绘制药物剂量反应曲线图,如图 1d所示,JIB-04抗PDCoV感染的EC50=0.216 μmol·L-1,计算得到JIB-04选择性指数>2 963。

|
a. JIB-04的化学结构式;b、c. 不同浓度JIB-04作用LLC-PK细胞24 h后细胞活力的变化;d.病毒感染后,不同浓度JIB-04作用细胞24 h细胞活力的变化 a. Chemical structural formula of JIB-04; b, c. Changes of cell viability after LLC-PK cells were treated with different concentration of JIB-04 for 24 h; d. Changes of cell viability after infected cells were treated with different concentration of JIB-04 for 24 h 图 1 JIB-04的结构式、细胞毒性和抗病毒效果 Fig. 1 Chemical structural formul, cytotoxicity and antiviral effect of JIB-04 |
在安全浓度确定后,分别选择5、10、20 μmol·L-1 JIB-04进行抗PDCoV感染研究,试验步骤模式图如图 2a所示。与未处理的PDCoV感染组相比,5、10、20 μmol·L-1 JIB-04预处理细胞组的病毒滴度无明显变化(图 2b)。与未处理的病毒感染组相比,病毒感染后应用5和10 μmol·L-1 JIB-04作用细胞(图 2b),病毒滴度极显著下降(P < 0.001),其中,未处理的病毒感染组的TCID50为8.26 lg TCID50·0.1 mL-1,5和10 μmol·L-1 JIB-04处理组的TCID50分别为6.47和6.29 lg TCID50·0.1 mL-1,当JIB-04浓度为20 μmol·L-1时,能够极显著抑制PDCoV复制(P < 0.000 1),病毒滴度降低至4.78 lg TCID50·0.1 mL-1。
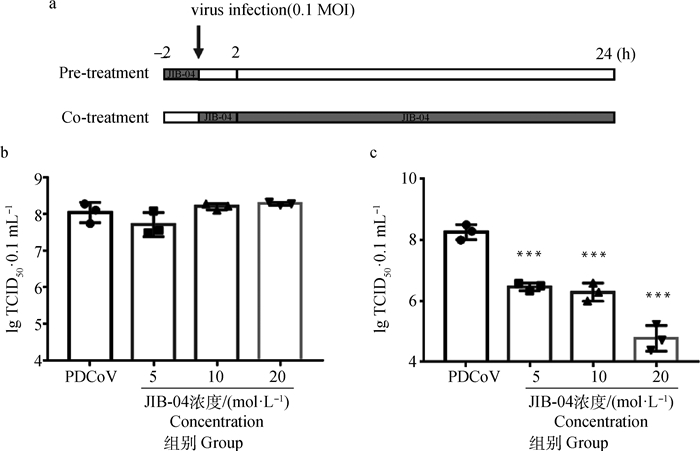
|
a. 试验步骤模式图;b. 不同浓度JIB-04预处理对PDCoV感染LLC-PK细胞的影响;c. 不同浓度JIB-04与PDCoV共处理LLC-PK细胞对病毒感染的影响。***.P < 0.001,****.P < 0.000 1 a. Diagram of experiment procedure; b. Effects of JIB-04 pre-treatment on the infection of PDCoV in LLC-PK cell; c. Effects of JIB-04 co-treatment on the infection of PDCoV in LLC-PK cell. ***. P < 0.001, ****. P < 0.000 1 图 2 JIB-04对PDCoV感染LLC-PK细胞的抑制作用 Fig. 2 Inhibitory effect of JIB-04 on the infection of PDCoV in LLC-PK cell |
鉴于JIB-04对PDCoV的复制有抑制作用,检测了其对病毒吸附和入侵阶段的影响,结果如图 3所示。TCID50的试验结果显示,与未处理的病毒感染组相比,JIB-04处理组吸附和入侵LLC-PK细胞的PDCoV滴度没有明显变化(图 3a)。

|
a. JIB-04对PDCoV吸附细胞的影响;b. JIB-04对PDCoV入侵细胞的影响 a. Anti-attachment effect of JIB-04 on PDCoV; b. Anti-penetration effect of JIB-04 on PDCoV 图 3 JIB-04对病毒吸附和入侵过程的影响 Fig. 3 Anti-attachment and anti-penetration effect of JIB-04 |
由于JIB-04对病毒的吸附和入侵过程没有影响,作者进一步检测了JIB-04对病毒复制的影响。qRT-PCR检测结果发现(图 4a),PDCoV感染LLC-PK细胞6 h后,未处理的病毒感染组和JIB-04处理组病毒基因组拷贝数分别是5.53、5.43 lg GE PDCoV·mL-1,下降20.57%;感染12 h后,各组病毒基因组拷贝数分别为7.07、6.61 lg GE PDCoV·mL-1,与未处理的病毒感染组相比,JIB-04处理组病毒基因组拷贝数极显著下降(P < 0.01),下降65.33%;感染24 h后,各组病毒基因组拷贝数分别为8.06、7.12 lg GE PDCoV·mL-1,与未处理的病毒感染组相比,JIB-04处理组病毒基因组拷贝数极显著下降(P < 0.01),下降88.52%。Western blot检测结果发现(图 4b),PDCoV感染LLC-PK细胞12和24 h后,与未处理的病毒感染组相比,JIB-04处理组PDCoV N表达量极显著降低(P < 0.0001),12 h时蛋白合成量下降85.13%,24 h时蛋白合成量下降89.07%。

|
a. JIB-04作用细胞对PDCoV感染后不同时间点病毒基因组拷贝数的影响;b. JIB-04处理对PDCoV感染后不同时间点PDCoV N蛋白表达的影响;c. JIB-04处理对PDCoV感染后不同时间点病毒滴度的影响。**.P < 0.01,***.P < 0.001,****.P < 0.000 1 a. Effects of JIB-04 on PDCoV genome copies after cells were infected with PDCoV at different hours post-infection. b. Effects of JIB-04 on PDCoV N expression after cells were infected with PDCoV at different hours post-infection. c. Effects of JIB-04 on virus titer after cells were infected with PDCoV at different hours post-infection. **. P < 0.01, ***. P < 0.001, ****. P < 0.000 1 图 4 JIB-04对病毒复制的影响 Fig. 4 Effect of JIB-04 on virus replication |
TCID50试验检测了JIB-04作用下具有感染能力的病毒数的变化,结果如图 5c所示。PDCoV感染LLC-PK细胞6 h后,未处理的病毒感染组和JIB-04处理组的TCID50分别为4.59、2.95 lg TCID50·0.1 mL-1,与未处理的病毒感染组相比,JIB-04处理组病毒滴度极显著下降(P < 0.01),下降97.71%;感染12 h后,未处理的病毒感染组和JIB-04处理组的TCID50分别为7.06、5.76 lg TCID50·0.1 mL-1,与未处理的病毒感染组相比,JIB-04处理组病毒滴度极显著下降(P < 0.001),下降94.99%;感染24 h后,未处理的病毒感染组和JIB-04处理组的TCID50分别为8.26、6.29 lg TCID50·0.1 mL-1,与未处理的病毒感染组相比,JIB-04处理组病毒滴度极显著下降(P < 0.001),下降98.93%。
3 讨论仔猪腹泻是威胁养猪业发展的重要传染性疾病,PDCoV是引起仔猪腹泻的重要病原体,迄今为止,PDCoV已在多个国家暴发。PDCoV感染仔猪后,在猪群中快速传播,病死率高,严重困扰我国养猪业的健康发展,对养猪业造成巨大的经济损失。目前,针对PDCoV仍然没有有效的疫苗或药物可用,因此急需研究可以抵抗PDCoV感染的药物,为动物疫病防治提供有效的手段,为抗击冠状病毒感染提供新的理论依据。
本试验首先对JIB-04进行了细胞毒性的检测,并计算了CC50,结果表明,JIB-04的CC50在LLC-PK细胞上>640 μmol·L-1,由于本试验前期发现JIB-04的浓度在1 280 μmol·L-1时不溶于培养基,因此未测定更高浓度药物作用下的细胞活力。据报道,Griffithsin是一种血凝素,可以抵抗PDCoV的感染,其在IPI-2I细胞上的选择性指数较高,为635.11,在ST细胞上的选择性指数为141.62,是一种潜在的可以预防和治疗PDCoV感染的候选药物。GC376是冠状病毒3C样蛋白酶(3CLpro)抑制剂,体外可以抑制PEDV的复制,该抑制剂的选择性指数>17.89。本研究结果表明,JIB-04对细胞的毒性较低,药物的选择性指数>2 963,具有进一步开发成为药物的潜力。
由于JIB-04可以有效缓解PDCoV感染对宿主细胞造成的细胞活力的下降,作者进一步用TCID50方法检测了JIB-04是否可以抑制病毒复制,结果表明,在PDCoV感染时,使用5 μmol·L-1 JIB-04即可显著地抑制病毒复制,而单独在感染前应用JIB-04处理细胞并不能明显抑制病毒复制,说明在细胞试验中,JIB-04对PDCoV的感染没有预防作用,而是在病毒感染过程中发挥作用的。病毒感染入侵细胞实现自我复制需要经过几个基本过程,即吸附、入侵、合成、组装、释放,释放出胞的病毒对周围的细胞进行下一轮感染[27]。因此,作者分析了JIB-04是否可以抑制病毒吸附或入侵从而发挥抗病毒功能,结果显示,JIB-04并没有改变吸附到细胞上或者入侵进入细胞内病毒的滴度,表明JIB-04不影响病毒吸附或入侵细胞的过程,提示JIB-04可能是通过抑制病毒复制来发挥抗病毒作用的。
进一步的研究表明,在病毒感染细胞12和24 h后,JIB-04显著降低了病毒基因组拷贝数和病毒蛋白的合成,证明其的确抑制了病毒的复制,对病毒的合成过程有抑制作用。病毒感染6 h后,JIB-04降低了44倍具有感染能力的病毒粒子数量,但却只降低了1.25倍病毒基因组拷贝数,表明在病毒生命周期中JIB-04很可能不仅在合成阶段起作用,在病毒组装阶段同样有抑制作用。本研究仅在细胞层面上证实了JIB-04的抗病毒效果,没有深入研究宿主组蛋白去甲基化在病毒感染过程中的机制。但是作者猜测,可能是病毒在感染过程中为了实现自身复制而改变了宿主组蛋白的甲基化修饰水平,改变某些宿主蛋白的翻译和转录,从而为病毒自身合成和组装提供有利的环境,这将是人们进一步研究的方向。
综上所述,JIB-04细胞毒性低,而在较低浓度时即可抑制PDCoV的复制,具有较高的药物选择性指数,本研究为JIB-04在抗冠状病毒领域的进一步研究和应用提供了理论依据。
4 结论JIB-04的细胞毒性较低,药物选择性指数较高,在体外能抵抗PDCoV感染,可以作为潜在的抗病毒药物。在PDCoV感染过程中,JIB-04通过抑制病毒核酸和蛋白质合成从而发挥抗病毒作用。
| [1] |
LU R J, ZHAO X, LI J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. Lancet, 2020, 395(10224): 565-574. DOI:10.1016/S0140-6736(20)30251-8 |
| [2] |
LI F. Structure, function, and evolution of coronavirus spike proteins[J]. Annu Rev Virol, 2016, 3: 237-261. DOI:10.1146/annurev-virology-110615-042301 |
| [3] |
WANG Q H, VLASOVA A N, KENNEY S P, et al. Emerging and re-emerging coronaviruses in pigs[J]. Curr Opin Virol, 2019, 34: 39-49. DOI:10.1016/j.coviro.2018.12.001 |
| [4] |
JUNG K, HU H, SAIF L J. Porcine deltacoronavirus infection: etiology, cell culture for virus isolation and propagation, molecular epidemiology and pathogenesis[J]. Virus Res, 2016, 226: 50-59. DOI:10.1016/j.virusres.2016.04.009 |
| [5] |
HUANG Y W, DICKERMAN A W, PIÑEYRO P, et al. Origin, evolution, and genotyping of emergent porcine epidemic diarrhea virus strains in the United States[J]. mBio, 2013, 4(5): e00737-13. |
| [6] |
HU H, JUNG K, VLASOVA A N, et al. Experimental infection of gnotobiotic pigs with the cell-culture-adapted porcine deltacoronavirus strain OH-FD22[J]. Arch Virol, 2016, 161(12): 3421-3434. DOI:10.1007/s00705-016-3056-8 |
| [7] |
ZHANG H L, HAN F F, SHU X L, et al. Co-infection of porcine epidemic diarrhoea virus and porcine deltacoronavirus enhances the disease severity in piglets[J]. Transbound Emerg Dis, 2021. DOI:10.1111/tbed.14144 |
| [8] |
WOO P C Y, LAU S K P, LAM C S F, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus Deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of Gammacoronavirus and Deltacoronavirus[J]. J Virol, 2012, 86(7): 3995-4008. DOI:10.1128/JVI.06540-11 |
| [9] |
WANG L Y, BYRUM B, ZHANG Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014[J]. Emerg Infect Dis, 2014, 20(7): 1227-1230. |
| [10] |
JUNG K, HU H, EYERLY B, et al. Pathogenicity of 2 porcine deltacoronavirus strains in gnotobiotic pigs[J]. Emerg Infect Dis, 2015, 21(4): 650-654. DOI:10.3201/eid2104.141859 |
| [11] |
CHEN Q, GAUGER P, STAFNE M, et al. Pathogenicity and pathogenesis of a United States porcine deltacoronavirus cell culture isolate in 5-day-old neonatal piglets[J]. Virology, 2015, 482: 51-59. DOI:10.1016/j.virol.2015.03.024 |
| [12] |
JIN X H, ZHANG Y F, YUAN Y X, et al. Isolation, characterization and transcriptome analysis of porcine deltacoronavirus strain HNZK-02 from Henan province, China[J]. Mol Immunol, 2021, 134: 86-99. DOI:10.1016/j.molimm.2021.03.006 |
| [13] |
LEDNICKY J A, TAGLIAMONTE M S, WHITE S K, et al. Independent infections of porcine deltacoronavirus among Haitian children[J]. Nature, 2021, 600(7887): 133-137. DOI:10.1038/s41586-021-04111-z |
| [14] |
WANG L, CHANG J J, VARGHESE D, et al. A small molecule modulates Jumonji histone demethylase activity and selectively inhibits cancer growth[J]. Nat Commun, 2013, 4: 2035. DOI:10.1038/ncomms3035 |
| [15] |
KIM M S, CHO H I, YOON H J, et al. JIB-04, a small molecule histone demethylase inhibitor, selectively targets colorectal cancer stem cells by inhibiting the Wnt/β-catenin signaling pathway[J]. Sci Rep, 2018, 8(1): 6611. DOI:10.1038/s41598-018-24903-0 |
| [16] |
ONER E, KOTMAKCI M, BAIRD A M, et al. Development of EphA2 siRNA-loaded lipid nanoparticles and combination with a small-molecule histone demethylase inhibitor in prostate cancer cells and tumor spheroids[J]. J Nanobiotechnol, 2021, 19(1): 71. DOI:10.1186/s12951-021-00781-z |
| [17] |
BAYO J, FIORE E J, DOMINGUEZ L M, et al. A comprehensive study of epigenetic alterations in hepatocellular carcinoma identifies potential therapeutic targets[J]. J Hepatol, 2019, 71(1): 78-90. DOI:10.1016/j.jhep.2019.03.007 |
| [18] |
TRAN T A, ZHANG Q J, WANG L, et al. Inhibition of Jumonji demethylases reprograms severe dilated cardiomyopathy and prolongs survival[J]. J Biol Chem, 2022, 298(2): 101515. DOI:10.1016/j.jbc.2021.101515 |
| [19] |
SON J, HUANG S M, ZENG Q R, et al. JIB-04 has broad-spectrum antiviral activity and inhibits SARS-CoV-2 replication and coronavirus pathogenesis[J]. mBio, 2022, 13(1): e0337721. DOI:10.1128/mbio.03377-21 |
| [20] |
FAN H H, QIAO L H, KANG K D, et al. Attachment and postattachment receptors important for hepatitis c virus infection and cell-to-cell transmission[J]. J Virol, 2017, 91(13): e00280-17. |
| [21] |
JIANG J Y, CUN W, WU X F, et al. Hepatitis C virus attachment mediated by apolipoprotein E binding to cell surface heparan sulfate[J]. J Virol, 2012, 86(13): 7256-7267. DOI:10.1128/JVI.07222-11 |
| [22] |
CUI X Y, WU Y H, FAN D Y, et al. Peptides P4 and P7 derived from E protein inhibit entry of dengue virus serotype 2 via interacting with β3 integrin[J]. Antiviral Res, 2018, 155: 20-27. DOI:10.1016/j.antiviral.2018.04.018 |
| [23] |
LUO Z, KUANG X P, ZHOU Q Q, et al. Inhibitory effects of baicalein against herpes simplex virus type 1[J]. Acta Pharm Sin B, 2020, 10(12): 2323-2338. DOI:10.1016/j.apsb.2020.06.008 |
| [24] |
ZHANG H L, LIANG Q Q, LI B X, et al. Prevalence, phylogenetic and evolutionary analysis of porcine deltacoronavirus in Henan province, China[J]. Prev Vet Med, 2019, 166: 8-15. DOI:10.1016/j.prevetmed.2019.02.017 |
| [25] |
TANG R F, GUO L J, FAN Q J, et al. Porcine deltacoronavirus infection is inhibited by Griffithsin in cell culture[J]. Vet Microbiol, 2022, 264: 109299. DOI:10.1016/j.vetmic.2021.109299 |
| [26] |
CHU H F, CHEN C C, MOSES D C, et al. Porcine epidemic diarrhea virus papain-like protease 2 can be noncompetitively inhibited by 6-thioguanine[J]. Antiviral Res, 2018, 158: 199-205. DOI:10.1016/j.antiviral.2018.08.011 |
| [27] |
MAGINNIS M S. Virus-receptor interactions: the key to cellular invasion[J]. J Mol Biol, 2018, 430(17): 2590-2611. DOI:10.1016/j.jmb.2018.06.024 |
(编辑 白永平)



