2. 重庆市计量质量检测研究院,重庆 401120
2. Chongqing Academy of Metrology and Quality Inspection, Chongqing 401120, China
抗生素自规模化应用以来,治愈了无数细菌性疾病,为动物与人类的健康安全发挥了举足轻重的作用[1]。但抗生素的长期滥用已导致越来越多的耐药菌株的出现,如耐药性大肠杆菌[2]、耐甲氧西林金黄色葡萄球菌(MRSA)等[3]。新型高效的抗生素替代品研究开发已成为业内的研究热点。而抗菌肽(AMPs)存在于各种生物中,是先天免疫的进化产物,相比抗生素具有广谱抗菌活性、对宿主的选择性细胞毒性和不易诱导耐药性等优势[4],且天然抗菌肽与传统抗生素作用机制不同,不易诱导病原菌产生耐药性[5]。这些优势都预示着抗菌肽在食品安全、医疗卫生和畜牧业等领域的巨大应用潜力。但目前某些天然抗菌肽仍存在杀菌的同时具有溶血性,本身具有毒性无法用于临床治疗等不足,因此针对抗菌肽的研究已从抗菌肽的发现与活性研究向作用机制以及人工改造或肽类似物开发转变[6]。
抗菌肽tachyplesin Ⅰ(TP Ⅰ)是1988年Nakamura等[7]从东方鲎血细胞分离纯化,由17个氨基酸残基(KWCFRVCYRGICYRRCR)组成的具有反向平行的β-折叠结构的抗菌肽,其具有抗细菌[8]、真菌[9]、病毒[10]、肿瘤[11]、寄生虫[12]等作用。本实验室前期在TP Ⅰ的结构基础上,利用生物信息学软件对其分子结构进行了重新设计,保持TP Ⅰ肽链长度与电荷数不变,将序列中形成TP Ⅰ两个二硫键的4个半胱氨酸用酪氨酸进行替换得到了TP Ⅰ的衍生物,一级结构为KWYFRVYYRGIYYRRYR,命名为TP Ⅰ-Y4。前期研究结果显示,TP Ⅰ-Y4相比于母肽TP Ⅰ,热稳定性更好,亲水性更强。圆二色谱检测TP Ⅰ-Y4在水相及在模拟细胞膜的疏水环境中均表现出β-折叠结构,且β-折叠含量高于相同环境中的TP Ⅰ。相比TP Ⅰ,TP Ⅰ-Y4对细菌的抑菌活性普遍提高,TP Ⅰ-Y4对大肠杆菌的最小抑菌浓度为0.125 μg·mL-1,相比于TP Ⅰ最小抑菌浓度降低了4倍,且TP Ⅰ-Y4的溶血性小,细胞毒性低,并具有很强的中和内毒素的能力。本研究以大肠杆菌为模式菌,构建脂质体作为模式膜,对比研究了抗菌肽TP Ⅰ/TP Ⅰ-Y4对细菌细胞膜的损伤机制,探讨了抗菌肽以细菌细胞膜为作用靶点的抗菌机制,为抗菌肽抑菌机理和构效关系的研究提供基础。
1 材料与方法 1.1 材料与主要试剂抗菌肽TP Ⅰ/TP Ⅰ-Y4:抗菌肽TP Ⅰ及TP Ⅰ-Y4均由江苏吉泰肽业科技有限公司采用标准Fmoc固相化学合成法进行合成,C18反相高效液相色谱纯化,再进行氨基酸分析及质谱鉴定,合成从C端到N端逐一进行,C-端酰胺化,纯度≥95%。
菌种:大肠杆菌(Escherichia coil ATCC 51459)购自于北京贝北纳创联生物技术研究院,由本课题组实验室保存。
LB培养基(g·L-1):称取酵母粉(5),蛋白胨(10),NaCl(10),溶解后调节pH(7.0),固体培养基则加入琼脂(15~20),121 ℃高压灭菌15 min。
M9培养基(g·dL-1):称取Na2HPO4·7H2O(1.28)、KH2PO4(0.3)、NaCl(0.05)、NH4Cl(0.1)、CaCl2(0.001)、乳糖(0.5)、MgSO4(0.05),121 ℃高压灭菌15 min。其中,MgSO4单独溶解灭菌后混匀,乳糖待培养基高压灭菌冷却后于无菌操作台内加入。
β-半乳糖苷酶反应缓冲液(g·dL-1):称取NaCl(0.8)、KCl(0.02)、Na2HPO4·12H2O(0.29)、KH2PO4(0.024)、MgSO4·7H2O(0.025)、β-硫基乙醇(0.39),121 ℃高压灭菌15 min。
试剂:邻硝基苯β-D-吡喃半乳糖苷(ONPG)、利福平、钙黄绿素、β-巯基乙醇购自上海罗恩试剂公司,红霉素购自上海阿拉丁生化科技股份有限公司,正十六烷购自成都市科隆化学品有限公司,钾离子、钙离子检测试剂盒购自南京建成生物工程研究所。
1.2 仪器与设备台式冷冻离心机(5804R)购自德国Eppendorf公司,全自动酶标仪(318 C+)购自上海沛欧,旋转蒸发器(RE-52A)购自上海亚荣生化,恒温培养振荡器(ZWY-2102C)购自上海智城,自动液相色谱分离层析仪(MB99-2)购自上海泸西,超声波细胞粉碎机(SCIENTZ-IID)购自宁波新芝生物,激光粒度仪(Zetasizer Nano ZS)购自马尔文公司,荧光分光光度计(F-4700)购自日本日立公司。
1.3 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌表面电位的影响参考陈飞龙[13]的方法略作修改,将培养至对数生长期的菌液5 000 r·min-1离心,无菌超纯水洗涤2~3次后,重悬至A630 nm=0.2~0.3。取500 μL菌悬液至离心管后,加入不同浓度TP Ⅰ/TP Ⅰ-Y4溶液,阴性对照为无菌超纯水。37 ℃静置孵育15 min,5 000 r·min-1离心5 min后,1 mmol·L-1的KNO3(pH6.2)溶液洗涤2~3次,KNO3溶液将其重悬稀释至A630 nm=0.1,激光粒度仪测定菌体细胞表面电位。每组样品设置3组,数据取其平均值。
1.4 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌表面疏水性的影响参照郝刚[14]的方法稍作修改。将培养至对数生长期的菌液5 000 r·min-1离心,无菌生理盐水洗涤2~3次,1 mmol·L-1的KNO3(pH6.2)重悬至A630 nm=0.2~0.3,取1 mL菌液后加入不同浓度TP Ⅰ/TP Ⅰ-Y4溶液,阴性对照为生理盐水。37 ℃静置孵育15 min,630 nm处测A0值。再取1 mL的菌液加入十六烷0.2 mL,旋涡器混匀充分,室温下静置孵育25 min,待两相完全分离后,取下层水相溶液在630 nm处测A1值。则大肠杆菌吸附率=(1-A1/A0)×100%。每组样品设置3组,数据取其平均值。
1.5 包裹钙黄绿素的脂质体的制备参照赵多艳和卫延安[15]的方法稍作修改。采用蛋黄卵磷脂和心磷脂(4∶1)进行制备,称取0.4 g磷脂加入30 mL氯仿溶解,加入10 mL 50 mmol·L-1钙黄绿素/PBS缓冲溶液,避光处理后,冰浴置于超声波细胞粉碎机,300 W间歇超声30 min,使溶液充分混合呈均一相。35 ℃减压旋转蒸发除去氯仿,待溶液至胶状时补加2~3 mL PBS溶液洗脱。形成的脂质体通过0.22 μm聚碳酸酯滤器过滤,得到大单层囊泡。再上葡聚糖凝胶G-25柱(1.6×50 cm),PBS缓冲溶液(pH7.4)进行洗脱,分离脂质体与未被包裹的钙黄绿素,收集脂质体适当浓缩后4 ℃保存。空白脂质体制备与上述方法相似,使用前适当稀释。
1.6 TP Ⅰ/TP Ⅰ-Y4引起空白脂质体膜破裂试验取96孔细胞培养板加入100 μL空白脂质体,再加入100 μL不同浓度的TP Ⅰ/TP Ⅰ-Y4溶液;阳性对照为90 μL的PBS和10 μL10% Triton X-100溶液;阴性对照为100 μL PBS溶液。混匀后室温孵育5 min,全自动酶标仪在595 nm处测量A值。每组样品设置3组,数据取其平均值。
1.7 TP Ⅰ/TP Ⅰ-Y4引起包裹钙黄绿素的脂质体的泄漏试验取包裹钙黄绿素的脂质体1.5 mL,加入1.5 mL不同浓度的TP Ⅰ/TP Ⅰ-Y4溶液,混匀,室温下孵育10 min,置于1 cm石英液池中,荧光分光光度计检测荧光强度F。设置激发波长485 nm,发射波长535 nm,光电倍增管电压400 V,狭缝2.5 nm。阳性对照为1.5 mL的PBS和30 μL的TritonX-100(10%)溶液,记录荧光强度为Ft;阴性对照为1.5 mL PBS溶液,记录荧光强度为F0。根据钙黄绿素泄漏率公式计算:泄漏率=(F-F0)/(Ft-F0)×100%。每组样品设置3组,数据取其平均值。
1.8 脂质体对TP Ⅰ/TP Ⅰ-Y4荧光光谱的影响取一定浓度TP Ⅰ/TP Ⅰ-Y4溶液1.5 mL,各加1.5 mL空白脂质体混匀后静置15 min,调节pH为9.0后置于1 cm石英液池中测量其荧光光谱,PBS缓冲液作对照试验。设定激发波长355 nm,扫描范围300~450 nm测定TP Ⅰ溶液中色氨酸的荧光光谱;激发波长305 nm,扫描范围230~350 nm测定TP Ⅰ-Y4溶液中酪氨酸的荧光光谱。光电倍增管电压400 V,狭缝1.0 nm,扫描速度240 nm·min-1。
1.9 TP Ⅰ/TP Ⅰ-Y4引起大肠杆菌胞内K+、Ca2+泄漏的测定参照钾离子、钙离子检测试剂盒说明书进行适当修改后测定。
1.10 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌外膜渗透性的影响选用疏水性的抗生素利福平和红霉素与TP Ⅰ/TP Ⅰ-Y4作用,进行对大肠杆菌的协同抑制试验。将培养至对数生长期的菌液5 000 r·min-1离心,无菌超纯水洗涤后,重悬至A630 nm=0.2左右。吸取菌液160 μL于96孔细胞培养板中,各加入20 μL的TP Ⅰ/TP Ⅰ-Y4溶液,使终浓度为1/2MIC,再加入不同浓度的利福平与红霉素溶液;阴性对照为20 μL无菌超纯水与20 μL红霉素和利福平溶液。37 ℃孵育10 h后,吸光度的减少量ΔA值用全自动酶标仪在630 nm处检测[16]。试验重复3次,数据取其平均值。
1.11 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌质膜渗透性的影响1.11.1 细胞质膜的渗透性检测 参考苏战强等[17]的方法稍作修改。将培养至对数生长期的菌液离心,无菌生理盐水洗涤2~3次后, 重悬至A630 nm=0.2~0.3。吸取2 mL加入10 mL的M9乳糖诱导培养基,37 ℃下振荡孵育8 h后, 离心洗涤,用β-半乳糖苷酶反应缓冲液重悬菌体至A630 nm= 0.2。吸取800 μL菌液于离心管中,分别加100 μL TP Ⅰ/TP Ⅰ-Y4溶液(终浓度为MIC、4MIC),再加入100 μL的ONPG(1 mg·mL-1)混匀,37 ℃孵育培养,每0.5 h测一次At值(λ=405 nm);阴性对照为100 μL β-半乳糖苷酶反应缓冲液+100 μL ONPG,测得A0值。大肠杆菌质膜渗透性增加导致的吸光度值ΔA=At-A0。
1.11.2 β-半乳糖苷酶渗透至胞外的检测 取“1.11.1”中β-半乳糖苷酶反应缓冲液重悬菌900 μL,分别加入100 μL TP Ⅰ/TP Ⅰ-Y4溶液(终浓度为MIC、2MIC)混匀,37 ℃孵育1 h后,离心取上清900 μL,加100 μL的ONPG(1 mg·mL-1)再孵育4 h,测得A值(λ=405 nm);细菌菌液加100 μL无菌水于37 ℃孵育1 h,冰浴置于超声波细胞粉碎机,300 W间歇破碎45 min后离心取上清,加入100 μL的ONPG(1 mg·mL-1)继续培养4 h,作为阳性对照测得A0值。则β-半乳糖苷酶相对活性=A/A0×100%[18]。
2 结果 2.1 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌表面特性的影响机制2.1.1 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌表面电位的影响 通过马尔文激光粒度仪检测抗菌肽对大肠杆菌细胞表面电位的影响。从表 1可知,抗菌肽TP Ⅰ/TP Ⅰ-Y4作为阳离子抗菌肽与带负电的细菌胞膜结合的第一步是依靠静电相互吸引作用,这导致了胞膜表面电负性降低,且随着肽浓度的增大电负性降低趋势越明显。与TP Ⅰ相比,TP Ⅰ-Y4引起胞膜表面电负性降低更明显。
|
|
表 1 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌表面电位的影响 Table 1 Effect of TP Ⅰ and TP Ⅰ-Y4 on the surface potential of E. coli |
2.1.2 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌表面疏水性的影响 正十六烷是一种对细菌没有损伤性的疏水性有机溶剂,大肠杆菌表面疏水性的变化可由正十六烷的吸附率直接体现。由表 2可知,相比于对照组,两种抗菌肽作用后,大肠杆菌的正十六烷吸附率明显升高,即细菌表面疏水性提高,且随浓度梯度的增加吸附率逐渐增大,细菌的表面疏水性在2MIC时较对照组提高了5倍左右。抗菌肽TP Ⅰ-Y4引起的吸附率增加较TP Ⅰ稍强。TP Ⅰ和TP Ⅰ-Y4作为两亲性阳离子抗菌肽,与大肠杆菌胞膜结合过程中带正电荷氨基酸结合细胞膜,而疏水性氨基酸暴露在细菌表面,进而使细菌表面疏水性提高。
|
|
表 2 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌表面疏水性的影响 Table 2 Effect of TP Ⅰ and TP Ⅰ-Y4 on the surface hydrophobicity of E. coli |
2.2.1 TP Ⅰ/TP Ⅰ-Y4对脂质体膜破坏的影响 以卵磷脂和心磷脂(4∶1)构建脂质体模拟细胞膜,考察抗菌肽TP Ⅰ和TP Ⅰ-Y4对脂质体膜的破坏作用。由图 1可看出,阳性对照Triton X-100作为乳化剂可快速溶解脂质体。相比于阴性对照PBS,TP Ⅰ未明显引起脂质体膜破裂,而TP Ⅰ-Y4能引起部分脂质体膜破坏,随肽浓度的升高对膜的破坏效果增加,但与阳性对照相比,脂质体膜并没有完全崩塌。
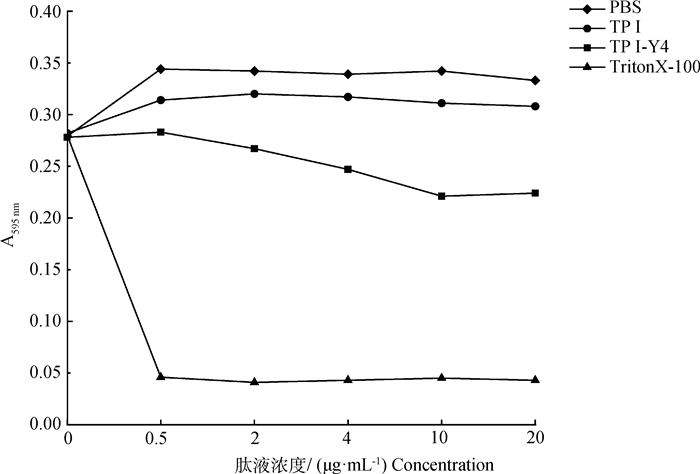
|
图 1 TP Ⅰ/TP Ⅰ-Y4对脂质体膜的破裂 Fig. 1 Rupture of liposome membrane by TP Ⅰ/TP Ⅰ-Y4 |
2.2.2 TP Ⅰ/TP Ⅰ-Y4对包裹钙黄绿素的脂质体的影响 通过抗菌肽TP Ⅰ/TP Ⅰ-Y4引起脂质体包裹的钙黄绿素的泄漏率来进一步评价肽对膜的作用。从图 2可看出,两种抗菌肽均能使钙黄绿素从脂质体中泄漏出来,且是浓度依赖性。相同浓度下,TP Ⅰ-Y4引起的钙黄绿素泄漏率远远大过TP Ⅰ,浓度为0.5 μg·mL-1时泄漏率就与20.0 μg·mL-1的TP Ⅰ相当,这说明TP Ⅰ-Y4能对磷脂双分子层造成很大的破坏。这种结果也与前面脂质体膜破裂结论相印证,两种肽在与脂质体膜结合后,插入脂质双分子层中使膜结构紊乱、破坏,导致内容物外泄。衍生肽TP Ⅰ-Y4对膜的破坏程度大于TP Ⅰ,这可能也是TP Ⅰ-Y4的抑菌活性强于TP Ⅰ的原因。
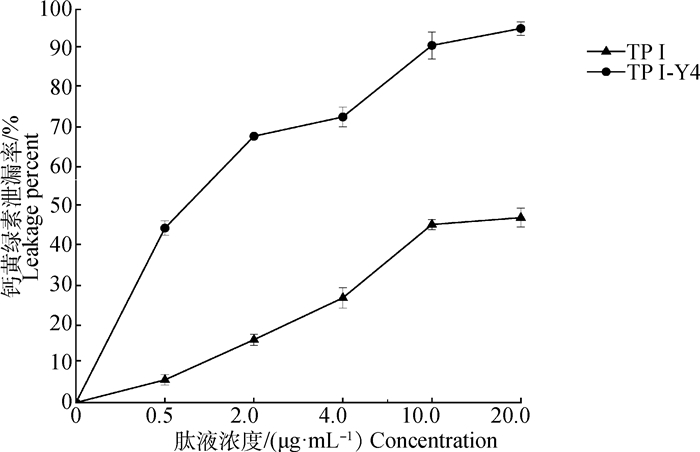
|
图 2 TP Ⅰ/TP Ⅰ-Y4引起脂质体包裹的荧光染料泄漏率 Fig. 2 Percentage leakage of liposome encapsulated fluorescent dyes induced by TP Ⅰ/TP Ⅰ-Y4 |
2.2.3 脂质体对TP Ⅰ/TP Ⅰ-Y4荧光光谱的影响 蛋白质分子在亲水环境中的荧光波长比它在疏水环境中的长。即溶剂疏水性提高,荧光光谱会蓝移,同时,伴随荧光强度增大。蛋白质处于水相环境中,若λmax蓝移或荧光强度增大,则荧光基团必处于疏水环境。抗菌肽TP Ⅰ序列N端处含有1个Trp2,而TP Ⅰ-Y4序列中分散着6个Tyr3, 7, 8, 12, 13, 16,两者都具有自身荧光光谱,可通过TP Ⅰ/TP Ⅰ-Y4作用于脂质体后的荧光光谱的变化来探究肽与膜的作用机制,结果如图 3所示。TP Ⅰ在354 nm处出现峰值,作用脂质体后荧光强度由8.63到737.8,增加了85倍;TP Ⅰ-Y4在304 nm出现峰值,作用脂质体后荧光强度由4.341~206.3,增加了47倍。虽然两者作用脂质体后最大荧光强度波长未发生明显蓝移,但荧光强度增大明显,表明两个肽皆能将自身荧光特性残基插入疏水的脂质双分子层中。色氨酸位于TP Ⅰ序列的N端第2个残基处,可推测TP Ⅰ的N端与脂质体结合插入到磷脂双分子层中。而TP Ⅰ-Y4中的6个酪氨酸分散在序列各个位置,且均比色氨酸位置靠后,推测TP Ⅰ-Y4至少是β-折叠结构的头部甚至整个分子插入脂质体的磷脂双分子层中,引起荧光强度的改变。结合溶液pH>8.5时色氨酸与酪氨酸的自身荧光强度之比是100∶9[19]分析,TP Ⅰ-Y4与脂质体的结合能力相对较TP Ⅰ强一些。

|
图 3 TP Ⅰ/TP Ⅰ-Y4作用脂质体后的荧光光谱图 Fig. 3 Fluorescence spectra of TP Ⅰ/TP Ⅰ-Y4 acting liposomes |
2.3.1 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌胞内离子泄漏的影响 抗菌肽TP Ⅰ/TP Ⅰ-Y4造成大肠杆菌胞内Ca2+和K+泄漏的结果如图 4所示。结果表明,两种肽都能引起胞内Ca2+和K+的泄漏,当抗菌肽TP Ⅰ和TP Ⅰ-Y4的浓度为MIC时,Ca2+泄漏率达到38.75%、52.19%,K+泄漏率达到65.84%、73.12%,且随着浓度的增大泄漏率逐渐增大。TP Ⅰ-Y4引起Ca2+和K+的泄漏率始终强于TP Ⅰ。这种结果说明了两种肽作用大肠杆菌后破坏了胞膜的通透性,导致胞内离子泄漏,细胞失去平衡最终导致死亡,TP Ⅰ-Y4对膜的破坏程度更大,抑菌活性更强。
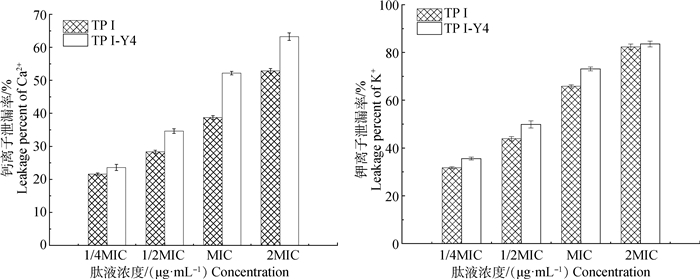
|
图 4 TP Ⅰ/TP Ⅰ-Y4诱导大肠杆菌胞内Ca2+和K+的泄漏率 Fig. 4 Percentage leakage of intracellular Ca2+ and K+ in E.coli by TP Ⅰ/TP Ⅰ-Y4 |
2.3.2 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌外膜渗透性的影响 通过抗生素利福平和红霉素这两种疏水性物质的协同抑菌试验来探究抗菌肽渗透革兰阴性菌细胞外膜的能力[20]。这两种抗生素不能有效穿透完整的革兰阴性菌的外膜,但能穿过被损坏或有缺陷的菌株外膜[21],因此可作为检测TP Ⅰ/TP Ⅰ-Y4诱导的外膜渗透性增加的探针。由图 5可以看出,抗菌肽TP Ⅰ/TP Ⅰ-Y4分别与利福平、红霉素协同作用后的吸光度变化值均高于两种抗生素单独作用的吸光度变化值。表明抗菌肽TP Ⅰ/TP Ⅰ-Y4与利福平、红霉素具有明显的协同作用,大肠杆菌对任何浓度的抗生素都表现的更加敏感。抗菌肽TP Ⅰ/TP Ⅰ-Y4均能提高大肠杆菌的外膜渗透性,TP Ⅰ协同红霉素及利福平诱导的外膜渗透性要比TP Ⅰ-Y4更加明显,可能是TP Ⅰ/TP Ⅰ-Y4的自身结构差异,与红霉素、利福平的协同抑菌方式不同所致。以上结果说明,抗菌肽TP Ⅰ/TP Ⅰ-Y4均能破坏大肠杆菌细胞外膜结构,诱使其膜渗透性增加,进而使大肠杆菌细胞形态发生变化,受到损伤,甚至死亡。

|
图 5 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌细胞外膜渗透性的影响 Fig. 5 Effect of TP Ⅰ/TP Ⅰ-Y4 on the permeability of outer membrane of E.coli |
2.3.3.1 细胞质膜的渗透性检测 为进一步探究抗菌肽TP Ⅰ/TP Ⅰ-Y4对大肠杆菌胞膜的作用机制,通过β-半乳糖苷酶活性探究两个肽对细菌质膜的渗透性。β-半乳糖苷酶存在于细菌胞内,可水解ONPG产生半乳糖和黄色的邻硝基苯酚(ONP)[22]。当细菌质膜渗透性增加,小分子ONPG渗透入细菌胞内与β-半乳糖苷酶发生反应,因此可测定其水解产物ONP的浓度来反映细胞质膜的渗透性。如图 6所示,两种抗菌肽仅仅作用30 min时,能扰动大肠杆菌内膜导致渗透性增加,大量ONPG流入胞内。TP Ⅰ-Y4扰动质膜引起ONPG渗入胞内的能力高于TP Ⅰ。两个肽的浓度为MIC、4MIC时渗透性变化不明显,浓度为MIC时已能扰动膜导致细菌质膜渗透性提高。这也与前期脂质体-钙黄绿素泄漏、胞内离子泄漏试验结果相印证。
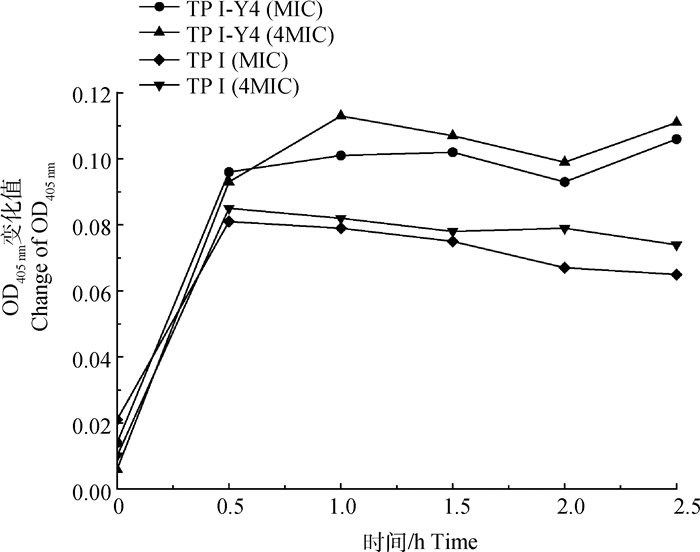
|
图 6 TP Ⅰ/TP Ⅰ-Y4对大肠杆菌细胞质膜的渗透性检测 Fig. 6 Detection of membrane permeability of E.coli by TP Ⅰ/TP Ⅰ-Y4 |
2.3.3.2 β-半乳糖苷酶渗透至胞外的检测 为考察抗菌肽TP Ⅰ/TP Ⅰ-Y4作用后β-半乳糖苷酶作为大分子细菌内源酶是否泄漏至胞外,取经抗菌肽处理后的细菌上清液检测β-半乳糖苷酶的相对活性。如表 3所示,两种抗菌肽皆导致β-半乳糖苷酶渗透至胞外。肽液浓度为MIC时,上清液中β-半乳糖苷酶的相对活性为45.77%和52.21%,且随浓度增加略有升高。TP Ⅰ和TP Ⅰ-Y4均表现出很强的细胞质膜破坏能力,导致胞内大分子内容物泄漏,TP Ⅰ-Y4对质膜的破坏能力较强。
|
|
表 3 β-半乳糖苷酶渗透至胞外的检测 Table 3 Permeability of extracellular β-galactosidase detection |
抗菌肽对微生物的抑制作用可通过多种方式实现,目前研究发现,大多数抗菌肽通过细胞质膜去极化,诱导磷脂不规则分布,抑制重要代谢产物的合成而达到杀菌目的[23]。而研究最多的是抗菌肽针对细胞膜的作用机制[24],即破坏细胞膜的完整性,增加细胞膜的通透性[25]。作者前期在抗菌肽TP Ⅰ的结构基础上,用4个芳香族氨基酸酪氨酸替换4个构成二硫键的半胱氨酸,重新设计了一种不含二硫键的衍生肽TP Ⅰ-Y4[26]。研究发现,相比于母肽TP Ⅰ,TP Ⅰ-Y4的抑菌活性和内毒素中和活性更强,溶血活性降低。细胞膜作为细菌的保护屏障,在受损时会导致其通透性改变而影响细菌细胞的新陈代谢[27]。本研究通过探究抗菌肽TP Ⅰ和TP Ⅰ-Y4作用大肠杆菌后对表面特性、离子泄漏和膜渗透性的影响以及与脂质体膜的作用,对比研究了两个肽对大肠杆菌细胞膜的作用机制。
膜电位监测和表面疏水性结果显示,两个肽通过与菌体表面带负电的基团如脂多糖以静电相互吸引作用结合膜,导致细菌表面电负性降低、疏水性增强,TP Ⅰ-Y4引起细菌表面电负性降低与疏水性增强要优于TP Ⅰ,这说明细菌表面能吸附更多的TP Ⅰ-Y4分子。与细菌表面结合是抗菌肽实施抗菌活性的第一步,肽最终起到扰动膜结构、破坏细胞壁膜的作用,这也与冯建岭[16]的研究结果相一致。肽与脂质体作用结果发现,TP Ⅰ-Y4引起钙黄绿素的泄漏率大于TP Ⅰ,推测TP Ⅰ仅仅是扰动了脂质体膜,而TP Ⅰ-Y4能引起部分脂质体膜破裂,但膜并不完全崩塌;Doherty等[28]通过NMR技术研究tachyplesin Ⅰ线性类似物肽与细胞脂膜的相互作用表明,天然鲎素和线性衍生肽对细胞膜的作用机理存在不同。荧光光谱也显示,两种肽均能将自身荧光特性氨基酸插入磷脂双分子层中,使膜结构紊乱,TP Ⅰ-Y4结合插入脂质体的能力强于TP Ⅰ。利福平和红霉素协同试验显示两种肽均能降低G-菌细胞外膜表面的选择渗透性功能,离子泄漏试验表明,TP Ⅰ-Y4随浓度增大引起的Ca2+和K+的泄漏率比TP Ⅰ大,这与脂质体试验结果一致。β-半乳糖苷酶渗透性试验表明, 两个肽浓度在MIC时就能引起内膜渗透性增大,导致胞内大分子内容物泄漏,设计肽TP Ⅰ-Y4对细胞膜的破坏程度更大。通过脂质体包裹荧光素、离子泄漏及细胞膜渗透性试验,证实了TP Ⅰ和TP Ⅰ-Y4对大肠杆菌内、外膜都具有很强的破坏能力,导致离子及胞内大分子内容物泄漏而使细胞死亡。这与相关研究发现TP Ⅰ通过阳离子性、两亲性与胞膜上脂多糖结合,改变膜的通透性形成穿膜孔道,引起胞内物质流出使细胞死亡的结果一致[29-31]。
相比母肽TP Ⅰ,Tyr的取代使得衍生肽TP Ⅰ-Y4亲水性更强、β-折叠含量更高,同时缺少了二硫键的束缚导致分子更加柔韧、伸展,这些结构上的因素导致更多的TP Ⅰ-Y4分子结合大肠杆菌细胞表面,在插入、穿透细胞外、内膜的过程中,对膜的扰动、破坏程度更大,导致离子及细胞内容物的泄漏程度更大。这也解释了为什么相比TP Ⅰ,TP Ⅰ-Y4对大肠杆菌的抑菌活性更强,杀菌速度更快。
4 结论本研究以抗菌肽TP Ⅰ及其衍生肽TP Ⅰ-Y4作用大肠杆菌细胞膜的抑菌机理进行对比研究。结果表明,TP Ⅰ/TP Ⅰ-Y4均能结合细胞膜引起膜表面电位升高,疏水性增强等特性变化;TP Ⅰ/TP Ⅰ-Y4均能插入磷脂双分子层扰动脂质体膜引起荧光素的泄漏;TP Ⅰ/TP Ⅰ-Y4均能诱导细胞内、外膜通透性增加,引起胞内离子以及大分子物质的泄漏。相比之下,衍生肽TP Ⅰ-Y4能更强地结合细胞膜,对膜的表面特性影响更大,膜的扰动、破坏程度更强,促使膜渗透性增加导致离子及大分子的泄漏更突出。作为β-折叠型抗菌肽的典型代表,tachyplesin I及其衍生物在活性、结构与膜作用机制之间的构效关系,有待进一步探索研究。
| [1] |
BROWN E D, WRIGHT G D. Antibacterial drug discovery in the resistance era[J]. Nature, 2016, 529(7586): 336-343. DOI:10.1038/nature17042 |
| [2] |
RAO L L, LV L C, ZENG Z L, et al. Increasing prevalence of extended-spectrum cephalosporin-resistant Escherichia coli in food animals and the diversity of CTX-M genotypes during 2003-2012[J]. Vet Microbiol, 2014, 172(3-4): 534-541. DOI:10.1016/j.vetmic.2014.06.013 |
| [3] |
DA SILVA A C, RODRIGUES M X, SILVA N C C. Methicillin-resistant Staphylococcus aureus in food and the prevalence in Brazil: a review[J]. Braz J Microbiol, 2020, 51(1): 347-356. DOI:10.1007/s42770-019-00168-1 |
| [4] |
DA COSTA J P, COVA M, FERREIRA R, et al. Antimicrobial peptides: an alternative for innovative medicines?[J]. Appl Microbiol Biotechnol, 2015, 99(5): 2023-2040. DOI:10.1007/s00253-015-6375-x |
| [5] |
刘志新, 沈腾飞, 蔡开蕊, 等. 猪源抗菌肽PMAP-23的改造及其活性测定[J]. 中国预防兽医学报, 2020, 42(8): 809-815. LIU Z X, SHEN T F, CAI K R, et al. Molecular design and antibacterial activity of antimicrobial peptide PMAP-23[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(8): 809-815. (in Chinese) |
| [6] |
CHOU S L, SHAO C X, WANG J J, et al. Short, multiple-stranded β-hairpin peptides have antimicrobial potency with high selectivity and salt resistance[J]. Acta Biomater, 2016, 30: 78-93. DOI:10.1016/j.actbio.2015.11.002 |
| [7] |
NAKAMURA T, FURUNAKA H, MIYATA T, et al. Tachyplesin, a class of antimicrobial peptide from the hemocytes of the horseshoe crab (Tachypleus tridentatus)[J]. J Biol Chem, 1988, 263(32): 16709-16713. DOI:10.1016/S0021-9258(18)37448-9 |
| [8] |
李寒梅, 唐勇军, 王顺启, 等. 抗菌肽鲎素的研究进展[J]. 生命科学研究, 2018, 22(4): 338-344. LI H M, TANG Y J, WANG S Q, et al. Research progresses on antimicrobial peptide tachyplesins[J]. Life Science Research, 2018, 22(4): 338-344. (in Chinese) |
| [9] |
YU R L, WANG J Y, SO L Y, et al. Enhanced activity against multidrug-resistant bacteria through coapplication of an analogue of tachyplesin I and an inhibitor of the QseC/B signaling pathway[J]. J Med Chem, 2020, 63(7): 3475-3484. DOI:10.1021/acs.jmedchem.9b01563 |
| [10] |
DING H, JIN G, ZHANG L J, et al. Effects of tachyplesin I on human U251 glioma stem cells[J]. Mol Med Rep, 2015, 11(4): 2953-2958. DOI:10.3892/mmr.2014.3021 |
| [11] |
MORVAN A, IWANAGA S, COMPS M, et al. In vitro activity of the limulus antimicrobial peptide tachyplesin I on marine bivalve pathogens[J]. J Invertebr Pathol, 1997, 69(2): 177-182. DOI:10.1006/jipa.1996.4642 |
| [12] |
LI H M, LIU B, WU J, et al. The inhibitory effect of tachyplesin I on thrombosis and its mechanisms[J]. Chem Biol Drug Design, 2019, 94(3): 1672-1679. DOI:10.1111/cbdd.13570 |
| [13] |
陈飞龙. Lactobacillus paracasei FX-6产抗菌肽对金黄色葡萄球菌作用机制及其应用研究[D]. 广州: 华南农业大学, 2016. CHEN F L. The action mechanism on Staphylococcus aureus and application of antimicrobial peptide produced by Lactobacillus paracasei FX-6[D]. Guangzhou: South China Agricultural University, 2016. (in Chinese) |
| [14] |
郝刚. BuforinⅡ抗菌肽的分子设计及对DNA作用抑菌机理研究[D]. 无锡: 江南大学, 2009. HAO G. Studies on the molecular design and antimicrobial mechanism of DNA action of antimicrobial peptide BuforinⅡ[D]. Wuxi: Jiangnan University, 2009. (in Chinese) |
| [15] |
赵多艳, 卫延安. 改性大豆磷脂在脂质体制备中的应用研究[J]. 中国油脂, 2017, 42(12): 149-153. ZHAO D Y, WEI Y A. Application of modified soybean phospholipid in preparation of liposomes[J]. China Oils and Fats, 2017, 42(12): 149-153. DOI:10.3969/j.issn.1003-7969.2017.12.038 (in Chinese) |
| [16] |
冯建岭. ε-聚赖氨酸的防腐效果及对大肠杆菌抑制机理的研究[D]. 济南: 齐鲁工业大学, 2014. FENG J L. Preservative effect of ε-polylysine and its antibacterial mechanism against Escherichia coli[D]. Ji'nan: Qilu University of Technology, 2014. (in Chinese) |
| [17] |
苏战强, 陈阳, 夏利宁, 等. 乳糖诱导大肠杆菌β-D-半乳糖苷酶试验[J]. 中国兽医杂志, 2016, 52(9): 24-27. SU Z Q, CHEN Y, XIA L N, et al. Lactose-induced β-D-galactosidase test of Escherichia coli[J]. Chinese Journal of Veterinary Medicine, 2016, 52(9): 24-27. DOI:10.3969/j.issn.0529-6005.2016.09.008 (in Chinese) |
| [18] |
FU J Y, YANG H, WANG H L, et al. [ARTICLE WITHDRAWN] Antimicrobial peptide bsn-37 inhibits the growth of Escherichia coli by targeting its cell wall and membrane[J]. Mater Express, 2020, 10(8): 1260-1264. DOI:10.1166/mex.2020.1773 |
| [19] |
夏锦尧. 实用荧光分析法[M]. 北京: 中国人民公安大学出版社, 1992: 442. XIA J Y. Practical fluorescence analysis[M]. Beijing: China People's Public Security University Press, 1992: 442. (in Chinese) |
| [20] |
侯温甫, 欧阳何一, 吴忌, 等. 曲酸对冷鲜鸭肉中优势腐败菌的抑制作用及其抑菌机理[J]. 食品科学, 2019, 40(1): 278-285. HOU W F, OUYANG H Y, WU J, et al. Inhibitory effect of kojic acid on dominant spoilage bacteria in chilled duck meat and its mechanism[J]. Food Science, 2019, 40(1): 278-285. (in Chinese) |
| [21] |
SITOHY M Z, MAHGOUB S A, OSMAN A O. In vitro and in situ antimicrobial action and mechanism of glycinin and its basic subunit[J]. Int J Food Microbiol, 2012, 154(1-2): 19-29. DOI:10.1016/j.ijfoodmicro.2011.12.004 |
| [22] |
EPAND R F, POLLARD J E, WRIGHT J O, et al. Depolarization, bacterial membrane composition, and the antimicrobial action of ceragenins[J]. Antimicrob Agents Chemother, 2010, 54(9): 3708-3713. DOI:10.1128/AAC.00380-10 |
| [23] |
王家俊. 非完美两亲性α螺旋肽的构效关系及其抗酶解活性的研究[D]. 哈尔滨: 东北农业大学, 2019. WANG J J. Studies on structure-function relationship and protease-resistant activity of imperfectly amphiphilic α-helical peptides[D]. Harbin: Northeast Agricultural University, 2019. (in Chinese) |
| [24] |
王青, 徐彦召, 杨磊, 等. 一种广谱、低毒的抗菌肽类似物HJH-3的生物学活性和膜活性的测定[J]. 中国预防兽医学报, 2019, 41(8): 800-806. WANG Q, XU Y Z, YANG L, et al. Determination of bioactivity and membrane activity of bovine antimicrobial peptide HJH-3[J]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(8): 800-806. (in Chinese) |
| [25] |
DONG Z, LUO W J, ZHONG H R, et al. Molecular cloning and characterization of antimicrobial peptides from skin of Hylarana guentheri[J]. Acta Biochim Biophys Sin (Shanghai), 2017, 49(5): 450-457. DOI:10.1093/abbs/gmx023 |
| [26] |
孙栋, 蔡寅川, 蒋思雨, 等. 抗菌肽Tachyplesin Ⅰ的分子设计、结构与活性分析[J]. 畜牧兽医学报, 2022, 53(6): 1905-1913. SUN D, CAI Y C, JIANG S Y, et al. Molecular design, structure and activity analysis of antimicrobial peptide tachyplesin Ⅰ[J]. Acta Veterinaria et Zootechnica Sinica,, 2022, 53(6): 1905-1913. (in Chinese) |
| [27] |
连凯琪, 周玲玲, 张元臣, 等. 新型黏虫抗菌肽AAP-1对大肠杆菌的抗菌作用[J]. 中国畜牧兽医, 2020, 47(11): 3626-3632. LIAN K Q, ZHOU L L, ZHANG Y C, et al. Antibacterial effect of novel armyworm antimicrobial peptide (AAP-1) against Escherichia coli[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(11): 3626-3632. (in Chinese) |
| [28] |
DOHERTY T, WARING A J, HONG M. Peptide-lipid interactions of the β-hairpin antimicrobial peptide tachyplesin and its linear derivatives from solid-state NMR[J]. Biochim Biophys Acta, 2006, 1758(9): 1285-1291. |
| [29] |
KUSHIBIKI T, KAMIYA M, AIZAWA T, et al. Interaction between tachyplesin I, an antimicrobial peptide derived from horseshoe crab, and lipopolysaccharide[J]. Biochim Biophys Acta (BBA)-Proteins Proteomics, 2014, 1844(3): 527-534. |
| [30] |
HONG J, GUAN W T, JIN G, et al. Mechanism of tachyplesin Ⅰ injury to bacterial membranes and intracellular enzymes, determined by laser confocal scanning microscopy and flow cytometry[J]. Microbiol Res, 2015, 170: 69-77. |
| [31] |
谢海伟, 杨贤松, 柯春林, 等. 化学合成抗菌肽抑制致病性大肠杆菌F41的分子作用机理[J]. 现代食品科技, 2016, 32(1): 44-51. XIE H W, YANG X S, KE C L, et al. Molecular mechanisms of novel synthetic analogs of tachyplesin against pathogenic Escherichia coli F41[J]. Modern Food Science and Technology, 2016, 32(1): 44-51. (in Chinese) |
(编辑 白永平)



