2. 东北农业大学动物医学学院,哈尔滨 150030
2. College of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, China
鸡毒支原体(Mycoplasma gallisepticum,MG)是养鸡场中最为常见的呼吸道病原体之一[1-3]。鸡单纯感染MG后死亡率较低,但会显著降低鸡的生产性能,例如肉鸡增重减缓、蛋鸡产蛋率下降及雏鸡弱雏率增高,这会给养殖户造成比较大的经济损失[4]。此外,MG感染还会造成免疫抑制,这会给其他病原体(例如流感病毒、大肠杆菌等)以可乘之机,一旦发生混合感染或者继发感染,鸡群死亡率会显著提高,进一步加大养殖户的经济损失[5-7]。从成本方面考虑,目前,养殖户主要是使用四环素类或大环内酯类抗生素预防和控制MG感染,但随着抗生素耐药问题的日益严重,使得家禽生产过程中抗生素的使用受到限制[8]。因此,有必要开发抗生素替代的预防和控制MG感染方法以满足生产需要。本课题组前期从健康鸡肠道内分离鉴定了1株唾液乳杆菌(Lactobacillus salivarius),并证实这株唾液乳杆菌具有促进肉鸡生长、抗应激、提高抗病力及改善共生菌群组成等多种益生性能[9-10]。但是该株唾液乳杆菌是否可以缓解MG感染所致肉鸡生长性能下降及肺损伤还未可知,因此,本研究在基础饲料中添加不同剂量该株唾液乳杆菌,通过分析各组鸡的体重、饲料转化率、肺部MG定植量、肺部病理损伤、肺部炎性损伤相关蛋白表达量及促炎性细胞因子含量来评价唾液乳杆菌缓解MG感染所致肉鸡生产性能下降及肺损伤效果,以期为肉鸡预防MG感染提供思路。
1 材料与方法 1.1 试验动物240只1日龄健康AA肉鸡购自哈尔滨光大养鸡场(经MG血清学检测为阴性),饲养于经甲醛熏蒸消毒的动物房内,自由采食和饮水。全部AA肉鸡使用2层的层叠式鸡笼进行笼养(100 cm×80 cm× 50 cm),每笼10只鸡。动物房内第1周温度设置为32 ℃±2 ℃,然后逐渐降至25 ℃±2 ℃。
1.2 MG及唾液乳杆菌培养MGR株由中国农业科学院哈尔滨兽医研究所辛九庆研究员馈赠,将MGR株冻干粉置于支原体完全培养基,复苏1次后,将MG培养至1×109CCU·mL-1;唾液乳杆菌由本课题组分离鉴定并保存(GenBank登录号:MT378407),将唾液乳杆菌冻干粉置于MRS培养基,复苏1次后,将唾液乳杆菌按照108 CFU·kg-1、109 CFU·kg-1添加至基础饲料中。支原体完全培养基组分为支原体无血清培养基80 mL(上海源培生物科技股份有限公司),无菌胎牛血清20 mL(美国Gibco公司),尼克酰胺二嘌呤核苷酸100 μL(北京索莱宝生物科技有限公司),青霉素溶液100 μL(大连美仑生物技术有限公司)。MRS培养基购自青岛海博生物。
1.3 试验设计将体重相近、健康状态良好的240只1日龄AA肉鸡随机分为6组,每组4个重复,每个重复10只鸡,包括对照组(Con)、低剂量唾液乳杆菌组(L)、高剂量唾液乳杆菌组(H)、MG感染组(MG)、MG感染+低剂量唾液乳杆菌组(MG+L)和MG感染+高剂量唾液乳杆菌组(MG+H)。Con组、MG组饲喂基础饲料,L组、MG+L组饲喂添加108 CFU · kg-1唾液乳杆菌的基础饲料,H组、MG+ H组饲喂添加109 CFU·kg-1唾液乳杆菌的基础饲料,7日龄时给与MG组、MG+L组和MG+H组进行气囊注射2×108CCU MG[11],饲养42 d后记录鸡的体重、饲料消耗情况,脱颈处死后,收集肺组织,用于组织病理学检测、炎性损伤相关蛋白表达及促炎性因子含量检测。
1.4 测定指标及方法1.4.1 生长性能 在1日龄和42日龄时准确记录各只鸡体重。饲养期间,准确记录饲料消耗情况,饲料转化率计算公式:饲料总消耗量/(42日龄体重-1日龄体重)。
1.4.2 肺部MG定植量检测 MG体外分离培养困难,不利于开展定量研究。因此,本试验采用前期已经建立的基于MG特异性基因mgc2单拷贝质粒qPCR检测方法进行肺部MG定植量检测[12]。具体方法:首先严格按照细菌基因组提取试剂盒[购自天根生化科技(北京)有限公司]操作说明提取MG基因组,通过引物(F: 5′-TTGGGTTTAGGGATTGGGATT -3′; R: 5′-CCAAGGGATTCAACCATCTT -3′) 进行PCR特异性扩增,反应体系为10×PCR buffer 5 μL,正反引物各1 μmol·L-1,DNA模板0.1 μg,Taq DNA聚合酶0.25 μL,补加水至50 μL。反应条件: 95 ℃ 2 min;95 ℃ 15 s,57 ℃ 30 s,72 ℃ 35 s,38个循环。将mgc2单拷贝质粒10倍梯度稀释作为模板进行上述PCR反应建立标准曲线,mgc2基因拷贝数=DNA质量浓度/DNA分子量;DNA分子量=DNA碱基×324.5;DNA质量浓度=260 nm吸收值×50 μg·mL-1×稀释倍数×6.02×1023。使用上述公式计算mgc2基因拷贝数来判断MG肺部定植情况。
1.4.3 肺部组织病理学检测 脱颈处死鸡后,迅速收集各组新鲜肺组织。生理盐水冲洗肺组织,尽可能去除血污。将肺组织修剪成适宜大小的组织块,室温固定于10%中性福尔马林溶液中。将固定好的肺组织经流水冲洗过夜、梯度酒精脱水、二甲苯透明、石蜡包埋后进行切片,切片厚度为4 μm。石蜡切片经过二甲苯透明、梯度酒精脱水、蒸馏水脱蜡水化后进行苏木精-伊红染色(hematoxylin-eosin staining,HE),染色后的切片经无水乙醇脱水、二甲苯透明后使用中性树脂封片,在光学显微镜下观察肺组织病理变化。
1.4.4 肺部炎性损伤相关蛋白表达检测 通过Western blot法检测肺组织炎性损伤相关蛋白表达。准确称量20 mg肺组织置于EP管中,加入250 μL含1 mmol·L-1PMSF的RIPA裂解液(武汉博士德生物工程有限公司)后充分匀浆,充分裂解后,12 000 r·min-1离心5 min后收集上清。提取的蛋白经高温变性后进行SDS-PAGE、转膜、封闭、孵育一抗、洗膜、孵育二抗、洗膜后,使用超敏ECL化学发光试剂(武汉博士德生物工程有限公司)在高灵敏化学荧光成像仪(美国Bio-Rad公司)下观察图像,并进行分析。一抗(TLR2、p-p65、p65、β-actin)购自北京博奥森生物技术有限公司,一抗(HMGB1、NLRP3、Caspase-1)购自武汉艾博泰克生物科技有限公司,二抗(辣根过氧化物酶标记山羊抗兔IgG)购自武汉博士德生物工程有限公司。
1.4.5 肺部促炎性细胞因子含量检测 ELISA法检测肺组织中促炎性细胞因子(TNF-α、IL-1β、IL-6、IL-8)含量。ELISA试剂盒购自南京建成生物工程研究所,严格按照试剂盒说明书进行操作。
1.4.6 数据统计分析 采用GraphPad Prism7软件对数据进行分析,数据以平均值(x)±标准差(s)表示,多组间差异比较采用one-way ANOVA或two-way ANOVA法伴随Tukey检验分析。**表示P<0.01,表示相较于Con组差异极显著;##表示P<0.01,表示相较于MG组差异极显著。
2 结果 2.1 唾液乳杆菌对MG感染肉鸡生长性能的影响相较于Con组,饲料中添加低剂量唾液乳杆菌(L组)和高剂量唾液乳杆菌(H组)均极显著提高肉鸡42日龄体重(图 1A,P<0.01)、极显著降低饲料转化率(图 1B,P<0.01)。相较于Con组,MG感染(MG组)极显著降低肉鸡42日龄体重(图 1A,P<0.01)、极显著提高饲料转化率(图 1B,P<0.01)。相较于MG组,饲料中添加低剂量唾液乳杆菌(MG+L组)和高剂量唾液乳杆菌(MG+H组)均极显著缓解MG感染导致的肉鸡体重下降(图 1A,P<0.01)、极显著降低饲料转化率(图 1B,P<0.01)。这些结果表明,唾液乳杆菌可以有效缓解MG感染造成的肉鸡生长性能下降。
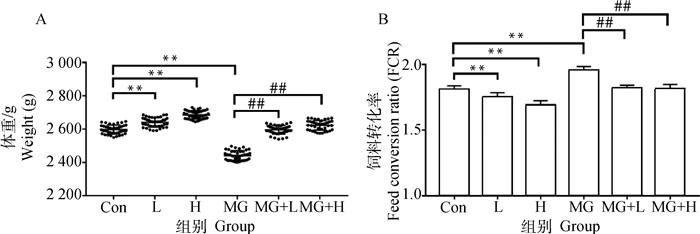
|
Con. 对照组;L. 低剂量唾液乳杆菌组;H. 高剂量唾液乳杆菌组;MG. 鸡毒支原体(Mycoplasma gallisepticum,MG)感染组;MG+L. MG感染+低剂量唾液乳杆菌组;MG+H. MG感染+高剂量唾液乳杆菌组。与Con组相比,**.P<0.01;与MG组相比,##.P<0.01。下同 Con.The control group; L. The low dose Lactobacillus salivarius group; H. The high dose Lactobacillus salivarius group; MG. The MG infection group; MG+L. The MG infection+low dose Lactobacillus salivarius group; MG+H. The MG infection+high dose Lactobacillus salivarius group. Compared with the Con group, **.P < 0.01; Compared with the MG group, ##.P < 0.01. The same as below 图 1 唾液乳杆菌对MG感染肉鸡体重(A)及饲料转化率(B)的影响(n=40) Fig. 1 Effects of Lactobacillus salivarius on body weight (A) and feed conversion ratio (B) of broilers challenged with MG (n=40) |
相较于Con组,MG感染(MG组)后肺部MG定植量极显著升高(图 2,P<0.01)。相较于MG组,饲料中添加低剂量唾液乳杆菌(MG+L组)和高剂量唾液乳杆菌(MG+H组)均极显著降低肺部MG定植量(图 2,P<0.01)。这些结果表明,唾液乳杆菌可以有效促进肺部MG清除。

|
图 2 唾液乳杆菌对MG感染肉鸡肺部MG定植影响(n=10) Fig. 2 Effects of Lactobacillus salivarius on MG colonization in broilers lung challenged with MG (n=10) |
相较于Con组,MG感染(MG组)后肺泡壁增厚,有大量炎性细胞浸润(图 3)。相较于MG组,饲料中添加低剂量唾液乳杆菌(MG + L组)和高剂量唾液乳杆菌(MG + H组)肺部病理损伤均明显缓解(图 3)。这些结果表明唾液乳杆菌可以有效缓解MG感染所致肉鸡肺部病理损伤。
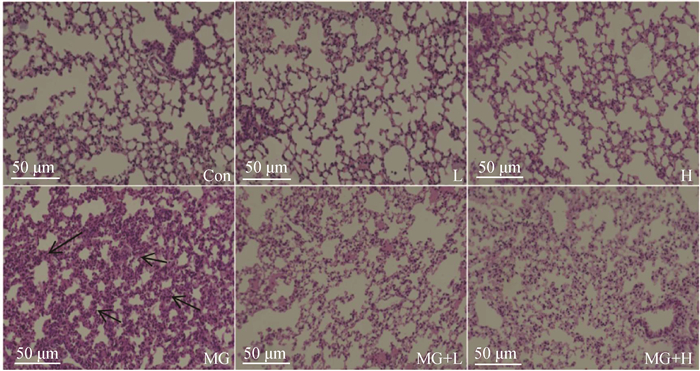
|
黑色箭头示肺泡壁增厚、炎性细胞浸润 Black arrows pointed alveolar wall thickening and inflammatory cell infiltration 图 3 肺部组织病理学对比 Fig. 3 Histopathological comparison of lung tissues |
相较于Con组,MG感染(MG组)极显著促进肺部促炎蛋白TLR2、HMGB1、p-p65/p65、NLRP3、Pro-Caspase-1/Caspase-1表达(图 4和图 5,P<0.01)。相较于MG组,饲料中添加低剂量唾液乳杆菌(MG+L组)和高剂量唾液乳杆菌(MG+H组)均极显著降低促炎蛋白TLR2、HMGB1、p-p65/p65、NLRP3、Pro-Caspase-1/Caspase-1表达(图 4和图 5,P<0.01)。这些结果表明唾液乳杆菌可以有效抑制MG感染所致肉鸡肺部炎性损伤相关蛋白表达。
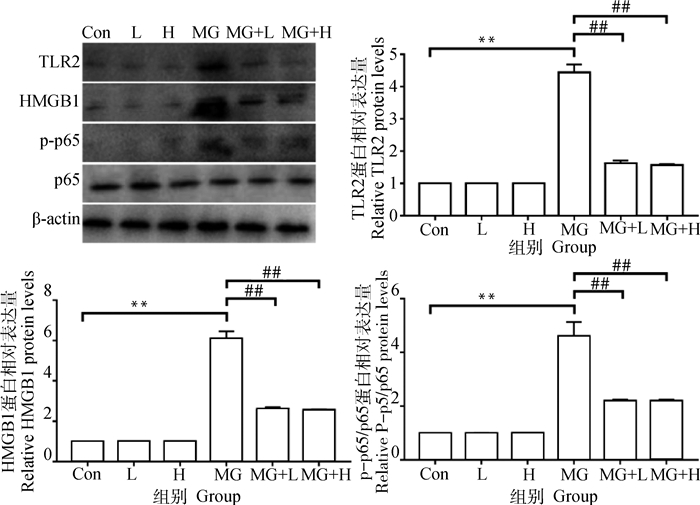
|
图 4 唾液乳杆菌对MG感染肉鸡肺部TLR2、HMGB1及p-p65/p65蛋白表达影响(n=3) Fig. 4 Effects of Lactobacillus salivarius on the protein expression of TLR2, HMGB1 and p-p65/p65 in lungs of broilers challenged with MG (n=3) |
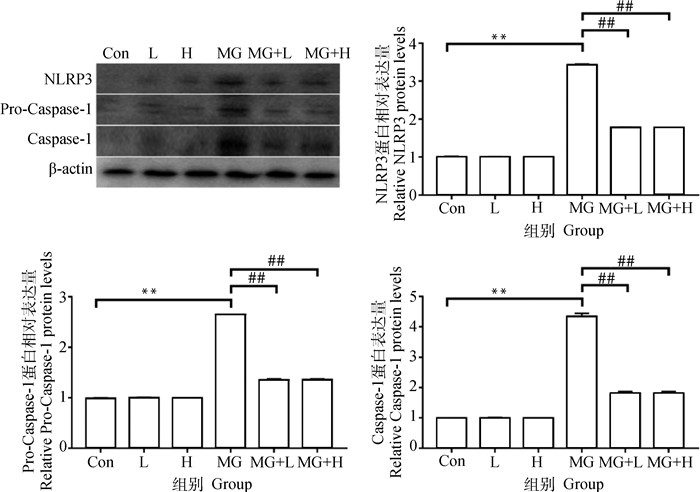
|
图 5 唾液乳杆菌对MG感染肉鸡肺部NLRP3、Pro-Caspase-1及Caspase-1蛋白表达影响(n=3) Fig. 5 Effects of Lactobacillus salivarius on the protein expression of NLRP3, Pro-Caspase-1 and Caspase-1 in lungs of broilers challenged with MG (n=3) |
相较于Con组,MG感染(MG组)极显著提高肺部促炎性细胞因子TNF-α、IL-1β、IL-6、IL-8含量(图 6,P<0.01)。相较于MG组,饲料中添加低剂量唾液乳杆菌(MG+L组)和高剂量唾液乳杆菌(MG+H组)均极显著降低肺部促炎性细胞因子TNF-α、IL-1β、IL-6、IL-8含量(图 6,P<0.01)。这些结果表明,唾液乳杆菌可以有效抑制MG感染所致肉鸡肺部促炎性细胞因子生成。

|
图 6 唾液乳杆菌对MG感染肉鸡肺部促炎性细胞因子含量影响(n=6) Fig. 6 Effects of Lactobacillus salivarius on the pro-inflammatory cytokines content in lungs of broilers challenged with MG (n=6) |
根据流行病学调查,我国养鸡场中MG感染阳性率为20%~80%[13-15]。各个日龄鸡对MG均易感,且一旦感染会终身携带MG,难以清除[16]。目前主要是使用四环素类或大环内酯类抗生素预防或治疗MG感染[17],但随着多重耐药细菌的不断出现,有必要开发抗生素替代且低成本的MG防控方法,这一方面有助于降低多重耐药细菌出现的概率,另一方面也对丰富现有MG防控策略有着重要意义。乳杆菌是首个被批准可以作为饲料添加剂的益生菌,具有生产成本低、可利用性强等优点[18-20]。本课题组前期从健康鸡肠道中分离鉴定了一株唾液乳杆菌,已证实每千克饲料中添加108CFU及109CFU该株唾液乳杆菌均能显著促进蛋鸡体重增加、胫骨生长[4]。本试验中,每千克饲料中添加108CFU及109CFU该株唾液乳杆菌也显著促进了肉鸡42日龄体重增加,这些结果表明这株唾液乳杆菌作为饲料添加剂具有良好的促生长效果。乳杆菌本身可以分泌蛋白酶促进营养物质消化吸收[21-22],这直接促进了肉鸡生长性能的提高。此外,乳杆菌作为益生菌可以改善肠道菌群组成,降低肠道内有害菌丰度,这大大降低了因激活免疫而导致的营养消耗,间接改善了饲料转化率[23-25]。
MG定植于鸡呼吸道并诱发呼吸道炎性损伤是其致病的主要原因[26-27]。在本试验中,唾液乳杆菌显著降低了鸡肺部MG定植、显著缓解了MG感染导致的肺部炎性损伤。MG感染可以激活肺部TLR-2/MyD88/NF-κB炎症信号通路[28],也可以激活Caspase-1形成炎症小体,导致促炎性细胞因子大量生成[29],引发过度炎症反应,诱导肺组织炎性损伤。本试验所用的唾液乳杆菌已被证实具有良好的抗炎效果,能够有效缓解大肠杆菌O78及鸡白痢沙门菌造成的肠道炎性损伤[9-10]。这一方面是因为唾液乳杆菌对大肠杆菌O78及鸡白痢沙门菌有直接抑制作用[9-10],另一方面由于唾液乳杆菌可以改善肠道菌群,进而改善肠道菌群代谢谱,特别是可以显著提高肠道内及循环血液中短链不饱和脂肪酸丰度[12]。短链不饱和脂肪酸可以直接抑制病原体增殖,也可以通过促进巨噬细胞杀菌能力促进病原体清除[30]。因此,本试验所用唾液乳杆菌可能是通过改善肠道菌群增强肺部抵抗MG感染能力,但更深入的机制仍有待进一步研究。
4 结论本试验所用唾液乳杆菌可有效缓解MG感染肉鸡生长性能下降,此外,该株唾液乳杆菌可通过调节TLR2、HMGB1、p-p65/p65、NLRP3、Caspase-1蛋白表达缓解MG感染肉鸡肺部炎性损伤。综上,本试验所用唾液乳杆菌对肉鸡抵抗MG感染具有较好作用,可减少MG感染带来的经济损失,在肉鸡生产中具有较大应用前景。
| [1] |
ARACHCHIGE S N K, CONDELLO A K, ZHU L, et al. Effects of immunosuppression on the efficacy of vaccination against Mycoplasma gallisepticum infection in chickens[J]. Vet Microbiol, 2021, 260: 109182. DOI:10.1016/j.vetmic.2021.109182 |
| [2] |
FEBERWEE A, DE WIT S, DIJKMAN R, et al. Clinical expression, epidemiology, and monitoring of Mycoplasma gallisepticum and Mycoplasma synoviae: an update[J]. Avian Pathol, 2022, 51(1): 2-18. DOI:10.1080/03079457.2021.1944605 |
| [3] |
FU P, WANG F, ZHANG Y K, et al. The application of aptamer Apt-236 targeting PvpA protein in the detection of antibodies against Mycoplasma gallisepticum[J]. Anal Methods, 2021, 13(27): 3068-3076. DOI:10.1039/D1AY00515D |
| [4] |
WANG J, ISHFAQ M, MIAO Y S, et al. Dietary administration of Bacillus subtilis KC1 improves growth performance, immune response, heat stress tolerance, and disease resistance of broiler chickens[J]. Poult Sci, 2022, 101(3): 101693. DOI:10.1016/j.psj.2021.101693 |
| [5] |
WU Z Y, FAN Q Q, MIAO Y S, et al. Baicalin inhibits inflammation caused by coinfection of Mycoplasma gallisepticum and Escherichia coli involving IL-17 signaling pathway[J]. Poult Sci, 2020, 99(11): 5472-5480. DOI:10.1016/j.psj.2020.08.070 |
| [6] |
WU Z Y, DING L J, BAO J X, et al. Co-infection of Mycoplasma gallisepticum and Escherichia coli triggers inflammatory injury involving the IL-17 signaling pathway[J]. Front Microbiol, 2019, 11(10): 2615. |
| [7] |
CANTER J A, TULMAN E R, BEAUDET J, et al. Transcriptional and pathological host responses to coinfection with virulent or attenuated Mycoplasma gallisepticum and low-pathogenic avian influenza A virus in chickens[J]. Infect Immun, 2019, 88(1): e00607-19. |
| [8] |
NHUNG N T, CHANSIRIPORNCHAI N, CARRIQUE-MAS J J. Antimicrobial resistance in bacterial poultry pathogens: a review[J]. Front Vet Sci, 2017, 10(4): 126. |
| [9] |
WANG J, ISHFAQ M, GUO Y Q, et al. Assessment of probiotic properties of Lactobacillus salivarius isolated from chickens as feed additives[J]. Front Vet Sci, 2020, 7: 415. DOI:10.3389/fvets.2020.00415 |
| [10] |
CHEN X P, ISHFAQ M, WANG J. Effects of Lactobacillus salivarius supplementation on the growth performance, liver function, meat quality, immune responses and Salmonella Pullorum infection resistance of broilers challenged with Aflatoxin B1[J]. Poult Sci, 2021, 101(3): 101651. |
| [11] |
MIAO Y S, NIU D, WANG Z, et al. Mycoplasma gallisepticum induced inflammation-mediated Th1/Th2 immune imbalance via JAK/STAT signaling pathway in chicken trachea: involvement of respiratory microbiota[J]. Vet Microbiol, 2022, 265: 109330. DOI:10.1016/j.vetmic.2021.109330 |
| [12] |
WANG J, ISHFAQ M, LI J C. Baicalin ameliorates Mycoplasma gallisepticum-induced inflammatory injury in the chicken lung through regulating the intestinal microbiota and phenylalanine metabolism[J]. Food Funct, 2021, 12(9): 4092-4104. DOI:10.1039/D1FO00055A |
| [13] |
钱佳晨, 陈文婷, 何常波, 等. 上海某地区鸡毒支原体血清学调查[J]. 上海畜牧兽医通讯, 2020, 4(4): 44-45. QIAN J C, CHEN W T, HE C B, et al. Serological investigation of Mycoplasma gallisepticum in Shanghai[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2020, 4(4): 44-45. (in Chinese) |
| [14] |
姜兰兰, 沈光年, 周德刚, 等. 北京市鸡毒支原体和滑液囊支原体血清学调查[J]. 中国动物检疫, 2020, 37(6): 25-29. JIANG L L, SHEN G N, ZHOU D G, et al. Serological investigation on Mycoplasma gallisepticum and Mycoplasma synoviae in Beijing city[J]. China Animal Health Inspection, 2020, 37(6): 25-29. (in Chinese) |
| [15] |
谢昊晋. 鸡毒支原体流行病学调查及病例分析[D]. 扬州: 扬州大学, 2021. XIE H J. Epidemiological investigation and case analysis of Mycoplasma gallisepticum[D]. Yangzhou: Yangzhou University, 2021. (in Chinese) |
| [16] |
YADAV J P, TOMAR P, SINGH Y, et al. Insights on Mycoplasma gallisepticum and Mycoplasma synoviae infection in poultry: a systematic review[J]. Anim Biotechnol, 2021, 1-10. DOI:10.1080/10495398.2021.1908316 |
| [17] |
DE JONG A, YOUALA M, KLEIN U, et al. Minimal inhibitory concentration of seven antimicrobials to Mycoplasma gallisepticum and Mycoplasma synoviae isolates from six European countries[J]. Avian Pathol, 2021, 50(2): 161-173. DOI:10.1080/03079457.2020.1861216 |
| [18] |
GAO P F, MA C, SUN Z, et al. Feed-additive probiotics accelerate yet antibiotics delay intestinal microbiota maturation in broiler chicken[J]. Microbiome, 2017, 5(1): 91. DOI:10.1186/s40168-017-0315-1 |
| [19] |
AL-KHALAIFA H, AL-NASSER A, AL-SURAYEE T, et al. Effect of dietary probiotics and prebiotics on the performance of broiler chickens[J]. Poult Sci, 2019, 98(10): 4465-4479. DOI:10.3382/ps/pez282 |
| [20] |
BHOGOJU S, KHWATENGE C N, TAYLOR-BOWDEN T, et al. Effects of Lactobacillus reuteri and Streptomyces coelicolor on growth performance of broiler chickens[J]. Microorganisms, 2021, 9(6): 1341. DOI:10.3390/microorganisms9061341 |
| [21] |
ZHENG X T, DUAN Y F, DONG H B, et al. Effects of dietary Lactobacillus plantarum on growth performance, digestive enzymes and gut morphology of Litopenaeus vannamei[J]. Probiotics Antimicrob Proteins, 2018, 10(3): 504-510. DOI:10.1007/s12602-017-9300-z |
| [22] |
PARK J H, LEE S I, KIM I H. Effect of dietary Spirulina (Arthrospira) platensis on the growth performance, antioxidant enzyme activity, nutrient digestibility, cecal microflora, excreta noxious gas emission, and breast meat quality of broiler chickens[J]. Poult Sci, 2018, 97(7): 2451-2459. DOI:10.3382/ps/pey093 |
| [23] |
WU X Z, WEN Z G, HUA J L. Effects of dietary inclusion of Lactobacillus and inulin on growth performance, gut microbiota, nutrient utilization, and immune parameters in broilers[J]. Poult Sci, 2019, 98(10): 4656-4663. DOI:10.3382/ps/pez166 |
| [24] |
SURESHKUMAR S, LEE H C, JUNG S K, et al. Inclusion of Lactobacillus salivarius strain revealed a positive effect on improving growth performance, fecal microbiota and immunological responses in chicken[J]. Arch Microbiol, 2021, 203(2): 847-853. DOI:10.1007/s00203-020-02088-3 |
| [25] |
FORTE C, MANUALI E, ABBATE Y, et al. Dietary Lactobacillus acidophilus positively influences growth performance, gut morphology, and gut microbiology in rurally reared chickens[J]. Poult Sci, 2018, 97(3): 930-936. DOI:10.3382/ps/pex396 |
| [26] |
WANG J, ISHFAQ M, FAN Q Q, et al. A respiratory commensal bacterium acts as a risk factor for Mycoplasma gallisepticum infection in chickens[J]. Vet Immunol Immunopathol, 2020, 230: 110127. DOI:10.1016/j.vetimm.2020.110127 |
| [27] |
WANG J, CHEN X P, LI J C, et al. Gut microbiota dysbiosis aggravates Mycoplasma gallisepticum colonization in the chicken lung[J]. Front Vet Sci, 2021, 11: 788811. |
| [28] |
CHEN C L, LI J C, ZHANG W, et al. Mycoplasma gallisepticum triggers immune damage in the chicken thymus by activating the TLR-2/MyD88/NF-κB signaling pathway and NLRP3 inflammasome[J]. Vet Res, 2020, 51(1): 52. DOI:10.1186/s13567-020-00777-x |
| [29] |
ISHFAQ M, WU Z Y, WANG J, et al. Baicalin alleviates Mycoplasma gallisepticum-induced oxidative stress and inflammation via modulating NLRP3 inflammasome-autophagy pathway[J]. Int Immunopharmacol, 2021, 101: 108250. DOI:10.1016/j.intimp.2021.108250 |
| [30] |
SCHULTHESS J, PANDEY S, CAPITANI M, et al. The short chain fatty acid butyrate imprints an antimicrobial program in macrophages[J]. Immunity, 2019, 50(2): 432-445. DOI:10.1016/j.immuni.2018.12.018 |
(编辑 白永平)



