粪肠球菌是一种常见革兰阳性球菌,广泛存在于环境及动物的消化道内[1-2]。目前,粪肠球菌耐药逐渐增强,已经成为一种公认的条件性致病菌[3-4],常引起人的尿路感染、菌血症、心内膜炎、化脓性关节炎、脑膜炎和手术腹腔感染等疾病[5-9]。近几年,粪肠球菌耐药性逐渐增强,由粪肠球菌引起的动物脑膜炎病例逐渐增多,已成为一个严重的公共卫生问题[10-11],给畜牧业的发展带来巨大的影响[12]。
实验室前期已分离到可致脑膜炎的粪肠球菌[13-16],本试验选取1株粪肠球菌(命名为XJ 6)作为试验株,以小鼠为实验动物,建立脑组织损伤模型,通过常规石蜡切片及HE染色,动态观察脑组织的病理学变化,采集不同感染时期与空白对照组小鼠脑组织做差异性表达分析,进一步丰富粪肠球菌引起脑组织损伤的机制。
1 材料 1.1 试验动物及菌株8周龄清洁级昆明鼠50只(22~25 g,购自达尔文生物科技有限公司),致脑膜炎粪肠球菌由本实验室前期分离并保存。
1.2 主要试剂及仪器总RNA提取试剂盒购自北京天根生化科技有限公司;全自动酶标仪购自美国BioTek仪器;ND2000微量核酸蛋白分析仪购自美国Nanodrop。
1.3 脑组织病理学观察1.3.1 细菌的复苏与毒力基因检测 取实验室前期保存的致脑膜炎粪肠球菌,编号为XJ6,复苏纯化后提取其DNA,除前期已检测的毒力基因外,设计了sprE等10个毒力因子的引物。引物序列如表 1所示。
|
|
表 1 引物信息 Table 1 Primer information |
1.3.2 样品的采集及石蜡切片的制作 参考李慧等[13]的方法,测定细菌的半数致死量LD50,选择XJ 6株的2/3 LD50为感染剂量,对小鼠进行腹腔注射,并注射相同剂量生理盐水作为空白对照。选取注射后2、4、6、12、24、36、60和72 h的小鼠,采集小鼠脑组织按照石蜡切片说明书进行制作。
1.4 感染细菌后小鼠脑组织转录组学差异分析1.4.1 总RNA的提取及质量检测 选择感染粪肠球菌后症状早期、症状明显期和转归期3个时间点(12、24、60 h)与空白对照小鼠的脑组织,提取上述脑组织RNA,利用琼脂糖凝胶电泳检测RNA的完整性;使用Nano Photometer spectrophotometer仪器检测来RNA纯度;通过Agilent 2100 bioanalyzer生物分析仪来精确检测RNA完整性。
1.4.2 mRNA文库的构建 通过Oligo(dT)磁珠富集带有polyA尾的mRNA。按照NEB普通建库方式或链特异性建库方式进行建库[17]。使用Qubit2.0 Fluorometer进行初步定量,使用Agilent 2100 bioanalyzer对文库的insert size进行检测,qRT-PCR对文库有效浓度进行准确定量。
1.4.3 差异表达基因富集分析 比较在用XJ6号株进行腹腔注射后12、24、60 h和空白处理组之间的基因表达差异,对差异性表达基因开展GO和KEGG通路富集分析。
1.5 荧光定量PCR验证根据测序结果,从转录组差异性表达的文库筛选在12、24和60 h均上调和下调的基因利用NCBI上及公布的基因序列在NCBI上或primerbank,设计上调基因H2-M3、Mrps10、Cox8b、Sp5、Pik3r2、H2-Q6、Gbp10、Mslnl、Gata3的引物,下调基因Fabp7、C1qtnf7、Stk33、Cyp11a1、Cdh12、Mzt1、Tomm6、Bdnf、Clstn2、Hmgcs1的引物,并选择β-actin为内参,测定各个基因的表达量,用SPASS 22软件进行差异显著性分析。引物序列如表 2和表 3所示。
|
|
表 2 上调基因引物序列表 Table 2 Sequence table of up-regulated gene primers |
|
|
表 3 下调基因引物序列表 Table 3 Sequence table of down-regulated gene primers |
荧光定量检测的程序为95 ℃ 10 min;94 ℃ 90 s,梯度PCR挑选的合适温度15 s,72 ℃ 90 s,40个循环;72 ℃ 10 min;体系为LightCycler 480 SYBR Green I Master 10 μL、dd H2O 7 μL、上下游引物各0.5 μL,cDNA模板2 μL进行荧光定量PCR检测。
2 结果 2.1 PCR鉴定对XJ 6粪肠球菌使用粪肠球菌毒力因子检测结果表明sprE、Ebp、hyp、SrtA、gls、psaA、Cbh、fsr八个毒力因子基因为阳性,如图 1所示。
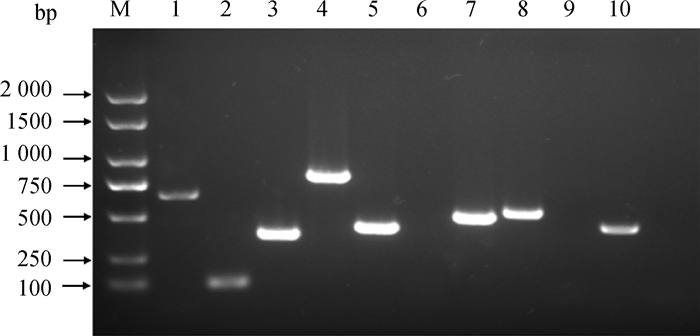
|
M. 2000 Plus DNA相对分子质量;1. sprE;2. Ebp;3. hyp;4. SrtA;5. gls;6. nuc;7. psaA;8. Cbh;9. CPS;10. fsr M. 2000 Plus DNA marker; 1. sprE; 2. Ebp; 3. hyp; 4. SrtA; 5. gls; 6. nuc; 7. psaA; 8. Cbh; 9. CPS; 10. fsr 图 1 毒力因子检测电泳图 Fig. 1 Electrophoresis of virulence factor detection |
如图 2所示:图 2A、B为PBS处理组,小鼠脑组织的脑膜及脑实质神经元均未见异常病变。感染粪肠球菌后,在12 h时病理变化如图 2C~E所示,脑膜及脑实质血管充血,血管周围的间隙明显增大,因水肿脑组织间隙增宽。在24 h时脑组织的病变如图 2F、G所示,脑组织血管充血,因水肿脑组织呈网格状间隙,细胞排列紊乱,微血栓的形成。在48 h时病理变化如图 2H、I所示,表现为脑血管充血,脑组织见网格状间隙,胶质细胞增生。在60 h时病理变化如图 2J、K所示,少数神经细胞周围出现空白间隙。在72 h时病理变化如图 2L所示,细胞形态逐步恢复正常,排列相对整齐,部分神经细胞恢复正常。

|
A、B.PBS组,脑膜未见异常;C~E.12 h处理组,脑膜充血,血管周围间隙增大;F、G.24 h处理组,水肿脑组织呈网格状间隙,细胞排列紊乱;H、I.48 h处理组,脑血管充血,胶质细胞增生;J、K.60 h处理组,神经细胞周围出现空白间隙;L.72 h处理组,部分神经细胞恢复正常 A, B.PBS group, no abnormality in meninges; C-E.12 h action group, meningeal hyperemia, enlarged perivascular spaces; F, G.24 h action group, edema brain tissue with grid-like gaps and disordered arrangement of cells; H, I.48 h action group, cerebral vascular congestion, gliosis; J, K. 60 h action group, Empty gaps appear around nerve cells; L.72 h action group, Some nerve cells return to normal 图 2 剖检和石蜡切片(B, 100×; D~L, 400×)观察结果 Fig. 2 Observation results of autopsy and paraffin section graphs (B, 100×; D-L, 400×) |
使用1%琼脂糖凝胶电泳,电压:180 V,时间16 min,如图 3所示,均显示清晰完整条带。经Nano Drop 2000量分光光度计测定,OD260 nm/OD280 nm均为1.81~1.90,且检测其Agilent 2100 bioanalyzer检测其完整性结果其评分均为8.90~9.40,评分为A。
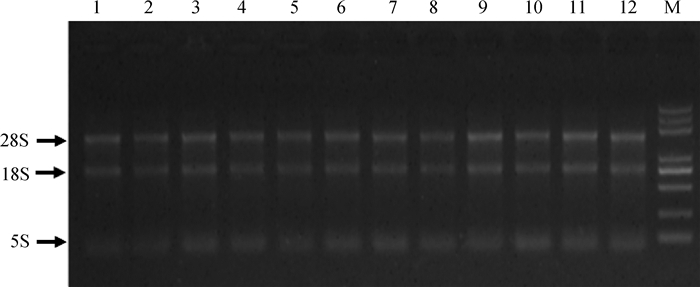
|
M. Trans 2K Plus DNA相对分子质量;1~3. 空白对照组;4~6. 12 h处理组;7~9. 24 h处理组;10~12. 60 h处理组 M. Trans 2K Plus DNA marker; 1-3. Blank control group; 4-6. The 12 h treatment group; 7-9. The 24 h treatment group; 10-12. The 60 h treatment group 图 3 总RNA质检图 Fig. 3 Total RNA quality chart |
与对照组相比12 h时有810个基因上调表达,768个基因下调表达,24 h时有1 733个基因上调表达,2 551个基因下调表达,60 h时有197个基因上调表达,118个基因下调表达。
2.5 差异表达基因GO富集情况通过GO富集分析,可以得知在12 h时主要富集到对β干扰素的反应、对γ干扰素的反应、对细菌的防御反应、对凋亡信号通路的调节和一些与线粒体相关的细胞组成等较为突出的46个生物进程,33个细胞组成和2个分子功能中。24 h时主要富集到分化的细胞形态发生的调控、外在凋亡信号通路、血管生成等较为突出的641个生物进程,98个细胞组成和68个分子功能中。60 h时主要富集到对细菌的防御反应、对其他生物的防御反应、对革兰阳性细菌的防御反应、细胞对γ和β干扰素的反应等较为突出的13个生物进程,16个细胞组成和4个分子功能中。
从12、24和60 h与对照组相比GO富集分析结果中选取最显著的30个Term绘制气泡图进行展示,如图 4所示。

|
A.12 h GO富集部分重要结果图;B.24 h GO富集部分重要结果图;C. 60 h GO富集部分重要结果图 A. Some important results of 12 h GO enrichment; B. Some important results of 24 h GO enrichment; C. Some important results of 60 h GO enrichment 图 4 差异性表达基因GO富集分析 Fig. 4 GO enrichment analysis of differentially expressed genes |
KEGG富集结果显示(图 5),12 h较显著富集的信号通路富集过氧物酶体、NOD样受体信号通路和氧化磷酸化3条信号通路上。24 h时主要富集到钙代谢信号传导途径、PI3K-Akt信号传导途径、Wnt信号通路、MAPK信号通路、GnRH分泌、VEGF信号通路、紧密连接等一些与血脑屏障损伤相关的通路上。60 h时主要富集到抗原的处理和呈递、细胞黏附分子CAMs等信号通路上。
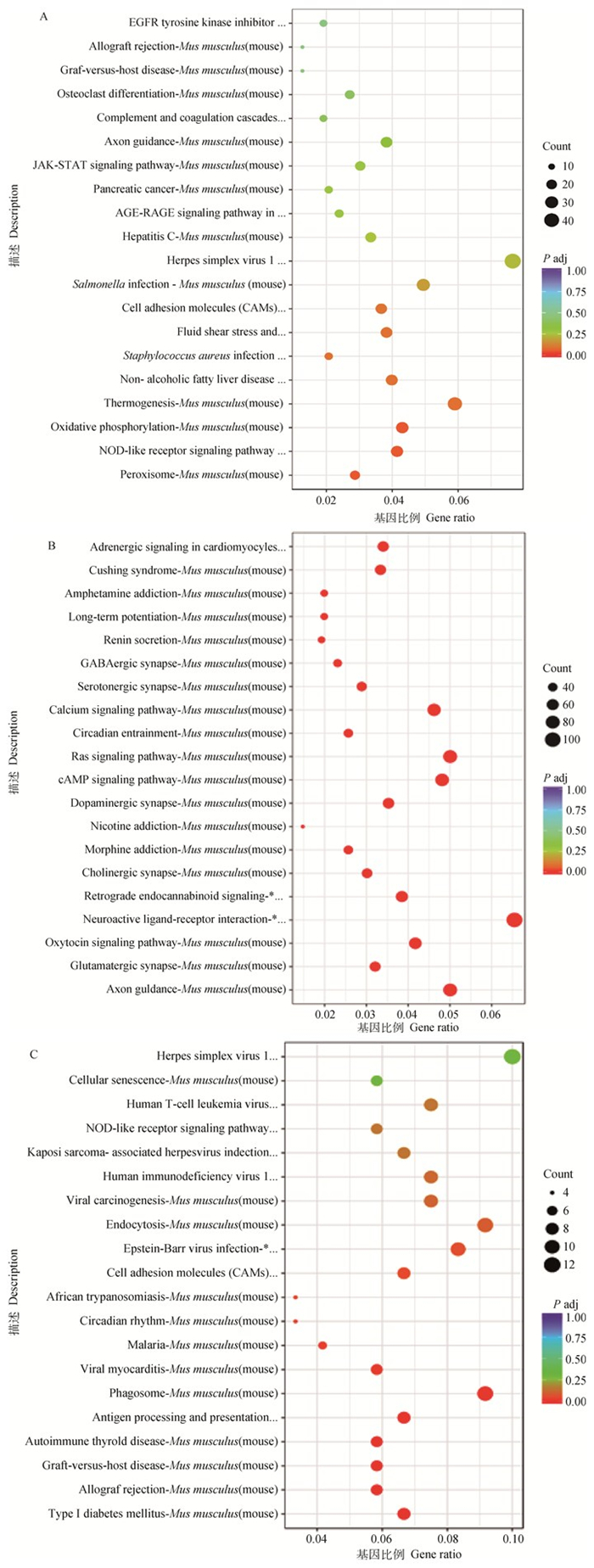
|
A.12 h KEGG富集结果图;B.24 h KEGG富集结果图;C.60 h KEGG富集结果图 A. 12 h KEGG enrichment result graph; B. 24 h KEGG enrichment results; C. 60 h KEGG enrichment result graph 图 5 差异性表达基因KEGG富集分析 Fig. 5 KEGG enrichment analysis of differentially expressed genes |
上调的基因中:在12 h时H2-Q6、H2-M3、Cox8b、Mrps10、Sp5、Gbp10、Pik3r2、Mslnl和Gata3基因的表达趋势与转录组学数据完全一致,在24 h时H2-Q6、H2-M3、Sp5、Gbp10、Pik3r2、Mslnl和Gata3基因的表达趋势与转录组学数据一致;在60 h时H2-M3、Mrps10、Sp5、Gbp10、Pik3r2、Mslnl和Gata3基因的表达趋势与转录组学数据一致。具体结果如图 6A和B所示。下调的基因中:在12 h时Cyp11a1、Mzt1、Cdh12、Bdnf、Hmgcs1、C1qtnf7、Clstn2和Fabp7基因的表达趋势与转录组学数据一致。在24和60 h时所选的基因的表达趋势与转录组学数据基本一致。具体结果如图 6C和D所示。

|
图 6 差异性表达基因q-PCR验证 Fig. 6 q-PCR validation of differentially expressed genes |
粪肠球菌是人和动物消化道的正常菌群之一,一般不引起疾病的发生[1]。目前,粪肠球菌耐药逐渐增强,已经成为一种公认的条件性致病菌[18],常引起人的尿路感染、菌血症、心内膜炎、化脓性关节炎、脑膜炎和手术腹腔感染等疾病[5]。
本研究选取实验室前期分离到的粪肠球菌(XJ 6),对其LD50和毒力基因进行了检测,除实验室前期检测到的毒力因子esp、gelE、CylA、asal、asa373、ace、efa、EF0591和EF3314外[19],XJ6株还检出了sprE、Ebp、hyp、SrtA、gls、psaA、Cbh、fsr 8个毒力因子。以2/3 LD50为感染剂量[13],选取小鼠攻毒后12、24、48、60、72 h及空白对照组的脑组织进行病理组织学观察,小鼠脑组织先后出现了血管充血,血管周围的间隙明显增大,脑组织水肿、细胞排列较乱、胶质细胞增生、微血栓形成及炎性细胞浸润,与李慧等[13]的研究结果基本一致。在半数致死量上,本次研究菌株的半数致死量与黎满香等[20]和王玉峰等[21]的研究结果相差较大,这可能与菌株的来源和保存年限有一定的关系。
在基因的差异性表达中,与对照组相比,小鼠攻毒12 h时有810个基因上调表达,768个基因下调表达,攻毒24 h时有1 733个基因上调表达,2 551个基因下调表达,攻毒60 h时有197个基因上调表达,118个基因下调表达。GO富集分析得到在12 h时β干扰素的反应以及对细菌的防御反应和一些凋亡调控等,Rasouli等[22]的研究表明,β干扰素可以作用于单核细胞,从而改善中枢系统的自身免疫,说明在攻毒12 h时,脑部对细菌的侵袭产生了防御作用。24 h时则主要集中在一些凋亡和细胞迁移以及血管合成等,权瑜等[23]的研究表明相关通路表达与脑微血管内皮细胞的损伤有关。60 h时主要集中在对细菌的防御反应、对其他生物的防御反应和对革兰阳性细菌的防御反应以及细胞对干扰素-γ和β的反应[22, 24],表明此时脑组织主要是以抵御粪肠球菌为主,从而减轻其对脑组织的伤害。通过KEGG富集分析,发现在12 h时主要富集到过氧化物酶体、NOD样受体信号通路和氧化磷酸化上,有很多的研究结果表明这三条通路与脑损伤有关[25-27]。24 h时主要富集到很多与血脑屏障损伤相关的通路及损伤指示的一些通路上,例如PI3K-Akt信号传导途径[28]、钙代谢信号传导途径[29]。60 h时主要富集到抗原的处理和呈递和细胞黏附分子的一些通路上。
目前,荧光定量检测技术已经在检测基因的表达和基因含量上被广泛应用。在很多癌症上也可以应用荧光定量检测技术检测原癌基因和抑癌基因的表达量,从而反映出机体患癌的可能性[30]。对于转录数据而言,目前,有Western blot验证、Northern blot验证和qRT-PCR验证三种方式,本研究选择qRT-PCR验证的方式,验证基因的表达趋势与转录组学的数据是否一致。上调的基因中:在12 h时H2-Q6、H2-M3、Cox8b、Mrps10、Sp5、Gbp10、Pik3r2、Mslnl和Gata3基因的表达趋势与转录组学数据完全一致,在24 h时H2-Q6、H2-M3、Sp5、Gbp10、Pik3r2、Mslnl和Gata3基因的表达趋势与转录组学数据一致;在60 h时H2-M3、Mrps10、Sp5、Gbp10、Pik3r2、Mslnl和Gata3基因的表达趋势与转录组学数据一致。下调的基因中:在12 h时Cyp11a1、Mzt1、Cdh12、Bdnf、Hmgcs1、C1qtnf7、Clstn2和Fabp7基因的表达趋势与转录组学数据一致,在24和60 h时所选的基因的表达趋势与转录组学数据基本一致。
4 结论本研究选取1株致脑膜炎粪肠球菌,通过构建脑组织损伤模型,对脑组织进行病理组织学观察,发现小鼠脑组织先后出现了脑血管充血、血管周围的间隙增大、脑组织水肿、微血栓形成及炎性细胞浸润。通过转录组测序筛选差异基因,GO分析发现相关基因主要富集在对β干扰素的反应、细胞对β干扰素的反应、对其他生物的防御反应、外在凋亡信号通路、调节外在凋亡信号通路、神经元凋亡过程等一些对细菌的防御反应和细胞凋亡途径中。KEGG分析发现主要富集在过氧物酶体、NOD样受体信号通路、氧化磷酸化、PI3K-Akt信号传导途径、钙代谢信号传导途径等通路上,这些通路多与脑组织损伤及损伤指示有关。本研究为继续探究粪肠球菌引起脑组织损伤机制提供了一定的理论依据。
| [1] |
STUCKI K, HARBARTH S, NENDAZ M. Enterococcal infections: from simple to most complex[J]. Rev Med Suisse, 2014, 10(446): 1918, 1920-1923. |
| [2] |
VAN TYNE D, GILMORE M S. Friend turned foe: evolution of enterococcal virulence and antibiotic resistance[J]. Annu Rev Microbiol, 2014, 68: 337-356. DOI:10.1146/annurev-micro-091213-113003 |
| [3] |
ARIAS C A, MURRAY B E. The rise of the Enterococcus: beyond vancomycin resistance[J]. Nat Rev Microbiol, 2012, 10(4): 266-278. DOI:10.1038/nrmicro2761 |
| [4] |
CH'NG J H, CHONG K K L, LAM L N, et al. Biofilm-associated infection by enterococci[J]. Nat Rev Microbiol, 2019, 17(2): 82-94. DOI:10.1038/s41579-018-0107-z |
| [5] |
FUKUOKA K, FURUICHI M, ITO K, et al. Longer duration of urinary catheterization increases catheter-associated urinary tract infection in PICU[J]. Pediatr Crit Care Med, 2018, 19(10): e547-e550. DOI:10.1097/PCC.0000000000001628 |
| [6] |
DAHL A, MIRO J M, BRUUN N E. Enterococcus faecalis bacteremia: please do the echo[J]. Aging (Albany NY), 2019, 11(23): 10786-10787. |
| [7] |
BONAZZETTI C, MORENA V, GIACOMELLI A, et al. Unexpectedly high frequency of Enterococcal bloodstream infections in coronavirus disease 2019 patients admitted to an Italian ICU: an observational study[J]. Crit Care Med, 2021, 49(1): e31-e40. DOI:10.1097/CCM.0000000000004748 |
| [8] |
PERICàS J M, AMBROSIONI J, MUÑOZ P, et al. Prevalence of colorectal neoplasms among patients with Enterococcus faecalis endocarditis in the GAMES cohort (2008-2017)[J]. Mayo Clin Proc, 2021, 96(1): 132-146. DOI:10.1016/j.mayocp.2020.06.056 |
| [9] |
SUN J L, SONG X B, KRISTIANSEN B E, et al. Occurrence, population structure, and antimicrobial resistance of enterococci in marginal and apical periodontitis[J]. J Clin Microbiol, 2009, 47(7): 2218-2225. DOI:10.1128/JCM.00388-09 |
| [10] |
邹晓旭, 张敏, 赵露, 等. 我国抗菌药物临床应用专项整治情况调查与分析[J]. 中国医院管理, 2014, 34(2): 10-12. ZOU X X, ZHANG M, ZHAO L, et al. Investigation and analysis of antibiotic stewardship program in China[J]. Chinese Hospital Management, 2014, 34(2): 10-12. (in Chinese) |
| [11] |
KHODABANDEH M, MOHAMMADI M, ABDOLSALEHI M R, et al. High-level aminoglycoside resistance in Enterococcus faecalis and Enterococcus faecium; as a serious threat in hospitals[J]. Infect Disord Drug Targets, 2020, 20(2): 223-228. |
| [12] |
狄婷婷, 高原. 粪肠球菌主要毒力因子研究进展[J]. 中国病原生物学杂志, 2012, 7(3): 231-234. DI T T, GAO Y. Advances in research on pathogenicity islands of Enterococcus faecalis[J]. Journal of Pathogen Biology, 2012, 7(3): 231-234. DOI:10.13350/j.cjpb.2012.03.007 (in Chinese) |
| [13] |
李慧, 王蒙蒙, 李傲寒, 等. 致动物脑膜炎粪肠球菌人工感染小鼠脑部模型的建立[J]. 动物医学进展, 2019, 40(8): 34-39. LI H, WANG M M, LI A H, et al. Establishment of brain model of artificially infected mice with Enterococcus faecalis causing animal encephalitis[J]. Progress in Veterinary Medicine, 2019, 40(8): 34-39. DOI:10.3969/j.issn.1007-5038.2019.08.007 (in Chinese) |
| [14] |
李益涛, 曹梦园, 陈明杰, 等. 体外血脑屏障模型的构建及致脑膜炎粪肠球菌对其的影响[J]. 中国畜牧兽医, 2021, 48(7): 2549-2558. LI Y T, CAO M Y, CHEN M J, et al. Establish of a blood-brain barrier model in vitro and the influence of meningitis-causing Enterococcus faecalis on the model[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(7): 2549-2558. DOI:10.16431/j.cnki.1671-7236.2021.07.031 (in Chinese) |
| [15] |
周霞, 剡根强, 马勋, 等. 致羔羊脑炎粪肠球菌人工感染小鼠模型的建立[J]. 西北农业学报, 2007, 16(5): 15-17, 21. ZHOU X, YAN G Q, MA X, et al. An animal model for encephalitis in lamb caused by Enterococcus faecalis[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2007, 16(5): 15-17, 21. DOI:10.3969/j.issn.1004-1389.2007.05.004 (in Chinese) |
| [16] |
李慧. 粪肠球菌对小鼠血脑屏障通透性及脑组织损伤相关因素的研究[D]. 石河子: 石河子大学, 2019. LI H. Effect of Enterococcus faecalis on blood-brain barrier permeability and brain tissue injury in mice[D]. Shihezi: Shihezi University, 2019. (in Chinese) |
| [17] |
GOLDSTEIN L D, CAO Y, PAU G, et al. Prediction and quantification of splice events from RNA-Seq data[J]. PLoS One, 2016, 11(5): e0156132.. DOI:10.1371/journal.pone.0156132 |
| [18] |
MOHAMED J A, HUANG D B. Biofilm formation by enterococci[J]. J Med Microbiol, 2007, 56(Pt 12): 1581-1588. |
| [19] |
周霞. 肠球菌性羔羊脑炎的发现及其病原特性和诊断方法研究[D]. 雅安: 四川农业大学, 2007. ZHOU X. The finding of lamb encephalitis induced by enterococcus and studies on its pathogenic characteristics and diagnosis method[D]. Yaan: Sichuan Agricultural University, 2007. (in Chinese) |
| [20] |
黎满香. 感染猪的粪肠球菌的分离鉴定及部分特性和诊断方法研究[D]. 长沙: 湖南农业大学, 2010. LI M X. Isolation and Identification of E. faecalis from infected pigs and studies on its partial characteristics and diagnosis method[D]. Changsha: Hunan Agricultural University, 2010. (in Chinese) |
| [21] |
王玉峰, 于宁, 刘晓军, 等. 熊源粪肠球菌小鼠感染模型的建立及其毒力基因的检测[J]. 畜牧与兽医, 2019, 51(9): 95-99. WANG Y F, YU N, LIU X J, et al. Establishment of mice pathological model of Enterococcus faecalis and detection of its virulence genes[J]. Animal Husbandry & Veterinary Medicine, 2019, 51(9): 95-99. (in Chinese) |
| [22] |
RASOULI J, CASELLA G, ISHIKAWA L L W, et al. IFN-β acts on monocytes to ameliorate CNS autoimmunity by inhibiting proinflammatory cross-talk between monocytes and Th cells[J]. Front Immunol, 2021, 12: 679498. DOI:10.3389/fimmu.2021.679498 |
| [23] |
权瑜, 王举波, 程格庆, 等. lncRNA MALAT1靶向miR-532-3p对脑出血继发脑损伤大鼠脑微血管内皮细胞模型凋亡和氧化损伤的影响[J]. 山西医科大学学报, 2021, 52(7): 874-882. QUAN Y, WANG J B, CHENG G Q, et al. Effect of lncRNA MALAT1 targeting miR-532-3p on apoptosis and oxidative damage of cerebral microvascular endothelial cell model in rats with secondary brain injury after intracerebral hemorrhage[J]. Journal of Shanxi Medical University, 2021, 52(7): 874-882. (in Chinese) |
| [24] |
嵇祝星, 王晓泉, 刘晓文, 等. 干扰素刺激基因15(ISG15)在天然免疫中的抗病毒作用研究进展[J]. 中国免疫学杂志, 2022, 38(2): 253-258. JI Z X, WANG X Q, LIU X W, et al. Research progress of antiviral effect of ISG15 in natural immune response[J]. Chinese Journal of Immunology, 2022, 38(2): 253-258. (in Chinese) |
| [25] |
YIN K J, DENG Z, HAMBLIN M, et al. Peroxisome proliferator-activated receptor δ regulation of miR-15a in ischemia-induced cerebral vascular endothelial injury[J]. J Neurosci, 2010, 30(18): 6398-6408. DOI:10.1523/JNEUROSCI.0780-10.2010 |
| [26] |
杨理. 长链非编码RNA在慢性脊髓损伤大鼠的差异表达研究[D]. 天津: 天津医科大学, 2019. YANG L. Differentially expression of long non-coding RNA in chronic spinal cord injury rat[D]. Tianjin: Tianjin Medical University, 2019. (in Chinese) |
| [27] |
HAORAH J, RAMIREZ S H, SCHALL K, et al. Oxidative stress activates protein tyrosine kinase and matrix metalloproteinases leading to blood-brain barrier dysfunction[J]. J Neurochem, 2007, 101(2): 566-576. DOI:10.1111/j.1471-4159.2006.04393.x |
| [28] |
WANG Z G, CHENG Y, YU X C, et al. bFGF protects against blood-brain barrier damage through junction protein regulation via PI3K-Akt-Rac1 pathway following traumatic brain injury[J]. Mol Neurobiol, 2016, 53(10): 7298-7311. DOI:10.1007/s12035-015-9583-6 |
| [29] |
SALVADOR E, BUREK M, FÖRSTER C Y. Stretch and/or oxygen glucose deprivation (OGD) in an in vitro traumatic brain injury (TBI) model induces calcium alteration and inflammatory cascade[J]. Front Cell Neurosci, 2015, 9: 323. |
| [30] |
OAK C H, WILSON D, LEE H J, et al. Potential molecular approaches for the early diagnosis of lung cancer (review)[J]. Mol Med Rep, 2012, 6(5): 931-936. DOI:10.3892/mmr.2012.1042 |
(编辑 白永平)



