2. 新疆农业大学畜牧学博士后流动站,乌鲁木齐 830052;
3. 新疆畜牧科学院兽医研究所,乌鲁木齐 830000
2. The Post Doctoral Station of Animal Husbandry Science, Xinjiang Agricultural University, Urumqi 830052, China;
3. Institute of Veterinary Medicine, Xinjiang Academy of Animal Sciences, Urumqi 830000, China
牛传染性鼻气管炎(bovine infectious rhinotracheitis,IBR)是由牛传染性鼻气管炎病毒(bovine infectious rhinotracheitis virus,IBRV)引起的牛的一种急性接触性传染病,又称红鼻病或坏死性鼻炎,临床上以高热、鼻炎和上呼吸道炎症为主要特征,并可引起脓疱性外阴阴道炎、龟头炎及母牛的乳汁减少和流产等症状[1-2]。近年来,随着IBR感染率的升高,给养牛业造成严重的经济损失。
目前,国内外对IBRV的研究主要集中在临床应用方面,而关于IBRV的致病机制及如何诱导宿主细胞线粒体损伤的研究还不够深入。线粒体是细胞的“动力工厂”,细胞生命活动所需能量大部分是由线粒体的氧化磷酸化产生[3]。多种细胞代谢过程都有线粒体的参与[4]。近年来研究表明,线粒体在宿主细胞抗病毒反应中起着核心作用[5]。一方面,当病毒感染细胞时,线粒体抗病毒信号蛋白(mitochondria antiviral signaling protein,MAVS)作为干扰素β的启动子,可刺激相关复合体的生成激活信号通路,诱导干扰素表达,进而诱发天然免疫反应[6]。另一方面,病毒入侵细胞后,也可通过造成线粒体膜电位(mitochondrial membrane potential,MMP) 的丢失、线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)的异常开放损伤线粒体,阻碍线粒体的正常功能,从而改变细胞内正常的生物学过程,进而诱导细胞凋亡[7-8]。综上所述,线粒体损伤是病毒诱导宿主细胞凋亡的关键因素。
本研究采用透射电镜、流式细胞术等技术观察细胞线粒体损伤情况、检测MMP、MPTP等指标,确定IBRV诱导MDBK细胞线粒体损伤最适浓度和时间点,以期为深入探讨IBR的发病机制奠定理论基础。
1 材料与方法 1.1 材料1.1.1 主要试剂 MDBK细胞购自中国科学院分子细胞科学卓越创新中心细胞库,IBRV病毒株(AV21)购自于中国兽医药品监察所,胎牛血清购自浙江天杭生物科技股份有限公司,DMEM高糖培养基购自Biological Industries公司,MPTP检测试剂盒购自上海贝博公司,MMP检测试剂盒购自上海碧云天生物技术有限公司,血液/细胞/组织基因组DNA提取试剂盒、SuperReal荧光定量预混试剂(探针法)购自天根生化科技(北京)有限公司,电镜固定液购自武汉塞维尔生物科技有限公司,812包埋剂购自SPI公司,锇酸购自Ted Pella Inc公司。
1.1.2 主要仪器 全自动新型隔水恒温培养箱购自上海一恒科学仪器有限公司;细胞培养箱(Galaxy 170 R)、高速离心机和移液器均购自Eppendorf;医用净化工作台(YJ-875)购自苏州净化设备公司,流式细胞仪购自Bri Cyte,普通光学显微镜(AE31E)购自Nikon,透射电子显微镜(HT7800)购自HITACHI,7500 Fast Real-Time PCR System购自Thermo Scientific。
1.2 方法1.2.1 IBRV诱导MDBK细胞病变情况检测 使用含10% FBS的DMEM高糖培养液,在37 ℃、含5% CO2的细胞培养箱中培养MDBK细胞,待细胞长至85%~90%,用0.5、1.0、1.5、2.0 MOI IBRV病毒感染MDBK细胞,于感染后6、12、24、36、48 h时间点置于光学显微镜下观察细胞病变。
1.2.2 IBRV诱导MDBK细胞线粒体损伤最适浓度的确定 按照3×105·孔-1细胞数将MDBK细胞接种至6孔板中,待细胞长至85%~90%,分别用0.5、1.0、1.5、2.0 MOI IBRV病毒感染MDBK细胞,12 h后收集细胞,按照病毒DNA提取试剂盒说明书提取DNA,用实时荧光定量PCR检测病毒拷贝数;根据MPTP及MMP检测试剂盒说明书,利用流式细胞术检测线粒体损伤情况。
1.2.3 IBRV诱导MDBK细胞线粒体损伤最佳时间的确定 按照3×105·孔-1细胞数将MDBK细胞接种至6孔板中,待细胞长至85%~90%,用1.5 MOI的病毒感染MDBK细胞,于感染后6、12、24、36 h后收集细胞,按照病毒DNA提取试剂盒说明书提取DNA,用实时荧光定量PCR检测病毒拷贝数;根据MPTP及MMP检测试剂盒说明书,利用流式细胞术检测线粒体损伤情况。
1.2.4 引物和探针 特异性引物和特异性TaqMan探针Probe是参照GenBank中已发表的IBRV-gB基因序列(登录号:MK654723.1),利用Primer Premier 5.0设计,由上海生工生物工程有限公司合成。引物序列如表 1。
|
|
表 1 引物及探针序列 Table 1 Sequence of primers and probe |
1.2.5 透射电镜观察线粒体损伤情况 按照3×106·孔-1细胞数将MDBK细胞接种至100 mm皿中,待细胞长至85%~90%,用1.5 MOI的IBRV病毒感染MDBK细胞6、24 h,用细胞刮收集细胞,放置2.5%戊二醛固定液固定24 h,再经过1%锇酸后固定,系列乙醇脱水,纯812包埋剂37 ℃ 5~8 h,超薄切片,醋酸铀和枸橼酸铅双重染色,最后用透射电镜观察。
1.2.6 统计分析 各组结果数据采用SPSS 22.0统计软件分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果 2.1 IBRV诱导MDBK细胞病变情况分别将感染0.5、1.0、1.5、2.0 MOI IBRV的MDBK细胞于6、12、24、36、48 h置于普通光学显微镜下观察,结果显示,12 h起就有细胞开始出现皱缩,随着时间的延长,细胞出现拉网、葡萄串样典型病变,48 h时细胞病变率达到90%以上(图 1)。

|
图 1 不同浓度及时间IBRV诱导MDBK细胞病变情况(bar=100 μm) Fig. 1 MDBK cell pathological changes induced by IBRV at different concentrations and times(bar=100 μm) |
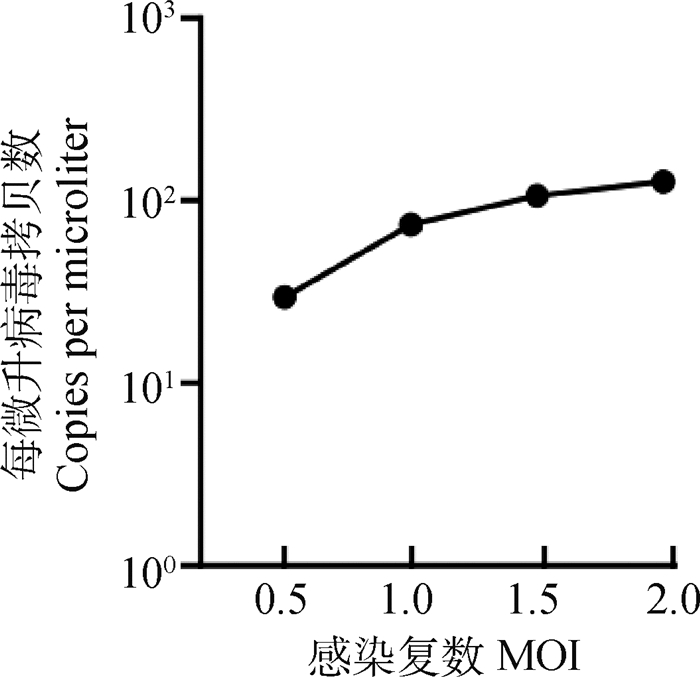
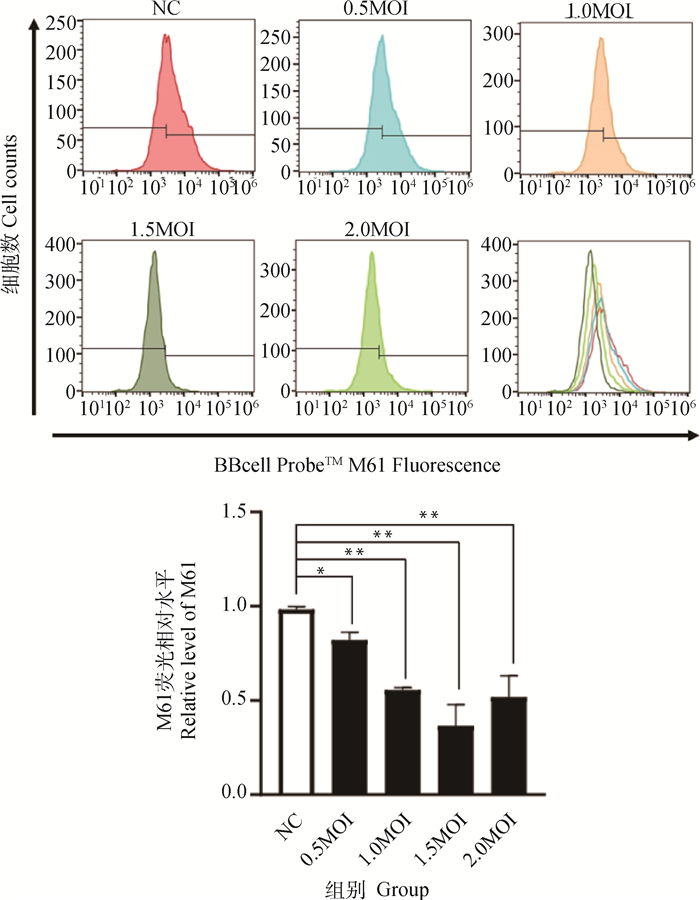
不同MOI IBRV感染MDBK细胞12 h后,用实时荧光定量PCR检测病毒拷贝数,结果显示:随着病毒浓度的增加,病毒拷贝数逐渐上升(图 2)。利用流式细胞仪检测MPTP及MMP变化情况,结果显示:MPTP检测值在0.5 MOI时,与对照组相比差异显著(P<0.05),其他三个感染组与对照组相比差异极显著(P<0.01),其中,1.5 MOI的检测值降低最明显(图 3)。MMP检测值在1.5~2.0 MOI时,与对照组相比差异极显著(P<0.01),其他两个感染组与对照组相比差异不显著(P>0.05)(图 4)。结果表明,1.5 MOI为IBRV诱导MDBK细胞线粒体损伤最适浓度。
|
图 2 不同MOI IBRV感染MDBK细胞12 h病毒拷贝数 Fig. 2 Virus copy number of MDBK cells infected with different MOI IBRV for 12 h |
|
*.P<0.05;**.P<0.01 图 3 不同MOI IBRV感染MDBK细胞12 h MPTP变化情况 Fig. 3 The changes of MPTP in MDBK cells infected with different MOI of IBRV for 12 h |

|
*.P<0.05;**.P<0.01 图 4 不同MOI IBRV感染MDBK细胞12 h MMP变化情况 Fig. 4 The changes of MMP in MDBK cells infected with different MOI of IBRV for 12 h |
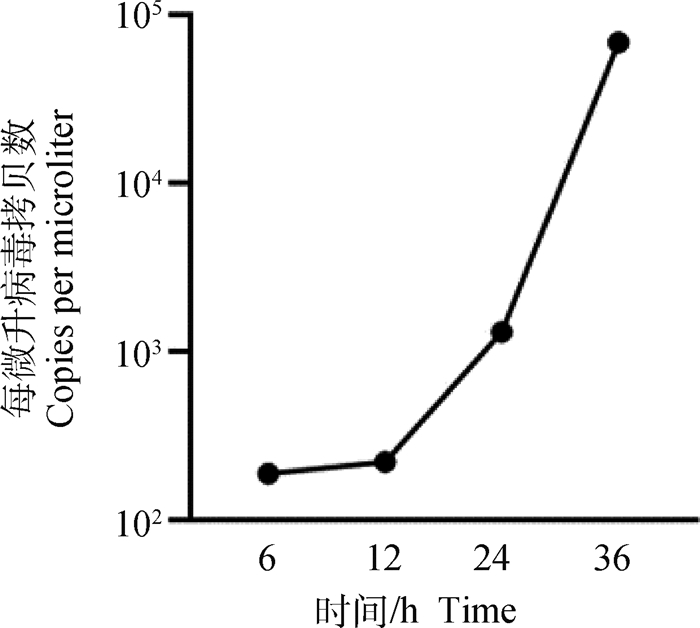
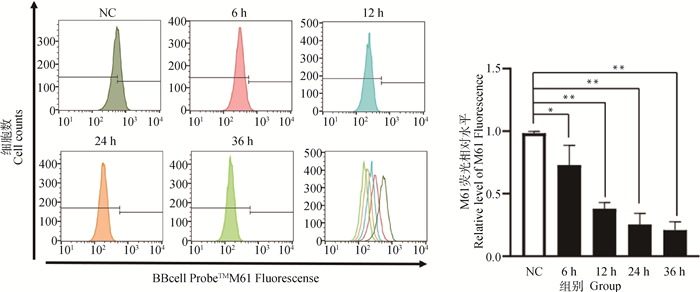
1.5 MOI的IBRV感染MDBK细胞6、12、24、36 h后,用实时荧光定量PCR检测病毒拷贝数,结果显示:随着时间的增加,病毒拷贝数逐渐上升(图 5)。用流式细胞仪检测MPTP、MMP变化情况,结果显示,与对照组相比,MPTP和MMP检测值随着病毒感染时间增加而降低,其中MPTP在12 h后极显著低于对照组(P<0.01)(图 6),MMP在24 h后极显著低于对照组(P<0.01)(图 7)。
|
图 5 1.5 MOI IBRV感染MDBK细胞不同时间病毒拷贝数 Fig. 5 Virus copy number of MDBK cells infected with 1.5 MOI IBRV at different times |
|
*.P<0.05;**.P<0.01 图 6 1.5 MOI IBRV感染MDBK细胞不同时间MPTP变化情况 Fig. 6 The changes of MPTP in MDBK cells infected with 1.5 MOI IBRV at different times |

|
*.P<0.05;**.P<0.01 图 7 1.5 MOI IBRV感染MDBK细胞不同时间MMP变化情况 Fig. 7 The changes of MMP in MDBK cells infected with 1.5 MOI IBRV at different times |
由图 8可见,IBRV感染MDBK细胞6 h和24 h后可以观察到细胞线粒体发生不同程度的损伤感染。NC组线粒体致密,6 h时线粒体肿胀,破裂,24 h线粒体肿胀更加明显,出现嵴断裂现象、空泡状,并且在线粒体附近可以看到IBRV病毒粒子。
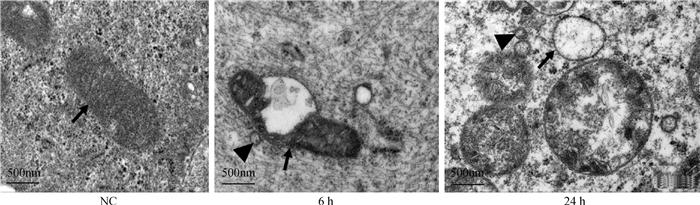
|
箭头所指为线粒体;三角所指为IBRV病毒粒子 The arrow points to the mitochondria; the triangle points to the IBRV virus particles 图 8 透射电镜观察MDBK细胞线粒体损伤情况 Fig. 8 Transmission electron microscope observation of mitochondrial damage in MDBK cells |
作为细胞存活和死亡的关键细胞器,线粒体损伤主要表现在形态、MMP、MPTP的开放情况以及Ca2+通透性等方面[9]。MMP的丢失会导致内膜(IM)和外膜(OM)的膜电位失衡,进而诱导正常细胞生物合成功能和生物能量学停滞,最终导致线粒体损伤,诱导细胞凋亡;其次MPTP的异常开放使得细胞色素C进入细胞质,通过caspase凋亡途径诱导细胞凋亡,也可导致MMP的消失,进而诱导线粒体损伤[5, 10]。因此,线粒体损伤的主要检测方法为MMP检测法、MPTP检测法、ROS检测法、mtDNA缺失突变法以及观察线粒体形态等[11]。本研究正是通过检测MPTP、MMP以及用透射电镜观察线粒体形态变化情况,证实IBRV可诱导MDBK线粒体损伤, 并且筛选出了最佳浓度和时间点。
线粒体在宿主抗病毒反应中起着不可或缺的作用,多种病毒感染细胞时都会引起线粒体损伤。例如,PRRSV感染会引起线粒体损伤,导致线粒体膜电位的破坏和活性氧的增加[12]。HCV感染通常导致ROS的产生,干扰细胞的钙信号通路,钙稳态的破坏改变了内质网的结构,增加的钙被线粒体吸收,导致MMP的破坏,进而使线粒体损伤[13]。而关于IBRV诱导宿主细胞线粒体损伤的研究较少。
在病毒诱导细胞线粒体损伤时间的研究中,王岩等[14]在CPV感染MDCK细胞24 h后,可显著提高细胞内ROS水平,引起细胞线粒体损伤。杨雪等[15]用HTLV-1感染细胞24 h后,宿主细胞线粒体膜电位呈显著下降趋势,线粒体出现损伤。这些研究表明,大多数病毒感染细胞24 h内就可引起线粒体损伤,导致功能障碍,造成细胞内能量合成受阻、代谢障碍、细胞发生自噬、凋亡等。在本研究中,使用光学显微镜观察MDBK细胞感染不同MOI的IBRV在6、12、24、36、48 h的变化情况,发现细胞在12 h时零星开始病变,用不同MOI感染MDBK细胞12 h检测MMP和MPTP变化,结果显示,1.5 MOI病毒液为诱导MDBK细胞线粒体损伤的最佳浓度;再用1.5MOI IBRV感染MBDK细胞6、12、24、36 h检测MMP和MPTP变化,结果显示,6~24 h为IBRV诱导MDBK细胞线粒体损伤的最佳时间。
细胞中的线粒体具有复杂的结构,且敏感多变,外界刺激很容易破坏其正常的形态和功能[16]。线粒体肿胀是引起线粒体大小改变导致线粒体损伤的重要特征,其中,还伴随着线粒体基质变透明、线粒体嵴被破坏呈空泡状等[17]。为进一步证实IBRV可诱导MDBK线粒体损伤,且在1.5 MOI感染6 h起就已经开始,作者又采用透射电镜技术对线粒体形态进行观察。结果显示,在1.5 MOI的IBRV感染MDBK细胞6 h,可明显观察到线粒体肿胀,出现部分空泡化;在24 h时,呈现线粒体嵴断裂、完全空泡化。
4 结论通过电镜技术观察线粒体损伤情况、流式细胞技术检测细胞MMP、MPTP,结果发现,IBRV感染MDBK细胞可诱导线粒体损伤,使MPTP、MMP水平降低,线粒体肿胀,且1.5 MOI病毒液感染6~24 h为诱导细胞线粒体损伤较理想的浓度和时间点。此研究为病毒感染细胞诱导线粒体损伤提供了培养模型,为进一步明确线粒体损伤发生机制及IBR的发病机制奠定理论基础。
| [1] |
SIBHAT B, AYELET G, SKJERVE E, et al. Bovine herpesvirus-1 in three major milk sheds of Ethiopia: serostatus and association with reproductive disorders in dairy cattle[J]. Prev Vet Med, 2018, 150: 126-132. DOI:10.1016/j.prevetmed.2017.12.019 |
| [2] |
MAJUMDER S, RAMAKRISHNAN M, NANDI S. Infectious bovine rhinotracheitis: an Indian perspective[J]. Int J Curr Microbiol Appl Sci, 2015, 4(10): 844-858. |
| [3] |
KANG J, PERVAIZ S. Mitochondria: redox metabolism and dysfunction[J]. Biochem Res Int, 2012, 2012: 896751. |
| [4] |
OHTA A, NISHIYAMA Y. Mitochondria and viruses[J]. Mitochondrion, 2011, 11(1): 1-12. DOI:10.1016/j.mito.2010.08.006 |
| [5] |
SUPINSKI G S, SCHRODER E A, CALLAHAN L A. Mitochondria and critical illness[J]. Chest, 2020, 157(2): 310-322. DOI:10.1016/j.chest.2019.08.2182 |
| [6] |
杨星星, 王凯, 陈晓娟, 等. 线粒体抗病毒信号蛋白(MAVS)在宿主天然免疫信号通路中的调节作用[J]. 生物化学与生物物理进展, 2013, 40(5): 397-405. YANG X X, WANG K, CHEN X J, et al. Functions and regulation of MAVS, the mitochondrial antiviral signaling protein in innate immunity[J]. Progress in Biochemistry and Biophysics, 2013, 40(5): 397-405. (in Chinese) |
| [7] |
ANAND S K, TIKOO S K. Viruses as modulators of mitochondrial functions[J]. Adv Virol, 2013, 2013: 738794. |
| [8] |
PINTI M, NASI M, GIBELLINI L, et al. The role of mitochondria in HIV infection and its treatment[J]. J Exp Clin Med, 2010, 2(4): 145-155. DOI:10.1016/S1878-3317(10)60024-1 |
| [9] |
左钱飞, 张海献, 鲁鹏飞. 线粒体损伤与检测方法研究进展[J]. 科学之友, 2009(6): 5-6. ZUO Q F, ZHANG H X, LU P F. The research of mitochondrial injury and detection[J]. Friend of Science Amateurs, 2009(6): 5-6. (in Chinese) |
| [10] |
RESHI L, WANG H V, HONG J R. Modulation of mitochondria during viral infections[M/OL]//TASKIN E, GUVEN C, SEVGILER Y. Mitochondrial diseases. London: IntechOpen, 2018: 443-459. [2022-07-01] https://www.intechopen.com/chapters/58886 doi: 10.5772/intechopen.73036
|
| [11] |
赵晓红, 毕婷婷, 孙健. 线粒体损伤机制及测定方法[C]//2014线粒体毒性与基于毒性通路的安全性评价新策略学术研讨会暨中国毒理学会毒理学替代法与转化毒理学专业委员会成立大会论文集. 北京, 2014: 56-57. ZHAO X H, BI T T, SUN J. Mitochondrial damage mechanism and determination method[C]//Proceedings of 2014 Workshop on Mitochondrial Toxicity and Pathway-Based Chemical Safety Assessment an Inaugural Symposium of the Society of Toxicological Alternatives and Translational Toxicology. Beijing, 2014: 56-57. (in Chinese) |
| [12] |
LEE S M, KLEIBOEKER S B. Porcine reproductive and respiratory syndrome virus induces apoptosis through a mitochondria-mediated pathway[J]. Virology, 2007, 365(2): 419-434. DOI:10.1016/j.virol.2007.04.001 |
| [13] |
RESHI M L, SU Y C, HONG J R. RNA viruses: ROS-mediated cell death[J]. Int J Cell Biol, 2014, 2014: 467452. |
| [14] |
王岩, 张建楼, 赵轶男, 等. 犬细小病毒通过促进ROS产生/线粒体损伤诱导宿主细胞的凋亡[J]. 河北农业大学学报, 2019, 42(3): 99-103, 114. WANG Y, ZHANG J L, ZHAO Y N, et al. Canine parvovirus-induced apoptosis of host cells by promoting ROS production and mitochondrial damage[J]. Journal of Hebei Agricultural University, 2019, 42(3): 99-103, 114. (in Chinese) |
| [15] |
杨雪, 谢业成, 郭仪琳, 等. HTLV-1病毒感染诱导宿主细胞线粒体损伤[J]. 中华微生物学和免疫学杂志, 2019, 39(12): 898-903. YANG X, XIE Y C, GUO Y L, et al. Mitochondrial damage induced by HTLV-1 infection in host cells[J]. Chinese Journal of Microbiology and Immunology, 2019, 39(12): 898-903. DOI:10.3760/cma.j.issn.0254-5101.2019.12.003 (in Chinese) |
| [16] |
GRAY M W. The pre-endosymbiont hypothesis: a new perspective on the origin and evolution of mitochondria[J]. Cold Spring Harb Perspect Biol, 2014, 6(3): a016097. |
| [17] |
白晓园. miR-4331对TGEV诱导PK-15细胞线粒体损伤的调控作用及机制研究[D]. 杨凌: 西北农林科技大学, 2016. BAI X Y. The effect and mechanisms of miR-4331 on mitochondrial damage induced by TGEV in PK-15 cells[D]. Yangling: Northwest A&F University, 2016. (in Chinese) |
(编辑 白永平)



