2. 宁夏动物疾病预防控制中心,银川 750011;
3. 银川海关,银川 750006
2. Ningxia Animal Disease Prevention and Control Center, Yinchuan 750011, China;
3. Yinchuan Customs, Yinchuan 750006, China
禽流感病毒(avian influenza virus, AIV)属于A型流感病毒(influenza A virus,IAV),是一种危害养禽业发展和威胁人类生命健康的重要人兽共患病病原,其基因组由8个节段的单股负链RNA组成,可编码PB2、PB1、PA、HA、NP、NA、M1、M2、NS1及NS2等多种功能蛋白及附件蛋白[1-4],其中,HA和NA是流感病毒的表面蛋白,也是主要的抗原蛋白。根据它们的抗原性差异,目前发现的IAV可分为18个HA亚型和11个NA亚型,其自然宿主是野生水禽,但也可感染人类、猪、鸡、鸭等多种生物[5],不过,H17N10和H18N11亚型IAV目前仅在蝙蝠体内发现[6-7]。历史上人类经历过的4次全球流感大流行当中,目前,认为AIV的基因片段参与了1957年H2N2,1968年H3N2以及2009年H1N1大流行流感病毒的形成[8-9]。同时,很多亚型的AIV已突破种间屏障,获得直接感染人的能力,截至2021年9月,全球已报道的能够直接感染人的AIV多达14种,包括H5(H5N1、H5N6、H5N8)、H7(H7N2、H7N3、H7N4、H7N7、H7N9)、H9N2、H10(H10N3、H10N7、H10N8)、H6N1、H4N8亚型[10],其中H5、H7亚型AIV感染人类可引起较高的致死率,对公共卫生的威胁尤为突出[11-12]。
H5及H7N9亚型HPAIV引起的禽HPAI死亡率可达100%,一旦发病,同群动物将被全部扑杀,造成重大的经济损失。1996年,H5N1亚型HPAIV在广东省首次被鉴定,在随后20多年的时间里,H5N1病毒在多种禽类宿主中广泛流行,已经传播到全球60多个国家和地区。1997年,中国香港报道了全球首例人感染H5N1禽流感病例[11],之后全球多地均报告了人感染病例。除N1以外,H5病毒的NA还主要包括N2、N6、N8等多种亚型,它们的HA基因大多来源于2.3.4.4分支。自2014年,H5病毒随候鸟迁徙形成世界性流行[13]。2013年,中国首次暴发人感染新型H7N9亚型禽流感疫情,并随即在养殖场和活禽市场分离到大量阳性样本,溯源分析表明,它的出现与各种亚型AIV在禽群间的流行密切相关[14-15]。
H5和H7N9等禽流感的防控对于养禽业的健康发展以及人类公共卫生均具有重大意义。本文通过对我国内地(不包含港澳台)流行的H5和H7N9等亚型HPAI的暴发情况以及监测数据进行回顾性分析,阐明其流行和发生规律,以期为禽流感的预警和防控提供参考。
1 材料与方法 1.1 H5及H7N9病毒HA基因序列的收集与比对从NCBI和GISAID流感病毒数据库分别下载1996-2021年H5亚型AIV HA基因序列和2013- 2021年H7N9亚型AIV HA基因序列,然后基于序列名去除两个数据库中的重复序列。对去重后的序列分别使用MAFFT本地工具进行多序列比对(MSA),手动纠正比对过程中的移码错误。
1.2 进化树的构建与美化将比对好的序列文件使用IQ-TREE本地工具构建最大似然法(ML)进化树,H5 HA进化树以A/Goose/Guangdong/1/1996为根,H7N9 HA进化树以A/Anhui/1/2013为根。疫苗株标注与局部放大图用Adobe Illustrator软件进行美化。
1.3 监测数据、疫苗株数据和疫情暴发数据的收集通过农业农村部官方网站的疫情发布、兽医公报以及中国兽药信息网等搜集监测数据、疫苗株数据和疫情暴发数据并进行统计、整理和分析,使用Graphpad prism 8进行图形制作和排版。
2 结果 2.1 H5亚型AIV在我国的流行概述H5亚型AIV是造成我国养禽业损失的重要病原,其中,主要以H5N1、H5N2、H5N6和H5N8等亚型为主,在我国家禽和野鸟中多次引发疫情。1996年,叶润全等[16]从广东省病死的家鹅体内分离出第一株H5N1亚型HPAIV(A/Goose/Guangdong/1/96)。1997年,香港报道了全球首例人感染高致病性H5N1禽流感病例,为此香港政府紧急扑杀了约150万只鸡、鸭、鹅和鸽,此次疫情共造成18人感染,6人死亡。根据溯源分析,此次感染人的H5N1重排了H9N2和H6N1亚型AIV的内部基因片段[11, 17]。此后,监测结果显示,H5N1亚型AIV在我国禽群中广泛流行,2004年1月,广西壮族自治区家禽中暴发H5N1亚型HPAI[18],在之后的短短20 d,疫情迅速蔓延到全国各地,16个省累计发生疫情49起,主要集中在广西、广东、湖北、湖南、江西、浙江和上海等中国南部和东部地区。2005年,青海湖候鸟大规模感染H5N1亚型HPAIV,造成6 000多只候鸟死亡[19-20],这是全球首次报道H5N1亚型HPAIV可导致野鸟死亡,引发全世界广泛关注。2005年年底,农业部要求“在全国范围内对禽类全面实施强制免疫,对所有水禽和散养禽开展集中免疫,免疫密度要达到100%”。之后,我国H5N1疫情暴发率有所下降。但在2006年和2009年,玉树县湿地的斑头雁和青海湖的野鸟中再度暴发H5N1亚型HPAI疫情,H5N1的传播和变异速度之快引发全球高度关注。2008年,世界卫生组织(WHO)根据HA基因特点,将H5分为10个不同的进化分支,分别为Clade 0~9[21],其中,一些分支下又进化形成了不同的亚分支,不同的分支之间抗原性存在明显差异。过去20多年间,我国流行的H5毒株主要可分为3个分支(图 1A),包括Clade7(7.2)、Clade2.3.2和Clade2.3.4.4,据最新进化分析,2020-2021年我国主要流行2.3.4.4b及2.3.4.4 h分支,而未分离到7分支和2.3.2分支病毒(图 1)。

|
图 1 我国H5病毒HA基因的遗传演化及目前流行分支 Fig. 1 The genetic evolution of the HA gene of H5 virus and the current epidemic clade |
2013年12月17日,河北省保定市一个蛋鸡养殖场突发H5N2亚型HPAI疫情,死亡4 000只鸡,这是中国内地首例H5N2亚型HPAI疫情。据农业农村部兽医公报,截至2021年9月,我国内地共报告禽间3起H5N2亚型HPAI疫情,扑杀约22万相关易感动物。2014年2月,中国首次报道人感染高致病性H5N6禽流感病例[22-23]。该事件之后,主动监测数据显示H5N6亚型AIV在我国南方活禽市场大量存在,并随时有感染人的风险,目前H5N6已取代H5N1成为我国禽群中主要流行的H5亚型AIV。2014-2017年,韩国、日本、欧洲及北美等地暴发了上千起高致病性H5N8亚型禽流感野鸟及家禽疫情,2020年,H5N8亚型HPAIV随野鸟迁徙传入我国,虽然尚未引起家禽暴发,但已导致我国多起野鸟疫情,提示人们需要进一步加强监测H5N8在野鸟中的传播,并密切评估对我国家禽的影响[24-25]。
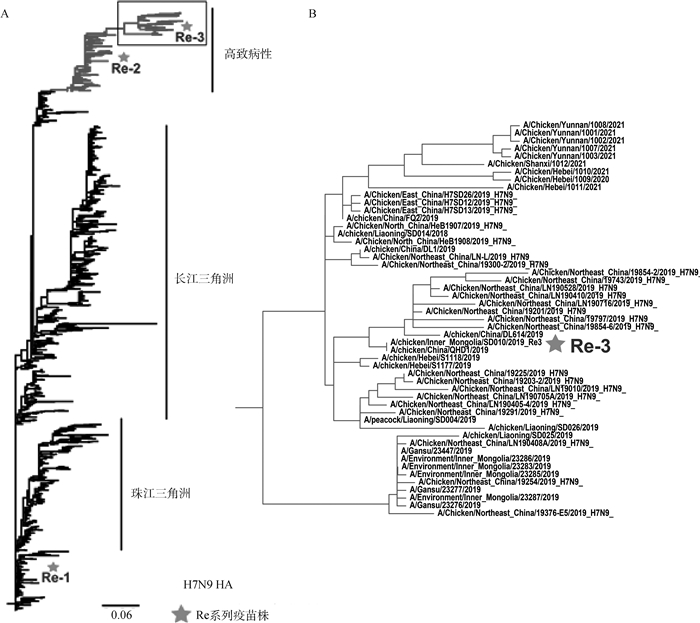
2.2 H7N9亚型AIV在我国的流行概述2013年3月,我国向WHO通报了3例人感染新型H7N9亚型AIV病例,均表现呼吸道感染以及严重肺炎和呼吸困难并最终死亡[26],随后,我国多个省份陆续报道了新型H7N9 AIV感染人事件,值得注意的是,此次感染人的H7N9是一种低致病性禽流感病毒。根据溯源分析,新型H7N9亚型AIV是一种三源重配病毒,其HA基因与在我国浙江省的鸭体内分离到的H7N3病毒同源性最高,NA基因则与鸭或野鸟中的H2N9、H4N9、H7N9或H11N9的亲缘关系最近,6个内部基因则完全来自于家禽中流行的H9N2亚型AIV[15, 27]。2016年,广东省首次分离出H7N9亚型HPAIV,鉴于H7N9的这一变化,农业农村部宣布自2017年秋季起对H7N9亚型HPAI实行强制免疫。在疫苗的保护下,H7N9在禽群中的暴发率显著下降。截至2021年9月,禽类中共暴发H7N9亚型HPAI疫情13起,扑杀约90万易感动物。H7N9病毒在我国人群中主要引起5波疫情,直至对H7N9亚型HPAI实施强制免疫后,才有效阻断了H7N9亚型AIV在人群中的传播[28-29]。目前,H7N9病毒在我国稳定流行,其HA基因进化形成明显的长江三角洲及珠江三角洲分支(图 2A),而高致病性H7N9病毒自2016年起源于珠江三角洲,随后传播至全国各地[30]。
|
图 2 我国H7N9病毒HA基因的遗传演化及目前流行毒株 Fig. 2 The genetic evolution of the HA gene of H7N9 virus and the current circulating strains |
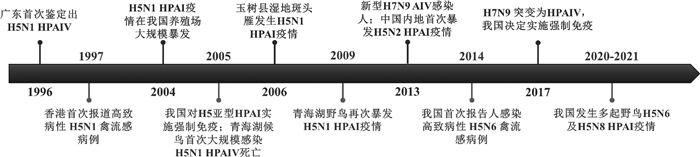
研究表明,H5和H7N9亚型AIV在我国的一系列流行事件(图 3)与H9N2亚型AIV的广泛流行密切相关[27]。H9N2经过一系列重排和变异,成为我国目前养殖鸡场分离率最高的流感病毒亚型[31-32]。H9N2病毒不仅可以感染人,它还通过提供全部6个内部基因给H5、H7等亚型流感病毒形成致病性和适应性更强的新型病毒[27, 33],H9N2病毒和这些新型病毒持续引发禽群和人类感染,造成极大的危害,成为我国禽流感防控的一大难题。
|
图 3 H5和H7N9亚型禽流感在我国的主要流行事件 Fig. 3 Main epidemic events of H5 and H7N9 subtypes of avian influenza in China |
免疫预防和扑杀相结合是我国防控HPAI所采取的主要措施,我国分别于2005年和2017年起对H5和H7N9亚型禽流感实施强制免疫。但由于这两种亚型AIV抗原性不断发生变化,需及时针对流行的优势毒株更新疫苗株。因此,我国强制免疫推荐疫苗会根据当年的AIV流行趋势而有所变化。表 1统计了自2005年对HPAI实施强制免疫以来的国家强制免疫推荐疫苗的更替及相关供体毒株信息,由于病毒的抗原性变异速度快,截至2021年,H5亚型高致病性禽流感Re系列疫苗已更新至Re-11和Re-12(图 1A),分别对应2.3.4.4 h分支和2.3.2.1分支毒株。根据遗传演化分析发现,Re-12对应的2.3.2.1分支H5在2020—2021年已经不再流行,而2.3.4.4b分支开始流行且目前尚无对应疫苗,提示H5亚型HPAI需要进行疫苗更新[34](图 1)。而H7N9亚型禽流感疫苗从2017年的Re-1已更新至Re-3(图 2A,表 1,截至2021年)。同样根据遗传演化分析发现,目前流行的H7N9亚型HPAIV与Re-3虽然进化关系较近(图 2B),但抗原性已经发生变化[35],疫苗可能需要再进行更新。
|
|
表 1 2005-2021年H5和H7N9亚型HPAI强制免疫推荐疫苗 Table 1 H5 and H7N9 subtype HPAI compulsory immunization recommended vaccines from 2005 to 2021 |
检测免疫动物血清抗体有利于评价疫苗免疫的合格率,病原学检测有利于了解AIV的流行情况,其中活禽市场的监测对于评估人类感染AIV风险及病原溯源有着重要意义。农业农村部每月都会组织各级检测机构对动物样品进行数万份的血清学检测和病原学检测,及时发现禽流感的流行和变异情况,为禽流感的暴发提供预警。作者统计了2004-2021年农业农村部公布的监测数据,主要包括监测样品总数、免疫动物血清样品数、免疫合格率、非免疫动物血清样品数、病原学样品数及相关阳性样品数及阳性率等。监测结果显示(图 4,表 2~4),我国每年检测H5及H7N9总样品数都超过百万份(图 4A,D),其中主要为免疫动物血清样品及病原学样品,以用于评判免疫合格率和病原阳性率。数据显示,自2005年和2017年分别对H5和H7N9实施强制免疫以来,我国家禽H5/H7N9亚型疫苗免疫合格率基本保持在90%以上(仅2006、2007和2009年未达90%)(图 4B、E),有效控制了禽流感疫情的暴发。同时,H5和H7N9亚型禽流感病原学样品阳性率也保持在极低的水平(图 4C、F),2017年H7N9的非免疫血清样品阳性率陡增(图 4F),这与H7N9突变为高致病性密切相关[29-30]。值得注意的是,2021年,H5的病原样品阳性率有大幅提升(图 4C)。

|
A. H5亚型样品监测量;B. H5亚型免疫合格率;C. H5亚型病原学样品阳性率;D. H7N9亚型样品监测量;E. H7N9亚型免疫合格率;F. H7N9亚型病原学及非免疫血清样品阳性率 A. The number of samples of H5 subtype; B. The qualified rate of immunity of H5 subtype; C. The positive rate of pathogenic samples of H5 subtype; D. The number of samples of H7N9 subtype; E. The qualified rate of immune of H7N9 subtype; F. Positive rate of samples of H7N9 subtype 图 4 H5和H7N9亚型HPAI的监测 Fig. 4 Surveillance of H5 and H7N9 subtypes of HPAI |
|
|
表 2 H5亚型HPAI监测(2004年1月-2021年9月) Table 2 HPAI monitoring of H5 subtypes (January 2004 to September 2021) |
|
|
表 3 强制免疫前H7N9流感监测(2013年4月-2017年10月) Table 3 H7N9 influenza surveillance before compulsory immunization (April 2013 to October 2017) |
|
|
表 4 强制免疫后H7N9流感监测(2017年11月-2021年9月) Table 4 H7N9 influenza surveillance after compulsory immunization (November 2017 to September 2021) |
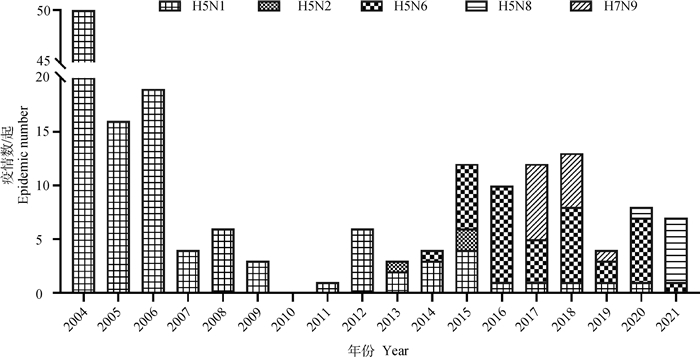
2.4.1 各亚型疫情数 据官方公布数据统计,2004—2021年,由于H5以及H7N9疫情影响,我国已共计扑杀相关易感动物近1 600万只(不完全统计),给我国养禽业带来重大损失(表 5)。其中,H5N1亚型AIV是对我国养殖业造成损失最大的AIV亚型,共有疫情119起,其次是H5N6,共有疫情36起。但最近几年,H5N1的暴发趋势有所放缓,H5N6和H5N8在逐渐抬头,2020-2021年,我国内地连续发生多起H5N6及H5N8野鸟疫情,值得高度关注。
|
|
表 5 2004年1月-2021年9月各亚型HPAI疫情暴发情况 Table 5 Outbreaks of HPAI epidemics of various subtypes from January 2004 to September 2021 |
2.4.2 疫情年份分布 按年份统计我国报告的禽间HPAI疫情情况,我国自2004年广泛暴发H5N1亚型HPAI之后,陆续又出现H5N2、H5N6、H7N9、H5N8等HPAI疫情。2004—2006年,HPAI疫情呈现高发状态(2004年50起,2006年16起,2007年19起),自2005年实施H5亚型HPAI强制免疫后,2007年疫情得到控制。但是从2015年开始,H5亚型HPAI疫情数量又有所回升(2015年12起,2016年10起,2017年12起,2018年13起),且H5N6已取代H5N1成为我国流行的主要H5亚型AIV。同时,随着H5N8的传入(2021年1—9月份6起),使得防控形势更加严峻(图 5)。
|
图 5 2004年1月-2021年9月我国HPAI疫情暴发数量 Fig. 5 Number of HPAI outbreaks in China from January 2004 to September 2021 |
2.4.3 疫情月份分布 从2004年1月—2021年9月,我国共报告178起HPAI疫情,其中,4—9月共报告54起,10月—次年3月共124起(图 6A);同时,根据病原学监测结果显示,阳性样本大部分都检出在10月—次年3月,表明禽流感疫情冬春季多发,符合禽流感病原特性。

|
A.疫情月份分布;B.疫情宿主分布 A. The month distribution of the epidemic; B. The distribution of the host of the epidemic 图 6 2004年1月-2021年9月我国HPAI疫情暴发时间段及宿主分布 Fig. 6 The time period and host distribution of the HPAI outbreak in China from January 2004 to September 2021 |
2.4.4 疫情省份分布 按地理位置进行分析,我国大部分省份均暴发过HPAI疫情,没有明显的地域局限性,但存在多发和少发的区别。从南北方来看,湖南、湖北、广东等南方地区发生疫情99起,北方地区79起,相对而言南方地区疫情较为多发,特别是两湖(湖南、湖北)及广东地区(表 6)。但在2020—2021年,北方野鸟H5N6及H5N8疫情有所增加,仅2020年年初新疆连续发生5起野鸟感染H5N6疫情[36],2021年,在山东、北京、西藏、陕西和宁夏发生5起野鸟感染H5N8以及辽宁发生1起野鸟感染H5N6疫情,而南方只有江苏发生1起H5N8野鸟疫情(图 5,表 6),这提示H5N6和H5N8在野鸟中有了进一步传播,且主要在北方地区,需要引起重视。
|
|
表 6 2004年1月-2021年9月我国HPAI疫情暴发省份分布 Table 6 Distribution of HPAI epidemics in provinces from January 2004 to September 2021 |
2.4.5 疫情宿主分布 根据暴发的HPAI疫情统计,鸡群中暴发的疫情次数最多,共有128起,其次是鸭,共有38起,此外,野鸟疫情也不容忽视,共有26起(图 6B),且主要集中在2020年之后,仅2020年—2021年9月已报告13起。
2.4.6 H5和H7N9亚型AIV的公共卫生学危害 H5和H7N9亚型AIV不仅可以感染禽,同时还可以跨越种间屏障感染人。据WHO数据,2003—2021年12月,全球共报道了863例人感染高致病性H5N1亚型禽流感病例,患者死亡率高达52.8%(456/863),病例覆盖东亚、东南亚、西亚以及非洲的18个国家[37],其中,我国53例,31例死亡,死亡率达58.5%,高于世界平均水平;自2014年4月我国首次报道人感染高致病性H5N6禽流感,截至2021年12月,全球共计报道了53例病例,其中52例发生在我国,1例来自老挝;2021年2月,俄罗斯境内发现全球首批7例人感染高致病性H5N8禽流感病例;2013年到2017年,H7N9亚型AIV在我国人群中造成5波严重疫情,共造成1 534人感染,在禽群中对H7N9禽流感进行强制免疫后,H7N9人间疫情被阻断[28],2018-2021年,仅报道了3例病例,且2019年4月之后无新增病例。截至2021年12月,我国内地累计报告人感染H7N9禽流感病例1 537例,病死率39.8%[37-38]。
3 小结与展望禽流感作为一种动物源性人兽共患病,对养禽业和人类健康均构成严重威胁。由于AIV亚型多,且基因组为分节段的RNA片段,所以很容易发生突变和重排,且生态传播链复杂,防控极为困难。总结全文,我国禽流感暴发具有以下几个特点。
第一,我国属于禽流感疫情多发国,特别是H5和H7N9高致病性禽流感严重威胁我国养禽产业和人类生命健康。我国疫情多发可能由多个因素共同决定,首先,我国家禽养殖业体量大,中小规模居多,部分养殖场基础设施和生物安全措施相对不足;其次,虽然实施了强制免疫,但仍存在禽流感疫苗免疫空白,水禽免疫密度较低等问题;此外,我国地域辽阔,野生鸟类繁多,并处于三条候鸟迁徙路线上,野鸟作为AIV的自然宿主,体内存在多种亚型流感病毒,在迁徙的过程中,可与迁徙路线上的养殖禽类接触而造成AIV传播;另外,地区间的活禽贸易也会促进AIV的交流和传播[39]。
第二,我国采取的强制免疫和扑杀相结合的方式能够有效降低我国HPAI疫情的暴发,但H5及H7N9病毒的抗原性变异快,需要持续监测,疫苗需要及时迭代。2020年以来,H5N8高致病性禽流感疫情导致韩国和日本扑杀超过2 000多万只家禽,而我国虽然在野生鸟类中也发现了H5N8病毒,但在家禽中没有引起疫情暴发,研究表明, 实施家禽疫苗接种在其中发挥着关键的作用[25]。尽管如此,持续的野鸟疫情以及病毒的频繁变异使我们仍需高度重视[40-44],需要有针对性地更新疫苗;同时,根据相关文章数据显示,目前,我国使用的H7N9疫苗与流行的H7N9病毒存在较大抗原差异[35],需要更新疫苗。
第三,H5及H7N9病毒的暴发频率与宿主、气候以及野鸟迁徙均存在一定关联。不同NA亚型的H5对宿主的易感性存在一定差异[45-46]。同时,禽流感病毒适宜在温度较低的冬春季节传播,而这段时期也刚好是野鸟迁徙的主要时间段,野鸟作为H5病毒长途传播的重要载体,其迁徙促进了不同地区的禽流感病毒重配和疫情暴发[47]。
免疫和扑杀相结合的方式虽然可以有效降低H5和H7N9亚型HPAI的暴发,降低经济损失,但禽流感疫情仍时有暴发,提示仅靠疫苗免疫防控禽流感尚有不足,还需要不断强化和优化禽流感防控体系。首先,做好生物安全是防控禽流感的首要任务。养殖场应建立健全生物安全防控措施,根据实际情况总结适合本地实际的家禽生物安全防护措施,并加强养殖人员技术和生物安全意识培训,切实提高防疫能力;其次,由于各种亚型禽流感病毒流行的区域和感染的宿主存在差异,疫苗免疫后的效果也各不相同,所以疫苗免疫应注重当地实际的流行状况,实现精准防控;最后,还应加强防疫部门与生态部门的联动。越来越多的研究表明,环境因素如植被结构、湿地水质、气候条件、野鸟群落组成及其密度以及野鸟之间接触的改变、人文环境的变化都与禽流感的暴发存在联系[48]。禽流感病毒的流行是病毒-动物-人类以及环境等多种因素共同作用的结果,采用传统手段单纯从家禽等某一动物种群或从病毒自身特性角度来制定防控措施是远远不够的,必须推动多部门联防联控。禽流感防控工作是一项长久而艰巨的任务,关系到国计民生,任重而道远。
| [1] |
WISE H M, FOEGLEIN A, SUN J C, et al. A complicated message: identification of A novel PB1-related protein translated from influenza A virus segment 2 mRNA[J]. J Virol, 2009, 83(16): 8021-8031. DOI:10.1128/JVI.00826-09 |
| [2] |
JAGGER B W, WISE H M, KASH J C, et al. An overlapping protein-coding region in influenza A virus segment 3 modulates the host response[J]. Science, 2012, 337(6091): 199-204. DOI:10.1126/science.1222213 |
| [3] |
MURAMOTO Y, NODA T, KAWAKAMI E, et al. Identification of novel influenza A virus proteins translated from PA mRNA[J]. J Virol, 2013, 87(5): 2455-2462. DOI:10.1128/JVI.02656-12 |
| [4] |
WISE H M, HUTCHINSON E C, JAGGER B W, et al. Identification of a novel splice variant form of the influenza A virus M2 ion channel with an antigenically distinct ectodomain[J]. PLoS Pathog, 2012, 8(11): e1002998. DOI:10.1371/journal.ppat.1002998 |
| [5] |
WEBSTER R G, BEAN W J, GORMAN O T, et al. Evolution and ecology of influenza A viruses[J]. Microbiol Rev, 1992, 56(1): 152-179. DOI:10.1128/mr.56.1.152-179.1992 |
| [6] |
TONG S X, LI Y, RIVAILLER P, et al. A distinct lineage of influenza A virus from bats[J]. Proc Natl Acad Sci U S A, 2012, 109(11): 4269-4274. DOI:10.1073/pnas.1116200109 |
| [7] |
TONG S X, ZHU X Y, LI Y, et al. New world bats harbor diverse influenza A viruses[J]. PLoS Pathog, 2013, 9(10): e1003657. DOI:10.1371/journal.ppat.1003657 |
| [8] |
SMITH G J D, BAHL J, VIJAYKRISHNA D, et al. Dating the emergence of pandemic influenza viruses[J]. Proc Natl Acad Sci U S A, 2009, 106(28): 11709-11712. DOI:10.1073/pnas.0904991106 |
| [9] |
De WIT E, FOUCHIER R A M. Emerging influenza[J]. J Clin Virol, 2008, 41(1): 1-6. DOI:10.1016/j.jcv.2007.10.017 |
| [10] |
FREIDL G S, MEIJER A, DE BRUIN E, et al. Influenza at the animal-human interface: a review of the literature for virological evidence of human infection with swine or avian influenza viruses other than A(H5N1)[J]. Euro Surveill, 2014, 19(18): 20793. |
| [11] |
SHORTRIDGE K F, ZHOU N N, GUAN Y, et al. Characterization of avian H5N1 influenza viruses from poultry in Hong Kong[J]. Virology, 1998, 252(2): 331-342. DOI:10.1006/viro.1998.9488 |
| [12] |
LI Q, ZHOU L, ZHOU M H, et al. Epidemiology of human infections with avian influenza A(H7N9) virus in China[J]. N Engl J Med, 2014, 370(6): 520-532. DOI:10.1056/NEJMoa1304617 |
| [13] |
CUI Y F, LI Y K, LI M H, et al. Evolution and extensive reassortment of H5 influenza viruses isolated from wild birds in China over the past decade[J]. Emerg Microbes Infect, 2020, 9(1): 1793-1803. DOI:10.1080/22221751.2020.1797542 |
| [14] |
严雅瑶, 顾敏, 刘秀梵. HA蛋白位点变异影响H7N9亚型流感病毒特性的研究进展[J]. 畜牧兽医学报, 2021, 52(8): 2093-2106. YAN Y Y, GU M, LIU X F. Advance in the influence of amino acid variation in HA protein on the biological properties of H7N9 subtype influenza virus[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(8): 2093-2106. (in Chinese) |
| [15] |
LAM T T Y, WANG J, SHEN Y Y, et al. The genesis and source of the H7N9 influenza viruses causing human infections in China[J]. Nature, 2013, 502(7470): 241-244. DOI:10.1038/nature12515 |
| [16] |
唐秀英, 田国斌, 赵传删, 等. 中国禽流感流行株的分离鉴定[J]. 中国畜禽传染病, 1998, 20(1): 1-5. TANG X Y, TIAN G B, ZHAO C S, et al. Isolation and characterization of prevalent strains of avian influenza viruses in China[J]. Chinese Journal of Animal and Poultry Infectious Diseases, 1998, 20(1): 1-5. (in Chinese) |
| [17] |
于康震, 陈化兰, 唐秀英. '97香港禽流感[J]. 中国畜禽传染病, 1998, 20(3): 187-191. YU K Z, CHEN H L, TANG X Y. Avian influenza in Hong Kong in 1997[J]. Chinese Journal of Animal and Poultry Infectious Diseases, 1998, 20(3): 187-191. (in Chinese) |
| [18] |
曹伟胜, 辛朝安, 梁昭平, 等. 2004年亚洲H5N1亚型高致病性禽流感流行特点及启示[J]. 中国人兽共患病杂志, 2004, 20(9): 801-804, 753. CAO W S, XIN C A, LIANG Z P, et al. Epidemic characteristics and enlightenment of Asian H5N1 subtype highly pathogenic avian influenza in 2004[J]. Chinese Journal of Zoonoses, 2004, 20(9): 801-804, 753. DOI:10.3969/j.issn.1002-2694.2004.09.019 (in Chinese) |
| [19] |
CHEN H L, LI Y B, LI Z J, et al. Properties and dissemination of H5N1 viruses isolated during an influenza outbreak in migratory waterfowl in western China[J]. J Virol, 2006, 80(12): 5976-5983. DOI:10.1128/JVI.00110-06 |
| [20] |
LIU J, XIAO H, LEI F, et al. Highly pathogenic H5N1 influenza virus infection in migratory birds[J]. Science, 2005, 309(5738): 1206. DOI:10.1126/science.1115273 |
| [21] |
WHO/OIE/FAO H5N1 Evolution Working Group. Toward a unified nomenclature system for highly pathogenic avian influenza virus (H5 N1)[J]. Emerg Infect Dis, 2008, 14(7): e1. DOI:10.3201/eid1407.071681 |
| [22] |
PAN M, GAO R B, LV Q, et al. Human infection with a novel, highly pathogenic avian influenza A (H5N6) virus: virological and clinical findings[J]. J Infect, 2016, 72(1): 52-59. DOI:10.1016/j.jinf.2015.06.009 |
| [23] |
ZHANG R S, CHEN T M, OU X H, et al. Clinical, epidemiological and virological characteristics of the first detected human case of avian influenza A(H5N6) virus[J]. Infect Genet Evol, 2016, 40: 236-242. DOI:10.1016/j.meegid.2016.03.010 |
| [24] |
SHI W F, GAO G F. Emerging H5N8 avian influenza viruses[J]. Science, 2021, 372(6544): 784-786. DOI:10.1126/science.abg6302 |
| [25] |
CUI P F, ZENG X Y, LI X Y, et al. Genetic and biological characteristics of the globally circulating H5N8 avian influenza viruses and the protective efficacy offered by the poultry vaccine currently used in China[J]. Sci China Life Sci, 2022, 65(4): 795-808. DOI:10.1007/s11427-021-2025-y |
| [26] |
GAO R B, CAO B, HU Y W, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engl J Med, 2013, 368(20): 1888-1897. DOI:10.1056/NEJMoa1304459 |
| [27] |
PU J, WANG S G, YIN Y B, et al. Evolution of the H9N2 influenza genotype that facilitated the genesis of the novel H7N9 virus[J]. Proc Natl Acad Sci U S A, 2015, 112(2): 548-553. DOI:10.1073/pnas.1422456112 |
| [28] |
ZENG X Y, TIAN G B, SHI J Z, et al. Vaccination of poultry successfully eliminated human infection with H7N9 virus in China[J]. Sci China Life Sci, 2018, 61(12): 1465-1473. DOI:10.1007/s11427-018-9420-1 |
| [29] |
SHI J Z, DENG G H, KONG H H, et al. H7N9 virulent mutants detected in chickens in China pose an increased threat to humans[J]. Cell Res, 2017, 27(12): 1409-1421. DOI:10.1038/cr.2017.129 |
| [30] |
YANG L, ZHU W F, LI X Y, et al. Genesis and spread of newly emerged highly pathogenic H7N9 avian viruses in mainland China[J]. J Virol, 2017, 91(23): e01277-17. |
| [31] |
PAN Q, LIU A J, ZHANG F M, et al. Co-infection of broilers with Ornithobacterium rhinotracheale and H9N2 avian influenza virus[J]. BMC Vet Res, 2012, 8(1): 104. DOI:10.1186/1746-6148-8-104 |
| [32] |
BI Y H, LI J, LI S Q, et al. Dominant subtype switch in avian influenza viruses during 2016-2019 in China[J]. Nat Commun, 2020, 11(1): 5909. DOI:10.1038/s41467-020-19671-3 |
| [33] |
GU M, XU L J, WANG X Q, et al. Current situation of H9N2 subtype avian influenza in China[J]. Vet Res, 2017, 48(1): 49. DOI:10.1186/s13567-017-0453-2 |
| [34] |
ZHANG J H, LI X D, WANG X M, et al. Genomic evolution, transmission dynamics, and pathogenicity of avian influenza A (H5N8) viruses emerging in China, 2020[J]. Virus Evol, 2021, 7(1): veab046. DOI:10.1093/ve/veab046 |
| [35] |
CHEN J H, LIU Z J, LI K, et al. Emergence of novel avian origin H7N9 viruses after introduction of H7-Re3 and rLN79 vaccine strains to China[J]. Transbound Emerg Dis, 2022, 69(2): 213-220. DOI:10.1111/tbed.14401 |
| [36] |
LI Y B, LI M H, LI Y L, et al. Outbreaks of highly pathogenic avian influenza (H5N6) virus subclade 2. 3. 4. 4 h in Swans, Xinjiang, western China, 2020[J]. Emerg Infect Dis, 2020, 26(12): 2956-2960. DOI:10.3201/eid2612.201201 |
| [37] |
PHILIPPON D A M, WU P, COWLING B J, et al. Avian influenza human infections at the human-animal interface[J]. J Infect Dis, 2020, 222(4): 528-537. DOI:10.1093/infdis/jiaa105 |
| [38] |
WANG X L, JIANG H, WU P, et al. Epidemiology of avian influenza A H7N9 virus in human beings across five epidemics in mainland China, 2013-17:an epidemiological study of laboratory-confirmed case series[J]. Lancet Infect Dis, 2017, 17(8): 822-832. DOI:10.1016/S1473-3099(17)30323-7 |
| [39] |
YANG Q Q, ZHAO X, LEMEY P, et al. Assessing the role of live poultry trade in community-structured transmission of avian influenza in China[J]. Proc Natl Acad Sci U S A, 2020, 117(11): 5949-5954. DOI:10.1073/pnas.1906954117 |
| [40] |
LI X, LV X R, LI Y, et al. Emergence, prevalence, and evolution of H5N8 avian influenza viruses in central China, 2020[J]. Emerg Microbes Infect, 2022, 11(1): 73-82. DOI:10.1080/22221751.2021.2011622 |
| [41] |
XIONG J S, ZHOU H, FAN L F, et al. Emerging highly pathogenic avian influenza (H5N8) virus in migratory birds in Central China, 2020[J]. Emerg Microbes Infect, 2021, 10(1): 1503-1506. DOI:10.1080/22221751.2021.1956372 |
| [42] |
HE G M, MING L, LI X, et al. Genetically divergent highly pathogenic avian influenza A(H5N8) viruses in wild birds, eastern China[J]. Emerg Infect Dis, 2021, 27(11): 2940-2943. DOI:10.3201/eid2711.204893 |
| [43] |
LI X, LV X R, LI Y, et al. Highly pathogenic avian influenza A(H5N8) virus in swans, China, 2020[J]. Emerg Infect Dis, 2021, 27(6): 1732-1734. DOI:10.3201/eid2706.204727 |
| [44] |
LI J, ZHANG C G, CAO J, et al. Re-emergence of H5N8 highly pathogenic avian influenza virus in wild birds, China[J]. Emerg Microbes Infect, 2021, 10(1): 1819-1823. DOI:10.1080/22221751.2021.1968317 |
| [45] |
MEI K, GUO Y, ZHU X H, et al. Different pathogenicity and transmissibility of goose-origin H5N6 avian influenza viruses in chickens[J]. Viruses, 2019, 11(7): 612. DOI:10.3390/v11070612 |
| [46] |
PARK M J, CHA R M, KYE S J, et al. Pathogenicity of H5N8 high pathogenicity avian influenza virus in chickens and ducks from South Korea in 2020-2021[J]. Viruses, 2021, 13(10): 1903. DOI:10.3390/v13101903 |
| [47] |
TIAN H Y, ZHOU S, DONG L, et al. Avian influenza H5N1 viral and bird migration networks in Asia[J]. Proc Natl Acad Sci U S A, 2015, 112(1): 172-177. DOI:10.1073/pnas.1405216112 |
| [48] |
GAIDET N, CARON A, CAPPELLE J, et al. Understanding the ecological drivers of avian influenza virus infection in wildfowl: a continental-scale study across Africa[J]. Proc Roy Soc B: Biol Sci, 2012, 279(1731): 1131-1141. |
(编辑 白永平)



